| |
| Med Sci (Paris). 37(11): 968–970. doi: 10.1051/medsci/2021154.Le rôle prépondérant des IgA dans la réponse immunitaire précoce contre le SARS-CoV-2 Delphine Sterlin,1,2* Anouk Malaussena,1 and Guy Gorochov1,2** 1Sorbonne Université, Inserm, Centre d’immunologie et des maladies infectieuses (CIMI-Paris)
,
83 boulevard de l’hôpital
,
75013Paris
,
France 2Département d’immunologie, Assistance Publique Hôpitaux de Paris (AP-HP), Hôpital Pitié-Salpêtrière
,
83 boulevard de l’hôpital
,
75013Paris
,
France MeSH keywords: Anticorps neutralisants, Anticorps antiviraux, COVID-19, Humains, Immunoglobuline A, SARS-CoV-2, immunologie |
En décembre 2019, un nouveau coronavirus, nommé SARS-CoV-2 (
severe acute respiratory syndrome coronavirus 2
), a été identifié comme la cause d’une maladie respiratoire aiguë, la COVID-19 (
coronavirus disease 2019
). Ce virus à ARN, enveloppé, membre de la famille des bêta-coronavirus, s’est répandu à travers le monde à une vitesse sans précédent. Les premières études ont rapidement montré qu’il induisait une forte réponse immunitaire humorale, en stimulant la production d’anticorps spécifiques [
1
]. Les immunoglobines de classe A (IgA), qui sont les immunoglobulines majoritaires des muqueuses, jouent localement un rôle crucial dans la protection contre les micro-organismes pathogènes, en neutralisant les virus respiratoires ou en empêchant leur liaison aux cellules épithéliales [
2
–
4
]. Cependant, le rôle des IgA au cours de l’infection par le SARS-CoV-2 n’avait pas été exploré.
|
Lors de la réponse immunitaire précoce à l’infection par le SARS-CoV-2, les plasmablastes circulants sécrètent préférentiellement des IgA
Dans un premier temps, nous avons recherché l’apparition de plasmablastes dans la circulation sanguine. Ces cellules sécrétrices d’anticorps, à courte durée de vie, apparaissent de façon rapide et transitoire dans la circulation sanguine lors d’une infection virale aiguë. Chez 38 patients infectés par le SARS-CoV-2, nous avons observé une augmentation significative de la proportion des plasmablastes entre le 1
er
et le 9
e
jour (J9) après le début des symptômes. Cette proportion atteint un maximum entre J10 et J15, puis décroît [
5
]. Une analyse détaillée a révélé que 40 % de ces cellules sécrétrices d’anticorps expriment CCR10, un récepteur de chimiokine impliqué dans la migration des cellules immunitaires vers les muqueuses, notamment la muqueuse pulmonaire [
6
]. Par ailleurs, au cours de la phase précoce de la réponse immunitaire (entre J10 et J15), la majorité des plasmablastes en circulation produisent des IgA, puis les plasmablastes produisant des IgG deviennent prédominants. La réponse humorale précoce est donc dominée par des cellules sécrétrices d’IgA dont le phénotype est compatible avec des cellules migrant dans les muqueuses.
|
Les IgA anti-SARS-CoV-2 apparaissent précocement
Nous avons ensuite évalué la prévalence des anticorps IgG, IgA et IgM reconnaissant deux protéines de surface du SARS-CoV-2 : la nucléocapside (NC) et le domaine RBD (
receptor-binding domain
) de la protéine de spicule (protéine
spike
). Dans le sérum de 132 patients, les IgA anti-RBD étaient détectables plus précocement que les IgG, ou même que les IgM, anti-RBD. En revanche, les anticorps anti-NC détectés précocement après le début des symptômes appartenaient à ces trois classes d’immunoglobulines. En termes de cinétique, les taux d’IgG anti-RBD et anti-NC augmentent jusqu’à la 4
e
semaine après le début des symptômes, puis restent stables, tandis que ceux des IgA anti-RBD et anti-NC augmentent pendant les trois premières semaines de l’infection, puis diminuent pour devenir indétectables un mois après la guérison des patients. Ces résultats suggèrent que la détection des IgA dirigées contre le SARS-CoV-2 permettrait un diagnostic plus précoce de la maladie. Néanmoins, au-delà de 28 jours après le début des symptômes, seules les IgG sont à rechercher.
Par ailleurs, nous avons étudié le lien entre le taux d’anticorps dirigés contre le SARS-CoV-2 et la sévérité de la COVID-19. Aucune différence notable en termes de taux d’IgG, d’IgM, ou d’IgA n’a pu être mise en évidence entre les patients atteints d’infection sévère et ceux dont l’infection a une expression clinique modérée. Il n’y a donc pas d’argument en faveur d’un rôle principalement délétère de la réponse humorale anti-SARS-CoV-2 au cours de la COVID-19, comme cela a été parfois proposé. |
Les IgA sériques sont des agents neutralisants précoces et puissants du SARS-CoV-2
Nous avons ensuite cherché à définir la contribution de chaque isotype d’anticorps dans la neutralisation du virus, en purifiant les IgA et les IgG à partir du sérum de patients infectés par le SARS-CoV-2. Nous avons utilisé un test à base de particules virales exprimant la protéine de spicule du SARS-CoV-2 et des cellules exprimant la protéine ACE-2 (
angiotensin-converting enzyme 2
), le récepteur du virus. Étonnamment, les IgA monomériques avaient une capacité de neutralisation environ sept fois plus importante que celle des IgG purifiées à partir du même sérum. La capacité neutralisante des IgA purifiées était corrélée au taux d’IgA anti-RBD dans le sérum, soulignant l’importance de la fixation des anticorps sur le domaine RBD de la protéine de spicule dans le processus de neutralisation du virus [
7
]. Ce résultat suggère que, durant les premiers jours après le début des symptômes, les IgA contribuent plus que les IgG à la neutralisation du virus.
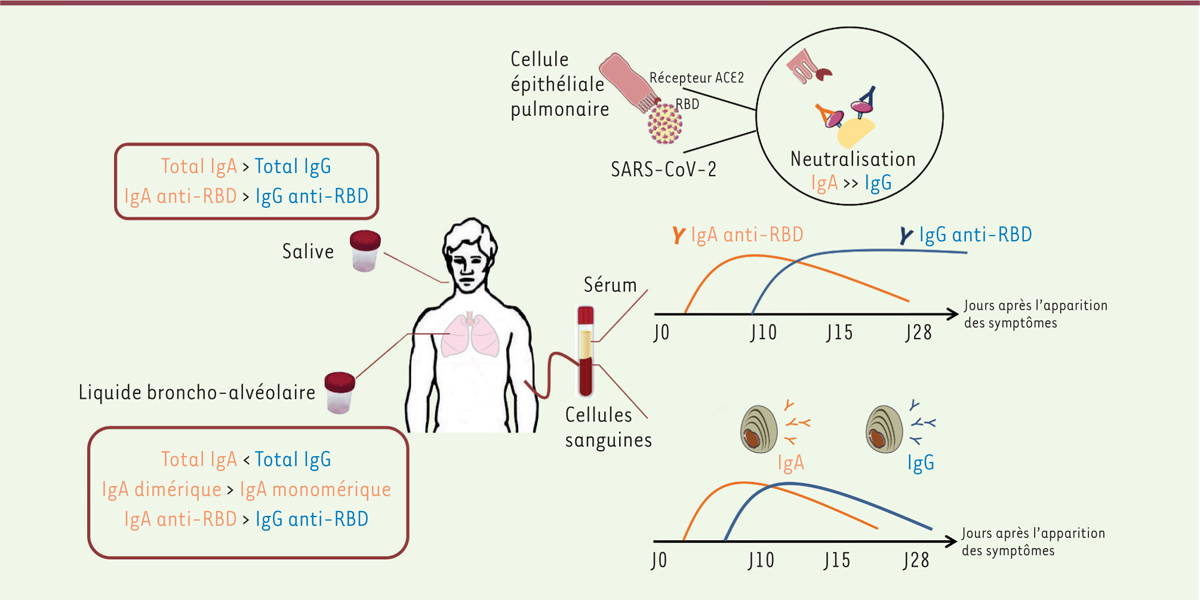
 | Figure 1.
Les IgA sériques et sécrétoires jouent un rôle clé dans la phase précoce de l’infection par le virus SARS-CoV-2.
Dans le sang, le nombre des cellules sécrétrices d’anticorps dirigés contre le virus atteint un pic environ 10 jours après le début des symptômes, puis diminue. Les plasmablastes circulants produisent majoritairement des IgA, puis des IgG. Dans la phase précoce de l’infection, la capacité du sérum à neutraliser le virus est principalement due aux IgA. Dans les muqueuses, il existe un gradient décroissant du taux d’IgA entre nez/gorge (ici mesuré dans la salive) et poumons (mesuré dans le liquide de lavage broncho-alvéolaire). Néanmoins, le taux d’IgA spécifiques est supérieur au taux d’IgG dans les deux compartiments analysés.
|
|
Dans les muqueuses, les IgA neutralisent le SARS-CoV-2
Après avoir analysé les contributions respectives des IgA et des IgG dans la réponse humorale générale à l’infection par le SARS-CoV-2, nous nous sommes intéressés aux acteurs de l’immunité muqueuse. En effet, les cellules épithéliales pulmonaires sont les premières cibles du SARS-CoV-2, et la réponse immunitaire des muqueuses peut différer de la réponse générale. Pour évaluer les anticorps présents au site de l’infection, nous avons collecté des échantillons de salive et de lavage broncho-alvéolaire. Contrairement aux IgA sériques, qui sont monomériques, les IgA du liquide broncho-alvéolaire se présentent sous forme monomérique et dimérique
1
. Tous les liquides broncho-alvéolaires testés avaient une capacité de neutralisation
in vitro
. Par ailleurs, des IgA anti-RBD ont été détectées dans la plupart des échantillons de lavage broncho-alvéolaire, alors que les taux des IgG anti-RBD étaient au-dessus du seuil de détection seulement dans la moitié de ces échantillons, suggérant que les IgA joueraient également un rôle prépondérant dans la neutralisation du virus dans les poumons. De même, dans la salive, l’activité de neutralisation du virus a pu être corrélée au taux des IgA anti-RBD, mais pas à celui des IgG anti-RBD.
|
Dans les premiers temps de l’infection par le SARS-CoV-2, les IgA, qu’elles soient monomériques ou dimériques, semblent jouer un rôle clé dans les mécanismes de défense contre le virus. Nos résultats ont d’ailleurs été confirmés par une équipe de recherche américaine qui, après avoir isolé et synthétisé
in vitro
les IgA et les IgG anti-SARS-CoV-2, ont comparé l’efficacité de ces IgA et IgG monoclonales, et ont pu vérifier la plus forte capacité de neutralisation du virus des monomères d’IgA par rapport à leurs équivalents IgG. De plus, l’activité neutralisante des IgA produites sous forme dimérique était encore bien plus forte que celle des IgA monomériques [
8
]. Cette efficacité des dimères d’IgA constitue un atout face à l’apparition de virus variants : même amoindrie par la présence de mutations dans le domaine RBD de la protéine de spicule, la capacité neutralisante des IgA dimériques représente une barrière probablement plus protectrice contre l’infection que celle des IgG monomériques. Il reste néanmoins à déterminer si la vaccination induit la production de ces IgA dimériques dans les muqueuses, comme cela est observé à la suite d’une infection.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Long
QX
,
Liu
BZ
,
Deng
HJ
,
et al.
Antibody responses to SARS-CoV-2 in patients with COVID-19.
.
Nat Med.
2020;
;
26
:
:845.
–
8
.
2.
Mazanec
MB
,
Kaetzel
CS
,
Lamm
ME
,
et al.
Intracellular neutralization of Sendai and influenza viruses by IgA monoclonal antibodies.
.
Adv Exp Med Biol.
1995;
;
371A
:
:651.
–
4
.
3.
Asahi-Ozaki
Y
,
Yoshikawa
T
,
Iwakura
Y
,
et al.
Secretory IgA antibodies provide cross-protection against infection with different strains of influenza B virus.
.
J Med Virol.
2004;
;
74
:
:328.
–
335
.
4.
Sterlin
D
,
Gorochov
G
.
When therapeutic IgA antibodies might come of age.
.
Pharmacology.
2021;
;
106
:
:9.
–
19
.
5.
Sterlin
D
,
Mathian
A
,
Miyara
M
,
et al.
IgA dominates the early neutralizing antibody response to SARS-CoV-2.
.
Sci Transl Med.
2021;
;
13
:
:eabd2223.
.
6.
Xiong
N
,
Fu
Y
,
Hu
S
,
et al.
CCR10 and its ligands in regulation of epithelial immunity and diseases.
.
Protein Cell.
2012;
;
3
:
:571.
–
580
.
7.
Shi
R
,
Shan
C
,
Duan
X
,
et al.
A human neutralizing antibody targets the receptor binding site of SARS-CoV-2.
.
Nature.
2020;
;
584
:
:120.
–
4
.
8.
Wang
Z
,
Lorenzi
JCC
,
Muecksch
F
,
et al.
Enhanced SARS-CoV-2 neutralization by dimeric IgA.
.
Sci Transl Med.
2021;
;
13
:
:eabf1555.
.
|