Le glucagon-like peptide 1 (GLP-1) est une hormone peptidique issue de la maturation post-traductionnelle du proglucagon. Elle est produite principalement par les cellules endocrines L intestinales [ 1 ], qui sont plus nombreuses dans l’iléon et le côlon. Le GLP-1 stimule la sécrétion d’insuline par les cellules β des îlots du pancréas lors des repas [ 2 ]. Cette activité « incrétine » du GLP-1 est dépendante de la glycémie [ 3 ]. Le GLP-1 agit également sur le cœur et sur l’estomac, comme l’indique la présence de récepteurs du GLP-1 dans ces organes [ 4 ]. Dans l’estomac, les récepteurs du GLP-1 sont présents sur les cellules pariétales, les cellules endocrines, les neurones du plexus myentérique et les terminaisons nerveuses du nerf vague. Le GLP-1 inhibe la sécrétion acide gastrique par une action directe sur la cellule pariétale, et par une action indirecte en augmentant la sécrétion de somatostatine par les cellules D gastriques [ 5 ]. De plus, le GLP-1 ralentit la vidange gastrique en provoquant une contraction du muscle pylorique [ 6 ]. Au cours d’un repas, cette action peut contribuer à réduire les variations glycémiques post-prandiales, ce qui contribuerait à l’homéostasie glucidique [ 7 ].
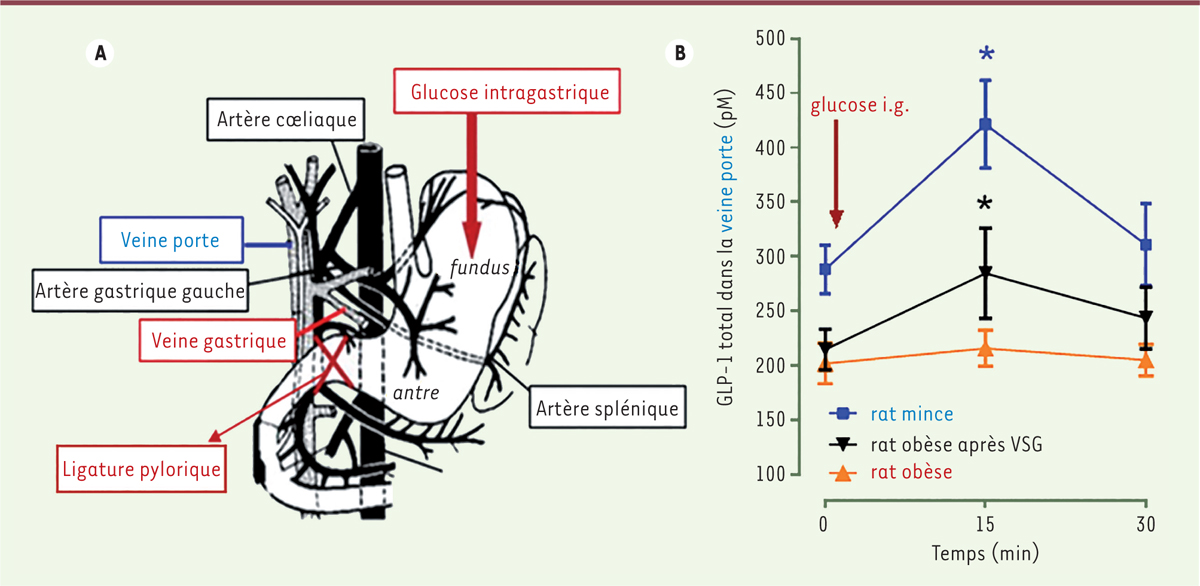
Toutefois, la possibilité que le GLP-1 produit par la partie distale de l’intestin atteigne les organes distants en concentration suffisante pour activer ses récepteurs est discutable du fait de sa demi-vie très brève, liée à une dégradation rapide par la dipeptidyl peptidase-4 (DPP-4). Cette question de distance entre lieu de production et lieu d’action a été en partie résolue par la mise en évidence du GLP-1 dans des extraits pancréatiques humains et des tumeurs pancréatiques productrices de proglucagon [ 8 ]. Le GLP-1 est co-localisé avec le glucagon dans les granules de sécrétion d’une sous-population de cellules α des îlots pancréatiques. En parallèle, la suppression tissu-spécifique, par génie génétique, de la production de GLP-1 dans des modèles murins a permis de suggérer que l’activité « incrétine » du GLP-1 résulterait en fait de sa synthèse locale dans le pancréas, et pas dans l’intestin [ 9 ]. Dans l’estomac, l’existence d’une petite population de cellules exprimant GLP-1 a été rapportée chez l’homme, le chien, le porc et le rat [ 10 – 12 ], mais elle a fait l’objet de nombreuses discussions, bien qu’une augmentation significative des taux circulants de GLP-1 après une charge en glucose par voie orale persiste en l’absence de la partie distale de l’intestin incluant l’iléon et le côlon, à la suite d’une résection chirurgicale chez l’homme [ 13 ]. La présence de cellules GLP-1 + produisant du GLP-1 bioactif, dans les muqueuses fundique et antrale de l’estomac vient d’être confirmée chez le rat et chez l’homme [ 14 ]. La densité et le nombre de ces cellules augmentent dans la muqueuse gastrique après chirurgie bariatrique, dans un modèle murin d’obésité nutritionnelle et chez l’homme. En outre, en réponse à une charge gastrique en glucose, les taux de GLP-1 dans la veine porte ( Figure 1 ) d’un rat mince participent à l’augmentation du taux circulant de cette hormone. Cette sécrétion gastrique de GLP-1 en réponse au glucose n’existe plus chez le rat obèse, mais une gastrectomie partielle par plicature ( vertical sleeve gastrectomy , VSG) la restaure chez ce dernier [ 14 ]. Les auteurs ont proposé que le GLP-1 produit par l’estomac aurait une action locale et contribuerait ainsi aux effets bénéfiques de cette chirurgie bariatrique, utilisée pour traiter l’obésité sévère.
| Figure 1.
Le glucose intragastrique augmente les concentrations de GLP-1 dans la veine porte. A.
Schéma de la vascularisation de l’estomac.
B.
Concentrations de GLP-1 total dans la veine porte avant (T0) et après une charge intragastrique (i.g.) de glucose (2 g/kg de masse corporelle) dans trois groupes de rats anesthésiés : minces, obèses, et obèses ayant subi une opération chirurgicale de gastrectomie partielle par plicature (VSG). Une ligature du pylore a été réalisée pour prévenir le passage du glucose dans le duodénum (ligature pylorique). Le GLP-1 a été quantifié par dosage radioimmunologique avec un anticorps anti-GLP-1, spécifique de toutes les formes moléculaires de ce peptide : GLP-1(7-36) amide, GLP-1(7-37), GLP-1(9-36) amide, GLP-1(9-37), GLP-1(1-36) amide, et GLP-1(1-37). Chaque point correspond à la moyenne ± erreur-type (
standard error of the mean
, s.e.m.) des valeurs obtenues chez 9 rats (* indique une différence statistiquement significative par rapport à la valeur à T0, au risque d’erreur
p
< 0,05). Noter qu’à l’état basal (T0) et en réponse à la charge en glucose, les concentrations de GLP-1 total dans le sang sont plus faibles chez le rat obèse que chez le rat mince.
|
Cette action locale du GLP-1 gastrique serait cohérente avec l’activation des récepteurs du GLP-1 du pylore et des terminaisons nerveuses vagales, conduisant à une réduction de la vidange gastrique. De plus, le GLP-1 produit par l’estomac pourrait atteindre le foie en concentration suffisante pour moduler la production et le métabolisme hépatique du glucose. En effet, l’injection de GLP-1 dans la veine porte active les afférences vagales hépatiques et augmente de manière synergique la sécrétion d’insuline stimulée par le glucose [ 15 ], des effets qui peuvent concourir à l’homéostasie du glucose. Enfin, il est à noter que les cellules du fundus et de l’antre gastrique exprimant GLP-1 produisent également de la ghréline et de la somatostatine, respectivement, ce qui illustre le fait qu’une même cellule endocrine peut produire et sécréter plusieurs hormones [ 16 ].
Les mécanismes impliqués dans la plasticité des cellules épithéliales gastriques (« gastroplasticité ») après une restructuration chirurgicale du tractus gastro-intestinal restent à comprendre. Cependant, il est possible que ces processus adaptatifs impliquent une reprogrammation de la différenciation des cellules endocrines le long du nouveau trajet des aliments.