| |
| Med Sci (Paris). 37(10): 948–950. doi: 10.1051/medsci/2021160.Inhiber pour mieux régner
Les systèmes anti-bactériens d’
Acinetobacter baumannii Quentin Boussau,1a Estée Grandidier,1b and Yazid Makmani1c 1École normale supérieure de Lyon, Département de biologie, Master biologie
,
Lyon
,
France MeSH keywords: Acinetobacter baumannii, Antibactériens, Bactéries, Multirésistance bactérienne aux médicaments, Humains, effets des médicaments et substances chimiques, pharmacologie |
Les systèmes d’inhibition de croissance contact-dépendants (CDI) sont des armes mises en place par de nombreuses bactéries Gram négatives pour attaquer d’autres bactéries compétitrices [
1
]. Ils sont composés de trois protéines : CdiA, CdiI et CdiB. CdiA est composée d’une partie N-terminale conservée, d’un domaine de liaison à un récepteur et d’un effecteur toxique dans sa partie C-terminale (CT). CdiI, quant à elle, est l’antitoxine de CdiA-CT [
1
]. Les deux molécules associées sont donc inactives. Enfin, CdiB est une protéine transmembranaire jouant le rôle de transporteur pour la toxine CdiA-CT vers la bactérie cible [
2
]. CdiB est ainsi assimilé à un système de sécrétion de type Vb [
3
]. L’ensemble des protéines produites par ces systèmes sont notées CdiABI.
Parmi les bactéries Gram négatives multirésistantes
, Acinetobacter baumannii
est devenue un problème sanitaire récurrent en étant à l’origine de nombreuses infections nosocomiales. L’étude des mécanismes impliqués dans ces infections est donc primordiale.
Roussin
et al.
s’intéressent à cette bactérie dans une étude du journal
Frontiers in Microbiology,
parue en 2019 [
4
]. Les auteurs ont identifié deux systèmes d’inhibition de croissance contact-dépendant (CDI) chez
Acinetobacter baumannii,
réduisant la formation de biofilms et l’adhérence sur la cellule cible des bactéries environnantes.
|
Acinetobacter baumannii
possède deux CDI différents
Par une approche bioinformatique de comparaison de séquences génomiques, Roussin
et al.
ont découvert deux CDI présents dans le génome de la souche DSM30011 d’
A. baumannii,
appelés Cdi
1
et Cdi
2
. Ils ont ensuite cherché à savoir si ces deux paires de toxines-antitoxines étaient interchangeables, c’est-à-dire si l’antitoxine CdiI
1
pouvait inhiber la toxine CdiA
2
et inversement. Pour cela, Roussin
et al.
ont transformé une souche d’
Escherichia coli
n’exprimant aucun CDI avec des plasmides permettant l’expression des différentes combinaisons possibles de couples toxines-antitoxines. Les bactéries
E. coli
exprimant la toxine CdiA
1
-CT ou la toxine CdiA
2
-CT montrent bien une inhibition de croissance, indiquant l’effet toxique de ces toxines. Seule l’antitoxine CdiI
1
restaure une croissance normale chez les bactéries exprimant CdiA
1
-CT et seule CdiI
2
chez les bactéries exprimant CdiA
2
-CT, démontrant que les deux paires de toxines-antitoxines ne sont pas interchangeables.
|
Les CdiA ont un effet toxique lorsqu’ils sont exprimés chez
E. coli
et jouent un rôle primordial dans la compétition bactérienne
La protéine CdiA
2
possède sur sa partie C-terminale (CT) un domaine similaire à une endonucléase, c’est-à-dire une enzyme dégradant l’ADN. Afin de vérifier que ce domaine a bien une activité endonucléasique, les chercheurs l’ont exprimé dans une bactérie modèle,
E. coli
, puis ont suivi en temps réel l’état du nucléoïde (ensemble du matériel génétique de la bactérie). Pour cela, ils ont visualisé l’ADN grâce à la microscopie à fluorescence en utilisant des bactéries exprimant des protéines HU, similaires aux histones eucaryotes, fusionnées avec une protéine fluorescente rouge. Ils observent alors que l’expression du gène codant CdiA
2
-CT chez
E. coli
induit une désorganisation du nucléoïde, puis une filamentation, conséquence de l’arrêt des divisions cellulaires. Cette désorganisation n’est pas observée si CdiI
2
, l’inhibiteur spécifique, est lui aussi produit dans la bactérie. Par ailleurs, les auteurs observent la formation d’agrégats de RecA, une protéine connue pour polymériser en cas de dommages à l’ADN, lorsque CdiA
2
est produite seule, ce qui confirme le lien entre désorganisation du nucléoïde et dommages à l’ADN et renforce l’hypothèse d’une activité endonucléasique de CdiA
2
.
CdiA
1
-CT n’induit quant à elle aucun dommage à l’ADN. En revanche, les auteurs ont mis en évidence une inhibition de la division bactérienne lorsque la toxine est exprimée chez
E. coli.
Les bactéries produisant CdiA
1
-CT seule sont en effet 25 % plus grandes que celles exprimant CdiA
1
-CT et CdiI
1
, et ne se divisent quasiment pas, contrairement aux bactéries sauvages qui se divisent généralement 4 fois plus.
Ainsi, ces deux toxines ont un effet antibactérien, soit par l’induction de dommages à l’ADN (CdiA
2
), soit par inhibition de la division des bactéries (CdiA
1
).
Les auteurs ont ensuite étudié l’action de ces systèmes lors d’expériences de compétitions
in vivo
. En conditions de laboratoire, les gènes du locus CDI
1
(région du chromosome comprenant le gène
cdi1
, c’est-à-dire permettant l’expression de l’ensemble des protéines CdiABI) s’expriment fortement alors que les gènes du locus CDI
2
s’expriment très peu. Cette différence d’expression pourrait être expliquée par la présence, dans la région promotrice de CdiB
2
, d’une boîte pho (à l’origine d’un mécanisme de régulation des gènes en fonction de la présence de phosphate), suggérant que son expression pourrait être régulée par la concentration en phosphate du milieu comme cela a déjà été observé chez
Pseudomonas aeruginosa
[
5
]. Le reste des expériences porte sur CDI
1
, qui est facilement observable en conditions de laboratoire.
Pour caractériser le fonctionnement
in vivo
de ce CDI, deux expériences de compétition inter-bactérienne ont été comparées. Des bactéries
A. baumannii
sans CDI
1
mais portant une cassette de résistance à la kanamycine ont été mises en compétition soit avec les bactéries d’une souche dont le CDI
1
est actif, soit avec les bactéries d’une souche dont le CDI
1
a été délété. Après quelques heures d’incubation, les bactéries sont placées sur milieu contenant de la kanamycine : seule la souche ayant la cassette se développe, et ce d’autant mieux que la compétition avec les souches sans cassette a été faible.
Le résultat obtenu montre que les bactéries de la souche avec cassette survivent 10 fois plus quand elles ont été incubées en présence des bactéries de la souche au CDI
1
délété. Les souches mutantes sont bien viables, montrant ainsi les différences de viabilité entre les deux expériences ne sont dues qu’à la compétition bactérienne. Par conséquent, les auteurs concluent que le locus CDI
1
est impliqué dans la compétition bactérienne
in vivo
chez
A. baumannii
. Les auteurs se sont ensuite intéressés à la virulence des souches ayant ces CDI.
|
Les CdiA semblent diminuer la formation de biofilms ainsi que les capacités d’adhérence d’
Acinetobacter Baumannii
Roussin
et al.
se sont alors demandés quel était le rôle de ce système dans la virulence d’
A. Baumannii
. Les protéines CdiA produites par différentes bactéries pathogènes étant connues pour leur rôle dans la formation de biofilms bactériens [
6
], les auteurs se sont intéressés à la formation de biofilms par
A. Baumannii
exprimant ou non CDI1. Ils ont alors observé que les bactéries
A. baumannii
au CDI
1
délété formaient significativement plus de biofilms par rapport aux bactéries sauvages. Ce système semble donc agir différemment chez
A. baumanii
!
De plus, ces protéines CdiA sont aussi connues pour leur rôle dans l’adhérence bactérienne aux cellules épithéliales [
6
]. Les auteurs ont donc analysé le pourcentage d’adhérence de bactéries exprimant ou non le CDI1 par microscopie confocale. Étonnamment, les bactéries au CDI
1
délété ont une adhérence trois fois plus importante que la souche sauvage, indiquant que le CDI
1
de
A. baumannii
limite l’adhérence bactérienne.
Ainsi, les auteurs concluent que le locus CDI
1
présent chez
A. baumannii
ne promeut pas seulement la compétition bactérienne, mais qu’il diminue également la propension des bactéries à créer des biofilms et leur capacité à adhérer aux cellules épithéliales.
|
Conclusion et perspectives
Les deux CDI mis en évidence chez cette souche d’
A. baumannii
promeuvent tous deux la compétition bactérienne, mais chacun par un mécanisme différent. Pour CDI
1
, le domaine C-terminal de la toxine bloque la division cellulaire sans endommager l’ADN (
Figure 1A
). Selon les auteurs, plusieurs hypothèses permettraient d’expliquer cela : la toxine pourrait dégrader les ARNt ou les ARNr comme c’est le cas pour d’autres CdiA [
7
], ou dissiper la force proton-motrice, ce qui diminuerait la quantité d’ATP disponible, comme c’est le cas pour le CdiA
EC93
d’
E. coli
[
8
]. La toxine de CDI
2
cause quant à elle des dommages à l’ADN (
Figure 1B
). Les paires toxines-antitoxines des deux systèmes n’étant pas interchangeables, cela pourrait suggérer une origine différente pour chaque système.
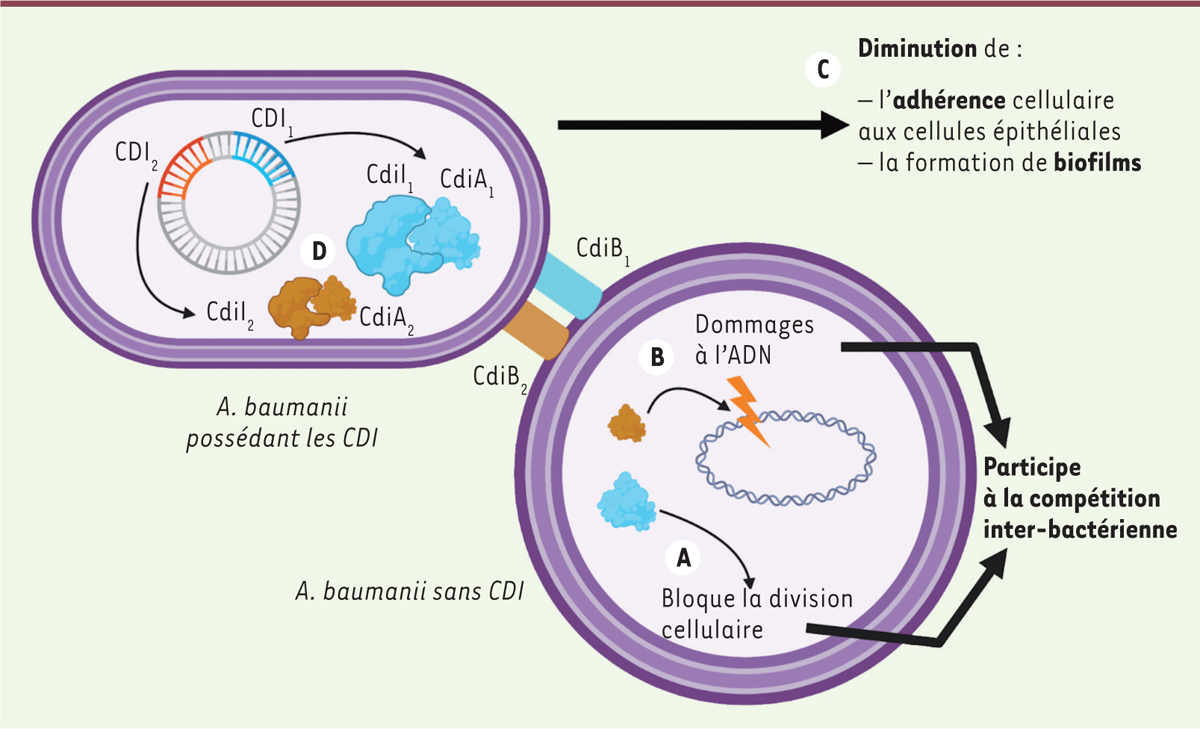
 | Figure 1.
Effet des CDI d’Acinetobacter baumannii lors d’une compétition contact-dépendante. A.
La sécrétion de CdiA
1
-CT à travers CdiB
1
bloque la division de la bactérie ciblée sans induire de dommages à l’ADN.
B.
La sécrétion de CdiA
2
-CT à travers CdiB
2
provoque des dommages à l’ADN.
C.
L’expression de ces gènes provoque une diminution de la formation de biofilms et de l’adhérence aux cellules épithéliales.
D.
La présence de CdiI
1
et CdiI
2
dans la bactérie émettrice la protège en cas d’attaque par une autre
A. baumannii
possédant le système et la protège de ses propres protéines.
|
Le CDI le plus exprimé chez
A. baumannii
DSM30011, CDI
1
, diminue l’adhérence des bactéries aux cellules épithéliales et la formation de biofilms (
Figure 1C
), contrairement à d’autres CDI déjà connus [
6
]. Néanmoins, ces CDI sont connus pour être multifonctionnels et avoir une régulation complexe, et certaines de leurs fonctions restent probablement à découvrir. Cela pourrait expliquer les effets surprenants du CDI
1
de
A. baumannii
observés par Roussin
et al.
.
De nouvelles pistes sont à explorer. Ainsi, il serait intéressant de comprendre quel est le rôle du système CDI dans le contexte d’une infection nosocomiale. Ce système est un modèle épithélial des voies respiratoires humaines qui permettrait d’observer l’infection en conditions similaires à celles
in vivo
, c’est-à-dire en présence de différentes cellules épithéliales et d’autres bactéries possiblement déjà présentes. En effet, connaître le rôle exact de CDI
1
lors d’une infection permettrait d’améliorer les traitements contre
A. baumannii
. Par ailleurs, comprendre quels paramètres de l’environnement sont susceptibles d’activer ces CDI, par exemple en plaçant les bactéries dans des milieux aux concentrations de phosphate différentes, rendrait l’expression de ces systèmes en laboratoire plus aisée. Cela permettrait d’élargir notre compréhension de ces derniers afin de saisir leurs fonctions et leur dynamique, et d’appréhender leur rôle complet chez les bactéries.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ikryannikova
LN
,
Kurbatov
LK
,
Gorokhovets
NV
,
et al.
Contact-dependent growth inhibition in bacteria: do not get too close!
Int J Mol Sci.
2020;
;
21
:
:7990.
.
2.
Ruhe
ZC
,
Subramanian
P
,
Song
K
,
et al.
Programmed secretion arrest and receptor-triggered toxin export during antibacterial contact-dependent growth inhibition.
.
Cell.
2018;
;
175
:
:921.
–
933
.
3.
Meuskens
I
,
Saragliadis
A
,
Leo
JC
,
et al.
Type V Secretion systems: an overview of passenger domain functions.
.
Front microbiol.
2019;
;
10
:
:1163.
.
4.
Roussin
M
,
Rabarioelina
S
,
Cluzeau
L
,
et al.
Identification of a contact-dependent growth inhibition (cdi) system that reduces biofilm formation and host cell adhesion of Acinetobacter baumannii DSM30011 Strain.
.
Front microbiol.
2019;
;
10
:
:2450.
.
5.
Faure
LM
,
Llamas
MA
,
Bastiaansen
KC
,
et al.
Phosphate starvation relayed by PhoB activates the expression of the Pseudomonas aeruginosa σvreI ECF factor and its target genes.
.
Microbiology.
2013;
;
159
:
:1315.
–
1327
.
6.
Garcia
EC
,
Perault
AI
,
Marlatt
SA
,
et al.
Interbacterial signaling via burkholderia contact-dependent growth inhibition system proteins.
.
Proc Natl Acad Sci USA.
2016;
;
113
:
:8296.
–
8301
.
7.
Willett
JLE
,
Ruhe
ZC
,
Goulding
CW
,
et al.
Contact-dependent growth inhibition (CDI) and CdiB/CdiA two- partner secretion proteins.
.
J Mol Biol.
2015;
;
427
:
:3754.
–
3765
.
8.
Aoki
SK
,
Webb
JS
,
Braaten
BA
,
et al.
Contact-dependent growth inhibition causes reversible metabolic downregulation in Escherichia coli.
.
J Bacteriol.
2009;
;
191
:
:1777.
–
1786
.
|