| |
| Med Sci (Paris). 37(10): 945–947. doi: 10.1051/medsci/2021159.Synergie entre pompes à efflux Rôle d’AcrAB-TolC dans l’initiation de la résistance aux antibiotiques Manuela Lizarralde-Guerrero1* and Florian Taraveau1** 1École normale supérieure de Lyon, Département de biologie, Master biologie
,
Lyon
,
France MeSH keywords: Antibactériens, Protéines bactériennes, Protéines Escherichia coli, Humains, Préparations pharmaceutiques, Plasmides, génétique |
La multiplication des souches bactériennes résistantes aux antibiotiques constitue un enjeu sanitaire majeur dans nos sociétés modernes. Ces résistances peuvent être acquises par transfert horizontal de gènes depuis une bactérie résistante. Le transfert horizontal se fait le plus souvent par conjugaison, un processus durant lequel une bactérie donneuse transfère un ADN circulaire simple brin issu d’un plasmide à une bactérie receveuse. La bactérie receveuse reforme ensuite le plasmide complet en synthétisant le brin complémentaire d’ADN. Cependant, plusieurs points restent à élucider concernant le rôle de ce transfert d’ADN pour la mise en place de résistances aux antibiotiques [
1
].
Dans leur travail, Nolivos
et al.
[
2
] cherchent à révéler les dynamiques d’acquisition de la résistance à la tétracycline par transfert horizontal du gène
tetA
. Ce gène code une pompe à efflux (TetA) capable d’exporter l’antibiotique hors de la cellule bactérienne. Néanmoins, la pompe TetA seule est insuffisante pour la mise en place de la résistance. En conséquence, l’intervention de la pompe à efflux non spécifique AcrAB-TolC a aussi été étudiée par les auteurs, apportant de nouvelles informations sur les mécanismes d’acquisition de résistance aux antibiotiques [
2
].
|
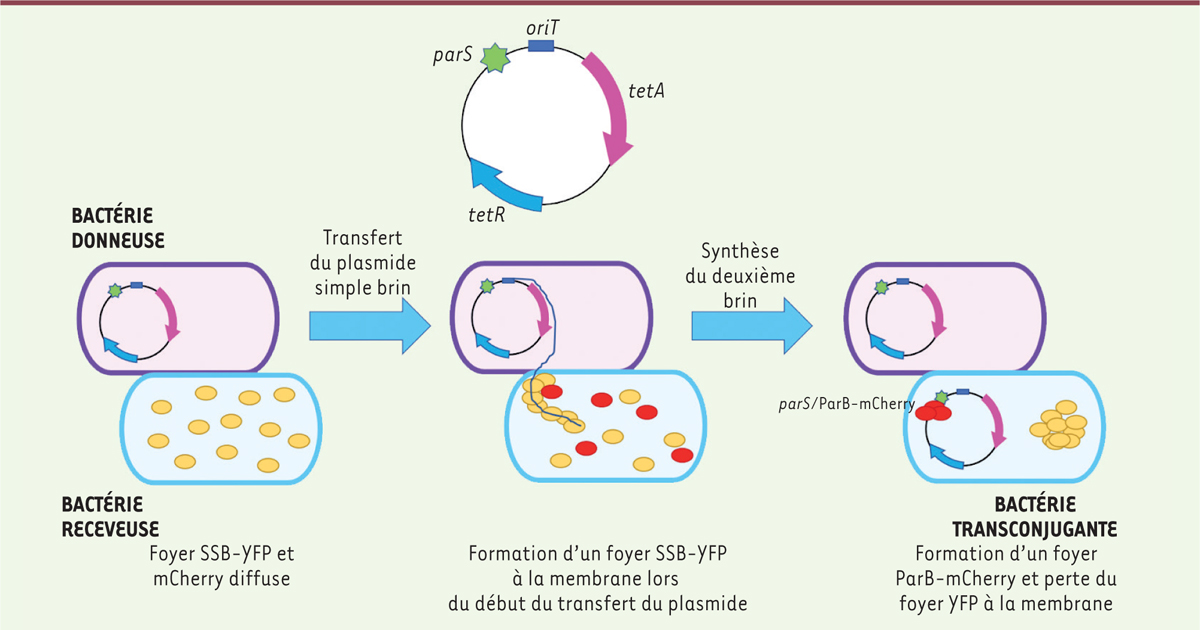
Le système de marquage ParABS permet de suivre en temps réel l’acquisition du plasmide de résistance
Dans cette étude, Nolivos
et al.
ont mis en place un ingénieux système chez la bactérie
Escherichia coli
permettant de suivre par microscopie le transfert par conjugaison bactérienne d’un plasmide contenant les gènes
tetA
et
tetR
(codant la pompe TetA et son inhibiteur TetR). Cette méthode utilise un couplage de la protéine SSB avec le du système ParABS. D’une part, la protéine SSB se lie à l’ADN simple brin et permet donc de marquer le plasmide au moment de son entrée dans la cellule receveuse. D’autre part, ParB a la capacité de se lier avec une affinité très forte à un site
parS
de l’ADN double brin [
3
]. Le site
parS
est ici inséré dans le plasmide dont on cherche à suivre le transfert, près du site d’origine de transfert,
ori
. Les cellules receveuses produisent le système SSB marqué par la
Yellow Fluorescent Protein
(YFP), ainsi que ParB fusionnée à la protéine fluorescente mCherry. Ainsi, le transfert du plasmide peut être visualisé par l’apparition de foyers SSB-YFP à la membrane plasmique de la cellule receveuse. Quand la synthèse d’ADN double brin du plasmide a ensuite lieu dans la cellule receveuse, ParB-mCherry est alors recrutée au site
parS
et forme des foyers détectables au microscope à fluorescence (
Figure 1
).
 | Figure 1.
Schéma explicatif du système ParB/parS permettant de marquer en temps réel l’acquisition du plasmide conférant la résistance à la tétracycline.
En jaune, YFP (marquant SSB). En rouge, mCherry (marquant ParB).
|
Dans une deuxième expérience, la pompe TetA a été marquée avec mCherry, et ParB avec la GFP. Initialement, seules les cellules donneuses produisent mCherry au niveau de leur membrane alors que les cellules receveuses produisent de la GFP de manière diffuse dans leur cytoplasme. Au cours de l’expérience, on observe l’apparition de bactéries transconjugantes – des cellules receveuses ayant désormais le plasmide – produisant de la GFP de manière localisée : ce sont les foyers ParB/
parS
. Ces transconjugants produisent également mCherry, marqueur de l’expression du gène
tetA
, et donc de l’acquisition de la résistance à l’antibiotique.
Grâce à ce modèle, les auteurs ont pu suivre l’entrée du plasmide porteur des gènes
tetA-tetR
, puis la transcription et la traduction de ces gènes. Ils ont ainsi observé que la production de la pompe TetA chez les transconjugants est significativement plus élevée que chez les cellules donneuses. Ce résultat inattendu suggère que l’absence de TetR (inhibiteur de l’expression de
tetA
) dans la cellule receveuse donne lieu à la production incontrôlée de TetA, avant que TetR ne soit également produit et que l’inhibition ne se mette en place. Pour vérifier cela, le transfert de plasmide a été testé sur des cellules receveuses exprimant constitutivement TetR. La production de TetA après transfert du plasmide est alors totalement inhibée, ce qui vient confirmer l’hypothèse avancée. Cet effet, aussi nommé induction zygotique, est fréquent lors des transferts d’ADN entre bactéries [
4
]. L’absence d’inhibiteur chez la cellule receveuse permet alors l’expression rapide de l’ADN reçu.
En bref, le système ParB/
parS
permet de suivre le transfert conjugatif du plasmide contenant les gènes
tetA-tetR
. Chez les transconjugants, la production de TetA est forte, suggérant que l’acquisition de la résistance à la tétracycline est bien effective.
|
En présence de tétracycline, la mise en place de la pompe TetA est ralentie mais reste possible Une des questions essentielles abordée par les auteurs est l’étude des processus qui peuvent mener des bactéries receveuses, initialement sensibles à la tétracycline, à acquérir une résistance par conjugaison dans un milieu contenant déjà l’antibiotique. La tétracycline est un antibiotique dit bactériostatique, c’est-à-dire qui ne tue pas les bactéries mais inhibe leur croissance de manière réversible. La pompe à efflux TetA offre aux bactéries un mécanisme de résistance à la tétracycline en excrétant l’antibiotique hors de la cellule. Néanmoins, si la tétracycline est déjà présente dans la cellule, la mise en place de la pompe TetA pourrait être affectée.
Pour étudier ce phénomène, les auteurs ont réalisé plusieurs séries de conjugaisons en présence ou en absence de tétracycline. La première observation rapportée est que la présence de tétracycline diminue fortement la production de TetA chez les transconjugants, sans l’empêcher complètement. Grâce au système de suivi de la conjugaison ParB/
parS
, il a pu être établi que la tétracycline n’influence pas le taux de réussite de la conjugaison. Une hypothèse peut alors être avancée en prenant en compte le mode d’action de la tétracycline. La tétracycline est un inhibiteur réversible de la traduction qui vient se fixer aux sous-unités ribosomiques [
5
] et peut donc, de cette manière, inhiber la traduction de toute nouvelle information génétique obtenue par la bactérie par transfert horizontal. Néanmoins, dans ce cas, pourquoi la présence de tétracycline ne suffit-elle pas à empêcher la traduction de TetA ? Une boucle positive d’activation pourrait être envisagée ici. Selon cette hypothèse, la production de quelques exemplaires de TetA permettrait d’exporter un peu de tétracycline hors de la cellule, laissant alors la possibilité de produire davantage de TetA et ainsi de lever progressivement l’inhibition. Néanmoins, grâce à l’utilisation de mutants de
tetA
(Δ
tetA
), les auteurs ont montré que la pompe à efflux TetA n’était impliquée ni dans sa propre traduction, ni dans le maintien de la traduction dans l’ensemble de la cellule : chez les mutants Δ
tetA
, la traduction est toujours maintenue à un niveau basal en présence de tétracycline. La réponse se trouve donc chez un autre acteur moléculaire de l’arsenal d’
Escherichia coli
.
|
Intervention de la pompe à efflux AcrAB-TolC dans l’acquisition de résistances aux antibiotiques en milieu défavorable
Suite aux expériences précédentes, l’hypothèse de l’intervention d’une autre pompe à efflux au sein de la cellule a été avancée. Chez
E. coli
, un tel complexe protéique existe et son rôle est déjà partiellement connu : la pompe AcrAB-TolC [
6
]. Il s’agit d’une pompe à efflux non spécifique dont l’activité est finement régulée et qui prend en charge une très grande variété de xénobiotiques.
Afin d’analyser le rôle d’AcrAB-TolC, des mutants des différentes sous-unités du complexe ont été obtenus (Δ
acrA,
Δ
acrB,
Δ
tolC
et des combinaisons des trois
)
et testés dans des conditions similaires à celles utilisées précédemment, en présence et en absence de tétracycline. Les résultats obtenus sont très clairs : lors de l’utilisation d’un mutant AcrAB-TolC (quel qu’il soit), la traduction, et donc la production de TetA, cesse complètement dans la cellule en présence de tétracycline. Cette action d’AcrAB-TolC a été étudiée de manière plus poussée par les auteurs, permettant de conclure que cette pompe à efflux, en participant à la sécrétion d’une partie de la tétracycline hors de la cellule bactérienne, permet de retarder et diminuer l’inhibition de la traduction. De cette manière, la production de TetA peut démarrer et l’acquisition de la résistance se met en place.
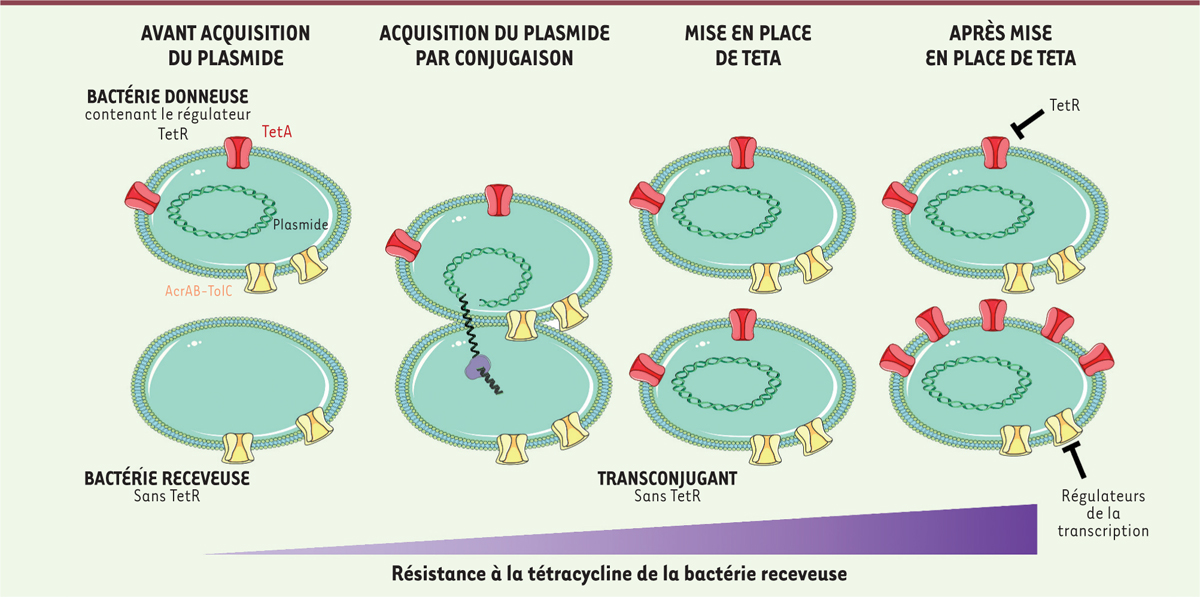
Il est finalement intéressant de noter que la production d’AcrAB-TolC est finement contrôlée, et est, en particulier, inhibée par des régulateurs de la transcription (
Figure 2
). Une mutation artificielle ciblant l’un de ces régulateurs provoque une augmentation de la quantité d’AcrAB-TolC, ce qui permet aux bactéries concernées d’éliminer rapidement des molécules antibiotiques. Cela faliciterait grandement l’apparition de résistances si une mutation semblable venait à se produire naturellement.
 | Figure 2.
Les pompes à efflux AcrAB-TolC (jaune) et TetA (rouge) agissent ensemble pour éliminer la tétracycline hors de la cellule bactérienne.
La production de TetA est inhibée par le répresseur TetR, tandis que celle de AcrAB-TolC est inhibée par différents régulateurs de la transcription ciblant au moins l’une des sous-unités de la pompe.
|
|
En conclusion, les transferts horizontaux permettent aux bactéries d’acquérir des résistances à une ou plusieurs molécules antibiotiques. Dans ce cadre, Nolivos
et al
montrent comment la pompe à efflux AcrAB-TolC facilite l’acquisition de ces résistances, comme c’est le cas avec la mise en place de la pompe TetA et l’acquisition de la résistance à la tétracycline. La concentration d’antibiotiques présente dans la bactérie est réduite par des pompes non spécifiques (AcrAB-TolC), permettant l’initiation de mécanismes de résistance spécifiques (pompe TetA). Il est intéressant de noter qu’AcrAB-TolC est un système couramment retrouvé chez les bactéries multirésistantes aux antibiotiques [
7
]. Ce système reste spécifique aux bactéries du genre
Escherichia
mais des systèmes similaires existent chez de très nombreux genres bactériens. Dans son ensemble, cette étude permet d’élucider un nouveau mécanisme que les bactéries utilisent pour contourner l’action des antibiotiques, ouvrant également de nouvelles pistes pour combattre ces phénomènes d’acquisition de résistance à ces derniers.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Lerminiaux
NA
,
Cameron
ADS
.
Horizontal transfer of antibiotic resistance genes in clinical environments.
.
Can J Microbiol.
2019;
;
65
:
:34.
–
44
.
2.
Nolivos
S
,
Cayron
J
,
Dedieu
A
,
et al.
Role of AcrAB-TolC multidrug efflux pump in drug-resistance acquisition by plasmid transfer.
.
Science.
2019;
;
364
:
:778.
–
782
.
3.
Bignell
C
,
Thomas
CM
.
The bacterial ParA-ParB partitioning proteins.
.
J Biotechnol.
2001;
;
91
:
:1.
–
34
.
4.
Feinstein
SI
,
Low
KB
.
Zygotic induction of the rac locus can cause cell death in E. coli.
.
Mol Gen Genet.
1982;
;
187
:
:231.
–
235
.
5.
Nguyen
F
,
Starosta
AL
,
Arenz
S
,
et al.
Tetracycline antibiotics and resistance mechanisms.
.
Biol Chem.
2014;
;
395
:
:559.
–
575
.
6.
Du
D
,
Wang
Z
,
James
NR
,
et al.
Structure of the AcrAB-TolC multidrug efflux pump.
.
Nature.
2014;
;
509
:
:512.
–
515
.
7.
Chowdhury
N
,
Suhani
S
,
Purkaystha
A
,
et al.
Identification of AcrAB-TolC efflux pump genes and detection of mutation in efflux repressor AcrR from omeprazole responsive multidrug-resistant Escherichia coli isolates causing urinary tract infections.
.
Microbiol Insights.
2019;
;
12
:
:1.
–
10
.
|