| |
| Med Sci (Paris). 37(10): 942–944. doi: 10.1051/medsci/2021158.Des interactions entre bactéries du microbiote pour compenser les effets de la malnutrition chez la drosophile Émilie Chabert1* 1École normale supérieure de Lyon, Département de biologie, Master Biosciences
,
Lyon
,
France MeSH keywords: Animaux, Bactéries, Drosophila, Malnutrition, complications |
Chez les animaux, la croissance est caractérisée par une prise de poids et une augmentation de la taille de l’individu. Outre les déterminants génétiques, l’apport nutritionnel lors de la phase juvénile est essentiel au bon déroulé de la croissance. Chez l’homme, la malnutrition pendant l’enfance conduit à de très graves séquelles, notamment des retards de croissance et des problèmes cognitifs [
1
,
2
]. De plus, de récentes études ont démontré que le microbiote intestinal, correspondant à l’ensemble des bactéries colonisant le tractus digestif, jouerait un rôle majeur dans le bon déroulé de la croissance. En effet, l’inoculation du microbiote d’enfants malnutris dans des souris initialement sans microbiote perturbe la croissance et conduit à des anomalies de la structure des os et des fonctions métaboliques de certains organes [
3
]. Au contraire, l’introduction de certaines souches de
Lactobacillus plantarum
maintient une croissance normale malgré une alimentation pauvre chez la souris et la drosophile [
4
,
5
]. Cependant, l’étude du microbiote est rendue difficile par l’abondance des espèces bactériennes dans le tractus intestinal. Ces bactéries forment un écosystème comprenant des réseaux métaboliques complexes. Comprendre les paramètres qui influencent spécifiquement la croissance n’est donc pas tâche aisée.
La drosophile est un organisme modèle particulièrement adapté à l’étude des interactions microbiote/hôte. En effet, elle possède un microbiote simple composé d’une dizaine d’espèces bactériennes seulement. Il est également facile de produire des lignées de drosophiles axéniques, c’est-à-dire sans microbiote, puis de les coloniser avec des souches bactériennes définies.
Pour essayer de mieux comprendre les mécanismes moléculaires des interactions entre le microbiote et l’hôte, Consuegra
et al.
[
6
] ont analysé la croissance de la larve de drosophile associée à ses deux bactéries commensales majoritaires :
Lactobacillus plantarum
et
Acetobacter pomorum
, dans des conditions de carence nutritive en acides aminés.
|
Le « dialogue métabolique » entre
Lactobacillus plantarum
et
Acetobacter pomorum
favorise l’accroissement de leurs biomasses respectives
Le cycle de vie de la drosophile dure 10 jours. L’embryon se développe en larve et grandit : cette étape correspond à la croissance juvénile. La larve forme ensuite une pupe et se métamorphose en adulte. Une carence nutritive chez une larve conduit à un retard de la métamorphose et à une taille réduite. L’inoculation de
L. plantarum
et
A. pomorum
dans l’intestin d’une larve axénique (sans microbiote) restaure une croissance similaire à celle observée en cas de régime alimentaire normal, ce qui n’est pas le cas lorsque les souches bactériennes sont introduites individuellement. Cette observation démontre la nécessité d’échanges métaboliques entre les deux espèces bactériennes pour avoir un effet bénéfique chez l’hôte. Les auteurs ont donc par la suite caractérisé les interactions entre les deux espèces bactériennes.
Les auteurs ont tout d’abord observé en culture liquide et dans l’intestin de la larve une augmentation de la biomasse des deux populations bactériennes en coculture par rapport aux monocultures. Ces observations suggèrent des échanges métaboliques bénéfiques entre les deux populations. Pour comprendre leurs interactions, les activités métaboliques des deux populations ont été analysées. Précédemment, les auteurs avaient démontré que
A. pomorum
est prototrophe, c’est-à-dire capable de fabriquer toutes les molécules organiques nécessaires à sa survie, alors que
L. plantarum
a besoin de capter certains acides aminés (arginine, isoleucine, leucine, valine, cystéine) et deux vitamines B (biotine et pantothénate) dans son milieu [
7
]. Dans cette nouvelle étude, les auteurs sont allés plus loin en montrant que
L. plantarum
co-cultivés avec
A. pomorum
est capable de se multiplier dans un milieu dépourvu des éléments pour lesquels la souche est auxotrophe. Ainsi,
A. pomorum
favorise la croissance de la population de
L. plantarum
en lui fournissant acides aminés et vitamines (
Figure 1
, flèche 1).
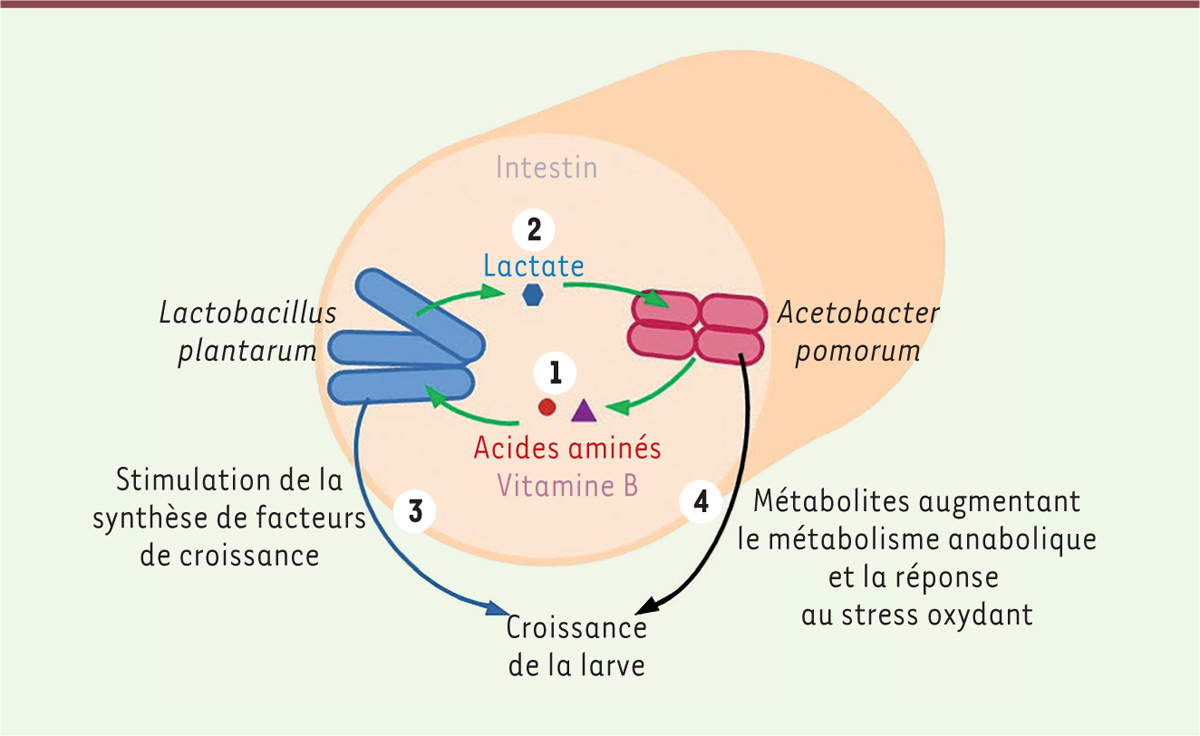
 | Figure 1.
Lactobacillus plantarum et Acetobacter pomorum limitent les effets délétères d’une alimentation pauvre en acides aminés chez la larve de drosophile.
L. plantarum
et
A. pomorum
interagissent au sein de l’intestin de la larve.
1.
L. plantarum
importe les acides aminés sécrétés par
A. pomorum
.
2.
A. pomorum
utilise le lactate produit par
L. plantarum
comme source additionnelle de carbone. Les interactions entre les deux bactéries bénéficient à l’hôte.
3.
L. plantarum
stimule la production de facteurs de croissance chez la larve.
4.
A. pomorum
fournit des métabolites impliqués dans l’anabolisme et la réponse au stress oxydant de la larve.
|
Réciproquement, les auteurs ont supposé que l’effet bénéfique de
L. plantarum
sur la biomasse d’
A. pomorum
pourrait passer par la production de sous-produits sécrétés par
L. plantarum
. En accord avec cette hypothèse, l’ajout du surnageant de
L. plantarum
dans une culture de
A. pomorum
augmente la croissance bactérienne. Consuegra
et al.
ont ensuite démontré que le lactate (ou acide lactique), produit majoritaire de la fermentation de
L. plantarum,
stimulait la croissance d’
A. pomorum
(
Figure 1
, flèche 2). En effet,
A. pomorum
importe le lactate extracellulaire et l’utilise comme source de carbone pour faire fonctionner différentes voies de biosynthèse. En particulier, la consommation de lactate par les bactéries
A. pomorum
augmente leur production et leur sécrétion d’acides aminés, dont certains sont nécessaires à la croissance de
L. plantarum
. Au final, les auteurs ont mis en lumière des interactions aboutissant à un bénéfice réciproque via l’échange de métabolites, conduisant à une augmentation de la biomasse de ces deux populations bactériennes.
|
Les interactions bénéfiques entre les deux espèces bactériennes modèrent les effets délétères de la malnutrition chez l’hôte
Consuegra
et al.
ont ensuite cherché à comprendre comment les interactions décrites plus haut pouvaient bénéficier à la larve face aux carences nutritives. Une étude précédente avait démontré que les bactéries du microbiote pouvaient directement servir de source de nutriments à la drosophile [
8
]. Par conséquent, les auteurs ont d’abord proposé que la biomasse bactérienne supplémentaire produite lors de l’interaction entre
L. plantarum
et
A. pomorum
pourrait servir de source de nutriments pour l’hôte et compenser ses carences nutritionnelles. Pour tester cette hypothèse, les auteurs ont inoculé les larves de drosophiles avec des bactéries mortes et ont ensuite soumis ces larves à un stress nutritif. Une légère amélioration de la croissance a été observée par comparaison aux drosophiles sans microbiote. Par conséquent,
L. plantarum
et
A. pomorum
constituent bien une ressource alimentaire pour l’hôte, mais ces observations indiquent que les bactéries doivent être métaboliquement actives pour exercer un effet complet.
Les auteurs ont ensuite supposé que les acides aminés sécrétés par
A. pomorum
en présence de lactate pourraient être directement absorbés par la larve et constituer une source de nutriments supplémentaire. Les acides aminés produits par
A. pomorum
en absence ou en présence de lactate ont été identifiés et quantifiés par chromatographie en phase liquide à haute performance, et les larves ont été nourries avec ces mélanges d’acides aminés. L’injection dans une drosophile axénique du mélange d’acides aminés sécrétés par
A. pomorum
en présence de lactate n’a pas d’effet positif sur la croissance. Cependant, lorsqu’on fournit à une drosophile inoculée avec
L. plantarum
le même mélange d’acides aminés, on observe une restauration de la croissance malgré l’alimentation pauvre. Ainsi, les acides aminés produits par
A. pomorum
en présence de lactate ne bénéficient pas directement à l’hôte, mais accentuent l’activité bénéfique de
L. plantarum
sur l’hôte (
Figure 1
, flèche 3). Cette activité a été détaillée dans une publication précédente et consiste à augmenter la production de facteurs de croissance appelés DILP (
Drosophila insulin-like peptides
), des peptides analogues aux IGF (
insulin growth factors
) des mammifères [
5
].
Une larve colonisée par
A. pomorum
seule
e
t nourrie avec du lactate a une croissance accélérée par rapport à une larve axénique. Ainsi,
A. pomorum
a également un effet positif sur l’hôte, dépendant du lactate mais indépendant de
L. plantarum
. L’hypothèse des auteurs est que cet effet serait dépendant de l’utilisation du lactate par
A. pomorum
. Pour tester cette hypothèse, les auteurs ont inoculé chez la drosophile des souches mutantes
de A. pomorum
incapables d’utiliser le lactate et ont montré qu’aucun effet bénéfique sur l’hôte n’était observé. Les auteurs ont ensuite déterminé les métabolites spécifiquement produits par
A. pomorum
en présence de lactate, par chromatographie en phase liquide à haute performance et spectrométrie de masse. Au total, 45 métabolites ont été identifiés. Parmi eux, sont présentes la cystéinylglycine et la spermidine, deux métabolites impliqués dans la résistance au stress oxydant chez l’hôte.
A. pomorum
libère aussi des sous-produits impliqués dans différentes voies anaboliques de l’hôte comme des ribonucléotides ou des cofacteurs d’enzymes [
9
]. Ces métabolites pourraient constituer un apport nutritionnel supplémentaire pour la larve et l’aider à maintenir une croissance normale malgré la malnutrition (
Figure 1
, flèche 4). D’autres études seront nécessaires pour identifier le rôle précis de ces métabolites sur le métabolisme de l’hôte.
|
Le modèle simplifié de microbiote présenté dans cet article met en lumière une coopération trophique étroite entre les bactéries de l’intestin chez la drosophile. Ce dialogue métabolique assure aux deux partenaires une multiplication optimale et, par conséquent, leur offre un avantage pour coloniser efficacement l’intestin de l’hôte. Les auteurs mettent aussi en lumière la façon dont l’hôte profite des sous-produits sécrétés par les bactéries pour combler les potentielles carences de son régime alimentaire et retrouver ainsi une croissance normale. Au vu des effets spectaculaires de l’association de
Lactobacillus plantarum
et
Acetobacter pomorum
chez la drosophile, on peut légitimement s’interroger sur leur impact en physiologie humaine. Les effets bénéfiques observés en cas de malnutrition pourraient être atténués chez l’homme car contrairement aux expériences présentées précédemment, la flore intestinale humaine est constituée de bien plus de deux espèces bactériennes. Des études chez des mammifères comme la souris pourraient apporter des premiers éléments de réponse sur l’utilité potentielle de ces bactéries en tant que probiotiques.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Dewey
KG
,
Begum
K
.
Long-term consequences of stunting in early life.
.
Matern Child Nutr.
2011;
;
7
(
(suppl 3)
):
:5.
–
18
.
2.
Goyal
MS
,
Venkatesh
S
,
Milbrandt
J
,
et al.
Feeding the brain and nurturing the mind: Linking nutrition and the gut microbiota to brain development.
.
Proc Natl Acad Sci USA.
2015;
;
112
:
:14105.
–
14112
.
3.
Blanton
LV
,
Charbonneau
MR
,
Salih
T
,
et al.
Gut bacteria that prevent growth impairments transmitted by microbiota from malnourished children.
.
Science.
2016;
;
351
:
:aad3311.
.
4.
Schwarzer
M
,
Makki
K
,
Storelli
G
,
et al.
Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition.
.
Science.
2016;
;
351
:
:854.
–
857
.
5.
Storelli
G
,
Defaye
A
,
Erkosar
B
,
et al.
Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing.
.
Cell Metab.
2011;
;
14
:
:403.
–
414
.
6.
Consuegra
J
,
Grenier
T
,
Akherraz
H
,
et al.
Metabolic cooperation among commensal bacteria supports Drosophila juvenile growth under nutritional stress.
.
iScience.
2020;
;
23
:
:101232.
.
7.
Consuegra
J
,
Grenier
T
,
Baa-Puyoulet
P
,
et al.
Drosophila-associated bacteria differentially shape the nutritional requirements of their host during juvenile growth.
.
PLoS Biol.
2020;
;
18
:
:e3000681.
.
8.
Bing
X
,
Gerlach
J
,
Loeb
G
,
et al.
Nutrient-dependent impact of microbes on Drosophila suzukii development.
.
mBio.
2018
;
:9.
.
9.
Mishra
D
,
Thorne
N
,
Miyamoto
C
,
et al.
The taste of ribonucleosides: novel macronutrients essential for larval growth are sensed by Drosophila gustatory receptor proteins.
.
PLoS Biol.
2018;
;
16
:
:e2005570.
.
|