| |
| Med Sci (Paris). 37(10): 910–919. doi: 10.1051/medsci/2021143.La fatigue chronique, un symptôme trop souvent négligé I. Une immunité dérégulée à son origine ? Alain Trautmann1* 1UMR CNRS 8104, Inserm 1016, université Paris Descartes, Institut Cochin
,
rue Méchain
,
75014Paris
,
France |
Vignette (© Alain Trautmann).
Une version anglaise est disponible à l’adresse
https://www.medecinesciences.org/10.1051/medsci/2021143/olm
La fatigue chronique est un syndrome associé à de nombreuses maladies comme le cancer, les maladies neurodégénératives, les syndromes post-infectieux ou les rhumatismes inflammatoires chroniques. Comme cette fatigue chronique est difficile à mesurer et qu’elle n’est pas spécifique d’une maladie, elle est considérée comme inclassable et trop souvent négligée, malgré la souffrance importante qu’elle engendre chez ceux qui en sont affectés. Dans cet article, notre postulat de départ est de considérer que la fatigue associée à ces différentes maladies, même avec des points de départ différents, met en jeu des mécanismes communs qu’il importe d’élucider. On cherchera d’abord à préciser les points communs et les différences entre la fatigue chronique pathologique et la fatigue physiologique éprouvée après un effort physique ou intellectuel important. Pour comprendre l’impact de ces mécanismes sur la fatigue chronique, nous examinerons, dans une deuxième partie, les conséquences possibles sur le cerveau d’une inflammation périphérique chronique. |
Fatigue aiguë et fatigue chronique La fatigue physiologique ressentie après un effort physique intense est due à des phénomènes assez bien connus. Le fonctionnement musculaire nécessite la production abondante d’ATP (adénosine triphosphate) par les mitochondries, au sein de toutes les cellules vivantes, qui ont besoin pour cela, la plupart du temps, de glucose et d’oxygène. Le manque d’un de ces éléments entraîne une baisse de la force contractile musculaire. Ainsi, l’anémie peut être une cause fréquente de fatigue. Quand elle est due à une carence de vitamine B12 ou à un défaut d’érythropoïétine (EPO), elle est facilement traitée par la prise de vitamine B12 ou d’EPO (ce que les coureurs cyclistes professionnels n’ignorent pas…).
Incidemment, on peut se demander si la fatigue intellectuelle procède de mécanismes similaires, localisés au niveau cérébral et non pas musculaire. Il n’y a pas aujourd’hui de réponse claire à cette question. On peut néanmoins préciser que, durant un effort cérébral soutenu, il est possible de mesurer une augmentation de consommation de glucose d’environ 12 %, sans qu’une variation globale de la consommation d’oxygène soit observée [
1
]. Rappelons que, bien que le poids d’un cerveau d’adulte moyen ne représente que 2 % du poids du corps, en l’absence d’effort physique ou intellectuel, celui-ci consomme 20 % de l’énergie disponible. Une activité intellectuelle intense modifie peu cette consommation de base déjà très importante. Du moins globalement, car pendant une tâche intellectuelle précise, on peut observer par IRMf (imagerie par résonance magnétique fonctionnelle) des augmentations ou des diminutions locales du signal BOLD (
blood-oxygen-level-dependent signal
)
1
[
2
]. On ne peut donc pas exclure que la fatigue intellectuelle soit, comme la fatigue musculaire, liée à une production localement insuffisante d’ATP, mais il est probable que la fatigue intellectuelle corresponde à des mécanismes plus complexes.
La fatigue physiologique se résout normalement par le repos et un sommeil réparateur. Comme elle est transitoire, on peut parler de fatigue aiguë, par analogie avec une inflammation aiguë, elle aussi transitoire.
Mais il existe une autre fatigue, perçue même en l’absence d’effort physique. Chronique, elle est ressentie par la plupart des personnes souffrant de maladies neurodégénératives, ou couramment observée après certaines infections (mononucléose infectieuse, grippe, Covid-19). La maladie donnant lieu à une fatigue chronique qui a été la mieux étudiée est le syndrome de fatigue chronique (SFC) ou en anglais, ME/CFS (
myalgic encephalomyelitis/chronic fatigue syndrome
), une dénomination qui souligne son association avec une neuro-inflammation et des douleurs musculo-squelettiques. La définition et même la réalité du SFC ont fait l’objet de débats importants depuis plus de 30 ans. Les principaux éléments considérés aujourd’hui comme caractéristiques du SFC sont 1) une fatigue chronique débilitante, source de souffrance mentale majeure pour le patient, durant au moins six mois ; 2) un malaise post-effort avec aggravation des autres symptômes après un effort ou un stress, et une récupération anormalement lente ; ce trait, appelé SEID, (
systemic exercice intolerance disease
) est parfois utilisé comme dénomination alternative au ME/CFS ; 3) un sommeil non réparateur ; 4) des troubles cognitifs (mémoire, capacité de concentration) ; et, parfois, 5) une intolérance orthostatique survenant lors d’une position verticale prolongée (pour des revues récentes sur le SFC, voir [
3
–
5
]).
Les fatigues aiguë et chronique partagent certaines caractéristiques. En particulier, il est possible de distinguer dans les deux cas une fatigue périphérique et une fatigue centrale. La première se traduit par une réponse amoindrie à une stimulation directe du muscle. La seconde se déduit de l’amplitude réduite de myopotentiels évoqués par la stimulation magnétique transcrânienne du cortex moteur [
6
].
La fatigue chronique a cependant de nombreuses caractéristiques qui lui sont propres, à commencer par une composante métabolique. En particulier, il a été montré que les leucocytes, ou PBMC (
peripheral blood mononuclear cells
), de personnes souffrant de SFC présentent des anomalies dans l’expression de plusieurs protéines mitochondriales, fondamentales pour la production d’ATP. Ces anomalies peuvent s’expliquer par l’hypothèse d’un déficit dans la production d’ATP, avec une compensation partielle de ce déficit qui aboutit, paradoxalement, à une augmentation du stress oxydant avant un effort, et plus encore après [
7
,
8
]. Cette hypothèse est parfaitement cohérente avec les résultats d’une analyse portant sur la fonction respiratoire de PBMC isolés de patients souffrant de SFC [
9
]. Ce stress oxydant excessif reflète sans doute un dysfonctionnement des mitochondries, mais aussi une expression trop faible d’une des principales molécules qui permettent de limiter ce stress : les protéines de choc thermique ou hsp (
heat-shock proteins
) [
10
]. L’existence d’un tel stress oxydant excessif peut être facilement mesurée en dosant des facteurs sériques, comme les TBARS (
thiobarbituric acid-reactive substances
) ou des peroxydes lipidiques, qui signent une oxydation excessive, et en évaluant, en parallèle, le niveau de molécules anti-oxydantes, comme le RAA (
reduced ascorbic acid
) [
10
]. Il peut donc y avoir une origine en partie périphérique (hors du système nerveux central) de la fatigue chronique, mais de nombreux éléments supplémentaires nécessitent d’être pris en compte pour comprendre l’origine de cette fatigue.
|
Fatigue chronique post-infectieuse et importance des IFN-α/β (
Figure 1
)
Une fatigue marquée associée à une infection est une expérience commune. Elle met fréquemment en jeu les interférons (IFN) de type I (IFN-α et IFN-β). Lors d’une infection virale, toutes les cellules, y compris les plus différenciées comme les neurones ou les hépatocytes, sont capables de produire un peu d’IFN-α/β. Ces molécules induisent un ralentissement considérable de la transcription d’ADN en ARN, donc de la production de protéines par la cellule. En se mettant ainsi au ralenti, la cellule empêche la réplication du virus et sa transmission aux cellules voisines. Une analyse de plus de 600 métabolites, présents dans le plasma de sujets souffrant de SFC ou de sujets sains, a permis de montrer que, malgré l’hétérogénéité de la maladie, une signature métabolique de cette dernière pouvait être dégagée. Elle se caractérise par un hypométabolisme qui évoque le
dauer
, un état ressemblant à l’hibernation, qui permet aux cellules de survivre au ralenti dans un environnement hostile [
11
]. L’hypométabolisme induit par les IFN-α/β, déterminant pour leur action anti-virale, repose sur l’activation de centaines de gènes, les ISG (
interferon stimulated genes
), dont la famille de protéines Schlafen (SLFN) (« dormir », en allemand) [
12
]. Le rôle absolument décisif des IFN-α/β dans la défense antivirale peut être illustré par le fait que, au cours de la longue co-évolution entre virus et mammifères, la plupart des virus ont développé un arsenal anti-IFN-α/β capable d’affaiblir les défenses antivirales de l’hôte qu’ils infectent, un arsenal particulièrement efficace chez les coronavirus comme le SARS-CoV-2 (
severe acute respiratory syndrome coronavirus 2
) responsable de la COVID-19 [
13
].
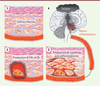 | Figure 1.
(1) Une cellule infectée par un virus dans laquelle il se réplique produit des IFN-α/β lorsque sa présence est détectée (2).
Ces interférons qui induisent la transcription de gènes spécifiques, les ISG (
interferon-stimulated genes
), tarissent la synthèse des protéines dans la cellule et bloquent ainsi la réplication virale, non seulement dans la cellule infectée mais aussi dans les cellules voisines.
(3)
Ces interférons déclenchent localement une réponse inflammatoire. Les cytokines pro-inflammatoires ainsi produites peuvent passer dans le sang et
(4)
atteindre le cerveau, où elles déclenchent neuro-inflammation et fatigue.
|
Les IFN-α/β sont également de puissants inducteurs de fatigue. Ainsi, chez le rat, l’injection d’une molécule provoquant la production des IFN-α/β induit très rapidement leur changement de comportement : les animaux se déplacent lentement et semblent léthargiques. Tout se passe comme s’ils étaient soudain fatigués, et leur température corporelle s’élève [
14
]. Chez l’homme, le traitement par les IFN-α/β de patients infectés par le virus de l’hépatite C déclenche une très importante fatigue qui peut persister longtemps après l’arrêt des injections [
15
]. Cette fatigue induite par le traitement s’ajoute à celle due à l’infection elle-même, notamment en raison de la production d’IFN-α/β par l’organisme en réponse à cette infection.
D’un point de vue évolutif, on peut chercher un sens à cette association de trois effets déclenchés par les IFN-α/β : un arrêt de la production de protéines, une fièvre et une fatigue marquée. Tous trois contribuent à la lutte antivirale. La fièvre augmente nettement l’efficacité du système immunitaire et diminue la réplication virale (très ralentie au-delà de 39°C). La fatigue empêche la personne infectée de dépenser dans des efforts physiques, une énergie alors nécessaire au fonctionnement du système immunitaire. Ce « confinement forcé » du sujet infecté, induit par la fatigue, limite aussi ses interactions avec d’autres individus, ce qui ralentit la propagation du virus dans la population. Il n’est certes pas prouvé, mais envisageable qu’un tel mécanisme, en étant sélectionné par l’évolution, ait contribué à améliorer la résistance des mammifères aux infections virales. C’est lors de la phase aiguë (infectieuse) qu’un tel mécanisme pourrait avoir un intérêt évolutif. Il n’en aurait en revanche aucun lors de la phase chronique (post-infectieuse), puisqu’à ce stade le patient n’est plus contagieux.
Comme lors d’une infection, les IFN-α/β pourraient également être à l’origine de la fatigue que ressentent les personnes dont le cancer est traité par chimio- ou radiothérapie. En effet, l’efficacité de ces traitements semble associée au déclenchement de la production d’IFN-α/β [
16
], qui présente une toxicité plus importante pour des cellules à division rapide, comme les cellules tumorales, que pour des cellules saines [
17
]. La fatigue associée aux traitements de certains cancers pourrait donc être due à des mécanismes similaires à ceux impliqués dans la fatigue post-infectieuse, et s’ajouter aux conséquences de l’anémie souvent induite par les molécules anti-métaboliques anti-cancéreuses.
L’action des IFN-α/β peut perdurer,
via
l’activation prolongée de certains ISG. Néanmoins, les IFN-α/β et les ISG qu’ils induisent, n’expliquent pas à eux seuls la fatigue post-infectieuse qui est retrouvée non seulement en cas d’infection virale mais aussi en cas d’infection bactérienne, comme dans la forme persistante de la maladie de Lyme
(Encart 1)
. Les mécanismes sous-jacents à la fatigue qui suit une infection bactérienne sont mal compris. On notera cependant qu’un taux anormalement élevé des IFN-α/β a été mesuré chez des patients souffrant de Lyme long [
18
], ce qui est compatible avec notre hypothèse d’un rôle majeur des IFN-α/β dans la fatigue post-infectieuse. En irait-il de même pour ce que l’on nomme désormais le
Covid long
, cette maladie observée chez les personnes ayant été infectées par le SARS-CoV-2 et qui présentent des persistants invalidants pendant des mois.
|
Immunité dérégulée, auto-immunité et mimétisme moléculaire
Comment une infection peut-elle déboucher sur une immunité dérégulée de façon durable ? Il existe de nombreux exemples de maladies autoimmunes apparues à la suite d’une infection. Il n’est cependant pas évident d’établir s’il existe un lien de causalité entre les deux, et il est vain de chercher à identifier un pathogène précis et une molécule pathogénique comme origine d’une maladie autoimmune. Un exemple de cette situation concerne la sclérose en plaque (SEP) et le phénomène de mimétisme moléculaire, ou
molecular mimicry (Encart 2).
|
Si la majorité des personnes ayant développé une maladie de Lyme après une piqûre de tique infectée par la bactérie
Borrelia
sont guéries par un traitement antibiotique approprié, 10 à 20 % d’entre elles
1
[
38
] développent une pathologie chronique appelée PTLDS (
post-treatment Lyme disease syndrome
).
Le PTLDS est défini par la conjonction de quatre éléments [
39
,
40
] : 1) un syndrome polymorphe associant fatigue chronique sévère, algies diffuses et troubles de la cognition, avec notamment atteinte de la mémoire immédiate et brouillard cérébral (
brain fog
) ; 2) la preuve d’une borréliose antérieure correctement traitée ; 3) l’absence de borréliose active avérée ; et 4) l’absence d’autres diagnostics (rhumatologique, neurologique, psychiatrique). Le PTLDS fait l’objet de vives controverses entre les infectiologues qui minimisent sa fréquence et sa gravité, et affirment l’inutilité de traitement antibiotique (ATB) [
41
–
43
], et ceux qui soulignent sa gravité et conseillent les traitements ATB d’épreuve [
40
,
44
,
45
]. Le SPPT, ou symptomatologie/syndrome persistant(e) polymorphe après une possible piqûre de tique [
46
], est équivalent au PTLDS, excepté pour le deuxième critère qui retient simplement la
possibilité
d’une piqûre de tique, sans certitude de borréliose passée.
On regroupera ici PTLDS et SPPT sous le terme de
Lyme long
. Les difficultés de son diagnostic sont associées à l’absence fréquente de souvenir de la piqûre de tique et/ou à une sérologie négative, dans plus de 20 % des neuroborrélioses, et, enfin, à l’implication d’agents pathogènes co-infectants qui ont été injectés par la tique [
47
].
Des pathogènes persistants sont-ils impliqués dans le Lyme long ? Certains, convaincus de leur absence, se fondent sur 1) le fait que le syndrome résisterait à un traitement ATB de un à trois mois, et 2) l’absence de pathogène détectable par PCR (
polymerase chain reaction
) chez ces patients, la maladie devant être probablement d’origine auto-immune [
43
].
Aux mêmes faits, une autre interprétation peut être donnée : 1) les ATB utilisés actuellement contre
Borrelia
en monothérapie n’ont pas une efficacité optimale, comparable à l’efficacité d’un cocktail de trois ou quatre ATB utilisés dans le traitement de la tuberculose [
48
]. On a en effet détecté des
Borrelia
dans différents tissus, dont le cerveau, à l’autopsie de patients traités avec la doxycycline [
49
,
50
] et,
in vitro
, cet ATB est totalement inefficace contre les formes dormantes de
Borrelia
[
51
] ; 2) la sensibilité de détection de
Borrelia
dans le sang par PCR est faible, ne serait-ce que parce que son abondance est bien moindre dans le sang que dans des tissus conjonctifs par exemple [
52
]. Il a été montré que l’efficacité d’un traitement ATB était plus grande à trois mois qu’à un mois [
53
]. Ce résultat a été critiqué dans un article au protocole discutable [
42
] et qui, au passage, montre bien la sévérité du Lyme long chez des personnes ayant développé un PTLDS malgré un traitement ATB par voie intraveineuse de trois semaines. Enfin, les médecins convaincus de l’utilité de prolonger des traitements ATB ne publient pas leurs résultats. Seuls des essais cliniques encadrés et publiés permettront de trancher la question de l’utilité ou de la dangerosité réelles de tels traitements prolongés.
Face à un Lyme long, nul ne peut avoir aujourd’hui de certitude, ni sur l’absence ni sur la présence de
Borrelia
chez ces patients. Si
Borrelia
est présente, la santé du patient devrait être améliorée par un traitement ATB d’épreuve avec un ATB efficace, et de nouveaux ATB ont été proposés [
54
,
55
]. Cela dit, une amélioration clinique en réponse à un ATB indique la présence pathogénique d’une ou plusieurs bactéries, mais ne prouve évidemment pas qu’il s’agisse nécessairement de
Borrelia
. D’autres bactéries peuvent avoir un effet pathogène à la suite d’une piqûre de tique, que ce soit des bactéries co-infectantes, ou des bactéries apportées par une infection ultérieure. Enfin, il peut y avoir une translocation pathologique de bactéries, depuis le microbiote intestinal, qui auraient quitté leur niche initiale [
40
]. Quelle que soit l’interprétation correcte, si un traitement ATB d’épreuve peut aboutir à une amélioration clinique, il devrait pouvoir être tenté (dans l’intérêt du patient) dans le cadre d’un essai clinique, contribuant ainsi à l’avancement des connaissances.
|
|
L’apparition de la SEP
dans les Îles Féroé en 1943 a coïncidé avec la présence d’un cantonnement de troupes britanniques pendant la seconde guerre mondiale. La présence des premiers cas de SEP à proximité de ce cantonnement a conduit à l’hypothèse d’un lien avec une maladie infectieuse contagieuse. Une explication communément admise, mais très discutable, est que le phénomène de mimétisme moléculaire, ou
molecular mimicry,
ait induit une auto-immunité. L’idée est que des fragments du pathogène peuvent être identiques à des fragments de protéines de l’hôte, comme la myéline, et que des anticorps dirigés initialement contre le pathogène lient également des protéines de l’hôte, provoquant une rupture de tolérance vis-à-vis de ses propres molécules, et donc la maladie. Si l’hypothèse est séduisante, sa démonstration n’a jamais pu être faite [
56
]. Dans le cas de la SEP aux Îles Féroé, de longues enquêtes ont été menées pour déterminer quel pouvait être l’agent infectieux initial. Elles n’ont jamais abouti [
57
]. La raison de cet échec est sans doute qu’il n’y a pas d’agent infectieux initial unique, mais plusieurs possibles. L’explication linéaire ne tient pas, celle qui recherche un pathogène précis, une molécule pathogénique précise, et le mimétisme moléculaire avec une molécule du soi.
|
|
Les interférons de type I (principalement les IFN-α/β) et de type II (IFN-g) sont des molécules déterminantes pour notre défense contre des pathogènes. Outre leur nom, elles partagent une partie de leur signalisation intracellulaire. Leurs importances fonctionnelles respectives sont distinctes. Les IFN-α/β sont les molécules-clés de la défense antivirale. Leur action aboutit à inhiber toute transcription, et ce faisant, à ralentir la réplication et la propagation des virus, et à alerter le système immunitaire de l’existence d’un danger local. Les IFN-α/β peuvent être produits par la plupart des cellules subissant une infection virale, et exercer des effets ubiquitaires.
En revanche, le nombre de cellules capables de produire l’IFN-g ou d’en être la cible est beaucoup plus limité. Cette cytokine est surtout produite, notamment lors d’une infection, par certains lymphocytes T activés, et certaines cellules NK (
natural killer
). Une cible majeure de cet IFN-g sont des cellules myéloïdes, les monocytes/macrophages, que l’IFN-g contribue à activer fortement. Sur un site infectieux ou inflammatoire, dans le dialogue entre lymphocytes T et monocytes/macrophages, ces derniers peuvent stimuler les lymphocytes en leur présentant des antigènes, et en retour être activés par l’IFN-g produit par les lymphocytes T. Cet échange bidirectionnel d’informations entre lymphocytes et cellules myéloïdes est très utile pour le développement d’une réponse anti-infectieuse. Le même type de dialogue peut cependant entraîner des effets délétères sur un site inflammatoire où peuvent se retrouver des lymphocytes T auto-réactifs et des monocytes activés, chacune de ces cellules entretenant alors l’état d’activation de l’autre, favorisant ainsi une chronicisation de l’inflammation. Cela pourrait expliquer le taux sérique d’IFN-g anormalement élevé chez des personnes souffrant de SFC, du moins dans la première phase de la maladie [
58
]. C’est aussi cohérent avec le fait que certains polymorphismes du gène codant l’IFN-g (
IFNG
) peuvent être associés à des SFC sévères [
59
], ainsi qu’à une autre catégorie de polymorphisme touchant le rétro-contrôle négatif de l’activation des lymphocytes T, qui empêche normalement un emballement de cette réponse. Ainsi, un polymorphisme risquant de prolonger excessivement la durée de la réponse T,
via
un dysfonctionnement des molécules PTPN22 (
protein tyrosine phosphatase non-receptor type 22
)
1
et CTLA-4 (
cytotoxic T-lymphocyte-associated protein 4
) augmente le risque de développer un SFC après un épisode infectieux [
60
].
|
|
La notion d’ASIA (
autoimmune/inflammatory syndrome induced by adjuvants
) a été proposée en 2011 par Yehuda Shoenfeld. Elle vise à proposer une explication à l’origine d’un syndrome très ressemblant au SFC, qui serait déclenché, chez certains individus, par une réponse immunitaire forte, en l’absence d’infection [
61
]. Quatre maladies ont été regroupées sous ce terme : la siliconose, le syndrome de la guerre du Golfe, le syndrome de myofasciite à macrophages, et les phénomènes post-vaccinaux. Dans chacun de ces cas, l’activation des cellules myéloïdes par un adjuvant provoquerait une dérégulation durable du système immunitaire, chez des personnes ayant une susceptibilité génétique et une histoire immunitaire appropriées. Ces quatre maladies partagent un ensemble de signes et de symptômes qui suggèrent l’existence d’un dénominateur commun. D’où le concept d’ASIA.
La siliconose a été observée chez une minorité de patientes ayant eu un implant mammaire, mais c’est une minorité qui ne peut être négligée. Pour le syndrome de la guerre du Golfe, on sait que les anciens combattants américains avaient tous reçu un vaccin contre l’anthrax, en six injections, contenant comme adjuvant des sels d’aluminium et du squalène. Quasiment tous ces vétérans avaient développé des anticorps anti-squalène, même si tous n’étaient pas malades. La myofasciite à macrophages [
62
] a une composante locale (inflammation au site d’injection d’un vaccin avec des sels d’aluminium, avec un infiltrat de macrophages contenant, des années après, des inclusions d’aluminium) [
63
], et une maladie auto-immune inflammatoire chronique avec une kyrielle de symptômes, dont une fatigue chronique majeure et des troubles cognitifs importants et durables [
64
]. Quant aux maladies chroniques post-vaccinales, pour être peu fréquentes, elles n’en sont pas moins sévères et durables pour les patients qui en souffrent. Face à cela, deux risques d’erreurs majeures existent : d’un côté une attitude
anti-vax
(anti-vaccin) systématique, de l’autre la négation dogmatique de l’existence de telles maladies.
|
Une raison pour écarter le mimétisme moléculaire dans le développement d’une maladie auto-immune comme la SEP, est que cette hypothèse repose sur le rôle central des lymphocytes T et B qui seraient les uniques responsables de cette maladie. Or on sait désormais que c’est inexact. Il est en effet établi que toute personne en bonne santé possède un grand nombre de lymphocytes et d’anticorps autoréactifs. Ceux-ci participent donc au système immunitaire normal, à son développement et à son maintien dans un état fonctionnel [
19
]. Posséder des lymphocytes autoréactifs n’est donc pas problématique. C’est uniquement lorsque ces lymphocytes se multiplient massivement et s’activent que la situation se dégrade. Cette dégradation doit beaucoup à un troisième type de cellules immunitaires, les cellules myéloïdes, constituées des monocytes et des macrophages inflammatoires.
L’hypothèse que nous privilégions pour le développement des maladies autoimmunes, comme alternative au mimétisme moléculaire, est celle des dégâts collatéraux résultant d’une immunité dérégulée et du phénomène de
bystander activation
, mal traduit en français par
activation aléatoire de proximité
. Selon cette hypothèse, une maladie autoimmune serait due à l’activation excessive d’un réseau cellulaire et moléculaire comprenant monocytes et macrophages inflammatoires, lymphocytes T et B, et autoanticorps, ainsi que d’autres cellules de l’immunité. Au sein de ce réseau, chaque élément le constituant activerait un ou plusieurs autres éléments. Les anticorps sont des protéines, les immunoglobulines, formées d’une partie comprenant des domaines variables (VH et VL), le Fab (pour
fragment antigen binding
), qui assure la reconnaissance spécifique d’antigènes très variés, et d’une partie constante, appelée région Fc (pour
fragment crystallisable
). Lorsqu’une bactérie (ou un virus) est reconnue par des anticorps spécifiques des antigènes qu’elle exprime, elle se retrouve hérissée de ces immunoglobulines (généralement d’isotype G, ou IgG). Ainsi « décoré », le pathogène sera mieux reconnu par les monocytes ou les macrophages qui expriment à leur surface des récepteurs spécifiques de la région Fc des IgG, les RFcg : c’est ce qui est appelé opsonisation par anticorps. Cette fixation aux cellules myéloïdes dépendant des anticorps est à l’origine de la phagocytose des particules opsonisées (bactéries ou virus) par ces cellules, qui deviennent cytotoxiques en produisant quantité de radicaux toxiques, nitrosylés (comme l’oxyde d’azote, NO) et oxygénés (comme H
2
O
2
), ce qui provoque une véritable « javellisation » de l’environnement. Ces macrophages seront également stimulés par l’IFN-g, une cytokine notamment produite par les lymphocytes T CD4
+
activés lors de l’infection
(Encart 3)
, eux-mêmes stimulés lors de la présentation par les macrophages des antigènes produits par ces derniers après la phagocytose des pathogènes.
L’opsonisation, lorsqu’elle est efficace (reposant sur des anticorps abondants ayant une bonne affinité vis-à-vis des antigènes bactériens ou viraux), contribue ainsi puissamment à l’élimination des pathogènes. Cependant, lorsqu’elle est inefficace (lors de certaines infections ou en raison, par exemple, d’un vaccin induisant des anticorps peu affins ou peu abondants ou qui ne sont pas neutralisants et qui permettent néanmoins la fixation du pathogène aux cellules cibles
via
les récepteurs des immunoglobulines sans le neutraliser), l’opsonisation peut être à l’origine d’un mécanisme redoutable : la facilitation par anticorps ou ADE (
antibody-dependent enhancement
). L’ADE aura pour conséquence, chez certains individus de provoquer une maladie plus sévère que chez les sujets ne présentant aucun anticorps, ceux-ci procurant au virus une voie d’entrée dans la cellule. C’est ce qui est observé avec la dengue hémorragique, pour laquelle les sujets ayant développé une réponse humorale sont plus sujets à développer une maladie sévère qui se traduit par des hémorragies fatales. C’est aussi ce qui a été observé aux Philippines à la suite d’un programme de vaccination contre ce même virus de la dengue par le vaccin Dengvaxia, qui a été lié à de nombreux décès, ce qui a conduit, de plus, à une chute de la confiance de la population dans la vaccination en général, notamment contre la rougeole et la Covid-19 [
20
]. Deux mécanismes sont impliqués dans l’ADE : 1) la facilitation de l’entrée du virus dans les cellules qui expriment des RFcg, comme les macrophages, qui contribuent à la dissémination du virus aux autres cellules de l’organisme ; et 2) une activation de ces macrophages par les « complexes immuns » formés entre IgG et pathogènes [
21
]. Toute perturbation du système immunitaire (infection, parfois vaccination) est susceptible d’activer ce réseau entre anticorps et cellules potentiellement dangereux. Et pour cela, nul besoin de mimétisme moléculaire particulier. Un simple traumatisme accidentel, non infectieux, peut, en provoquant la mort de nombreuses cellules, saturer le dispositif d’élimination des cellules mortes par les macrophages. Une telle saturation peut conduire à l’activation de ce réseau délétère, et ainsi provoquer la multiplication et la stimulation de lymphocytes T et B autoréactifs qui préexistent et sont inoffensifs quand ils sont en faible nombre. De simples adjuvants peuvent suffire, parfois, à provoquer une réponse immunitaire qui se chronicise et conduit au syndrome ASIA (
autoimmune/inflammatory syndrome induced by adjuvants
), un syndrome ressemblant au SFC apparaissant chez des sujets dont le système immunitaire est très actif en dehors de toute infection
(Encart 4)
. Des phénomènes inflammatoires peuvent également être observés chez des sujets dont les macrophages présentent un dysfonctionnement dans leur capacité à éliminer des pathogènes intracellulaires par autophagie ou xénophagie
2
. Plusieurs polymorphismes de gènes du système d’autophagie (
ATG, autophagy-related genes
) ont ainsi été mis en cause dans les phénomènes d’autoinflammation [
22
].
Reste à expliquer comment une telle immunité dérégulée peut devenir chronique et être impliquée dans des maladies chroniques sévères, et la fatigue qui leur est associée. |
L’immunité individuelle a une histoire et plusieurs mémoires L’existence d’une fatigue chronique associée à une immunité dérégulée de façon durable demande une analyse de ce qu’est la mémoire immunitaire et de ce que sont les cellules dans lesquelles est inscrite cette mémoire.
La mémoire immunitaire qui s’installe à la suite d’une infection est couramment attribuée aux lymphocytes T et B mémoire. Il s’agit donc d’une réponse qui repose principalement sur l’immunité adaptative. Pourtant, si l’importance de ce concept et sa réalité physiologique établies de longue date restent incontestables, une mémoire immunitaire, indépendante de cette immunité, et reposant sur le système immunitaire inné a récemment été révélée. Ce mécanisme de mémoire, nommé
trained immunity
(ou immunité entraînée) dans le travail pionnier de Mihai Netea [
23
,
24
] est également appelé
mémoire innée
. Ce terme confine à l’oxymore, puisqu’une mémoire est nécessairement acquise. Mais, en l’occurrence, cette mémoire est bien acquise, bien que par des cellules qui ont été jusque-là catégorisées comme centrales dans l’immunité innée, d’où ce raccourci.
Cette mémoire aurait pour support, après une infection et sa résolution, des modifications persistantes de cellules telles que les monocytes et macrophages, les cellules NK (
natural killer
), les cellules endothéliales, ainsi que des modifications touchant leurs cellules progénitrices (les cellules souches). Ces dernières modifications permettraient de comprendre comment cette mémoire peut perdurer des mois, bien au-delà de la durée de vie des cellules immunitaires innées, qui n’est que de quelques jours [
24
,
25
].
La mémoire innée repose en fait non sur des rérrangements de gènes, comme c’est le cas de la mémoire adaptative, mais sur des modifications épigénétiques
3
, avec l’ouverture ou la fermeture de la chromatine qui permet de transcrire les gènes, et qui peut ainsi aboutir soit à un état sensibilisé (ouvert), soit à un état de tolérance immune (fermé). Ainsi, lors d’une seconde infection, la mémoire innée se traduira soit par une réponse amplifiée, soit par une réponse atténuée. On comprend cependant encore mal le mécanisme qui permet de basculer dans une direction plutôt que dans l’autre.
Cette modification durable des cellules innées peut avoir un impact sur la réponse immunitaire contre une seconde infection, et cela non seulement lorsque le deuxième pathogène infectieux est identique au premier, mais bien au-delà. Cette mémorisation croisée de divers stress infectieux subis, permet de comprendre comment une vaccination par le BCG (bacille de Calmette et Guérin), utilisé contre la tuberculose, peut améliorer la réactivité du système immunitaire contre une grande variété d’agents pathogènes comme
Mycobacterium tuberculosis
mais aussi
Candida albicans
ou
Schistosoma mansoni
[
24
] et peut-être même le SARS-CoV-2 [
26
].
Cette mémoire innée peut être induite par des bactéries pathogènes mais également par des bactéries commensales, et donc par le microbiote, cet ensemble de bactéries peuplant nos épithéliums. Dans l’intestin, lorsque l’intégrité de l’épithélium est altérée par une inflammation par exemple, des bactéries présentes peuvent migrer de la lumière de l’intestin vers les vaisseaux et les ganglions lymphatiques intestinaux, voire au-delà. C’est que l’on nomme la translocation bactérienne. Dans certaines maladies inflammatoires, des bactéries intestinales typiques, comme
Tropheryma Whipplei
ont ainsi été détectées… dans les articulations des patients [
27
].
Le système immunitaire a donc plusieurs mémoires. Une mémoire à long terme, qui repose sur les lymphocytes T et B et sur les anticorps que les lymphocytes B produisent lorsqu’ils se sont différenciés en plasmocytes. Cette mémoire peut parfois durer quelques années, par exemple après une vaccination contre le tétanos, ce qui nécessite alors des rappels vaccinaux réguliers. Elle peut aussi durer toute la vie, comme c’est le cas pour des maladies infantiles (rougeole, oreillons, rubéole). Une mémoire à plus court terme qui dure probablement quelques mois existe également. Il s’agit de la mémoire innée. Cette mémoire innée des stress infectieux passés, persiste lorsqu’elle repose sur des modifications épigénétiques touchant des cellules souches, ou des cellules à longue durée de vie, comme les neurones. Ces deux mémoires ne sont pas complètement indépendantes puisque des auto-antigènes présentés par les cellules myéloïdes ont un rôle dans l’activation des lymphocytes autoréactifs. |
Le syndrome d’activation mastocytaire
Nous avons vu le rôle important des IFN-α/β dans la fatigue persistante induite par une infection virale. Nous avons également examiné comment une infection pouvait déréguler le système immunitaire par le mécanisme de
bystander activation
qui implique lymphocytes et monocytes/macrophages. Une telle dérégulation peut également mettre en jeu les mastocytes. Ces cellules, qui jouent un rôle de sentinelles à proximité des vaisseaux de tissus richement vascularisés, comme le poumon, la muqueuse intestinale, la peau et le cerveau, peuvent être activées de multiples façons : par les TLR (
Toll-like receptors
), des détecteurs de pathogènes exprimés également par les monocytes/macrophages ; mais aussi par des allergènes, reconnus par des IgE spécifiques fixées aux récepteur RFcε de type I (en anglais FcεRI) de haute affinité des mastocytes. Activés par ces différents récepteurs, les mastocytes libèrent de nombreuses molécules, dont l’histamine, des médiateurs lipidiques (prostaglandines et leucotriènes), du TNF-a (
tumor necrosis factor alpha
), etc.
Dans un contexte inflammatoire dans lequel sont produits des cytokines inflammatoires ou des neuropeptides (comme la substance P), l’activation des mastocytes fonctionne comme un amplificateur de l’inflammation primaire. Une activation excessive, incontrôlée, de ces cellules, peut alors être responsable du syndrome d’activation mastocytaire (SAMA, en anglais MCAS,
mast cell activation syndrome
), dans lequel on retrouve l’association d’une inflammation chronique, d’une fatigue extrême, d’un brouillard cérébral, et de douleurs musculo-articulaires. Ce syndrome est difficile à diagnostiquer et à traiter.
L’activation des mastocytes
via
les FcεRI, peut être traitée par des molécules appelées stabilisateurs de mastocytes, comme le cromoglycate de sodium. Ces dernières agissent en bloquant leur dégranulation qui est induite par la liaison de l’allergène aux IgE fixées aux FcεRI (ce qui produit le pontage – ou
cross-linking
– de ces derniers et l’activation de la signalisation). Malheureusement, si l’efficacité de nombre de ces inhibiteurs a pu être montrée
in vitro
, leur efficacité
in vivo
reste très limitée. Ces inhibiteurs n’interfèrent pas avec les autres voies d’activation des mastocytes rappelées ci-dessus (TLR ou substance P). Une certaine efficacité a été observée avec des inhibiteurs de récepteurs histaminiques de type H1, comme le ketotifène, mais cette molécule est loin d’inhiber l’ensemble des conséquences dues à une activation mastocytaire massive.
|
Régime alimentaire, inflammation et microbiote
On sait désormais que le régime alimentaire peut influer sur une inflammation chronique. L’existence de liens entre régime alimentaire et inflammation est en effet reconnue, en particulier l’association entre obésité et état inflammatoire. Ce régime peut donc aussi, probablement, avoir un impact sur la fatigue qui est souvent associée à l’état inflammatoire. Les mécanismes permettant d’expliquer cette association méritent d’être rappelés. Faisons pour cela faire un détour en examinant les processus impliqués dans la régulation du taux de glucose sanguin chez les mammifères. Le niveau de glucose dans le sang (glycémie) est efficacement régulé. Mais il est loin d’être constant : après un repas copieux, ce taux peut doubler ; il redescendra dans les heures qui suivent le repas pour être normalisé [
28
], notamment par des mécanismes qui permettent la transformation du glucose (en excès) en triglycérides qui seront stockés dans les adipocytes. La masse de tissu adipeux, constitué de ces cellules, est elle aussi régulée, notamment par le TNF-a [
29
]. Chez le sujet sain, cette cytokine est présente, mais en faible quantité dans le tissu adipeux. Chez le sujet obèse, en revanche, son taux augmente fortement dans ce tissu. Le TNF-a est alors déversé dans le sang périphérique où il contribue à l’état inflammatoire général que l’on observe chez ces individus.
Au cours d’un jeûne, le taux de glucose dans le sang diminue [
30
] mais cette baisse est compensée progressivement par l’apparition d’un autre carburant : les corps cétoniques (KB,
ketone bodies
). Les corps cétoniques sont produits essentiellement par le foie à partir des lipides libérés par les adipocytes [
31
]. Ils représentent un excellent carburant pour la production d’ATP par les cellules et sont aussi efficaces que le glucose pour la production d’énergie. Ils ont en outre un rôle anti-inflammatoire, notamment dans le cerveau, où ils représentent un apport essentiel en cas de carence [
32
]. Ces corps cétoniques sont quasiment absents du sang d’un individu bien nourri. Leur taux sanguin ne s’élève qu’après quelques jours de jeûne. À ce moment, le glucose est devenu rare et il n’est plus stocké dans les adipocytes. La production de TNF-a est alors réduite, ce qui contribue à l’instauration d’un état anti-inflammatoire. Ces effets, pro-inflammatoires d’une nourriture excessive, riche en carbohydrates, et, au contraire, anti-inflammatoires du jeûne, sont connus depuis très longtemps [
33
]. Ils reposent en partie sur une modification de la composition du microbiote intestinal [
34
], dont les bactéries assurent certaines étapes de la digestion et de l’assimilation des nutriments. Par leur action sur les cellules immunitaires présentes dans la muqueuse intestinale, les bactéries du microbiote influencent le système immunitaire [
35
]. Une catégorie très importante de molécules que ces bactéries produisent lors de la digestion d’aliments riches en fibres, est représentée par les acides gras à chaîne courte (SCFA,
short chain fatty acids
). Plusieurs de ces molécules ont des propriétés anti-inflammatoires. Une étude récente a ainsi montré le bénéfice remarquable, pour des patients atteints de SEP, de la complémentation de leur nourriture avec l’acide propionique, l’un de ces SCFA [
36
].
On sait maintenant que plus les populations bactériennes peuplant notre microbiote sont variées, plus celui-ci est équilibré et efficace pour la digestion des aliments, mais aussi pour assurer l’équilibre de notre système immunitaire. Le jeûne augmente cette diversité bactérienne. À l’inverse, une alimentation riche la fait décroître (pour revue, voir [
37
]). Ces données pourraient donc plaider en faveur d’une utilisation d’un jeûne encadré pour ses vertus potentiellement anti-inflammatoires. Il nous faut néanmoins insister sur le fait que la plupart des conclusions sur le lien entre régime alimentaire et inflammation ont été obtenues chez des souris. Et les hommes ne sont pas des souris…
Les données sur l’effet du jeûne chez l’homme restent encore incomplètes. Il est donc difficile de recommander cette approche pour ses vertus anti-inflammatoires, d’autant que la privation de nourriture prolongée peut avoir de nombreuses conséquences délétères, notamment en affaiblissant le système immunitaire. Une base scientifique existe cependant pour recommander aux personnes souffrant d’une inflammation chronique d’avoir une alimentation équilibrée sans excès, pauvre en carbohydrates et riche en fibres. Mais des études restent nécessaires afin de déterminer le bien-fondé de ce type de régime. |
Dans cette première partie, nous avons rappelé comment des infections pouvaient entraîner une inflammation et une fatigue persistantes, et modifier durablement le fonctionnement du système immunitaire, en mettant en jeu le phénomène de
bystander activation
, qui peut entraîner des phénomènes d’auto-immunité pathologique, et de mémoire du système immunitaire inné (
trained immunity
), le tout pouvant être amplifié par une activation excessive des mastocytes. L’état d’inflammation global, ou inflammation de bas grade, peut être influencé par le régime alimentaire et la composition du microbiote intestinal. Pour comprendre l’impact de ces phénomènes sur la fatigue chronique, il faudra examiner comment une inflammation périphérique peut être à l’origine d’une neuro-inflammation, et d’une activation chronique de l’axe hypothalamus-hypophyse-glande surrénale. Cela sera l’objet de la deuxième partie de cette revue.
|
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Madsen
PL
,
Hasselbalch
SG
,
Hagemann
LP
,
et al.
Persistent resetting of the cerebral oxygen/glucose uptake ratio by brain activation: evidence obtained with the Kety-Schmidt technique.
.
J Cereb Blood Flow Metab.
1995;
;
15
:
:485.
–
491
.
2.
Raichle
ME
.
Two views of brain function.
.
Trends Cogn Sci.
2010;
;
14
:
:180.
–
190
.
3.
Gerwyn
M
,
Maes
M
.
Mechanisms explaining muscle fatigue and muscle pain in patients with myalgic encephalomyelitis/chronic fatigue syndrome (me/cfs): a review of recent findings.
.
Curr Rheumatol Rep.
2017;
;
19
:
:1.
.
4.
Morris
G
,
Maes
M
,
Berk
M
,
et al.
Myalgic encephalomyelitis or chronic fatigue syndrome: how could the illness develop?
.
Metab Brain Dis.
2019;
;
34
:
:385.
–
415
.
5.
Sweetman
E
,
Noble
A
,
Edgar
C
,
et al.
Current research provides insight into the biological basis and diagnostic potential for myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS).
.
Diagnostics.
2019;
;
9
:
:73.
.
6.
Jammes
Y
,
Retornaz
F
.
Understanding neuromuscular disorders in chronic fatigue syndrome.
.
F1000Res.
2019
;
:8.
.
7.
Jammes
Y
,
Steinberg
JG
,
Delliaux
S
,
et al.
Chronic fatigue syndrome combines increased exercise-induced oxidative stress and reduced cytokine and Hsp responses.
.
J Intern Med.
2009;
;
266
:
:196.
–
206
.
8.
Sweetman
E
,
Kleffmann
T
,
Edgar
C
,
et al.
A SWATH-MS analysis of myalgic encephalomyelitis/chronic fatigue syndrome peripheral blood mononuclear cell proteomes reveals mitochondrial dysfunction.
.
Jl Transl Med.
2020;
;
18
:
:365.
.
9.
Missailidis
D
,
Sanislav
O
,
Allan
CY
,
et al.
Cell-based blood biomarkers for myalgic encephalomyelitis/chronic fatigue syndrome.
.
Int J Mol Sci.
2020;
;
21
:
:1142.
.
10.
Jammes
Y
,
Steinberg
JG
,
Delliaux
S
Chronic fatigue syndrome: acute infection and history of physical activity affect resting levels and response to exercise of plasma oxidant/antioxidant status and heat shock proteins.
.
J Intern Med.
2012;
;
272
:
:74.
–
84
.
11.
Naviaux
RK
,
Naviaux
JC
,
Li
K
,
et al.
Metabolic features of chronic fatigue syndrome.
.
Proc Natl Acad Sci USA.
2016;
;
113
:
:E5472.
–
E5480
.
12.
Mavrommatis
E
,
Fish
EN
,
Platanias
LC
The schlafen family of proteins and their regulation by interferons.
.
J Interferon Cytokine Res.
2013;
;
33
:
:206.
–
210
.
13.
Feuillet
V
,
Canard
B
,
Trautmann
A
.
Combining antivirals and immunomodulators to fight COVID-19.
.
Trends Immunol.
2021;
;
42
:
:31.
–
44
.
14.
Yamato
M
,
Tamura
Y
,
Eguchi
A
,
et al.
Brain Interleukin-1β and the intrinsic receptor antagonist control peripheral Toll-like receptor 3-mediated suppression of spontaneous activity in rats.
.
PLoS One.
2014;
;
9
.
15.
Russell
A
,
Hepgul
N
,
Nikkheslat
N
,
et al.
Persistent fatigue induced by interferon-alpha: a novel, inflammation-based, proxy model of chronic fatigue syndrome.
.
Psychoneuroendocrinology.
2019;
;
100
:
:276.
–
285
.
16.
Guerin
MV
,
Regnier
F
,
Feuillet
V
,
et al.
TGFβ blocks IFNα/β release and tumor rejection in spontaneous mammary tumors.
.
Nat Commun.
2019;
;
10
:
:4131.
.
17.
Sujobert
P
,
Trautmann
A
Conflicting signals for cancer treatment.
.
Cancer Res.
2016;
;
76
:
:6768.
–
6773
.
18.
Jacek
E
,
Fallon
BA
,
Chandra
A
,
et al.
Increased IFNα activity and differential antibody response in patients with a history of Lyme disease and persistent cognitive deficits.
.
J Neuroimmunol.
2013;
;
255
:
:85.
–
91
.
19.
Bouneaud
C
,
Kourilsky
P
,
Bousso
P
Impact of negative selection on the T cell repertoire reactive to a self-peptide: a large fraction of t cell clones escapes clonal deletion.
.
Immunity.
2000;
;
13
:
:829.
–
840
.
20.
Larson
HJ
,
Hartigan-Go
K
,
de Figueiredo
A
Vaccine confidence plummets in the Philippines following dengue vaccine scare: why it matters to pandemic preparedness.
.
Hum Vaccin Immunother.
2019;
;
15
:
:625.
–
627
.
21.
Lee
WS
,
Wheatley
AK
,
Kent
SJ
,
et al.
Antibody-dependent enhancement and SARS-CoV-2 vaccines and therapies.
.
Nat Microbiol.
2020;
;
5
:
:1185.
–
91
.
22.
Levine
B
,
Mizushima
N
,
Virgin
HW
Autophagy in immunity and inflammation.
.
Nature.
2011;
;
469
:
:323.
–
335
.
23.
Netea
MG
,
Joosten
LAB
,
Latz
E
,
et al.
Trained immunity: a program of innate immune memory in health and disease.
.
Science.
2016;
;
352
:
:aaf1098.
.
24.
Netea
MG
,
Quintin
J
,
van der Meer
JWM
Trained immunity: a memory for innate host defense.
.
Cell Host Microbe.
2011;
;
9
:
:355.
–
361
.
25.
Naik
S
,
Larsen
SB
,
Gomez
NC
et al.
Inflammatory memory sensitizes skin epithelial stem cells to tissue damage.
.
Nature.
2017;
;
550
:
:475.
–
480
.
26.
Curtis
N
,
Sparrow
A
,
Ghebreyesus
TA
,
et al.
Considering BCG vaccination to reduce the impact of COVID-19.
.
Lancet.
2020;
;
395
:
:1545.
–
6
.
27.
Berthelot
J-M
,
Wendling
D
.
Translocation of dead or alive bacteria from mucosa to joints and epiphyseal bone-marrow: facts and hypotheses.
.
Joint Bone Spine.
2020;
;
87
:
:31.
–
6
.
28.
Piccione
G
,
Fazio
F
,
Caola
G
,
et al.
Daily rhythmicity of glycemia in four species of domestic animals under various feeding regimes.
.
J Physiol Sci.
2008;
;
58
:
:271.
–
275
.
29.
Jung
UJ
,
Choi
M-S
Obesity and its metabolic complications: the role of adipokines and the relationship between obesity, inflammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease.
.
Int J Mol Sci.
2014;
;
15
:
:6184.
–
6223
.
30.
Cahill
GF
,
Herrera
MG
,
Morgan
AP
,
et al.
Hormone-fuel interrelationships during fasting.
.
J Clin Invest.
1966;
;
45
:
:1751.
–
1769
.
31.
Longo
VD
,
Mattson
MP
Fasting: molecular mechanisms and clinical applications.
.
Cell Metab.
2014;
;
19
:
:181.
–
192
.
32.
Wang
A
,
Huen
SC
,
Luan
HH
,
et al.
Opposing effects of fasting metabolism on tissue tolerance in bacterial and viral inflammation.
.
Cell.
2016;
;
166
:
:1512.
–
25.e12
.
33.
Sinclair
U
.
The fasting cure.
.
New York:
:
M. Kennerly;
,
1911
;
:154.
p.
34.
Cignarella
F
,
Cantoni
C
,
Ghezzi
L
,
et al.
Intermittent fasting confers protection in cns autoimmunity by altering the gut microbiota.
.
Cell Metab.
2018;
;
27
:
:1222.
–
35.e6
.
35.
Goldszmid
RS
,
Trinchieri
G
The price of immunity.
.
Nat Immunol.
2012;
;
13
:
:932.
–
938
.
36.
Duscha
A
,
Gisevius
B
,
Hirschberg
S
,
et al.
Propionic acid shapes the multiple sclerosis disease course by an immunomodulatory mechanism.
.
Cell.
2020;
;
180
:
:1067.
–
80.e16
.
37.
Cantoni
C
,
Dorsett
Y
,
Fontana
L
,
et al.
Effects of dietary restriction on gut microbiota and CNS autoimmunity.
.
Clin Immunol.
2020
;
:108575.
.
38.
Adrion
ER
,
Aucott
J
,
Lemke
KW
,
et al.
Health care costs, utilization and patterns of care following Lyme disease.
.
PLoS One.
2015;
;
10
:
:e0116767.
.
39.
Rebman
AW
,
Bechtold
KT
,
Yang
T
,
et al.
The clinical, symptom, and quality-of-life characterization of a well-defined group of patients with posttreatment lyme disease syndrome.
.
Front Med (Lausanne).
2017;
;
4
:
:224.
.
40.
Rebman
AW
,
Aucott
JN
.
Post-treatment Lyme disease as a model for persistent symptoms in lyme disease.
.
Front Med (Lausanne).
2020;
;
7
:
:57.
.
41.
Wormser
GP
,
Dattwyler
RJ
,
Shapiro
ED
,
et al.
The clinical assessment, treatment, and prevention of lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious diseases society of America.
.
Clin Infect Dis.
2006;
;
43
:
:1089.
–
1134
.
42.
Berende
A
,
ter Hofstede
HJM
,
Vos
FJ
,
et al.
Randomized trial of longer-term therapy for symptoms attributed to Lyme disease.
.
N Engl J Med.
2016;
;
374
:
:1209.
–
1220
.
43.
Steere
AC
.
Posttreatment Lyme disease syndromes: distinct pathogenesis caused by maladaptive host responses.
.
J Clin Invest.
2020;
;
130
:
:2148.
–
51
.
44.
Fallon
BA
,
Petkova
E
,
Keilp
JG
,
et al.
A reappraisal of the US clinical trials of post-treatment lyme disease syndrome.
.
Open Neurol J.
2012;
;
6
:
:79.
–
87
.
45.
Delong
AK
,
Blossom
B
,
Maloney
EL
,
et al.
Antibiotic retreatment of Lyme disease in patients with persistent symptoms: a biostatistical review of randomized, placebo-controlled, clinical trials.
.
Contemp Clin Trials.
2012;
;
33
:
:1132.
–
1142
.
47.
Garg
K
,
Meriläinen
L
,
Franz
O
,
et al.
Evaluating polymicrobial immune responses in patients suffering from tick-borne diseases.
.
Sci Rep.
2018;
;
8
:
:15932.
.
48.
Yilancioglu
K
,
Cokol
M
.
Design of high-order antibiotic combinations against M. tuberculosis by ranking and exclusion.
.
Sci Rep.
2019;
;
9
:
:11876.
.
49.
Sapi
E
,
Kasliwala
RS
,
Ismail
H
,
et al.
The long-term persistence of Borrelia burgdorferi antigens and dna in the tissues of a patient with Lyme disease.
.
Antibiotics (Basel).
2019
;
:8.
.
50.
Gadila
SKG
,
Rosoklija
G
,
Dwork
AJ
,
et al.
Detecting Borrelia spirochetes: a case study with validation among autopsy specimens.
.
Front Neurol.
2021
;
:12.
.
51.
Feng
J
,
Wang
T
,
Shi
W
,
et al.
Identification of novel activity against Borrelia burgdorferi persisters using an FDA approved drug library.
.
Emerg Microbes Infect.
2014;
;
3
:
:e49.
.
52.
Aguero-Rosenfeld
ME
,
Wang
G
,
Schwartz
I
,
et al.
Diagnosis of Lyme borreliosis.
.
Clin Microbiol Rev.
2005;
;
18
:
:484.
–
509
.
53.
Donta
ST
Tetracycline therapy for chronic Lyme disease.
.
Clin Infect Dis.
1997;
;
25
:
(suppl 1)
:S52.
–
S56
.
54.
Wu
X
,
Sharma
B
,
Niles
S
,
et al.
Identifying vancomycin as an effective antibiotic for killing Borrelia burgdorferi.
.
Antimicrob Agents Chemother.
2018
;
:62.
.
55.
Imai
Y
,
Meyer
KJ
,
Iinishi
A
,
et al.
A new antibiotic selectively kills Gram-negative pathogens.
.
Nature.
2019;
;
576
:
:459.
–
464
.
56.
Benoist
C
,
Mathis
D
Autoimmunity provoked by infection: how good is the case for T cell epitope mimicry?
.
Nat Immunol.
2001;
;
2
:
:797.
–
801
.
57.
Wallin
MT
,
Heltberg
A
,
Kurtzke
JF
Multiple sclerosis in the Faroe Islands. 8. Notifiable diseases.
.
Acta Neurol Scand.
2010;
;
122
:
:102.
–
109
.
58.
Hornig
M
,
Montoya
JG
,
Klimas
NG
,
et al.
Distinct plasma immune signatures in ME/CFS are present early in the course of illness.
.
Science Advances.
2015;
;
1
:
:e1400121.
.
59.
Piraino
B
,
Vollmer-Conna
U
,
Lloyd
AR
Genetic associations of fatigue and other symptom domains of the acute sickness response to infection.
.
Brain Behav Immun.
2012;
;
26
:
:552.
–
558
.
60.
Steiner
S
,
Becker
SC
,
Hartwig
J
,
et al.
Autoimmunity-related Risk variants in PTPN22 and CTLA4 are associated with ME/CFS with infectious onset.
.
Front Immunol.
2020
;
:11.
.
61.
Shoenfeld
Y
,
Agmon-Levin
N
ASIA autoimmune/inflammatory syndrome induced by adjuvants.
.
J Autoimmun.
2011;
;
36
:
:4.
–
8
.
62.
Gherardi
R
,
Coquet
M
,
Chérin
P
,
et al.
Macrophagic myofasciitis: an emerging entity.
.
Lancet.
1998;
;
352
:
:347.
–
352
.
63.
Gherardi
RK
,
Coquet
M
,
Cherin
P
,
et al.
Macrophagic myofasciitis lesions assess long-term persistence of vaccine-derived aluminium hydroxide in muscle.
.
Brain.
2001;
;
124
:
:1821.
–
1831
.
64.
Passeri
E
,
Villa
C
,
Couette
M
,
et al.
Long-term follow-up of cognitive dysfunction in patients with aluminum hydroxide-induced macrophagic myofasciitis (MMF).
.
J Inorg Biochem.
2011;
;
105
:
:1457.
–
1463
.
|