| |
| Med Sci (Paris). 37(10): 902–909. doi: 10.1051/medsci/2021119.Les organoïdes hépatiques Quels sont les enjeux ? Eléanor Luce,1,2* Antonietta Messina,1,2 Amandine Caillaud,3 Karim Si-Tayeb,3 Bertrand Cariou,3 Etienne Bur,2,4 Anne Dubart-Kupperschmitt,1,2,4 and Jean-Charles Duclos-Vallée1,2,4* 1Inserm UMRS 1193, Université Paris-Saclay
,
12-14 avenue Paul Vaillant Couturier
,
F-94800Villejuif
,
France 2Fédération hospitalo-universitaire Hépatinov, hôpital Paul Brousse
,
F-94800Villejuif
,
France 3Université de Nantes, CHU Nantes, CNRS, Inserm, Institut du thorax
,
F-44000Nantes
,
France 4Institut français de BioFabrication, hôpital Paul Brousse
,
F-94800Villejuif
,
France |
Vignette (Photo : Morphologie et marquage du cytosquelette par la phalloïdine d’un organoïde de foie dérivé de hPSC - © Eléanor Luce).
Cet article est dédié à la mémoire
du Professeur Axel Kahn qui a été visionnaire
dans la réflexion éthique de la
médecine régénératrice
La possibilité de disposer d’organoïdes susceptibles de reproduire l’anatomie structurale et fonctionnelle d’un tissu constitue une révolution biomédicale majeure. Le foie, organe essentiel en physiologie humaine, représente ainsi un sujet particulièrement important dans le champ de la bioconstruction d’organes à partir d’organoïdes. Nous décrivons dans cette revue les différentes approches de la fabrication des organoïdes hépatiques, ainsi que leurs applications cliniques présentes et futures. |
Le foie : un organe complexe Le foie est un des organes les plus complexes du corps humain. Ses nombreuses fonctions permettent en effet le maintien de l’homéostasie de l’ensemble de l’organisme. Il est composé de plusieurs types de cellules qui ont des origines embryologiques différentes, dont les hépatocytes, les cellules biliaires (cholangiocytes), les cellules étoilées, les cellules de Kupffer et les cellules endothéliales sinusoïdales.
Les hépatocytes représentent la principale population de cellules épithéliales du foie. Ils sont responsables de la majorité des fonctions hépatiques : métabolisme des lipoprotéines et des protéines, oxydation des triglycérides pour la production d’énergie, synthèse des acides gras et du cholestérol, homéostasie du glucose (
via
la synthèse du glycogène, la glycogénolyse, la glycolyse et la gluconéogenèse), production d’urée, synthèse de protéines plasmatiques (comme la plupart des facteurs de la coagulation et l’albumine), détoxification de toxines et de nombreux xénobiotiques, production de la bile, et synthèse des hépatokines.
Les cholangiocytes sont les cellules épithéliales polarisées formant les parois des voies biliaires. Ils représentent environ 3 % des cellules hépatiques. Ils ont un rôle crucial dans le fonctionnement hépatique car ils régulent la sécrétion de la bile en modifiant ses constituants et leurs concentrations. Ils forment également un arbre biliaire pour collecter celle-ci et la transporter des hépatocytes vers l’intestin. Les autres cellules non parenchymateuses, quant à elles, représentent environ 40 % des cellules du foie. Elles assurent l’irrigation sanguine ainsi que des fonctions de signalisation et d’interactions avec les autres cellules hépatiques et avec les cellules du système immunitaire. |
Élaborer des organoïdes à partir de cellules souches : la voie royale
Les hépatocytes primaires humains sont considérés comme l’outil de référence pour étudier
in vitro
les différentes fonctions hépatiques, mais aussi pour développer de nouveaux médicaments et évaluer leur toxicité. Cependant, le faible nombre de donneurs permettant d’accéder à ces cellules, de même que la stabilité et la fonctionnalité de ces dernières, qui restent limitées
ex vivo
, constituent un frein à leur utilisation. Le développement de protocoles de différenciation guidée de cellules souches pluripotentes, c’est-à-dire de cellules souches embryonnaires (ESC -
embryonic stem cells
) et de cellules souches pluripotentes induites (iPSC -
induced pluripotent stem cells
), a cependant permis d’obtenir une source quasi inépuisable d’hépatocytes [
1
].
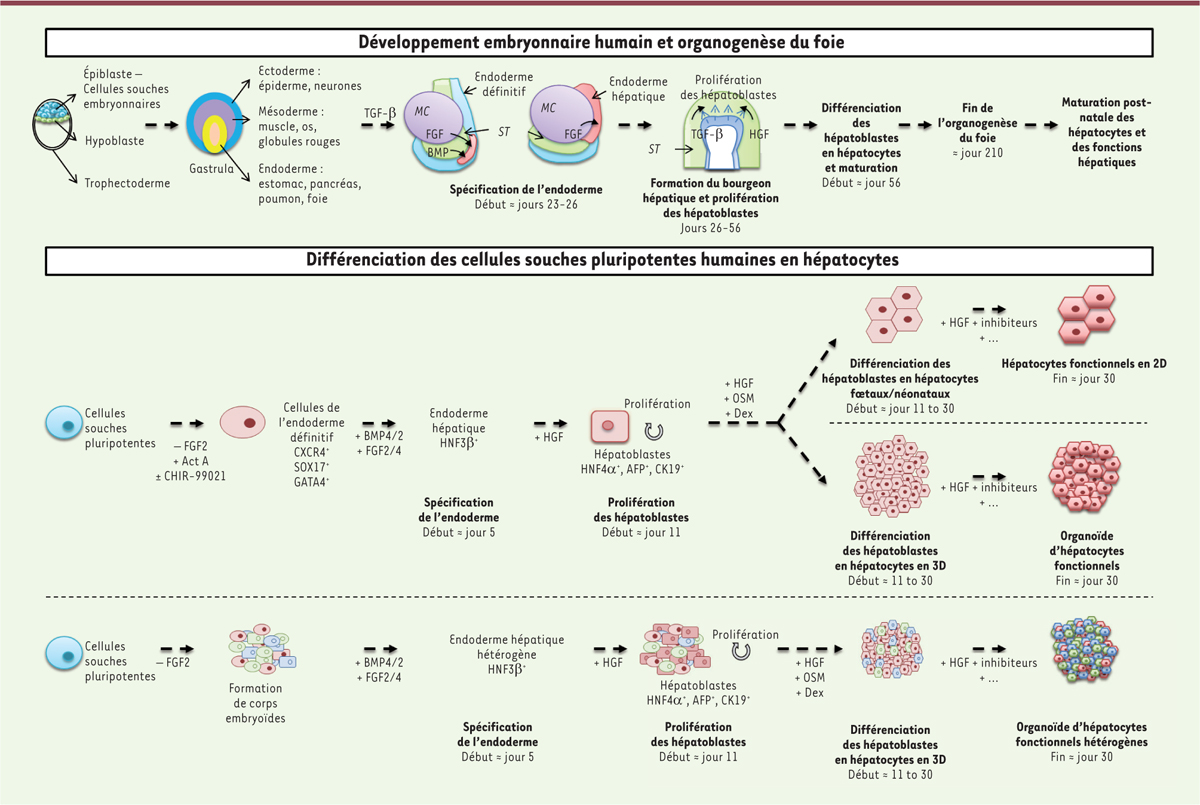
Les cellules souches pluripotentes peuvent en effet être différenciées en tous types de cellules de l’organisme, généralement en les cultivant en présence de facteurs de croissance selon une séquence temporelle identique à celle les menant
in vivo
à leur différenciation au cours du développement embryonnaire
(
Figure 1
)
. Ce processus, appelé différenciation guidée, est le résultat d’un mécanisme très complexe. La première étape consiste à induire la formation d’un des trois feuillets embryonnaires, l’endoderme définitif, par activation de la voie du TGF-β (
transforming growth factor
b) en traitant les cellules par l’activine A. Ensuite, pour orienter ces cellules vers la voie hépatique, des molécules membres des familles BMP (
bone morphogenic protein
) et FGF (
fibroblast growth factor
), ou des inhibiteurs de la voie du TGF-β sont utilisés. Cette étape permet d’obtenir des progéniteurs hépatiques bipotents, appelés hépatoblastes, qui peuvent se différencier en hépatocytes ou en cholangiocytes [
2
]. Si certains cocktails de facteurs de croissance utilisés peuvent varier selon les protocoles appliqués, la plupart d’entre eux font appel à l’HGF (
hepatocyte growth factor
) et à l’OSM (oncostatine M) au cours de la dernière étape de la différenciation, afin d’imiter les voies de signalisation activées au cours de l’organogenèse. Des inhibiteurs de la voie Notch ou de la voie du TGF-β peuvent également être utilisés. Au cours du développement embryonnaire, l’activation des voies Notch et TGF-β détermine en effet la différenciation des hépatoblastes en cholangiocytes, leur inhibition entraînant par contre un destin hépatocytaire.
 | Figure 1.
1. Principe de différenciation des cellules souches pluripotentes (PSC) en hépatocytes.
La connaissance des différentes étapes du développement embryonnaire humain et de l’organogenèse du foie (partie supérieure) a permis l’établissement de protocoles de différenciation des cellules souches pluripotentes (PSC) en hépatocytes in vitro, dans des systèmes de culture 2D ou 3D (partie inférieure). ST: septum transversum ; MC : mésoderme cardiaque ; TGF-β :
transforming growth factor β
; FGF :
fibroblast growth factor
; HGF :
hepatocyte growth factor
; Act A : activine A ; BMP4/2 :
bone morphogenic protein 2/4
; HNF3β :
hepatocyte nuclear factor 3β
; AFP : α-fœtoprotéine ; CK19 :
cytokeratin 19
; OSM : oncostatine M ; Dex : dexaméthasone.
|
Les cellules obtenues après leur différenciation en hépatocytes (que l’on appelle HLC pour
hepatocyte-like cells
) expriment des marqueurs spécifiques, comme HNF4α (
hepatocyte nuclear factor 4
a) et l’albumine. Elles acquièrent des fonctions hépatocytaires variées, comme celle de détoxification par les cytochromes P450. Il est néanmoins admis que ces HLC conservent des caractéristiques d’hépatocytes fœtaux ou de nouveau-nés, avec une expression persistante d’alpha-fœtoprotéine et une faible production d’albumine [
3
]. Cette immaturité des HLC pourrait s’expliquer par le fait que les fonctions hépatocytaires nécessitent une organisation spatiale des cellules bien définie, qui reste impossible à reproduire en culture sous forme de monocouche cellulaire.
Des approches de culture en trois dimensions (3D), en particulier d’organoïdes, permettent néanmoins la génération de structures plus complexes qui imitent l’organisation des tissus. L’intérêt des équipes de recherche pour les organoïdes date des années 1940. Depuis, des expériences de culture permettant d’étudier l’organogenèse ont révélé la capacité intrinsèque des cellules à interagir et à s’auto-organiser en structures qui ressemblent à des organes [
4
]. Si la définition du mot
organoïde
a longtemps évolué, ce terme désigne aujourd’hui un assemblage tridimensionnel d’un ou plusieurs types cellulaires, qui mime la micro-anatomie d’un organe et assure,
in vitro,
une ou plusieurs de ses fonctions. Le comportement de cet assemblage de cellules, qui s’explique d’un point de vue mécano-physique, mais aussi biologique, par la théorie de l’
adhérence différentielle
proposée par Malcolm S Steinberg [
5
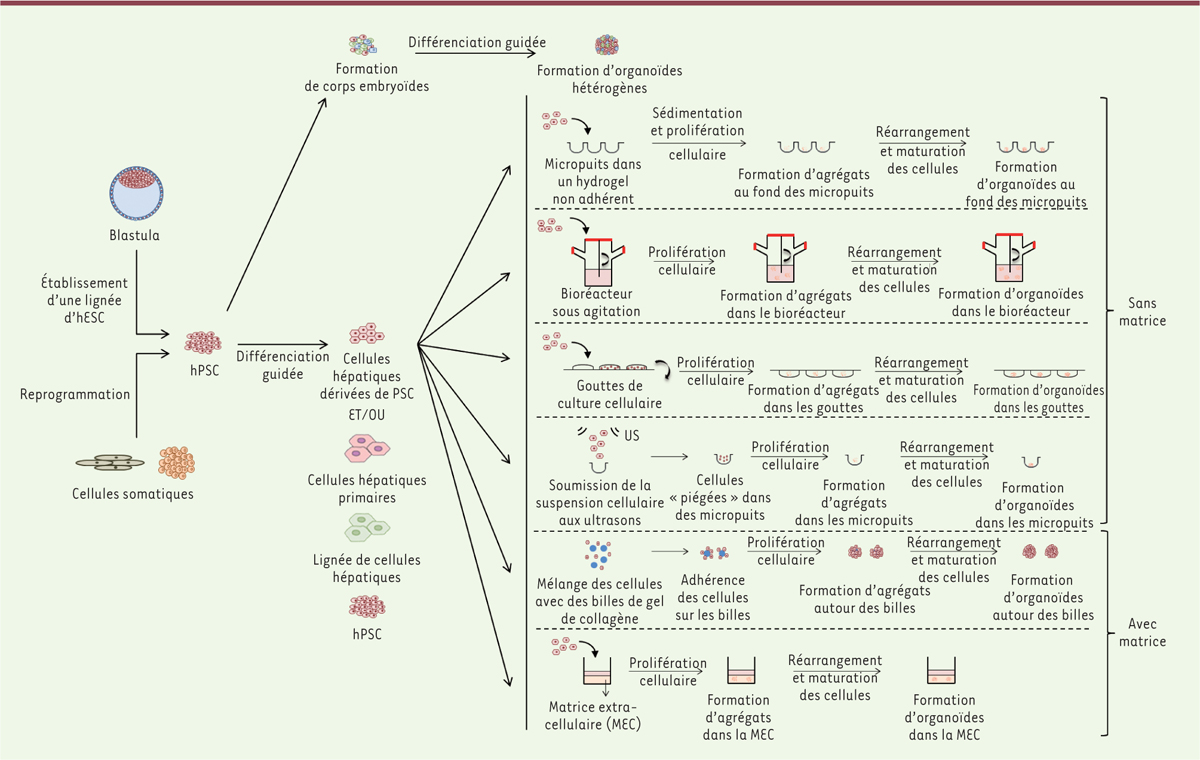
], fait des organoïdes le nouvel instrument de prédilection de la recherche en biologie. De nombreux travaux réalisés sur les cellules souches pluripotentes (PSC), les matrices extracellulaires (MEC), et de nouvelles techniques de culture cellulaire en 3D, ont permis de développer plusieurs techniques de formation d’organoïdes à partir de cellules souches ou de cellules différenciées, en s’appuyant sur la capacité d’auto-assemblage des cellules ou sur l’utilisation de matrices préformées ou imprimées
(
Figure 2
)
[
6
].
 | Figure 2.
Principales techniques de formation d’organoïdes de foie.
hESC : human embryonic stem cells - cellules souches embryonnaires humaines ; (h)PSC : (human) pluripotent stem cells - cellules souches pluripotentes (humaines) ; MEC : matrice extracellulaire.
|
|
Reproduire la complexité du foie : favoriser la diversité cellulaire
Outre l’absence d’organisation tridimensionnelle, la différenciation et la maturation incomplètes des HLC en culture 2D peuvent s’expliquer par l’absence d’autres types de cellules présentes dans le foie. Ces cellules sécrètent certains facteurs de croissance, produisent de la matrice extracellulaire (MEC) et, par des interactions directes, peuvent participer à la polarisation des hépatocytes. Si l’on souhaite reproduire la complexité du foie dans des organoïdes, plusieurs types de cellules sont en effet nécessaires [
7
]. Takanori Takebe
et al.
ont ainsi exploité les connaissances actuelles sur l’organogenèse hépatique précoce afin de générer des bourgeons hépatiques constitués de cellules dérivées de PSC. Ces cellules hépatiques, co-cultivées en présence de cellules souches mésenchymateuses et de cellules endothéliales humaines primaires (MSC [cellules souches mésenchymateuses] et HUVEC [cellules endothéliales de veine ombilicale humaine]), ont permis d’engendrer, pour la première fois, des structures en 3D contenant des ébauches de vaisseaux sanguins qui, après transplantation chez la souris, se sont remodelés et connectés au système vasculaire de l’animal [
8
]. Cette approche de transplantation chez l’animal a été validée dans un modèle murin d’insuffisance hépatique. D’autres approches visant à vasculariser des bourgeons hépatiques ont aussi été développées. La présence de cellules endothéliales, également dérivées des PSC, améliore ainsi la maturation des hépatocytes et leur greffe dans des modèles
in vivo
[
9
]. Notons cependant qu’aucun organoïde hépatique n’a été perfusé
in vitro
jusqu’à présent. Ils ne peuvent donc pas être considérés comme complètement vascularisés [
10
].
D’autres exemples de systèmes de co-culture, constitués de cellules étoilées humaines ou d’HUVEC, induisent la génération, à partir d’iPSC, d’hépatocytes qui présentent des caractéristiques morphologiques et phénotypiques plus proches de celles des hépatocytes primaires humains qu’en l’absence de ces cellules [
11
]. Des modèles de co-culture d’hépatocytes et de cholangiocytes ont également été décrits. Ils permettent, chez le rat, la formation de micro-tissus hépatiques qui présentent un réseau biliaire fonctionnel [
12
]. Plusieurs protocoles de différenciation de PSC humaines en cholangiocytes ont été développés [
13
]. Ils ouvrent ainsi la voie vers des systèmes de co-cultures fondés sur l’utilisation de cellules humaines dérivées de PSC. Récemment, des protocoles de différenciation d’iPSC en organoïdes hépatiques ont permis d’obtenir les différents types cellulaires constituant le foie et de démontrer le fort potentiel de ces modèles pour l’étude des maladies métaboliques complexes qui reposent sur l’activité de plusieurs types cellulaires [
14
].
L’adhérence des cellules et leur homéostasie au sein des organoïdes qui sont développés sont consolidées par la matrice extracellulaire (MEC). Celle-ci permet en effet les échanges entre les cellules et joue un rôle de soutien physique à la structure tridimensionnelle. Cette MEC peut être endogène, c’est-à-dire produite par les cellules au sein de l’organoïde [
15
], ou exogène [
16
]. Néanmoins, l’origine exogène de ces MEC peut compromettre l’utilisation en clinique des organoïdes, par exemple lorsqu’elles sont d’origine animale ou si leur composition est mal définie. En réponse à ces problématiques, de nouvelles matrices ont été développées avec, par exemple, une formulation modulable impliquant de l’acide hyaluronique, des collagènes et des protéines d’adhérence.
|
Des applications diverses, pour des situations cliniques variées Les organoïdes peuvent être utilisés pour des applications thérapeutiques qui correspondent à des situations cliniques très variées. L’une des priorités actuelles consiste à développer un système fonctionnel d’épuration hépatique, appelé foie bioartificiel (ou BAL), qui inclut un bioréacteur « cellularisé ». Un tel système est en cours d’étude chez le petit animal. Cette approche est essentielle dans la perspective de la prise en charge clinique de patients en attente d’un greffon difficile à obtenir. Le BAL pourrait en effet permettre aux patients atteints d’hépatite aiguë très sévère ou fulminante d’attendre un greffon, voire d’être sujets à une régénération hépatique spontanée, qui permettrait d’éviter la transplantation.
Par ailleurs, la transplantation d’organoïdes chez l’homme constitue un espoir thérapeutique majeur. Des résultats très prometteurs ont été obtenus dans un modèle préclinique d’hépatite fulminante, par transplantation d’organoïdes constitués de plusieurs types cellulaires différenciés à partir d’iPSC [
17
]. De même, des organoïdes biliaires peuvent, par exemple, être utilisés dans le contexte de chirurgies d’exérèse étendue, ou de complications biliaires post-transplantation [
18
].
La modélisation
in vitro
des maladies hépatiques représente également un défi majeur. Plusieurs de ces affections ont été modélisées
in vitro
, comme le déficit en α1-antitrypsine (A1AT, un inhibiteur de protéases), une maladie génétique qui se manifeste par un emphysème pulmonaire, mais aussi parfois une cirrhose. La mutation la plus fréquente du gène
SERPINA1
, qui code l’A1AT, induit une accumulation de protéines non fonctionnelles au sein des hépatocytes. Des organoïdes produits à partir d’iPSC spécifiques de patients atteints de cette maladie ont permis de reproduire les altérations du réticulum endoplasmique qui y sont observées [
19
]. Le syndrome d’Alagille, qui associe des maladies hépatiques, cardiaques et musculaires, a également été reproduit à partir d’iPSC de patients dans les rares organoïdes cholangiocytaires qui ont été développés, dans lesquels des anomalies de transport des acides biliaires ont été démontrées [
20
]. De même, des cancers primitifs du foie (carcinome hépatocellulaire et cholangiocarcinome) ont été modélisés à partir de lignées tumorales, révélant de nouveaux biomarqueurs d’intérêt mais aussi des inhibiteurs potentiels [
21
]. Des organoïdes d’hépatoblastome ont aussi été obtenus à partir de cellules tumorales isolées d’un patient. Ils ont permis l’évaluation de plusieurs candidats médicaments et ont mis en évidence l’efficacité de l’un d’entre eux, le JQ1, un inhibiteur de Brd4 (
bromodomain-containing protein
4) [
22
]. L’utilisation d’organoïdes tumoraux pourrait ainsi permettre le développement d’une médecine personnalisée, en testant de nouvelles approches thérapeutiques pour les patients ne répondant pas aux thérapies existantes.
La stéatose non alcoolique ou NAFLD (
non alcoholic fatty liver disease
), une autre maladie hépatique due en partie au mode de vie, est devenue un problème majeur de santé publique. Les différentes étapes de la maladie (stéatose, stéatohépatite, cirrhose) ont été reproduites dans un modèle d’organoïdes dérivés d’iPSC qui ont été exposés à certains acides gras [
23
]. Ainsi, de nombreux modèles de maladies hépatiques, d’ores et déjà établis en culture 2D, pourraient être améliorés, en termes de performance et de pertinence, en utilisant plutôt des organoïdes. Ces modèles permettent en effet, en plus des hépatocytes, d’inclure d’autres types cellulaires qui sont impliqués dans la physiopathologie. Ces modèles devraient finalement être intégrés aux systèmes sur puces, les
organs-on-chips
, actuellement en développement, qui, selon le besoin, pourront inclure des organoïdes reproduisant d’autres tissus, en particulier pour l’étude de maladies affectant plusieurs organes [
24
].
|
Quels sont les verrous et les obstacles à surmonter ?
L’utilisation d’organoïdes hépatiques dérivés de PSC dans ces différentes applications nécessite leur production à très grande échelle. Pour leur transplantation chez l’homme, par exemple, environ 10
8
cellules/kg sont nécessaires, ce qui représente 6 à 12 × 10
9
cellules par transplantation [
25
]. Les foies bio-artificiels nécessiteraient encore plus de cellules, entre 10
10
et 20
10
hépatocytes. La standardisation et une automatisation partielle de la production d’iPSC, puis d’organoïdes, seront donc nécessaires [
26
] pour une possible utilisation en clinique. Le développement de méthodes de cryoconservation qui préservent les fonctions des cellules hépatocytaires sera également indispensable afin de construire des banques de cellules différenciées prêtes pour une utilisation thérapeutique.
La thérapie fondée sur des cellules différenciées à partir de PSC en organoïdes 3D ou en cultures monocouches, nécessite le développement de protocoles validés, reproductibles, et qui respectent les directives des bonnes pratiques de fabrication (BPF ou GMP pour
good manufacturing practices
). Trois lignées de PSC répondant à ces BPF ont déjà été différenciées en hépatocytes. Celles-là présentent des phénotypes et une fonctionnalité très reproductibles [
27
].
Une autre préoccupation majeure, inhérente à l’utilisation de PSC, est liée à leur instabilité génétique potentielle. L’intégrité génomique de ces cellules nécessite en effet d’être contrôlée [
28
]. La préservation de l’intégrité génomique lors de la différenciation des cellules en hépatocytes reste cependant insuffisamment documentée, de même que la présence potentielle de cellules souches résiduelles dans le produit thérapeutique final. Vérifier ces deux paramètres est impératif même si, chez la souris, la transplantation d’hépatocytes différenciés en 3D ne semble pas être à l’origine de la formation de tératome ou de tumeur [
29
]. Il est néanmoins nécessaire de définir les contrôles qualité à réaliser sur le produit final, non seulement en termes de fonction mais aussi de sécurité.
Enfin, de nombreux groupes ont étudié l’immunogénicité des cellules dérivées de PSC dans des modèles animaux. Aucun consensus n’a cependant été établi, des résultats contradictoires ayant été rapportés. Certaines études ont en effet montré que les cellules dérivées de PSC étaient bien tolérées par le système immunitaire [
30
]. D’autres, en revanche, ont rapporté des réponses immunitaires différentes selon la lignée cellulaire utilisée [
31
]. L’utilisation de cellules dérivées d’iPSC dont les molécules d’histocompatibilité HLA (
human leukocyte antigen
) sont compatibles entre donneur et receveur et n’induisent pas d’allo-réaction, pourrait constituer une solution [
32
].
|
Quels enjeux économiques ?
Une récente étude a montré que le marché mettant à profit les organoïdes représentait un demi-milliard de dollars (environ 416 millions d’euros) en 2019 et pourrait peser environ 2,8 milliards de dollars (soit environ 2,33 milliards d’euros) en 2027 [
33
]. Ce marché concerne l’ensemble des produits et dispositifs nécessaires à la culture d’organoïdes. Il a deux objectifs principaux : l’utilisation des organoïdes en médecine régénérative pour l’implantation de tissus ou d’organes biofabriqués, et leur utilisation pour la modélisation et le traitement de maladies, notamment pour le criblage systématique de molécules (
drug screening
), l’analyse de leur toxicité et de leur pharmacocinétique. Si le premier objectif représente aujourd’hui environ un tiers du marché, sa part devrait diminuer au profit de celle de la modélisation.
Les dépenses annuelles de recherche et développement de l’industrie pharmaceutique mondiale s’élèvent actuellement à environ 200 milliards de dollars (environ 166 milliards d’euros), en augmentation régulière de 7 à 10 % par an [
34
]. La part de la recherche exploratoire et des essais précliniques est de 50 milliards de dollars (environ 41,6 milliards d’euros) [
35
]. Le taux d’échec reste considérable : seule une molécule sur trois réussit le passage de l’essai préclinique à l’essai clinique [
36
], et seule une sur dix reçoit une autorisation de mise sur le marché, pour un coût total par molécule estimé à 2,6 milliards de dollars (environ 2,16 milliards d’euros) [
37
].
L’organoïde, construit à partir de cellules souches pluripotentes (PSC), est un facteur d’économies substantielles et d’efficacité accrue pour la recherche et le développement pharmaceutiques, servant au moins à écarter précocement des molécules initialement envisagées comme candidates. Dans une étude récente, aucune des molécules inefficaces sur des organoïdes ne s’est montrée efficace chez le patient. Par contre, 9 molécules sur 10, ayant montré une efficacité sur des organoïdes de tumeurs digestives, se sont révélées efficaces chez les patients [
38
]. Pour le criblage systématique de molécules susceptibles de montrer un effet digne d’intérêt, l’utilisation des organoïdes devrait donc permettre de revisiter à moindre coût, l’ensemble de la pharmacopée actuelle, comme l’a montré une étude portant sur plus de 1 000 molécules testées sur des organoïdes neuronaux infectés par le virus Zika [
39
].
Le marché potentiel utilisant la technologie fondée sur les organoïdes peut donc s’élever à plusieurs milliards d’euros dans les années qui viennent. Encore faudra-t-il que leur production réponde aux exigences de l’industrie pharmaceutique en termes de reproductibilité, d’automatisation, et de standardisation des méthodes d’analyse. Des acteurs de plus en plus nombreux s’efforcent de résoudre les difficultés de leur mise en place, laissant entrevoir des progrès importants à court et moyen termes.
Les bio-banques, publiques ou privées, spécialisées en iPSC, sont une pierre angulaire de la recherche sur les organoïdes et de leur industrialisation. Les coûts de la collecte de cellules de donneurs sains ou malades, de leur analyse génétique, de leur reprogrammation, de l’analyse de leur pluripotence et de leur conservation, nécessitent la mise en œuvre d’un réseau important de laboratoires et des moyens considérables. Des bio-banques publiques ont été créées
1
. Des acteurs privés (Fujifilm Cellular Dynamics Intl, Sumitomo Dainippon, ReproCELL, Tempo Bioscience, Evotec) ont déjà investi dans ces approches en levant les capitaux nécessaires.
Des laboratoires de plus en plus nombreux s’efforcent de valoriser leur savoir-faire dans des conditions répondant aux BPF, en déposant des brevets en vue d’une industrialisation et d’une utilisation clinique, comme cela a récemment été décrit pour des organoïdes de pancréas [
40
]. Une
start-up
(SunBioscience) a également été constituée à la suite de la mise au point d’un processus de fabrication à grande échelle d’organoïdes standardisés [
41
].
|
La production et l’utilisation d’organoïdes : une démarche éthique nécessaire
La possibilité de bio-construire des organoïdes, et peut-être un jour des organes, à partir de cellules en culture et de divers matériaux, biologiques ou non, en utilisant des techniques parfois très élaborées, est une vraie révolution, tant du point de vue biomédical que du point de vue conceptuel. La naissance de cette nouvelle discipline doit s’accompagner d’une réflexion éthique des scientifiques concernés, mais aussi de la Société dans son ensemble pour aboutir à un développement qui soit éthique dès l’émergence de ce nouveau domaine de la biologie
2
[
43
] (
→
).
(→) Voir l’Éditorial de H. Chneiweiss,
m/s
n° 2, février 2020, page 99
Les questions posées sont multiples et concernent les cellules impliquées pour la production des organoïdes, avec plus ou moins d’acuité s’il s’agit de cellules primaires, d’ESC ou d’iPSC (réglementations différentes selon les pays ; information et consentement des donneurs ; propriété des organoïdes ; brevetabilité ; profits éventuels de leur commercialisation ; protection des données génétiques). Un problème moral peut également émerger dans le cas de l’utilisation d’organoïdes en transplantation et la perception que le donneur pourrait avoir de ces greffons comme étant une partie de soi chez un autre individu, comme cela peut être le cas avec la greffe d’organe. Il en est de même pour le receveur, avec, de plus, si l’on attache une valeur morale à la distinction entre naturel et artificiel, un problème lié à l’association éventuelle d’éléments biologiques et d’éléments artificiels au sein des organoïdes.
Ces problèmes ont été perçus par la communauté scientifique et font l’objet de discussions et d’études, avec, en particulier, une forte contribution de l’ISSCR (
International Society for Stem Cell Research
[
42
]). La commission européenne, à la suite de l’appel d’offre
Science with and for Society
intitulé
The ethics of organoïds
, finance le projet HYBRIDA
3,
, dans lequel le comité d’éthique de l’Inserm est partenaire
4
. Ce projet, initié en mars 2021, proposera des lignes directrices opérationnelles, un code de conduite responsable (CoC) pour les chercheurs académiques et de l’industrie, un ensemble de contributions aux cadres éthiques et normatifs existants et, si nécessaire, un supplément au code de conduite européen pour l’intégrité de la recherche (ECoC).
|
La production d’organoïdes hépatiques et leurs applications cliniques sont en plein essor. Des progrès considérables ont été réalisés ces dernières années pour produire des organoïdes qui possèdent un très haut niveau de maturité. Ces avancées permettent désormais d’envisager concrètement des applications pour le traitement de patients atteints de maladies hépatiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient le Professeur Dominique Franco qui offre un soutien majeur depuis le début du programme RHU iLite.
|
Ce manuscrit s’inscrit dans le programme du RHU iLite (Innovations for Liver Tissue Engineering, ANR-16-RHUS-0005) dont l’objectif est de développer un foie bioconstruit, et dans celui du RHU CHOPIN (CHOlesterol Personalized Innovation, ANR-16-RHUS-0007) dont l’objectif est d’identifier de nouvelles cibles thérapeutiques dans l’hypercholestérolémie.
|
Footnotes |
1.
Si-Tayeb
K
,
Noto
FK
,
Nagaoka
M
,
et al.
Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells.
.
Hepatology.
2010;
;
51
:
:297.
–
305
.
2.
Chen
X
,
Zeng
F
Directed hepatic differentiation from embryonic stem cells.
.
Protein Cell.
2011;
;
2
:
:180.
–
188
.
3.
Baxter
M
,
Withey
S
,
Harrison
S
,
et al.
Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes.
.
J Hepatol.
2015;
;
62
:
:581.
–
589
.
4.
Harris
M.
The compatibility of rat and mouse cells in mixed tissue cultures.
.
Anat Rec.
1943;
;
87
:
:107.
–
117
.
5.
Steinberg
MS
Reconstruction of tissues by dissociated cells. Some morphogenetic tissue movement and the sorting out of embryonic cells may have a common explanation.
.
Science.
1963;
;
141
:
:401.
–
408
.
6.
Prior
N
,
Inacio
P
,
Huch
M
Liver organoids: from basic research to therapeutic applications.
.
Gut.
2019;
;
68
:
:2228.
–
2237
.
7.
Ardalani
H
,
Sengupta
S
,
Harms
V
,
et al.
3-D culture and endothelial cells improve maturity of human pluripotent stem cell-derived hepatocytes.
.
Acta Biomaterialia.
2019;
;
95
:
:371.
–
381
.
8.
Takebe
T
,
Sekine
K
,
Enomura
M
,
et al.
Vascularized and functional human liver from an iPSC-derived organ bud transplant.
.
Nature.
2013;
;
499
:
:481.
–
484
.
9.
Takebe
T
,
Sekine
K
,
Kimura
M
,
et al.
Massive and reproducible production of liver buds entirely from human pluripotent stem cells.
.
Cell Rep.
2017;
;
21
:
:2661.
–
2670
.
10.
Vargas-Valderrama
A
,
Messina
A
,
Mitjavila-Garcia
MT
, et al.
The endothelium, a key actor in organ development and hPSC-derived organoid vascularization.
.
J Biomed Sci.
2020;
;
27
:
:67.
.
11.
Freyer
N
,
Greuel
S
,
Knöspel
F
,
et al.
Effects of co-culture media on hepatic differentiation of hipsc with or without HUVEC co-culture.
.
IJMS.
2017;
;
18
:
:1724.
.
12.
Hafiz
EOA
,
Bulutoglu
B
,
Mansy
SS
, et al.
Development of liver microtissues with functional biliary ductular network.
.
Biotechnol Bioeng.
2021;
;
118
:
:17.
–
29
.
13.
Dianat
N
,
Dubois-Pot-Schneider
H
,
Steichen
C
,
et al.
Generation of functional cholangiocyte-like cells from human pluripotent stem cells and HepaRG cells.
.
Hepatology.
2014;
;
60
:
:700.
–
714
.
14.
Ouchi
R
,
Togo
S
,
Kimura
M
,
et al.
Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids.
.
Cell Metab.
2019;
;
30
:
:374.
–
84.e6
.
15.
Nie
YZ
,
Zheng
YW
,
Miyakawa
K
,
et al.
Recapitulation of hepatitis B virus–host interactions in liver organoids from human induced pluripotent stem cells.
.
EBio Med.
2018;
;
35
:
:114.
–
123
.
16.
Saheli
M
,
Sepantafar
M
,
Pournasr
B
,
et al.
Three-dimensional liver-derived extracellular matrix hydrogel promotes liver organoids function.
.
J Cell Biochem.
2018;
;
119
:
:4320.
–
4333
.
17.
Takebe
T
,
Sekine
K
,
Kimura
M
,
et al.
Massive and reproducible production of liver buds entirely from human pluripotent stem cells.
.
Cell Rep.
2017;
;
21
:
:2661.
–
2670
.
18.
Sampaziotis
F
,
Muraro
D
,
Tysoe
OC
, et al.
Cholangiocyte organoids can repair bile ducts after transplantation in the human liver.
.
Science.
2021;
;
371
:
:839.
–
46
.
19.
Huch
M
,
Gehart
H
,
van Boxtel
R
,
et al.
Long-term culture of genome-stable bipotent stem cells from adult human liver.
.
Cell.
2015;
;
160
:
:299.
–
312
.
20.
Guan
Y
,
Xu
D
,
Garfin
PM
,
et al.
Human hepatic organoids for the analysis of human genetic diseases.
.
JCI Insight.
2017;
;
2
:
:e94954.
.
21.
Broutier
L
,
Mastrogiovanni
G
,
Verstegen
MM
,
et al.
Human primary liver cancer–derived organoid cultures for disease modeling and drug screening.
.
Nat Med.
2017;
;
23
:
:1424.
–
1435
.
22.
Saltsman
JA
,
Hammond
WJ
,
Narayan
NJC
, et al.
A human organoid model of aggressive hepatoblastoma for disease modeling and drug testing.
.
Cancers.
2020;
;
12
:
:2668.
.
23.
Gurevich
I
,
Burton
SA
,
Munn
C
, et al.
iPSC-derived hepatocytes generated from NASH donors provide a valuable platform for disease modeling and drug discovery.
.
Biol Open.
2020;
;
9
:
:bio055087.
.
24.
Jalili-Firoozinezhad
S
,
Miranda
CC
,
Cabral
JMS
.
Modeling the human body on microfluidic chips.
.
Trends Biotechnol.
2021;
;
39
:
:838.
–
52
.
25.
Hughes
RD
,
Mitry
RR
,
Dhawan
A
Current status of hepatocyte transplantation.
.
Transplantation.
2012;
;
93
:
:342.
–
347
.
26.
Yamashita
T
,
Takayama
K
,
Sakurai
F
,
et al.
Billion-scale production of hepatocyte-like cells from human induced pluripotent stem cells.
.
Biochem Biophys Res Commun.
2018;
;
496
:
:1269.
–
1275
.
27.
Blackford
SJI
,
Ng
SS
,
Segal
JM
,
et al.
Validation of current good manufacturing practice compliant human pluripotent stem cell-derived hepatocytes for cell-based therapy: validation of cGMP hPSCs for liver therapy.
.
Stem Cells Transl Med.
2019;
;
8
:
:124.
–
137
.
28.
Laurent
LC
,
Ulitsky
I
,
Slavin
I
,
et al.
Dynamic changes in the copy number of pluripotency and cell proliferation genes in human ESCs and iPSCs during reprogramming and time in culture.
.
Cell Stem Cell.
2011;
;
8
:
:106.
–
118
.
29.
Wang
S
,
Wang
X
,
Tan
Z
,
et al.
Human ESC-derived expandable hepatic organoids enable therapeutic liver repopulation and pathophysiological modeling of alcoholic liver injury.
.
Cell Res.
2019;
;
29
:
:1009.
–
1026
.
30.
de Almeida
PE
,
Meyer
EH
,
Kooreman
NG
,
et al.
Transplanted terminally differentiated induced pluripotent stem cells are accepted by immune mechanisms similar to self-tolerance.
.
Nat Commun.
2014;
;
5
:
:3903.
.
31.
Liu
X
,
Li
W
,
Fu
X
,
et al.
The immunogenicity and immune tolerance of pluripotent stem cell derivatives.
.
Front Immunol.
2017;
;
8
:
:645.
.
32.
Sugita
S
,
Mandai
M
,
Hirami
Y
, et al.
HLA-matched allogeneic ips cells-derived rpe transplantation for macular degeneration.
.
J Clin Med.
2020;
;
9
:
:2217.
.
33.
Organoids and spheroids market by type (organoids and spheroids), application (personalized medicine, developmental biology, drug toxicity and efficacy testing, disease pathology testing and regenerative medicine), end-use, region, global industry analysis, market size, share, growth, trends, and forecast 2020 to 2027.
. fiormarkets
2020
.
https://www.fiormarkets.com/report/organoids-and-spheroids-market-by-type-organoids-and-418832.html
.
36.
Hackam
DG
,
Redelmeier
DA
Translation of research evidence from animals to humans.
.
JAMA.
2006;
;
296
:
:1727.
.
37.
DiMasi
JA
,
Grabowski
HG
,
Hansen
RW
Innovation in the pharmaceutical industry: New estimates of R&D costs.
.
J Health Econom.
2016;
;
47
:
:20.
–
33
.
38.
Vlachogiannis
G
,
Hedayat
S
,
Vatsiou
A
,
et al.
Patient-derived organoids model treatment response of metastatic gastrointestinal cancers.
.
Science.
2018;
;
359
:
:920.
–
926
.
39.
Zhou
T
,
Tan
L
,
Cederquist
GY
,
et al.
High-content screening in hpsc-neural progenitors identifies drug candidates that inhibit Zika virus infection in fetal-like organoids and adult brain.
.
Cell Stem Cell.
2017;
;
21
:
:274.
–
283.e5
.
40.
Dossena
M
,
Piras
R
,
Cherubini
A
, et al.
Standardized GMP-compliant scalable production of human pancreas organoids.
.
Stem Cell Res Ther.
2020;
;
11
:
:94.
.
43.
Chneiweiss
H
.
Organoïdes : nouvelles perspectives et nouvelles questions éthiques.
.
Med Sci (Paris).
2020;
;
36
:
:99.
–
100
.
|