| |
| Med Sci (Paris). 37(10): 882–887. doi: 10.1051/medsci/2021147.Contraception dans le contexte de l’obésité Cécile Ciangura1 and Anne Bachelot2* 1Service de nutrition, ICAN (Institut de cardiométabolisme et nutrition), Hôpital Pitié Salpêtrière, Sorbonne Université
,
47-83 boulevard de l’hôpital
,
75013Paris
,
France 2Endocrinologie et médecine de la reproduction, Centre de référence des maladies endocriniennes rares de la croissance et du développement, Centre de référence des pathologies gynécologiques rares, Hôpital universitaire Pitié Salpêtrière
,
47-83 boulevard de l’hôpital
,
75013Paris
,
France |
Vignette (© Inserm/Universcience/CNDP/Picta productions-Véronique Kleiner).
L’obésité touche de plus en plus de femmes en âge de procréer [
1
]. Elle est définie par un indice de masse corporelle (IMC)
1,
supérieur à 30 kg/m
2
. L’obésité sévère est définie par un IMC supérieur à 35 kg/m
2
et l’obésité morbide, par un IMC de plus de 40 kg/m
2
. La prévalence globale de l’obésité en France était en 2015, de 17 %, avec 11 % des femmes âgées de 18 à 39 ans. Cette prévalence est inversement proportionnelle au niveau socio-économique et elle augmente en particulier chez les femmes âgées de 18 à 25 ans. En parallèle, le nombre d’interventions de chirurgies bariatriques
2,
ne cesse d’augmenter, et la file active
3
de personnes opérées atteignait 450 000 fin 2017. La population concernée par la chirurgie est majoritairement féminine (85 %), avec un âge moyen de 38 ans.
La contraception est une question essentielle chez la femme présentant une obésité. Une étude française a en effet montré un risque de grossesse non désirée quatre fois supérieur chez la femme présentant une obésité que chez les femmes de poids normal du même âge [
2
]. Ces femmes utilisent plus souvent (huit fois plus) une méthode contraceptive ne demandant pas l’intervention d’un médecin, et à plus forte raison d’un gynécologue, mais qui est considérée comme moins efficace. Si aucune contraception n’est
a priori
contre-indiquée chez une femme de moins de 35 ans présentant une obésité sans facteur de risque cardiovasculaire associé, ces femmes présentent souvent ces facteurs de risque, devant faire reconsidérer l’emploi des contraceptions hormonales œstroprogestatives (COP).
La question de la contraception chez la femme obèse peut être envisagée sous plusieurs angles : l’obésité en tant que facteur de risque d’échec d’une contraception hormonale ; l’obésité en tant que facteur de risque cardio-vasculaire et pouvant majorer ce risque lors de l’association à une contraception hormonale. La littérature traitant de ce sujet est néanmoins assez pauvre pour permettre de répondre à ces questions, l’obésité étant souvent un facteur d’exclusion des études. |
L’obésité comme facteur de risque d’échec d’une contraception hormonale
Les modifications métaboliques observées au cours de l’obésité et la masse corporelle plus importante des femmes qui présentent une obésité peuvent être à l’origine d’une réduction de l’efficacité de la contraception hormonale. En effet, d’une façon générale, l’efficacité d’un médicament dépend de propriétés pharmacocinétiques qui sont modifiées par des différences génotypiques et/ou phénotypiques, telles que l’obésité, avec des effets au niveau de son absorption, de sa biodistribution, de son métabolisme et de son excrétion, modifications qui touchent également ses métabolites [
3
,
4
]. L’excès de graisse corporelle peut également modifier la distribution dans l’organisme des médicaments hautement lipophiles. Les patients obèses ont, de plus, une masse maigre (musculaire) et hydrique totale ainsi qu’un volume plasmatique qui sont supérieurs à ceux des sujets de poids normal [
5
,
6
]. Le volume sanguin, le débit cardiaque et la taille de certains organes augmentent également avec le poids du sujet [
7
]. La taille du foie et celle du cœur s’accroissent plus que celle du rein. Ces augmentations sont dues à l’accumulation de graisse [
8
].
L’obésité sévère est associée à des augmentations de la pression artérielle systémique, du débit sanguin plasmatique rénal, du taux de filtration glomérulaire et du taux d’excrétion d’albumine [
9
,
10
]. L’ensemble de ces altérations peuvent aussi modifier la pharmacocinétique des médicaments. Les augmentations de la taille des organes et du débit cardiaque peuvent influencer leur clairance et, par conséquent, leur exposition [
4
]. L’obésité est également associée à un risque plus élevé de stéatose hépatique non alcoolique et de de stéatohépatite, d’inflammation chronique de bas grade, de changements hormonaux et de production d’adipokines, des cytokines inflammatoires produites par les adipocytes [
11
–
13
].
Les études de pharmacocinétique s’intéressant aux contraceptifs oraux œstroprogestatifs (COP) n’ont pas permis de déterminer l’effet de l’obésité sur leur efficacité. Westhoff
et al.
[
14
,
15
] ont montré que chez les femmes obèses sous contraception orale combinée (COC) contenant 30 µg d’éthinylœstradiol (EE) et 150 µg de lévonorgestrel (LNG), des concentrations circulantes plus faibles des deux stéroïdes étaient retrouvées par rapport aux femmes ayant un IMC normal. Néanmoins, les concentrations minimales (Cmin, qui correspond à la concentration 24 heures après la prise du comprimé) de ces molécules se sont révélées être similaires dans les deux groupes de femmes. Edelman
et al.
[
14
,
15
] ont également trouvé des concentrations plus faibles de LNG et d’EE chez les femmes obèses après prise de COC associant 20 µg d’EE et 100 µg de LNG. Ces études limitées n’ont pas réellement évalué les paramètres pharmacocinétiques liés à l’absorption et à la distribution de ces stéroïdes. Cependant, l’évaluation de l’activité folliculaire de ces femmes n’a montré aucune différence avec celle de femmes de poids normal, montrant leur efficacité contraceptive.
Dans une méta-analyse regroupant 89 femmes inclues dans quatre études indépendantes [
16
], l’augmentation de l’IMC a été corrélée à la diminution de la concentration maximale (Cmax) et de l’aire sous la courbe des concentrations
4
de LNG et d’EE, mais aucune corrélation n’a été trouvée pour la Cmin. La demi-vie du LNG et de l’EE était plus élevée chez les femmes obèses. Les paramètres pharmacologiques du LNG et de EE étaient bien corrélés entre eux, indiquant que la physiologie des sujets affectait les deux composés de la même manière. L’altération, somme toute assez modeste, des paramètres de propriétés pharmacocinétiques ne se traduit probablement pas, selon les auteurs, par un risque accru de grossesse chez les femmes obèses, mais son association avec une observance médiocre pourrait en accroître le risque. Ces résultats pharmacocinétiques ne s’appliquent qu’aux COC comportant du LNG et de l’EE. Ils ne concernent pas les autres combinaisons de COC, ou les autres progestatifs, pour lesquels il n’existe pas de données.
Deux études pharmacocinétiques s’intéressant à l’administration non orale des contraceptions estroprogestatives, l’une par patch, et l’autre par anneau vaginal, incluant également un petit nombre de femmes, ont montré que, malgré la diminution des concentrations circulantes d’EE, l’activité folliculaire (évaluée par échographie et hormonologie) des femmes présentant une obésité était supprimée par ces méthodes de contraception de façon similaire à ce que l’on observe chez les femmes de poids normal [
17
,
18
].
Sur le plan épidémiologique, le risque d’échec de la contraception hormonale chez les femmes obèses ou en surpoids reste actuellement très discuté [
19
–
25
]. Deux études épidémiologiques cas-contrôles rapportent en effet un risque relatif de grossesse significativement augmenté chez les femmes obèses. À l’inverse, trois études rétrospectives de cohorte et une étude cas-contrôles ne retrouvent pas d’association entre échec de la COP et obésité. Une étude clinique a montré, quant à elle, que les femmes en surpoids ou obèses avaient un risque modérément plus important de grossesse que les femmes ayant un IMC normal, mais ce risque était à la limite de la significativité sur le plan statistique. Zieman
et al.
ont, quant à eux, mis en évidence une association significative spécifiquement entre le poids et le risque de grossesse chez les femmes utilisant le patch estroprogestatif [
25
].
Il n’existe donc pas de preuve formelle d’une efficacité moindre de la COP chez les femmes obèses qui utilisent correctement cette contraception, et quasiment aucune donnée concernant les femmes ayant un IMC supérieur à 35 kg/m² (obésité sévère et morbide) n’a été publiée [
22
,
24
].
Très peu d’études se sont intéressées à l’efficacité des contraceptions progestatives seules chez les femmes en surpoids ou obèses [
24
]. En particulier, aucune donnée n’existe sur l’efficacité chez ces femmes des microprogestatifs et des macroprogestatifs par voie orale, aux doses prescrites habituellement. Concernant l’implant à l’étonogestrel, l’expérience clinique au cours de la troisième année d’utilisation, chez les femmes présentant un surpoids, est limitée. Il a néanmoins été rapporté que les concentrations sériques d’étonogestrel, à la fin des trois ans, chez les femmes de poids supérieur à 70 kg, étaient plus basses que chez les femmes de poids normal [
26
]. Il n’existe cependant aucun argument en faveur d’une baisse d’efficacité de cette contraception dans la population de femmes obèses, car il n’a pas été observé (dans des échantillons de faible taille) d’augmentation du taux de grossesse non désirée chez les femmes l’utilisant [
27
]. Concernant l’acétate de médroxyprogestérone (DMPA) injectable, aucune grossesse chez des femmes obèses n’a été détectée dans une étude menée sur une année, même si les taux circulants d’étonogestrel mesurés chez les femmes obèses étaient réduits [
24
]. Les informations concernant le DIU au LNG sont elles aussi limitées. L’analyse des données acquises par le projet
Contraceptive CHOICE
ne montre pas d’effet de l’IMC sur les échecs de cette contraception [
28
].
|
L’obésité en tant que facteur de risque cardiovasculaire
Chez les femmes, l’obésité est associée à un risque thromboembolique veineux qui augmente avec l’importance de l’IMC, en dehors de toute utilisation de contraception orale œstroprogestative (COP) [
29
]. Ce risque relatif est estimé à 3,70 pour les femmes ayant un IMC supérieur à 30 par rapport aux femmes dont l’IMC est inférieur à 21 [
30
]. La COP est, en elle-même, associée à une augmentation du risque de thrombose veineuse : le risque relatif d’accident thromboembolique veineux varie en effet de 2 à 4 selon la COP utilisée [
31
].
Plusieurs études ont analysé le risque thromboembolique veineux lié à la COP selon l’IMC des femmes qui l’utilisent [
29
]. Contrairement aux autres facteurs de risque cardio-vasculaire, la combinaison de l’obésité et de la contraception orale semble multiplicative [
29
]. Les femmes obèses utilisant une COP ont ainsi un risque thromboembolique veineux 24 fois supérieur à celui des femmes dont l’IMC est normal et qui n’utilisent pas de COP [
30
].
Concernant le risque artériel, il existe très peu d’études spécifiques chez les patientes obèses. Tanis
et al
. ont évalué le risque d’infarctus du myocarde chez des femmes présentant ou non une obésité et utilisant ou non une COP. Dans le sous-groupe des femmes obèses, le risque relatif en l’absence de COP, a été évalué à 3,4, mais il est de 5,1 chez les femmes obèses utilisant une COP [
32
]. Il est néanmoins important de noter que ces événements sont extrêmement rares chez les femmes de moins de 35 ans.
|
Le cas particulier de la chirurgie bariatrique
La contraception des femmes candidates à la chirurgie bariatrique est une question primordiale. En effet, un délai d’au moins 12 mois après la chirurgie est recommandé avant de débuter une grossesse [
33
–
34
]. La contraception doit donc être mise en place avant la chirurgie.
Différentes techniques de chirurgie bariatrique existent
(
Figure 1
)
.
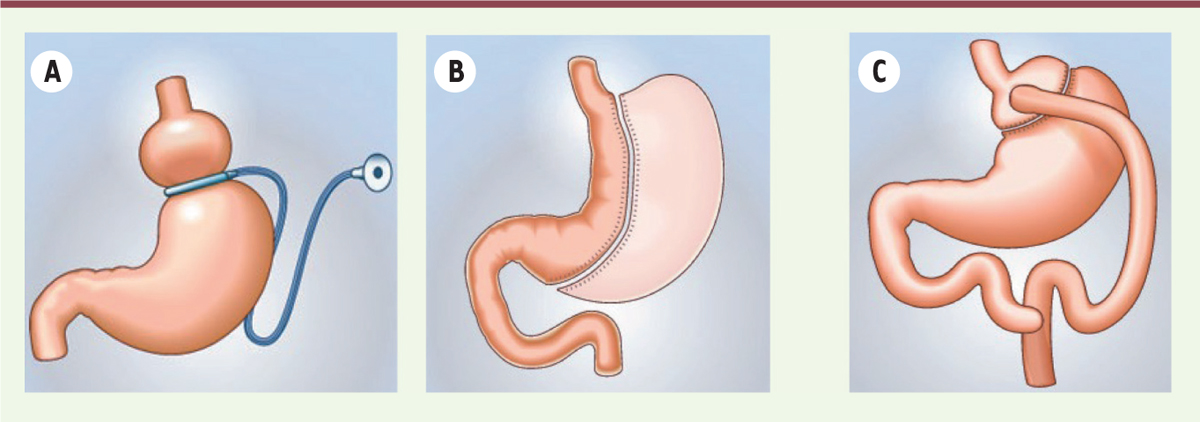
 | Figure 1.
Les chirurgie bariatriques.
Représentation schématique
(A)
de l’anneau gastrique,
(B)
de la
sleeve
gastrectomie et
(C)
du
bypass
gastrique en Y.
|
L’anneau gastrique, qui consiste à placer un anneau en silicone autour de la partie supérieure de l’estomac, le diamètre de l’anneau étant ajustable. Il est relié, grâce à une tubulure, à un boitier placé sous la peau permettant par injection de liquide d’en modifier le diamètre. Il s’agit d’une technique permettant une restriction du volume gastrique. Ces dernières années, le recours à cette technique a fortement diminué (elle ne représente plus que 10 % des interventions), en raison de son efficacité qui reste variable, de l’inconfort digestif qu’elle induit et de la nécessité, pour près de 50 % des patientes, d’une ré-intervention à moyen terme.
La
sleeve
gastrectomie est la technique actuellement la plus pratiquée en France, correspondant à plus de 60 % des interventions. Il s’agit d’une gastrectomie longitudinale des 2/3 de l’estomac, conduisant à une tubulisation de l’estomac, avec un volume résiduel d’environ 120 ml
5
. Elle induit une restriction alimentaire et a un effet satiétogène.
Enfin, le
bypass
gastrique en Y (30 % des interventions) associe la création d’une poche gastrique de petit volume (conduisant à une restriction alimentaire) à une dérivation entre l’estomac et le jéjunum, par une anse intestinale montée en Y. Cette chirurgie implique des mécanismes multiples qui conduisent à la perte de poids, au contrôle de l’appétit et améliorent les comorbidités. La perte de poids est habituellement importante : environ 70 % de l’excès de corpulence, correspondant à une perte de 20 à 30 % du poids corporel, sur le long terme [
35
–
37
].
La modification drastique de l’anatomie gastro-intestinale résultant de la chirurgie bariatrique peut cependant être à l’origine de changements majeurs de biodisponibilité pour un médicament administré par voie orale. Certaines enzymes, responsables du métabolisme des médicaments et certains transporteurs sont en effet principalement localisés dans l’intestin grêle proximal contourné. Les médicaments qui sont absorbés de façon importante à ce niveau peuvent ainsi avoir une biodisponibilité orale qui sera augmentée après la mise en place d’un
bypass
[
38
–
42
]. L’estomac résiduel, réduit après
bypass
et
sleeve
gastrectomie, peut modifier considérablement les processus biopharmaceutiques des médicaments oraux qui ont lieu dans le tractus gastro-intestinal (impliquant la vidange gastrique, la dissolution médicamenteuse, etc., alors diminuées). Des études cliniques, réalisées depuis quelques années, ont évalué l’effet du
bypass
sur l’absorption de ce type de médicaments administrés par voie orale [
38
–
42
]. Il reste cependant difficile de tirer une conclusion générale sur l’effet du
bypass
sur la biodisponibilité de ces médicaments car, pour certains, elle peut être augmentée (atorvastatine, moxifloxacine, metformine), et pour d’autres, réduite (inhibiteurs de la recapture de la sérotonine) [
38
–
42
]. Des études contrôlées sont également nécessaires pour évaluer spécifiquement les effets de l’obésité et du
bypass
.
Concernant les contraceptions hormonales, très peu d’études ont porté sur leur efficacité après chirurgie bariatrique. Des données, obtenues chez trois patientes utilisant un implant à l’étonogestrel, révèlent néanmoins des taux circulants d’étonogestrel concordants avec la persistance d’un effet contraceptif, six mois après la chirurgie et huit mois après la pose de l’implant [
43
]. Une étude récente réalisée chez 20 femmes ayant bénéficié d’un
bypass
et 20 femmes témoins, a évalué la pharmacocinétique, après la prise d’une dose unique, d’un contraceptif oral combiné (COC) associant 30 µg d’EE et 150 µg de LNG. Les résultats de cette étude pilote suggère que le
bypass
n’affecterait pas l’absorption de ces deux composés [
44
]. Une étude pharmacocinétique s’est intéressée par ailleurs à l’absorption de désogestrel (prise orale de 75 µg) chez 14 femmes, avant et après leur chirurgie bariatrique par
bypass
. Comme cela était attendu, une perte de poids significative a été observée chez toutes les femmes après chirurgie. Le désogestrel étant absorbé dans la partie supérieure du tractus gastro-intestinal, cette chirurgie devait altérer son absorption. Néanmoins, aucune différence significative, avant et après la mise en place du
bypass
, n’a pourtant été observée dans l’aire sous la courbe des concentrations sur 24 heures, les demi-vies (temps nécessaire pour que, après administration du médicament, sa concentration plasmatique diminue de moitié), ainsi que le temps nécessaire pour atteindre la concentration maximale de l’étonogestrel (métabolite actif du désogestrel). Par contre, les concentrations maximales se sont révélées être supérieures à celles mesurées avant l’opération (après 52 ± 2 semaines). Cette première étude n’a donc révélé aucun changement cliniquement significatif de la pharmacocinétique de l’étonogestrel, suggérant que le désogestrel, son précurseur, peut être utilisé oralement sans crainte de perte d’efficacité par les femmes après une chirurgie par
bypass
[
45
]. Ces résultats, qui peuvent paraître surprenants, s’expliquent par la capacité de l’ensemble du tube digestif à absorber et à métaboliser les stéroïdes [
46
]. Cependant, la taille de l’échantillon de l’étude étant limitée, ceux-ci nécessitent d’être interprétés avec prudence.
Les recommandations françaises et celles de l’Organisation mondiale de la santé (OMS) s’accordent pour les préconisations de contraception dans le contexte de l’obésité [
33
,
34
,
47
]
(
Figures 2
et
3
)
.
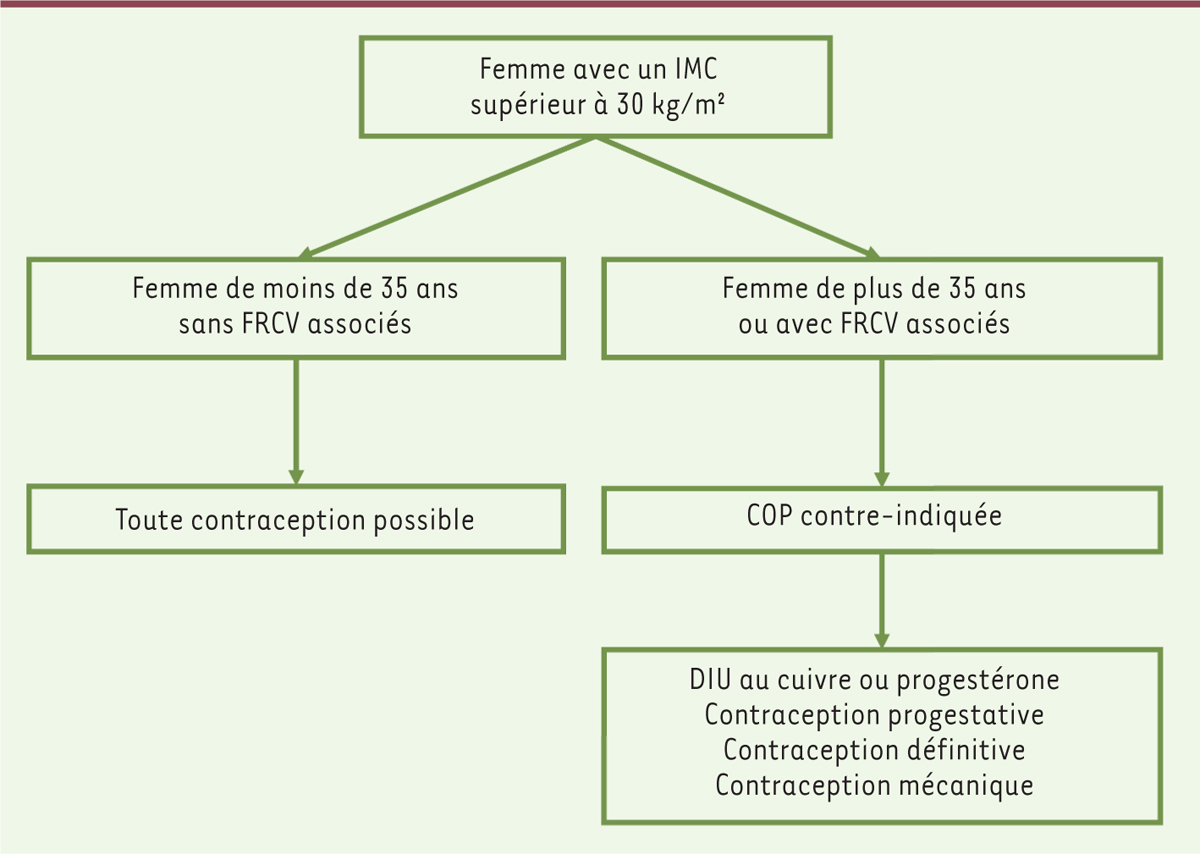
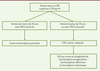 | Figure 2.
Algorithme de choix de la contraception chez les femmes avec une obésité.
IMC : indice de masse corporelle ; FRCV : facteur de risque cardiovasculaire ; COP : contraception orale œstroprogestative ; DIU : dispositif intra-utérin.
|
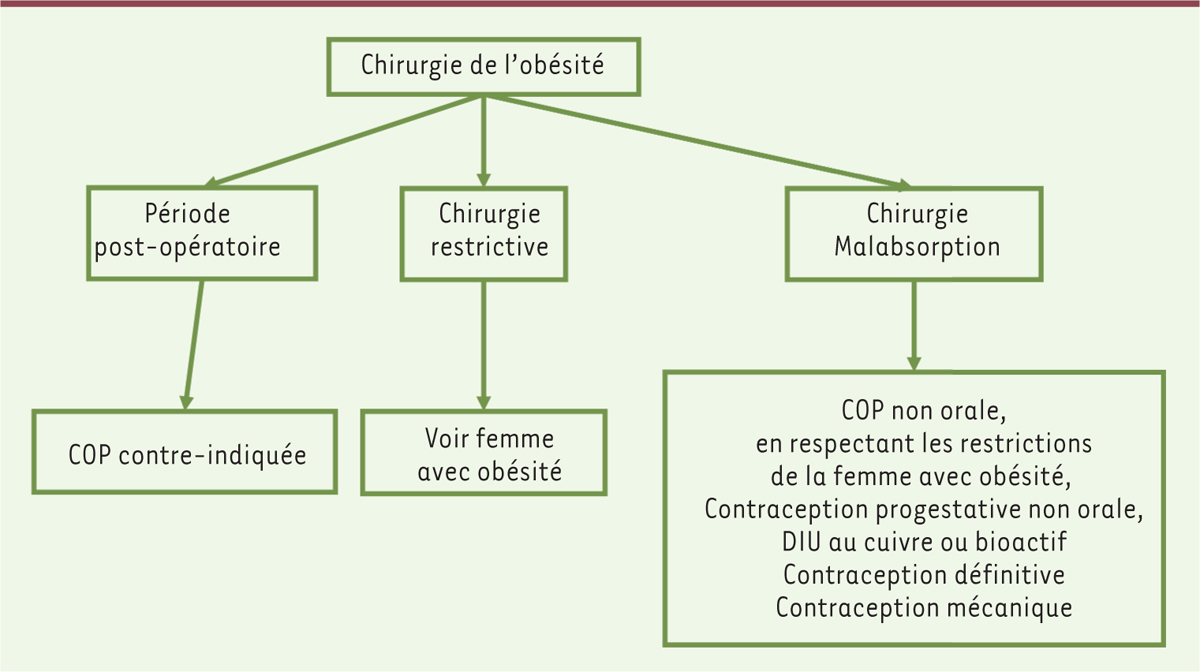
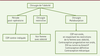 | Figure 3.
Algorithme de choix de la contraception chez les femmes ayant un antécédent de chirurgie bariatrique.
COP : contraception orale œstroprogestative ; DIU : dispositif intra-utérin.
|
Pour une femme de moins de 35 ans, sans facteur de risque cardio-vasculaire associé, et présentant un IMC supérieur à 30 kg/m², les avantages des COP sont plus importants que les risques théoriques. Les précautions d’emploi listées dans les autorisations de mises sur le marché des COP mentionnent néanmoins l’obésité comme facteur à prendre en considération. Les contraceptions microprogestatives, les progestatifs injectables, les implants et le dispositif intra-utérin (DIU) au lévonorgestrel sont classés sans restriction d’utilisation chez les femmes obèses. Il existe néanmoins une augmentation de poids sous contraception progestative injectable chez l’adolescente obèse, ce qui doit faire discuter son utilisation.
Après chirurgie restrictive pure (anneau,
sleeve
), les contraceptifs oraux combinés ou progestatifs peuvent être employés, en tenant compte des restrictions liées aux facteurs de risque associés.
Après intervention entraînant une malabsorption, comme le
bypass
, les contraceptifs oraux restent contre-indiqués. On leur préfèrera les implants progestatifs et les dispositifs intra-utérins.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
2.
Bajos
N
,
Wellings
K
,
Laborde
C
et al.
Sexuality and obesity, a gender perspective : results from French national random probability survey of sexual behaviours.
.
BMJ.
2010;
;
340
:
:c2573.
.
3.
Brill
MJ
,
Diepstraten
J
,
van Rongen
A
et al.
Impact of obesity on drug metabolism and elimination in adults and children.
.
Clin Pharmacokinet.
2012;
;
51
:
:277.
–
304
.
4.
Hanley
MJ
,
Abernethy
DR
,
Greenblatt
DJ
Effect of obesity on the pharmacokinetics of drugs in humans.
.
Clin Pharmacokinet.
2010;
;
49
:
:71.
–
87
.
5.
Ciangura
C
,
Bouillot
JL
,
Lloret-Linares
C
et al.
Dynamics of change in total and regional body composition after gastric bypass in obese patients.
.
Obesity.
2010;
;
18
:
:760.
–
765
.
6.
Chumlea
WC
,
Guo
SS
,
Zeller
CM
et al.
Total body water reference values and prediction equations for adults.
.
Kidney Int.
2001;
;
59
:
:2250.
–
2258
.
7.
Poirier
P
,
Giles
TD
,
Bray
GA
et al.
Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss : an update of the 1997 American heart association scientific statement on obesity and heart disease from the obesity committee of the council on nutrition, physical activity, and metabolism.
.
Circulation.
2006;
;
113
:
:898.
–
918
.
8.
Edholm
D
,
Kullberg
J
,
Haenni
A
et al.
Preoperative 4-week low-calorie diet reduces liver volume and intrahepatic fat, and facilitates laparoscopic gastric bypass in morbidly obese.
.
Obes Surg.
2011;
;
21
:
:345.
–
350
.
9.
Ribstein
J
,
du Cailar
G
,
Mimran
A
Combined renal effects of overweight and hypertension.
.
Hypertension.
1995;
;
26
:
:610.
–
615
.
10.
Valensi
P
,
Assayag
M
,
Busby
M
et al.
Microalbuminuria in obese patients with or without hypertension.
.
Int J Obes Relat Metab Disord.
1996;
;
20
:
:574.
–
579
.
11.
Fabbrini
E
,
Sullivan
S
,
Klein
S
Obesity and nonalcoholic fatty liver disease: biochemical, metabolic, and clinical implications.
.
Hepatology.
2010;
;
51
:
:679.
–
689
.
12.
Lumeng
CN
,
Saltiel
AR
Inflammatory links between obesity and metabolic disease.
.
J Clin Invest.
2011;
;
121
:
:2111.
–
2117
.
13.
Tilg
H
,
Kaser
A
Gut microbiome, obesity, and metabolic dysfunction.
.
J Clin Invest.
2011;
;
121
:
:2126.
–
2132
.
14.
Westhoff
CL
,
Torgal
AH
,
Mayeda
ER
et al.
Pharmacokinetics of a combined oral contraceptive in obese and normal-weight women.
.
Contraception.
2010;
;
81
:
:474.
–
480
.
15.
Westhoff
CL
,
Torgal
AH
,
Mayeda
ER
et al.
Ovarian suppression in normal-weight and obese women during oral contraceptive use: a randomized controlled trial.
.
Obstet Gynecol.
2010;
;
116
:
:275.
–
283
.
16.
Luo
D
,
Westhoff
CL
,
Edelman
AB
et al.
Altered pharmacokinetics of combined oral contraceptives in obesity – multistudy assessment.
.
Contraception.
2019;
;
99
:
:256.
–
263
.
17.
Westhoff
CL
,
Reinecke
I
,
Bangerter
K
,
Merz
M
Impact of body mass index on suppression of follicular development and ovulation using a transdermal patch containing 0.55-mg ethinyl estradiol/2.1-mg gestodene : a multicenter, open-label, uncontrolled study over three treatment cycles.
.
Contraception.
2014;
;
90
:
:272.
–
279
.
18.
Westhoff
CL
,
Torgal
AH
,
Mayeda
ER
, et al.
Pharmacokinetics and ovarian suppression during use of a contraceptive vaginal ring in normal-weight and obese women.
.
Am J Obstet Gynecol.
2012;
;
207
:
:39.e1.
-
6
.
19.
Grimes
DA
,
Shields
WC
Family planning for obese women: challenges and opportunities.
.
Contraception.
2005;
;
72
:
:1.
–
4
.
20.
Trussell
J
,
Schwarz
EB
,
Guthrie
K
Obesity and oral contraceptive pill failure.
.
Contraception.
2009;
;
79
:
:334.
–
338
.
21.
Holt
VL
,
Cushing-Haugen
KL
,
Daling
JR
Body weight and risk of oral contraceptive failure.
.
Obstet Gynecol.
2002;
;
99
:
:820.
–
827
.
22.
Trussell
J
,
Schwarz
EB
,
Guthrie
K
Obesity and oral contraceptive pill failure.
.
Contraception.
2009;
;
79
:
:334.
–
338
.
23.
Holt
VL
,
Scholes
D
,
Wicklund
KG
et al.
Body mass index, weight, and oral contraceptive failure risk.
.
Obstet Gynecol.
2005;
;
105
:
:46.
–
52
.
24.
Lopez
LM
,
Bernholc
A
,
Chen
M
, et al.
Hormonal contraceptives for contraception in overweight or obese women.
.
Cochrane Database Syst Rev.
2016
;
:CD008452.
.
25.
Zieman
M
,
Guillebaud
J
,
Weisberg
E
et al.
Contraceptive efficacy and cycle control with the Ortho Evra/Evra transdermal system: the analysis of pooled data.
.
Fertil Steril.
2002;
;
77
:
:S13.
–
S18
.
26.
Huber
J
,
Wenzl
R
Pharmacokinetics of Implanon.
.
An integrated analysis. Contraception.
1998;
;
58
:
:S85.
–
S90
.
27.
Xu
H
,
Wade
JA
,
Peipert
JF
et al.
Contraceptive failure rates of etonogestrel subdermal implants in overweight and obese women.
.
Obstet Gynecol.
2012;
;
120
:
:21.
–
26
.
28.
Robinson
JA
,
Burke
AE
Obesity and hormonal contraceptive efficacy.
.
Womens Health (Lond).
2013;
;
9
:
:453.
–
466
.
29.
Effect of different progestagens in low oestrogen oral contraceptives on venous thromboembolic disease. World Health Organization collaborative study of cardiovascular disease and steroid hormone contraception.
.
Lancet.
1995;
;
346
:
:1582.
–
8
.
30.
Pomp
ER
,
le
,
CS
,
Rosendaal
FR
,
Doggen
CJ
.
Risk of venous thrombosis: obesity and its joint effect with oral contraceptive use and prothrombotic mutations.
.
Br J Haematol.
2007;
;
139
:
:289.
–
296
.
31.
Skeith
L
,
Le Gal
G
,
Rodger
MA
.
contraceptives and hormone replacement therapy : How strong a risk factor for venous thromboembolism?
Thromb Res Oral.
2021;
;
202
:
:134.
–
8
.
32.
Tanis
BC
,
van den Bosch
MA
,
Kemmeren
JM
et al.
Oral contraceptives and the risk of myocardial infarction.
.
N Engl J Med.
2001;
;
345
:
:1787.
–
1793
.
33.
WHO.
.
Medical eligibility criteria for contraceptive use. A WHO family planning cornerstone.
, 5
e
ed.
Geneva:
:
World Health Organization;
,
2015
.
34.
Ciangura
C
,
Coupaye
M
,
Deruelle
P
et al.
Clinical practice guidelines for childbearing female candidates for bariatric surgery, pregnancy, and post-partum management after bariatric surgery.
.
Obes Surg.
2019;
;
29
:
:3722.
–
3734
.
35.
Sjöström
L.
Review of the key results from the Swedish obese subjects (SOS) trial – a prospective controlled intervention study of bariatric surgery.
.
J Intern Med.
2013;
;
273
:
:219.
–
234
.
36.
Thereaux
J
,
Veyrie
N
,
Barsamian
C
et al.
Similar postoperative safety between primary and revisional gastric bypass for failed gastric banding.
.
JAMA Surg.
2014;
;
149
:
:780.
–
786
.
37.
Ciangura
C
,
Bouillot
JL
,
Lloret-Linares
C
et al.
Dynamics of change in total and regional body composition after gastric bypass in obese patients.
.
Obesity.
2010;
;
18
:
:760.
–
765
.
38.
Padwal
R
,
Brocks
D
,
Sharma
AM
A systematic review of drug absorption following bariatric surgery and its theoretical implications.
.
Obes Rev.
2010;
;
11
:
:41.
–
50
.
39.
Padwal
RS
,
Ben-Eltriki
M
,
Wang
X
et al.
Effect of gastric bypass surgery on azithromycin oral bioavailability.
.
J Antimicrob Chemother.
2012;
;
67
:
:2203.
–
2206
.
40.
Padwal
RS
,
Gabr
RQ
,
Sharma
AM
et al.
Effect of gastric bypass surgery on the absorption and bioavailability of metformin.
.
Diabetes Care.
2011;
;
34
:
:1295.
–
1300
.
41.
Hamad
GG
,
Helsel
JC
,
Perel
JM
et al.
The effect of gastric bypass on the pharmacokinetics of serotonin reuptake inhibitors.
.
Am J Psychiatry.
2012;
;
169
:
:256.
–
263
.
42.
Angeles
PC
,
Robertsen
I
,
Seeberg
LT
et al.
The influence of bariatric surgery on oral drug bioavailability in patients with obesity: a systematic review.
.
J Obes Rev.
2019;
;
20
:
:1299.
–
1311
.
43.
Ciangura
C
,
Corigliano
N
,
Basdevant
A
et al.
Etonorgestrel concentrations in morbidly obese women following Roux-en-Y gastric bypass surgery: three case reports.
.
Contraception.
2011;
;
84
:
:649.
–
651
.
44.
Moreira de Brito
C
,
de Melo
ME
,
Mancini
MC
, et al.
Pharmacokinetics of oral levonorgestrel and ethinylestradiol in women after Roux-en-Y gastric bypass surgery.
.
Surg Obes Relat Dis.
2021;
;
17
:
:673.
–
81
.
45.
Ginstman
C
,
Frisk
J
,
Carlsson
B
et al.
Plasma concentrations of etonogestrel in women using oral desogestrel before and after Roux-en-Y gastric bypass surgery: a pharmacokinetic study.
.
BJOG.
2019;
;
126
:
:486.
–
492
.
46.
Madden
S
,
Back
DJ
,
Martin
CA
,
Orme
ML
Metabolism of the contraceptive steroid desogestrel by the intestinal mucosa.
.
Br J Clin Pharmacol.
1989;
;
27
:
:295.
–
299
.
47.
Chabbert-Buffet
N
,
Marret
H
,
Agostini
A
et al.
Clinical practice guidelines for contraception by the French national college of gynecologists and obstetricians (CNGOF).
.
J Gynecol Obstet Hum Reprod.
2019;
;
48
:
:441.
–
454
.
|