| |
| Med Sci (Paris). 37(10): 863–872. doi: 10.1051/medsci/2021145.Les chimères « systémiques » homme/animal Pierre Savatier1* and Irène Aksoy1 1
Université Lyon 1, unité Inserm 1208, Cellules souches et cerveau (
Stem Cell and Brain Research Institute
, SBRI)
,
18 avenue Doyen Lépine
,
69500Bron
,
France |
Vignette (© Pierre Savatier).
Une chimère inter-espèce est un organisme, embryonnaire, fœtal ou adulte, constitué d’un mélange de cellules provenant de deux espèces différentes. Chez les mammifères, des chimères mouton/chèvre, bœuf/zébu et rat/souris ont été obtenues par agrégation d’embryons préimplantatoires [
1
]. Ces chimères sont dites « systémiques » car le mélange des cellules des deux espèces concerne tous les organes, y compris la lignée germinale. Pour produire des chimères inter-espèces systémiques, une technique, différente de l’agrégation préimplantatoire, consiste à introduire des cellules souches pluripotentes d’une espèce dans un embryon d’une autre espèce. Les cellules injectées s’agrègent aux cellules pluripotentes de l’épiblaste et participent alors à l’organogenèse, après que l’embryon chimère obtenu ait été re-transféré dans l’utérus de l’animal. Les cellules souches pluripotentes utilisées peuvent être soit des cellules souches embryonnaires (ou ES) fabriquées à partir d’embryons préimplantatoires, soit des cellules souches pluripotentes induites (ou iPS) fabriquées par reprogrammation de cellules différenciées. Des chimères inter-espèces produites par adjonction de cellules souches pluripotentes de rat et de mulot à des embryons de souris ont ainsi été obtenues [
1
]. Cette technique repose sur la capacité remarquable des cellules souches pluripotentes de rongeurs à coloniser l’embryon préimplantatoire pour produire des chimères germinales intra-espèces, une propriété utilisée depuis trois décennies pour fabriquer des souris
knockout
, dont un gène ou plusieurs gènes ont été invalidés.
Depuis quelques années, ce paradigme expérimental est appliqué aux cellules ES et iPS humaines dans le but de produire des chimères systémiques homme/animal. Bien que cette technique n’en soit qu’à ses balbutiements, elle ouvre de nombreuses perspectives médicales et biotechnologiques [
1
–
6
]. Elle permettrait d’étudier les mécanismes du développement embryonnaire et fœtal humain, sain et pathologique. Grace aux chimères homme/animal, il serait ainsi possible de modéliser l’efficacité et la sécurité des thérapies cellulaires, ou d’étudier la toxicité de composés chimiques et l’efficacité de nouvelles molécules thérapeutiques sur des cellules humaines différenciées
in vivo,
chez un animal. À plus long terme, cette technique pourrait être utilisée pour produire des tissus et organes humains en vue de leur transplantation.
|
Les chimères rat/souris et la complémentation développementale
Lorsque des cellules ES de souris sont injectées dans des embryons préimplantatoires de rat ou, inversement, que des cellules ES de rat sont injectées dans des embryons préimplantatoires de souris, les cellules injectées colonisent l’épiblaste de l’embryon hôte et participent à la formation de tous les tissus. Les deux types cellulaires forment alors une mosaïque attestant la participation des cellules des deux espèces au développement de l’organisme chimère. L’analyse histologique de ces animaux chimériques a révélé un détail inattendu : lorsqu’on injecte des cellules ES de souris, une espèce possédant une vésicule biliaire, dans des embryons de rat, une espèce qui en est naturellement dépourvue, les animaux chimériques ainsi obtenus possèdent une vésicule biliaire entièrement dérivée des cellules ES de souris. Ainsi, en l’absence de compétition par les cellules de l’embryon hôte, les cellules ES injectées sont capables de former un organe entier qui n’existe pas naturellement chez l’hôte [
7
]. Cette observation fortuite a contribué à l’émergence du concept de
complémentation développementale
.
La complémentation développementale a été explorée dans divers tissus et organes, dont le pancréas, le foie, le poumon, le cœur, le rein, le thymus, le cerveau, les tissus vasculaire et hématopoïétique et la lignée germinale mâle [
5
]. Nous ne discuterons ici que de la complémentation développementale inter-espèces. Le modèle expérimental repose sur l’injection des cellules ES de rat dans des embryons préimplantatoires issus de souris transgéniques porteuses d’une mutation empêchant la formation de l’organe qui est ciblé. Par exemple, la mutation du gène
Pdx1
(
pancreatic and duodenal homeobox 1
), qui code un facteur de transcription, empêche la formation du pancréas endocrine (les cellules b) lors du développement. L’agrégation de cellules ES de rat à des embryons de souris de génotype
Pdx1
-/-
(dépourvues d’expression de ce facteur) produit un animal chimère dans lequel le pancréas, exocrine et endocrine, est entièrement constitué de cellules de rat
(
Figure 1
)
. La complémentation fonctionne également en sens inverse : l’agrégation de cellules ES de souris à des embryons préimplantatoires de rat
Pdx1
-/-
produit un animal chimère dans lequel le pancréas est entièrement constitué de cellules de souris [
8
]. Dans ces expériences, la taille du pancréas formé dans l’animal chimérique est déterminée par l’espèce hôte. Ainsi, le pancréas de rat formé après injection de cellules ES de rat dans des embryons de souris a la taille d’un pancréas de souris, naturellement plus petit, alors que, dans l’expérience inverse, le pancréas de souris formé dans la chimère a la taille d’un pancréas de rat, naturellement plus gros. La greffe d’îlots de Langerhans, extraits du pancréas de l’animal chimérique, à des animaux nouveau-nés syngéniques, donc génétiquement identiques, dépourvus de pancréas, permet de réguler le taux de glucose sérique, indiquant que l’organe ainsi créé est fonctionnel [
9
]. D’autres expériences de complémentation développementale ont été réalisées avec des cellules ES de rat, introduites dans des embryons de souris transgéniques
Nkx2.5
-/-
1,
et
Pax6
-/-
2,
. Dans les fœtus chimères ainsi obtenus, les organes ciblés étaient majoritairement constitués de cellules de rat [
7
]. Dans le cas de la complémentation utilisant les embryons
Nkx2.5
-/-
, les fœtus chimères ont retrouvé une croissance normale au 11
e
jour de gestation.
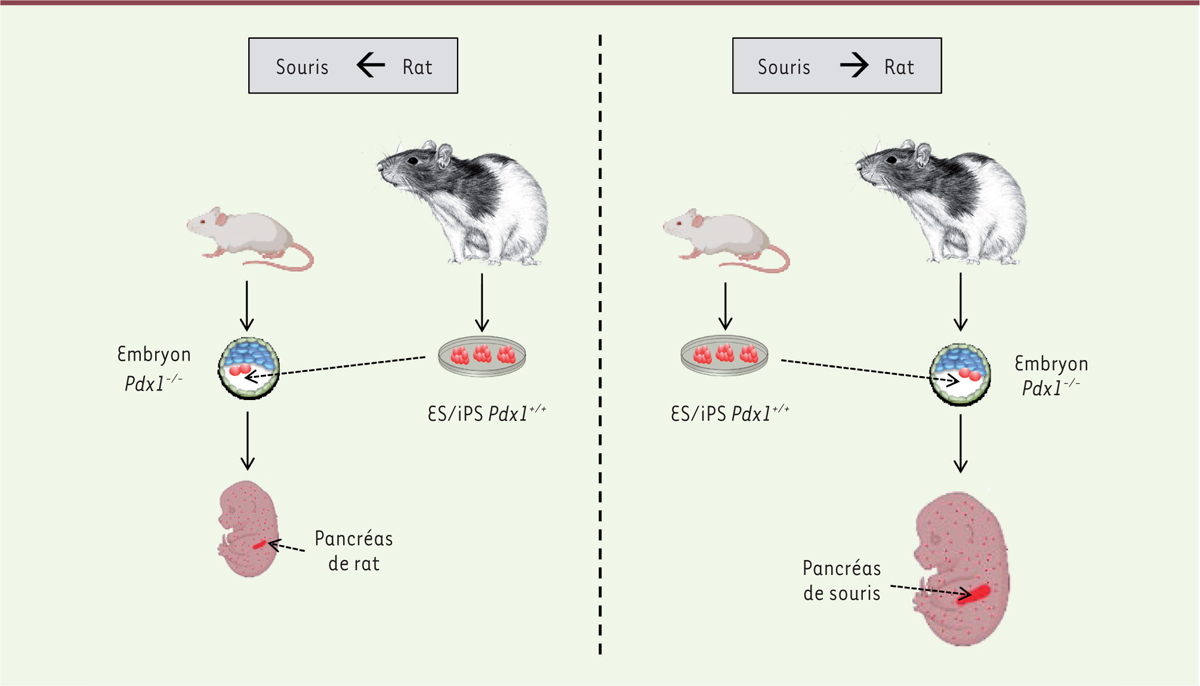
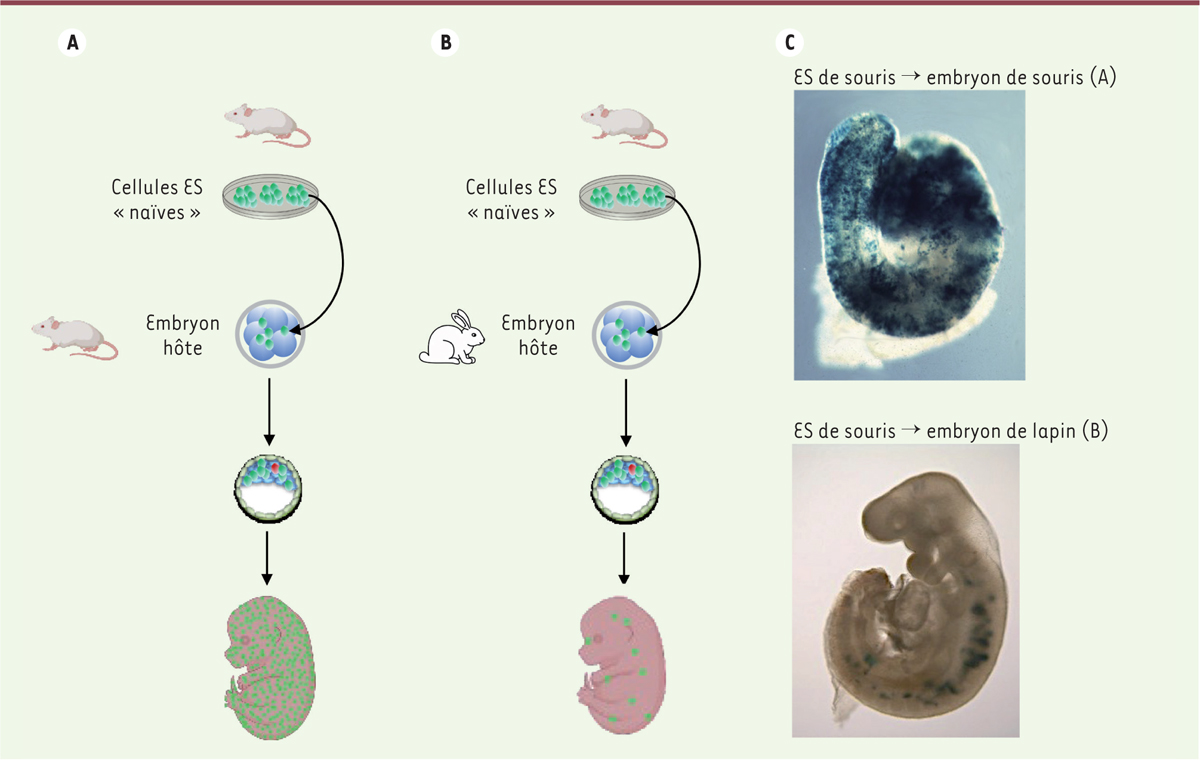
 | Figure 1.
Complémentation développementale entre le rat et la souris.
De rat à souris (panneau de gauche) : l’introduction de cellules ESC/iPSC
Pdx1
+/+
de rat dans des embryons de souris
Pdx1
-/-
produit des fœtus chimères dans lesquels le pancréas est presque entièrement constitué de cellules de rat. De souris à rat (panneau de droite) : l’introduction de cellules ESC/iPSC
Pdx1
+/+
de souris dans des embryons de rat
Pdx1
-/-
produit des fœtus chimères dans lesquels le pancréas est presque entièrement constitué de cellules de souris. Les points rouges dans les fœtus représentent les cellules dérivées des cellules ESC/iPSC qui ont colonisé les autres organes.
Pdx1
:
pancreatic and duodenal homeobox 1
; ESC/iPSC : cellules souches embryonnaires/cellules souches pluripotentes induites.
|
Une étude récente a étudié la complémentation développementale rat/souris dans la cadre de la différenciation germinale [
10
]. Des cellules ES et iPS de souris ont été introduites dans des blastocystes de rat dont le gène
Prdm14
3
avait été inactivé bloquant ainsi la formation des cellules germinales primordiales. Des spermatides de souris se sont développées dans les testicules du rat et des ovocytes de souris fécondés avec ces gamètes ont produit des souriceaux. Toutes ces données suggèrent que la niche développementale créée par la mutation peut être comblée par les cellules d’une autre espèce et que le tissu ou l’organe ainsi obtenu est fonctionnel.
|
L’état naïf de pluripotence et la compétence des cellules ES et iPS à coloniser l’embryon préimplantatoire
L’efficacité de la colonisation des embryons de rat par des cellules ES de souris, et celle du scénario inverse, tient à au moins deux facteurs. Le premier est la proximité phylogénétique des deux espèces (voir plus loin). Le second est relatif aux caractéristiques intrinsèques des cellules ES et iPS des rongeurs. Ces cellules peuvent exister dans deux états différents, appelés « naïf » et « amorcé », selon la nature des facteurs de croissance utilisés pour les produire et les maintenir en culture. L’état naïf requiert l’une des cytokines de la famille de l’interleukine (IL)-6, comme le
leukemia inhibitory factor
(LIF), alors que l’état amorcé est strictement dépendant des facteurs de croissance
fibroblast gowth factor
(FGF)2 et activine A [
11
] (
→
).
(→) Voir la Synthèse de M. Afanassieff
et al.
,
m/s
n° 11, novembre 2018, page 944
L’obtention de chimères systémiques requière des cellules ES et iPS à l’état naïf, l’état le plus immature, qui correspond à l’état dans lequel se trouvent les cellules pluripotentes de l’épiblaste de l’embryon préimplantatoire. Ainsi, lorsque les cellules ES sont réintroduites dans des embryons, elles sont replacées dans leur niche d’origine et participent au développement en contribuant à la formation de tous les tissus et organes, y compris la lignée germinale
(
Figure 2A
)
. C’est le concept d’
équivalence développementale
ou
homochronie
entre les cellules ES implantées et les cellules de l’hôte. Les cellules iPS naïves possèdent les mêmes caractéristiques.
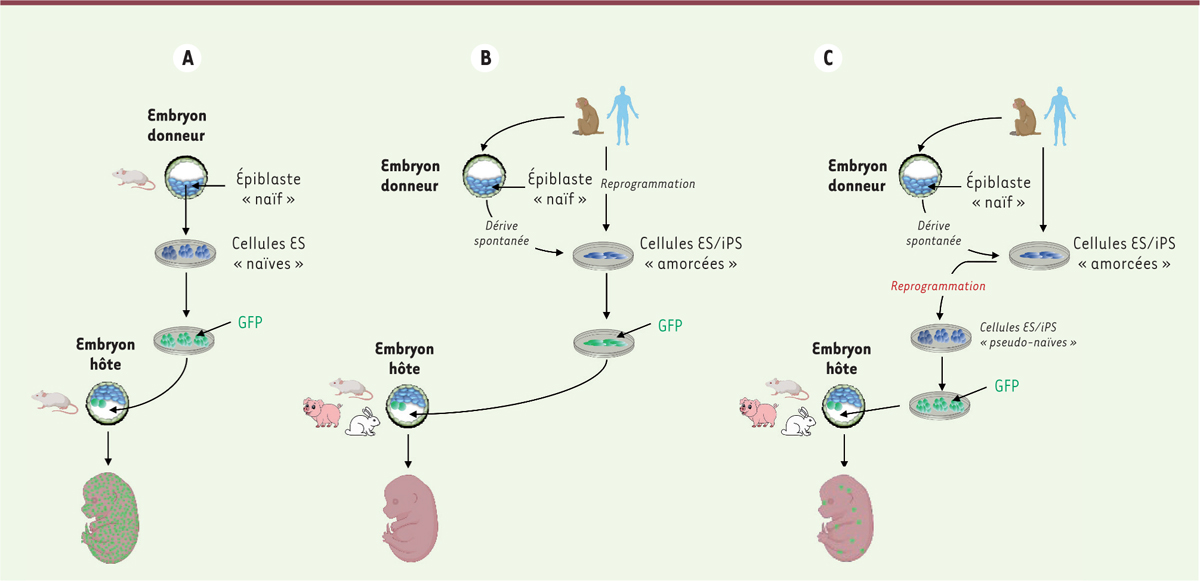
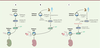 | Figure 2.
Colonisation des embryons préimplantatoires de mammifères par les cellules ES ou iPS de souris, d’homme et de singe macaque Rhésus. (A)
Colonisation de l’embryon de souris par des cellules ES (cellules souches embryonnaires) et iPS (cellules souches pluripotentes induites) de souris.
(B)
Colonisation des embryons de souris, de lapin et de porc par les cellules ES ou iPS d’homme ou de singe macaque Rhésus à l’état amorcé de pluripotence.
(C)
Colonisation des embryons de souris, de lapin et de porc par les cellules ES ou iPS d’homme ou de singe macaque Rhésus à l’état pseudo-naïf de pluripotence. Les cellules injectées sont marquées par la GFP (
green fluorescent protein
).
|
La situation des primates est radicalement différente. Les cellules ES de primates, humain et non-humains, ne répondent pas aux cytokines de la famille de l’IL-6 et n’ont pas les caractéristiques fondamentales de l’état naïf, bien qu’elles soient dérivées d’embryons préimplantatoires, comme chez les rongeurs. En culture, elles subissent en effet une dérive spontanée et ne peuvent s’auto-renouveler efficacement qu’à l’état amorcé, grâce au FGF2 et à l’activine A. Les cellules ES de primates sont donc incapables de former des chimères systémiques après introduction dans des embryons préimplantatoires de souris (ou de primates non-humains) car il n’y a pas d’équivalence développementale avec les cellules de l’hôte
(
Figure 2B
)
. Les cellules iPS de primates, humain et non-humains, présentent les mêmes propriétés et sont également inaptes à la colonisation de l’embryon d’une autre espèce comme la souris [
11
,
12
].
Afin de restaurer l’équivalence développementale, qui fait défaut entre les cellules ES et iPS de primates et les embryons des autres espèces, des protocoles de culture ont été élaborés pour reprogrammer les cellules ES et iPS humaines vers un état naïf
(
Figure 2C
)
. Ces protocoles utilisent différents cocktails de molécules, comprenant des facteurs de croissance, des inhibiteurs de kinases et d’histones déacétylases, ainsi que des agonistes de facteurs de transcription. Les cellules ainsi obtenues présentent les caractéristiques cardinales de l’état naïf de pluripotence avec une reconfiguration du transcriptome et de l’épigénome qui rapprochent les cellules ainsi reprogrammées des cellules pluripotentes naïves de l’embryon préimplantatoire de primates [
13
–
17
]. Après injection dans des embryons de souris, de lapin, de porc, et de singe macaque, les cellules humaines, dites naïves, sont alors capables de coloniser l’embryon préimplantatoire au stade blastocyste. Lorsque les embryons chimères sont transférés dans des femelles hôtes, on observe néanmoins une faible contribution des cellules humaines au développement du fœtus. Le taux de chimérisme obtenu varie en fait d’une étude à l’autre. Les taux les plus faibles ont ainsi été obtenus après injection de cellules iPS humaines dans des embryons de porc (moins de 1 cellule humaine sur 10
4
à 21-28 jours de gestation [
7
]), et les taux les plus élevés (bien qu’inférieurs à 5 % de cellules humaines) après injection dans des embryons de souris [
18
]. Dans ces fœtus chimériques, certaines cellules d’origine humaine expriment des marqueurs spécifiques de l’un ou l’autre des trois lignages embryonnaires (ectoderme, mésoderme et endoderme), indiquant une différenciation au moins partielle de ces cellules. Aucune étude n’a cependant vérifié la diploïdie des cellules. On ne peut donc exclure une fusion entre cellules humaines et cellules de l’hôte, ce qui serait à l’origine de cellule tétraploïdes homme/animal, comme cela a été récemment décrit chez la souris [
19
].
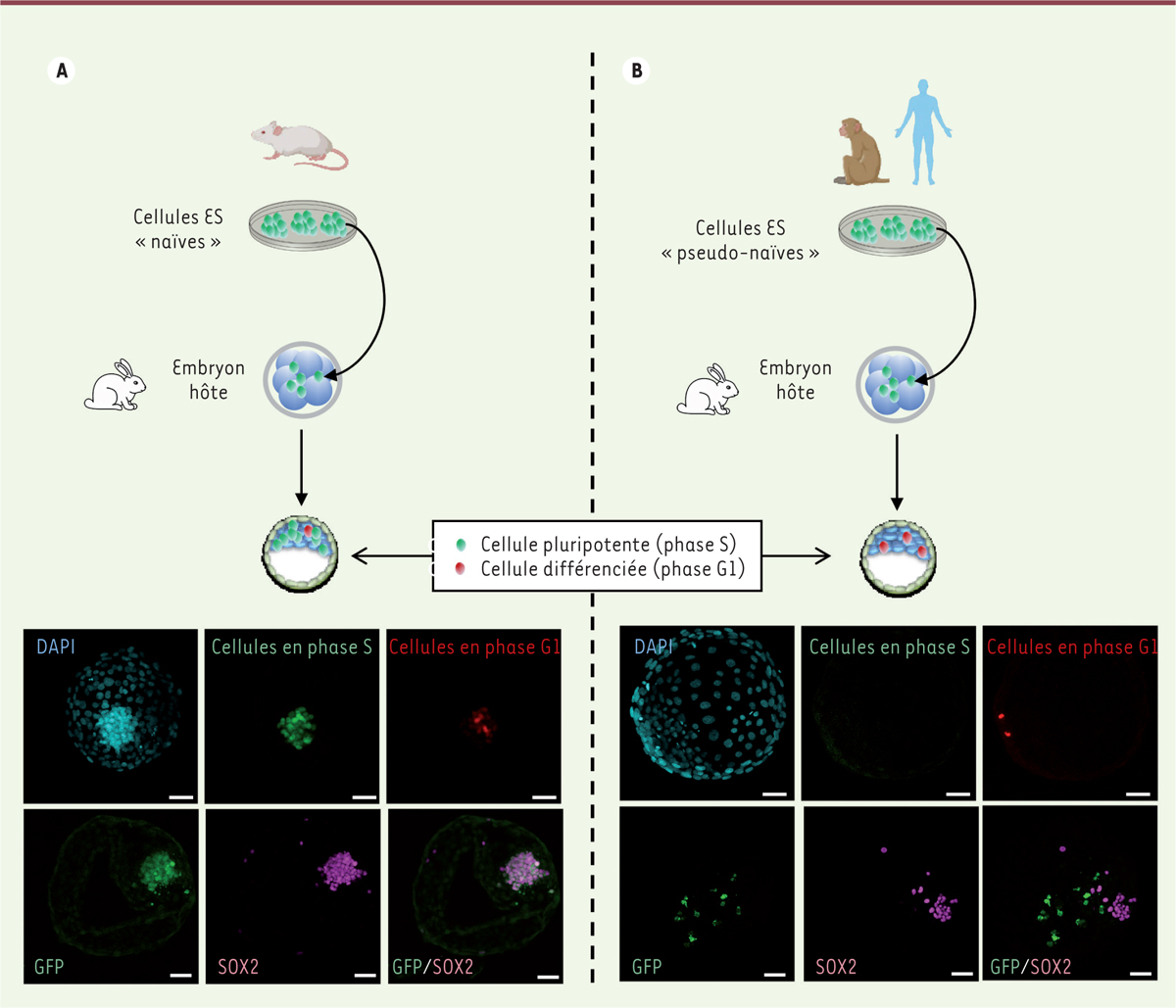
Une question importante est de savoir la raison pour laquelle les cellules ES et iPS de primates, humain et non-humains, alors qu’elles sont reprogrammées à l’état naïf, sont beaucoup moins efficaces que les cellules ES et iPS de rongeurs pour coloniser les embryons. Pour répondre à cette question, nous avons reprogrammé des cellules ES de singe macaque rhésus et des cellules iPS humaines à l’état naïf à l’aide de différents protocoles, puis nous avons introduit les cellules ainsi obtenues dans des embryons de lapin et de singe macaque cynomolgus afin d’étudier leur devenir. Des cellules ES de souris ont été analysées en parallèle, avec le même schéma expérimental. Nous avons observé que les cellules ES de souris se multiplient très activement au sein des embryons de lapin et de macaque, la plupart restant pluripotentes pendant au moins 72 heures. En revanche, les cellules ES de macaque rhésus et les cellules iPS humaines ont un comportement radicalement différent. Après leur injection dans les embryons, la plupart meurent par apoptose. Les cellules qui survivent s’arrêtent en phase G1 du cycle cellulaire et se différencient prématurément en cellules exprimant des marqueurs de l’endoderme et du mésoderme
(
Figure 3
)
[
20
]. Ces résultats révèlent une différence importante entre les cellules souches pluripotentes naïves de souris et de primates : les cellules de primates sont incapables de maintenir un cycle mitotique actif une fois introduites dans l’environnement embryonnaire, ce qui freine leur intégration compétitive aux cellules pluripotentes de l’épiblaste de l’hôte et donc leur participation à son développement.
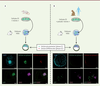 | Figure 3.
Colonisation des embryons préimplantatoires de lapin par les cellules ES de souris (A) et de singe macaque Rhésus (B).
Les photographies montrent des embryons de lapin chimères obtenus après introduction de cellules ES (cellules souches embryonnaires) de souris (A) et de singe macaque Rhésus (B), puis soumis à un immunomarquage pour révéler les cellules en phase S (en vert) et en phase G1 (en rouge), les cellules injectées exprimant la GFP (
green fluorescent protein
), et les cellules pluripotentes exprimant le facteur SOX2 (
sex determining region Y-box 2
) (en violet). Les noyaux sont marqués au DAPI (en bleu).
|
|
L’impact de l’espèce hôte sur la colonisation de l’embryon par les cellules ES et iPS humaines
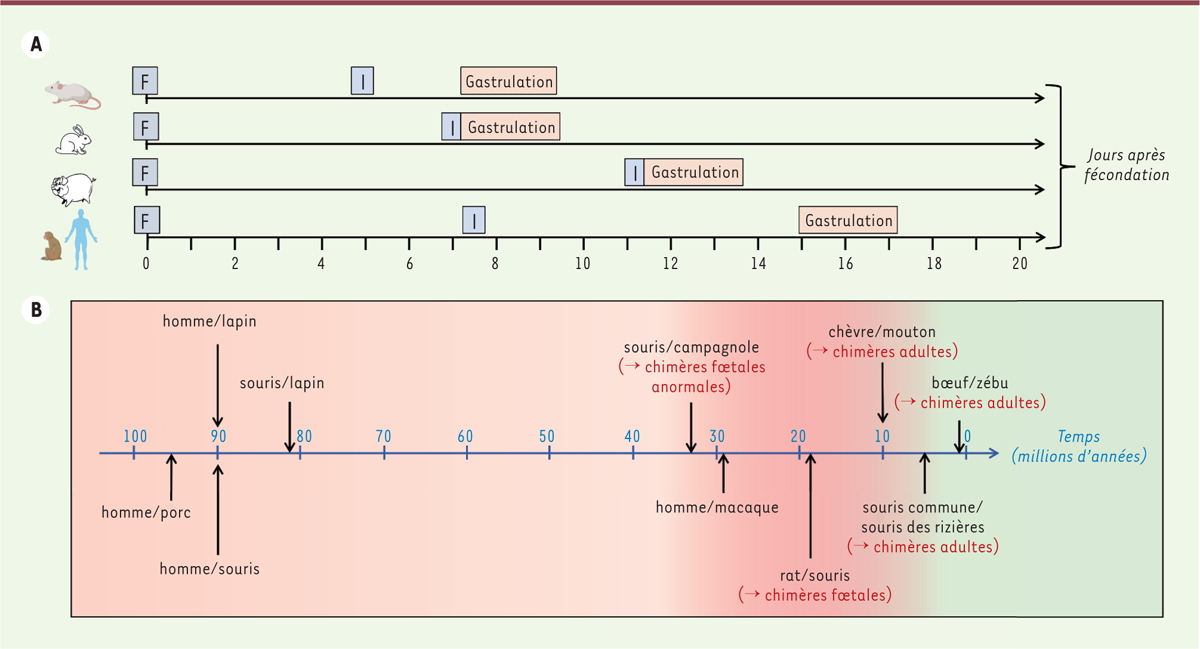
Le choix de l’espèce hôte répond à des contraintes pratiques, biologiques et éthiques. La première contrainte est la disponibilité des embryons. Pour cette raison, la plupart des expériences de chimères homme/animal ont ainsi été réalisées avec des embryons de souris et de lapin. Mais la différence dans la taille des individus et dans la cinétique du développement embryonnaire et fœtal, limite considérablement l’intérêt des rongeurs et des lagomorphes (comme le lapin)
(
Figure 4A
)
. En effet, chez la souris et le lapin, la gastrulation débute au 7
e
jour de développement, mais seulement au 15
e
jour chez l’homme. La vitesse de multiplication des cellules humaines est donc naturellement plus lente que celle des cellules hôtes, ce qui peut expliquer la dilution graduelle des cellules humaines implantées que l’on observe au début du développement post-implantatoire dans les expériences de chimères homme/souris et homme/lapin. Les expériences de complémentation développementale entre le rat et la souris ont révélé que la taille de l’organe était dictée par l’espèce hôte. Un pancréas humain de la taille de celui d’une souris ou d’un lapin serait donc de peu d’utilité pour des applications médicales ou biotechnologiques. Pour ces deux raisons, le porc semble donc, à première vue, une espèce hôte qui serait plus appropriée.
 | Figure 4.
A. Cinétiques de développement comparées de la souris, du lapin, du porc et de l’homme.
F : fécondation ; I : implantation.
B. Âge estimé des ancêtres communs entre espèces utilisées pour fabriquer des chimères systémiques
(d’après
www.timetree.org
).
|
Les chimères homme/porc obtenues à ce jour montrent un taux de chimérisme extrêmement faible (moins de 1 cellule humaine pour 10
4
cellules animales [
7
]). Ce faible taux doit nous interroger sur la capacité des cellules souches pluripotentes humaines à former des chimères systémiques avec des embryons issus d’espèces aussi éloignées. Une chimère systémique inter-espèce ne se définit pas seulement par le mélange de cellules issues de deux espèces. Les cellules souches transférées, que cela soit par injection ou par agrégation, doivent être capables de participer à la différenciation des tissus de l’hôte et au développement de ses organes, en harmonie avec ses propres cellules. Ce co-développement doit s’effectuer sans dysplasie des cellules donneuses qui pourraient altérer la morphologie et le fonctionnement de l’organe chimérique. Dans les études portant sur les chimères homme/porc, 75 % des fœtus chimériques étaient malformés, suggérant un effet délétère des cellules humaines, même en faible nombre, sur le développement du fœtus [
7
]. Des différences de stratégies de développement, la divergence de séquences peptidiques de ligands et de leurs récepteurs, ainsi que des molécules d’adhérence cellulaire, peuvent interférer avec le développement de l’hôte et ainsi rendre le co-développement difficile, voire impossible.
Mais jusqu’à quelle distance phylogénétique le co-développement naturel des cellules de deux espèces est-il possible ? L’étude des chimères inter-espèces, obtenues soit par agrégation d’embryons préimplantatoires, soit par adjonction de cellules ES à des embryons, apporte une première réponse
(
Figure 4B
)
. Des chimères adultes ont pu être obtenues par agrégation d’embryons de bœuf et de zébu (qui ont un ancêtre commun daté de – 0,5 million d’années [MA]), de souris commune et de souris des rizières (ancêtre commun daté de – 6,5 MA), et de chèvre et de mouton (ancêtre commun daté de – 10 MA). Des fœtus chimères rat/souris (ancêtre commun daté de – 20 MA) ont également été obtenus, mais aucun n’a survécu après la naissance. Les fœtus chimériques réalisés entre la souris et le campagnol (ancêtre commun daté de – 33 MA) ont montré des malformations provoquant un arrêt de leur développement
in utero
[
1
]. Il semble donc exister une barrière, située vers – 10/- 15 MA, au-delà de laquelle le co-développement devient difficile, voire impossible. On peut alors s’interroger sur la capacité des chimères homme/porc à se développer, sachant que l’ancêtre commun des primates et des artiodactyles
4
remonte à – 96 MA…
Le singes macaque (rhésus ou cynomolgus) pourrait apporter une solution. On situe l’ancêtre commun des Cercopithèques (singes de l’ancien monde) et des Hominidés vers – 30 MA, une distance encore importante mais peut-être acceptable, si l’on considère le ralentissement de la divergence génétique décrites entre les primates, par rapport à celle décrite avec les rongeurs [
21
]. Les premières chimères embryonnaires entre cellules iPS humaines et embryons de singe macaque cynomolgus [
20
] que nous avons réalisées, ont montré une colonisation par les cellules d’origine humaine sensiblement améliorée par rapport à celle observée dans les chimères homme/lapin. En raison du cadre législatif français et des questions éthiques soulevées par les chimères homme/singe, nous n’avons pas étudié la participation des cellules humaines aux premières étapes de l’organogénèse
in utero
. Mais une équipe sino-américaine a réalisé cette expérience et a cultivé des embryons de macaque cynomolgus de 5 à 13 jours après injection de cellules iPS humaines [
22
]. Quelques embryons chimères ainsi obtenus ont incorporés des cellules humaines, mais ces dernières sont toujours en nombre inférieur à celui qui avait été injecté, ce qui questionne quant à leur survie au cours de la culture.
|
La réponse apoptotique des cellules ES et iPS humaines : un frein à la création de chimères homme/animal
Les cellules pluripotentes sont sujettes au processus de mort par apoptose. L’injection de cellules ES ou iPS humaines dans des embryons de souris, de porc, ou de lapin, déclenchent en effet leur mort par apoptose. Cette mort peut néanmoins être empêchée, grâce à la surexpression du gène anti-apoptotique
BCL2
(
B-cell lymphoma 2
) par les cellules. Par ce stratagème, une augmentation du taux de chimérisme dans l’embryon hôte [
23
] peut être obtenue, en particulier lorsque les cellules iPS sont injectées à l’état naïf de pluripotence [
20
]. L’apoptose apparaît donc comme le premier frein à la création d’embryons chimères homme/animal.
L’inhibition du processus apoptotique a permis de faire la preuve de concept de la possibilité d’une complémentation développementale entre l’homme et le porc. En effet, des cellules iPS humaines sur-exprimant la protéine anti-apoptotique Bcl2, ont été injectées dans des embryons préimplantatoires de porc, dont le gène
ETV2
(
ETS variant transcription factor 2
), un régulateur clé de la différenciation des lignages hémato-endothéliaux, avait été préalablement inactivé. Dans les chimères fœtales ainsi obtenues, la majorité des cellules humaines (plus de 85 %) ont colonisé les lignages hémato-endothéliaux. De rares cellules humaines ont colonisées les autres tissus, beaucoup restant indifférenciées [
24
]. La complémentation développementale est donc un concept qui pourrait être généralisé à d’autres espèces que les rongeurs, bien que, dans l’état actuel des connaissances, il soit nécessaire de réprimer la réponse apoptotique des cellules humaines pour l’observer.
|
La compétition cellulaire : une barrière au chimérisme inter-espèces ?
La compétition cellulaire est un mécanisme de sélection naturelle par lequel les cellules les plus aptes à survivre, appelées
winners
(ou gagneurs), éliminent les cellules voisines moins aptes, appelées
losers
(perdants). Cette compétition serait un mécanisme de surveillance du développement assurant l’intégrité génétique et l’homéostasie tissulaire [
25
,
26
]. Dans l’épiblaste embryonnaire de la souris, ce mécanisme permet l’élimination des cellules indéterminées ou engagées prématurément dans la différenciation. Il assure ainsi l’homogénéité du stock de cellules pluripotentes avant la gastrulation [
27
,
28
]. L’introduction des cellules ES ou iPS dans l’embryon pré-implantatoire perturbe l’homéostasie de l’épiblaste. La question est alors de savoir si l’aptitude intrinsèque de ces cellules, appelée aussi
fitness
, leur permet d’échapper aux mécanismes de surveillance, ou si, au contraire, si elles sont identifiées comme
losers
et éliminées par compétition cellulaire. Le cas des cellules ES de souris est intéressant à cet égard. Lorsqu’on injecte 10 à 15 cellules ES dans des embryons de souris au stade blastocyste, lui-même comprenant une dizaine de cellules pluripotentes, seules une, deux, voire trois cellules, colonisent l’embryon. Elles contribuent néanmoins très massivement (50-90 %) au développement des organes [
29
]. Par contre, lorsque les cellules ES de souris sont injectées dans des embryons pré-implantatoires de lapin, elles colonisent massivement l’épiblaste. Mais leur contribution finale à l’organogenèse est très faible, voire indétectable
(
Figure 5
)
[
20
]. Les cellules ES de souris se comporteraient donc comme des
winners
lorsqu’elles sont injectées dans des embryons de la même espèce, et comme des
losers
lorsqu’elles sont injectées dans des embryons d’une espèce éloignée, comme le lapin. Dans ce dernier cas, elles, ou leurs descendantes immédiates, seraient éliminées par compétition cellulaire.
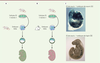 | Figure 5.
Colonisation des embryons préimplantatoires de souris (A) et de lapin (B) par les cellules ES (cellules souches embryonnaires) de souris.
(C) Chimères de 10 jours de développement, obtenues par introduction de cellules ES de souris exprimant le marqueur LacZ dans un embryon de souris (panneau supérieur) et de lapin (panneau inférieur). Le gène marqueur
LacZ
(couleur bleue) permet de mettre en évidence les cellules différenciées qui dérivent des cellules ES de souris.
|
Jun Wu et son équipe ont cherché à savoir si les cellules souches pluripotentes humaines étaient victimes de compétition cellulaire lorsqu’elles étaient mises en contact avec des cellules pluripotentes d’autres espèces [
30
]. En utilisant un système de co-culture, ils ont montré que les cellules souches pluripotentes humaines étaient graduellement éliminées lorsqu’elles sont cultivées en présence de cellules de rat ou de souris au même stade de pluripotence. Cette élimination compétitive est observée bien que les deux types cellulaires se multiplient à la même vitesse. En fait, les cellules de rongeurs active NF-kB (
nuclear factor-
k
B
) dans les cellules humaines, ce qui conduit au déclenchement de la mort de ces dernières par apoptose. Ce phénomène de compétition cellulaire a été également observé entre cellules de rat et cellules humaines, et entre cellules de souris ou de rat et cellules de macaque rhésus. Dans tous les cas, cette compétition cellulaire s’est toujours faite au détriment des cellules souches pluripotentes provenant de primates. Par contre, elle n’a pas été observée entre la souris et le rat ou entre le macaque rhésus et l’homme. Il semble donc que la compétition cellulaire ne soit déclenchée qu’entre cellules d’espèces phylogénétiquement éloignées, ce qui expliquerait la faible contribution des cellules humaines au développement des chimères homme/souris et homme/porc.
Chez la souris, l’inactivation du gène
TP53
, qui code le suppresseur de tumeur p53, inhibe l’apoptose, abolissant ainsi la compétition cellulaire entre cellules pluripotentes
winners
et
losers
au sein de l’épiblaste [
31
]. On peut alors se demander si l’inactivation de ce gène dans les cellules souches pluripotentes humaines leur permettrait d’échapper à la destruction par les cellules de l’hôte, et favoriserait leur colonisation, ainsi rendue plus efficace, des embryons d’autres espèces. L’équipe de Mary G Garry a cherché à répondre à cette question. Pour cela, elle a introduit des cellules iPS humaines n’exprimant plus
TP53
, dans des blastocystes de porc de génotypes
MYF
-/-
,
MYOD
-/-
et
MYF6
-/-
, des gènes impliqués dans la différenciation musculaire. Après deux à trois semaines de développement, l’analyse des fœtus chimères homme/porc ainsi obtenus a révélé que les cellules humaines colonisaient les tissus musculaires de l’animal [
32
]. La compétition cellulaire apparaît donc être un frein important à la complémentation développementale et au chimérisme inter-espèces.
|
Conclusions : quelles stratégies pour quels objectifs ?
La réalisation de chimères systémiques homme/animal à partir de cellules souches pluripotentes humaines requiert plusieurs conditions : 1) les cellules humaines doivent s’auto-renouveler de manière stable à l’état naïf de pluripotence, afin d’assurer une équivalence développementale avec les cellules pluripotentes naïves de l’embryon hôte ; 2) elles doivent avoir une vitesse de multiplication élevée, afin de ne pas être graduellement diluées par les cellules pluripotentes de l’hôte, et doivent être exemptes d’anomalies chromosomiques, afin de ne pas être éliminées par les mécanismes de surveillance embryonnaire ; 3) elles doivent échapper aux mécanismes de mesure de la
fitness
et à la compétition cellulaire ; 4) elles doivent se différencier en harmonie avec les cellules pluripotentes de l’hôte, ce qui implique une préservation des interactions cellulaires et moléculaires entre les deux espèces, en particulier la reconnaissance ligands-récepteurs et l’adhérence cellulaire. À ce jour, seules les chimères entre rat et souris remplissent toutes ces conditions. L’élaboration d’embryons et de fœtus chimères entre l’homme et l’animal se heurte à des verrous biologiques multiples, liés aux caractéristiques des cellules souches pluripotentes humaines, aux particularités du développement embryonnaire de chaque espèce, et à la distance phylogénétique. Deux de ces verrous, l’apoptose et la compétition cellulaire, peuvent être partiellement contournés de manière artificielle, grâce à la surexpression du gène
BCL2
(pour inhiber le processus d’apoptose) et par l’inactivation du gène suppresseur de tumeurs
TP53
(pour l’inhibition de la compétition cellulaire). Mais ces stratégies ne pourront être mises en œuvre pour des applications médicales.
Les chimères systémiques homme/animal soulèvent également de nombreuses interrogations sur le plan éthique. Certains pays ont choisi d’encadrer strictement les recherches par la loi. Dans d’autres pays, les académies nationales des sciences et de médecine, ainsi que les sociétés savantes, ont émis des recommandations
(
Tableau I
)
[
33
–
36
]. Un premier sujet d’inquiétude est le développement des neurones ou de cellules gliales humaines dans le cerveau d’une chimère homme/animal, qui pourrait conduire à la formation d’un cortex cérébral humanisé, doté de capacités cognitives augmentées [
37
]. Une solution consiste à arrêter le développement du fœtus chimérique avant la formation des neurones supra-granulaires impliqués dans l’acquisition des capacités cognitives supérieures. Si l’objet de la recherche exige de dépasser ce stade, il sera possible de verrouiller les mécanismes de la différenciation neurale ou neuronale dans les cellules souches pluripotentes humaines avant leur inoculation dans les embryons animaux, afin d’empêcher le chimérisme dans le cerveau ou le cortex cérébral. L’inactivation des gènes
NEUROGENIN
ou
OTX2
(
orthodenticle homeobox 2
), qui sont impliqués dans le développement neuronal, devrait permettre ce verrouillage. La différenciation germinale humaine dans les organes génitaux de l’animal adulte pose également un problème éthique. Un accouplement fortuit entre la chimère et un animal non chimérique pourrait théoriquement produire un génome diploïde hybride homme/animal. Dans ce cas également, l’arrêt du développement avant la naissance ou le verrouillage de la différenciation germinale grâce à l’inactivation du gène
PRDM14
constituent des solutions relativement simples à mettre en œuvre. Enfin, il est admis de façon consensuelle que les chimères homme/animal doivent conserver leur identité animale. La fabrication de chimères dont l’apparence révélerait une humanisation morphologique doit donc être proscrite.
Tableau I.
|
Cellules animales dans embryon humain |
Cellules humaines dans embryon animal |
Commentaires |
| France |
Interdit |
Autorisé |
La loi de bioéthique du août 2021 autorise l’adjonction de cellules ES et iPS humaines dans des embryons animaux. |
|
| Suisse |
Interdit |
Autorisé |
|
|
| Allemagne |
Interdit |
Autorisé |
Le Conseil d’éthique allemand a recommandé d’interdire certains types de recherche sur les chimères (y compris la création de chimères capables de former des gamètes humains) et d’imposer des restrictions supplémentaires à la création de chimères à partir de cerveaux Homme/animal, en particulier lorsque ces recherches impliquent des primates non humains. |
|
| Canada |
Interdit |
Autorisé |
Même si la création d’embryons chimériques par l’introduction de cellules humaines dans des embryons animaux n’est pas interdite, les principaux organismes responsables du financement de la recherche scientifique au Canada interdisent expressément la création de l’une ou l’autre forme d’embryon chimérique, bloquant ainsi toute recherche de ce type. |
|
| Australie |
Interdit |
Autorisé |
- |
|
| Japon |
Interdit |
Autorisé |
Les transferts des embryons chimères dans l’utérus animal sont autorisés. Le Comité japonais de la bioéthique recommande que la fabrication de cerveaux humanisés chez les primates non-humains soit interdite. |
|
| Royaume-Uni |
Autorisé |
Autorisé |
Les embryons chimériques résultant de l’introduction de cellules animales dans des embryons humains ne peuvent pas être cultivés au-delà du 14
e
jour et ne peuvent pas être transférés dans l’utérus animal. L’Académie des sciences médicales recommande une attention particulière pour les recherches pouvant induire chez l’animal chimère des fonctions cérébrales, des comportements ou une apparence physique « humanisés ». Elle rejette les recherches impliquant la création de chimères entre primates humains et non humains avec des fonctions cérébrales « humaines » ou l’élevage d’animaux avec des cellules germinales dérivées de l’homme.
|
|
| États-Unis
(lois fédérales) |
Autorisé |
Autorisé |
Les NIH (
National Institutes of Health
) ont décrété un moratoire sur le financement fédéral de la recherche sur les chimères Homme/animal. L’Académie nationale des sciences a recommandé d’examiner attentivement les recherches sur les chimères Homme/animal lorsqu’il existe une possibilité que les cellules humaines utilisées contribuent à la formation de tissus neuronaux ou gamétiques.
|
|
| International Society for Stem Cell Research |
- |
- |
L’
International Society for Stem Cell Research
(ISSCR) recommande de ne pas conduire de recherches sur les chimères Homme/animal si elles nécessitent la reproduction d’animaux avec le potentiel de former des gamètes humains. Elle recommande également que les recherches pouvant conduire au chimérisme Homme/animal dans le système nerveux central ou la lignée germinale soient surveillées.
|
Législation internationale et réglementation concernant la fabrication de chimères homme/animal.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nos travaux ont été financés par la Fondation pour la recherche médicale (FRM) (DEQ20170336757), L’Infrastructure nationale en biologie et santé INGESTEM, Le LabEx REVIVE (ANR-10-LABX-73), le LabEx DEVweCAN (ANR-10-LABX-0061), le LabEx CORTEX (ANR-11-LABX-0042), et le programme Investissements d’Avenir de l’université de Lyon (ANR-11-IDEX-0007).
|
Footnotes |
1.
Wu
J
,
Greely
HT
,
Jaenisch
R
,
et al.
Stem cells and interspecies chimaeras.
.
Nature.
2016;
;
540
:
:51.
–
59
.
2.
Rashid
T
,
Kobayashi
T
,
Nakauchi
H
Revisiting the flight of icarus: making human organs from pscs with large animal chimeras.
.
Cell Stem Cell.
2014;
;
15
:
:406.
–
409
.
3.
Masaki
H
,
Nakauchi
H
Interspecies chimeras for human stem cell research.
.
Development.
2017;
;
144
:
:2544.
–
2547
.
4.
Levine
S
,
Grabel
L
The contribution of human/non-human animal chimeras to stem cell research.
.
Stem Cell Res.
2017;
;
24
:
:128.
–
134
.
5.
Suchy
F
,
Nakauchi
H
Interspecies chimeras.
.
Curr Opin Genet Dev.
2018;
;
52
:
:36.
–
41
.
6.
De Los Angeles
A
.
The pluripotency continuum and interspecies chimeras.
.
Curr Protoc Stem Cell Biol.
2019
:
:e87.
.
7.
Wu
J
,
Platero-Luengo
A
,
Sakurai
M
,
et al.
Interspecies chimerism with mammalian pluripotent stem cells.
.
Cell.
2017;
;
168
:
(473–86)
:e15.
.
8.
Kobayashi
T
,
Yamaguchi
T
,
Hamanaka
S
,
et al.
Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells.
.
Cell.
2010;
;
142
:
:787.
–
799
.
9.
Yamaguchi
T
,
Sato
H
,
Kato-Itoh
M
,
et al.
Interspecies organogenesis generates autologous functional islets.
.
Nature.
2017;
;
542
:
:191.
–
196
.
10.
Kobayashi
T
,
Goto
T
,
Oikawa
M
, et al.
Blastocyst complementation using Prdm14-deficient rats enables efficient germline transmission and generation of functional mouse spermatids in rats.
.
Nat Commun.
2021;
;
12
:
:1328.
.
11.
Afanassieff
M
,
Aksoy
I
,
Beaujean
N
,
et al.
Cinquante nuances de pluripotence. Med Sci (Paris).
2018;
;
34
:
:944.
–
953
.
12.
Savatier
P
,
Osteil
P
,
Tam
PP
.
Pluripotency of embryo-derived stem cells from rodents, lagomorphs, and primates: slippery slope, terrace and cliff.
.
Stem Cell Res.
2017;
;
19
:
:104.
–
12
.
13.
Chen
H
,
Aksoy
I
,
Gonnot
F
,
et al.
Reinforcement of STAT3 activity reprogrammes human embryonic stem cells to naive-like pluripotency.
.
Nat Commun.
2015;
;
6
:
:7095.
.
14.
Manor
YS
,
Massarwa
R
,
Hanna
JH
Establishing the human naive pluripotent state.
.
Curr Opin Genet Dev.
2015;
;
34
:
:35.
–
45
.
15.
Weinberger
L
,
Ayyash
M
,
Novershtern
N
,
Hanna
JH
Dynamic stem cell states: naive to primed pluripotency in rodents and humans.
.
Nat Rev Mol Cell Biol.
2016;
;
17
:
:155.
–
169
.
16.
Warrier
S
,
Van der Jeught
M
,
Duggal
G
,
et al.
Direct comparison of distinct naive pluripotent states in human embryonic stem cells.
.
Nat Commun.
2017;
;
8
:
:15055.
.
17.
Collier
AJ
,
Rugg-Gunn
PJ
.
Identifying human naive pluripotent stem cells – evaluating state-specific reporter lines and cell-surface markers.
.
Bioessays.
2018
:
:e1700239.
.
18.
Hu
Z
,
Li
H
,
Jiang
H
, et al.
Transient inhibition of mTOR in human pluripotent stem cells enables robust formation of mouse-human chimeric embryos.
.
Sci Adv.
2020;
;
6
:
:eaaz0298.
.
19.
Zyzynska-Galenska
K
,
Bernat
A
,
Piliszek
A
, et al.
Embryonic environmental niche reprograms somatic cells to express pluripotency markers and participate in adult chimaeras.
.
Cells.
2021;
;
10
:
:490.
.
20.
Aksoy
I
,
Rognard
C
,
Moulin
A
, et al.
Apoptosis, G1 phase stall, and premature differentiation account for low chimeric competence of human and rhesus monkey naive pluripotent stem cells.
.
Stem cell reports.
2021;
;
16
:
:56.
–
74
.
21.
Wu
CI
,
Li
WH
Evidence for higher rates of nucleotide substitution in rodents than in man.
.
Proc Natl Acad Sci USA.
1985;
;
82
:
:1741.
–
1745
.
22.
Tan
T
,
Wu
J
,
Si
C
, et al.
Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo.
.
Cell.
2021;
;
184
:
:2020.
–
32.e14
.
23.
Masaki
H
,
Kato-Itoh
M
,
Takahashi
Y
,
et al.
Inhibition of apoptosis overcomes stage-related compatibility barriers to chimera formation in mouse embryos.
.
Cell Stem Cell.
2016;
;
19
:
:587.
–
592
.
24.
Das
S
,
Koyano-Nakagawa
N
,
Gafni
O
, et al.
Generation of human endothelium in pig embryos deficient in ETV2.
.
Nat Biotechnol.
2020;
;
38
:
:297.
–
302
.
25.
Amoyel
M
,
Bach
EA
Cell competition: how to eliminate your neighbours.
.
Development.
2014;
;
141
:
:988.
–
1000
.
26.
Wu
J
Izpisua Belmonte JC. Dynamic pluripotent stem cell states and their applications.
.
Cell Stem Cell.
2015;
;
17
:
:509.
–
525
.
27.
Diaz-Diaz
C
,
Fernandez de Manuel
L
,
Jimenez-Carretero
D
,
et al.
Pluripotency surveillance by myc-driven competitive elimination of differentiating cells.
.
Dev Cell.
2017;
;
42
:
:585.
–
599
.
28.
Hashimoto
M
,
Sasaki
H
.
Epiblast formation by TEAD-YAP-dependent expression of pluripotency factors and competitive elimination of unspecified cells.
.
Dev Cell.
2019;
;
50
:
:139.
–
54e5
.
29.
Wang
Z
,
Jaenisch
R
At most three ES cells contribute to the somatic lineages of chimeric mice and of mice produced by ES-tetraploid complementation.
.
Dev Biol.
2004;
;
275
:
:192.
–
201
.
30.
Zheng
C
,
Hu
Y
,
Sakurai
M
, et al.
Cell competition constitutes a barrier for interspecies chimerism.
.
Nature.
2021;
.
592
:
:272.
–
6
.
31.
Bowling
S
,
Di Gregorio
A
,
Sancho
M
,
et al.
P53 and mTOR signalling determine fitness selection through cell competition during early mouse embryonic development.
.
Nat Commun.
2018;
;
9
:
:1763.
.
32.
Maeng
G
,
Das
S
,
Greising
SM
, et al.
Humanized skeletal muscle in MYF5/MYOD/MYF6-null pig embryos.
.
Nat Biomed Eng.
2021;
;
5
:
:805.
–
14
.
33.
Mizuno
H
,
Akutsu
H
,
Kato
K
Ethical acceptability of research on human-animal chimeric embryos: summary of opinions by the Japanese expert panel on bioethics.
.
Life Sci Soc Policy.
2015;
;
11
:
:15.
.
34.
Hyun
I.
From naive pluripotency to chimeras: a new ethical challenge?
.
Development.
2015;
;
142
:
:6.
–
8
.
35.
Bourret
R
,
Martinez
E
,
Vialla
F
,
et al.
Human-animal chimeras: ethical issues about farming chimeric animals bearing human organs.
.
Stem Cell Res Ther.
2016;
;
7
:
:87.
.
36.
Koplin
JJ
,
Savulescu
J
Time to rethink the law on part-human chimeras.
.
J Law Biosci.
2019;
;
6
:
:37.
–
50
.
37.
Crane
AT
,
Voth
JP
,
Shen
FX
,
Low
WC
Concise review: human-animal neurological chimeras: humanized animals or human cells in an animal?
.
Stem Cells.
2019;
;
37
:
:444.
–
452
.
|