| |
| Med Sci (Paris). 37(10): 843–847. doi: 10.1051/medsci/2021133.Dysfonction mitochondriale et défaillance de la mitophagie dans la maladie d’Alzheimer Arnaud Mary,1* Loan Vaillant-Beuchot,1* Frédéric Checler,1 and Mounia Chami1* 1Université Côte d’Azur, Inserm, CNRS, Institut de pharmacologie moléculaire et cellulaire, Laboratoire d’excellence DistALZ
,
660 route des Lucioles
,
06560Sophia-Antipolis, Valbonne
,
France MeSH keywords: Maladie d'Alzheimer, Autophagie, Humains, Mitochondries, Mitophagie |
La maladie d’Alzheimer est la maladie neurodégénérative la plus répandue dans le monde. En l’absence de thérapie efficace, cette maladie, dont l’incidence ne cesse d’augmenter, représente un défi scientifique, économique, et sociétal. L’un de ses principaux symptômes est la perte de la mémoire, qui se développe sur plusieurs dizaines d’années, associée à une défaillance fonctionnelle de neurones situés dans des zones spécifiques du cerveau régissant les fonctions d’apprentissage et de mémorisation, notamment l’hippocampe. Les analyses
post-mortem
de cerveaux de patients atteints de la maladie d’Alzheimer, et des modèles murins de la maladie, ont conduit à définir cette maladie comme une « protéinopathie » qui se caractérise par l’accumulation dans les cellules et dans le milieu extracellulaire (s’agrégeant dans des plaques séniles) du peptide amyloïde β (Aβ), et par une phosphorylation anormale de la protéine Tau (pTau), conduisant à la dégénérescence neurofibrillaire (
neurofibrillary tangles
, NFT) des neurones [
1
].
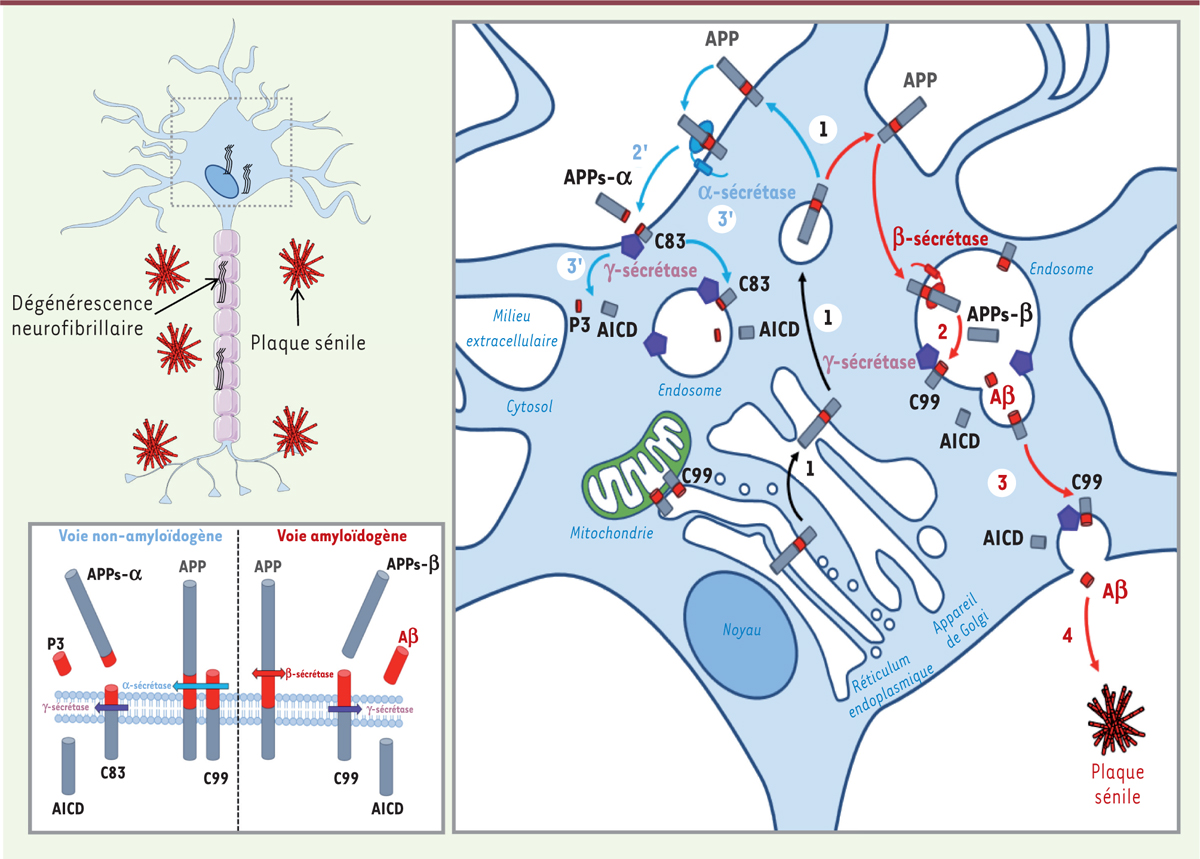
Le peptide Aβ est produit par clivages successifs de la protéine précurseur du peptide amyloïde (
amyloid protein precursor
, APP) par les enzymes β- et γ-sécrétases, dans la voie amyloïdogène
(
Figure 1
)
. L’apparition des formes familiales précoces et agressives de la maladie d’Alzheimer, favorisées par des mutations dans les gènes codant l’APP et les présénilines 1 et 2 (PS1/2, composants du complexe γ-sécrétase), a conduit à proposer que la voie amyloïdogène jouait un rôle majeur dans la pathogenèse de la maladie d’Alzheimer. Néanmoins, l’échec des traitements ciblant uniquement l’Aβ indique que d’autres fragments issus du clivage de l’APP pourraient contribuer aux dysfonctionnements cellulaires impliqués dans le développement de la maladie d’Alzheimer. Le rôle pathogène des fragments C-terminaux de l’APP (APP-CTF : C99 et C83)
(
Figure 1
)
a ainsi été récemment souligné dans différentes études [
2
].
 | Figure 1.
Représentation schématique de deux voies de protéolyse de l’APP : amyloïdogène
(1 à 4) et
non-amyloidogène
(1 à 3’). Dans les conditions physiologiques, l’APP mature est adressée à la membrane plasmique (1), produisant, après clivage par l’α-sécrétase (2’), le fragment soluble APPs-α et le fragment C83, qui reste ancré à la membrane. Ce dernier est ensuite clivé par la γ–secrétase (3’), produisant les peptides p3 et AICD (
APP intracellular domain
). Par ailleurs, l’APP mature (1) est clivée par la β-sécrétase (2) après son internalisation dans la voie des endosomes/lysosomes, produisant le fragment soluble APPs-β, qui est libéré dans l’environnement extracellulaire, et le fragment C99 qui reste ancré dans la membrane et est ensuite clivé par la γ-secrétase (3), produisant les peptides AICD et Aβ. La voie amyloïdogène est favorisée dans les formes familiales de la maladie d’Alzheimer. Dans les formes sporadiques, la baisse de la dégradation des peptides Aβ peut conduire à leur accumulation, à leur agrégation et à la formation des plaques séniles. Nous avons rapporté la présence et le clivage de l’APP dans les membranes associées aux mitochondries, et l’accumulation du fragment C99 dans la mitochondrie [
7
].
|
|
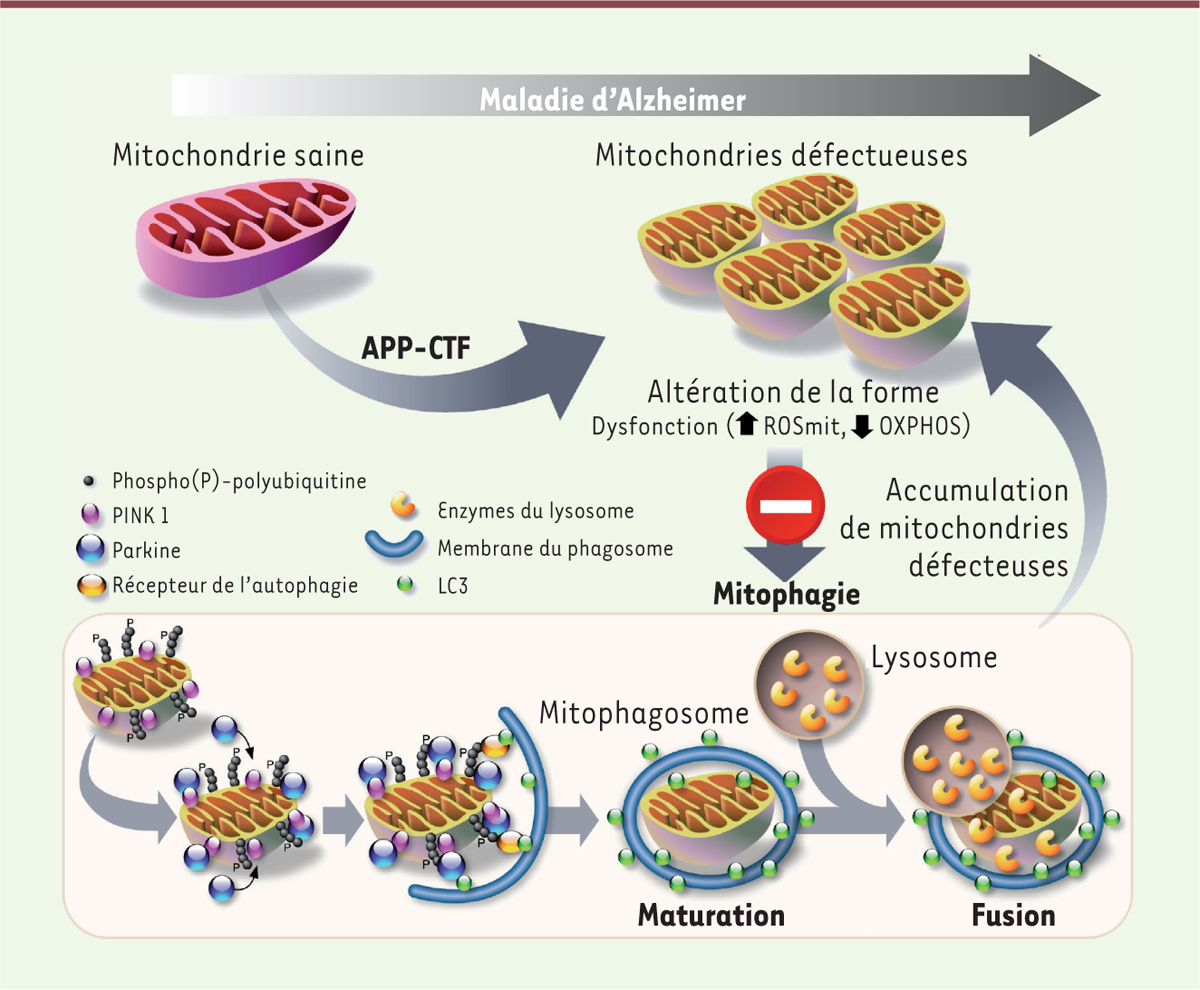
Les dysfonctions mitochondriales dans la maladie d’Alzheimer
Les mitochondries sont des organelles intracellulaires dont la fonction principale est de produire de l’énergie sous la forme d’ATP. Dans les neurones, l’ATP est nécessaire notamment à la libération des neurotransmetteurs et à la plasticité synaptique. L’homéostasie des mitochondries nécessite leur dégradation par un processus autophagique spécifique, la mitophagie, qui se réalise en trois étapes [
3
] : 1) la modification (par phosphorylation ou ubiquitination) de certaines protéines mitochondriales pour signaler les mitochondries dysfonctionnelles ; 2) la séquestration de la mitochondrie dysfonctionnelle dans une vacuole autophagique (appelée mitophagosome) ; et 3) la fusion de cette vacuole avec les lysosomes contenant des enzymes de dégradation afin de la détruire
(
Figure 2
)
.
 | Figure 2.
Impact de l’accumulation des fragments APP-CTF sur l’homéostasie mitochondriale dans des modèles d’étude de la maladie d’Alzheimer.
L’accumulation des fragments APP-CTF dans la mitochondrie entraîne des altérations spécifiques de sa structure et de sa fonction. Cette accumulation entraîne également une défaillance de la mitophagie, un processus au cours duquel les mitochondries altérées sont habituellement dégradées. La mitophagie dépendante de l’interaction fonctionnelle entre PINK1 et la parkine débute par la stabilisation de la protéine PINK1 à la surface de la mitochondrie, consécutive à la dépolarisation de la membrane mitochondriale, et son autophosphorylation, entraînant le recrutement de la parkine, une ubiquitine ligase, à la mitochondrie. Cette enzyme assure l’ubiquitination de plusieurs protéines mitochondriales, ce qui favorise le recrutement d’un autophagosome englobant la mitochondrie. Ce mitophagosome mature fusionne avec le lysosome, dont le contenu riche en protéases actives à pH acide permet la dégradation de la mitochondrie et de ses composants. Dans la maladie d’Alzheimer, l’accumulation des fragments APP-CTF induit un blocage de la fusion du mitophagosome avec le lysosome, aboutissant à l’accumulation des mitochondries défectueuses. ROSmit : espèces réactives de l’oxygène dans la mitochondrie ; OXPHOS : phosphorylation oxydante.
|
Plusieurs études reposant sur des modèles
in vitro
et
in vivo
de la maladie d’Alzheimer [
4
], et l’analyse
post-mortem
de cerveaux d’individus atteints de cette maladie à des stades précoces [
5
], ont montré l’existence d’une altération de la structure du réseau et du métabolisme mitochondrial. Ces défauts ont généralement été associés à la présence du peptide Aβ [
4
]. L’existence d’un défaut de la mitophagie impliquant principalement l’Aβ et la protéine Tau hyperphosphorylée a également été soulignée par certains auteurs [
6
]. Nous avons récemment démontré la présence et le clivage de l’APP dans les « membranes associées aux mitochondries » (
mitochondria-associated membranes
), des sites de contact entre mitochondries et réticulum endoplasmique, et rapporté la présence d’APP-CTF dans la mitochondrie
(
Figure 1
)
[
7
]. Cette observation nous a conduits à émettre l’hypothèse d’un rôle spécifique de ces APP-CTF dans le dysfonctionnement mitochondrial dans la maladie d’Alzheimer [
8
].
|
L’accumulation des fragments APP-CTF induit des défauts de la structure et de la fonction des mitochondries
Nous avons utilisé une lignée cellulaire de neuroblastome humain (la lignée SH-SY5Y) dont les cellules surexpriment un APP portant une double mutation décrite dans une famille suédoise, Lys670Met et Asn671Leu (APP
Lys670Met, Asn671Leu
également appelée APPswe), qui favorise l’accumulation des APP-CTF et de l’Aβ [
8
]. Ces cellules contiennent des mitochondries de plus grande taille, avec une désorganisation de leurs crêtes et une perte de la densité de leur matrice. Afin d’établir la contribution respective de l’Aβ et des fragments APP-CTF dans l’altération de la structure de ces mitochondries, nous avons traité les cellules APPswe avec un inhibiteur de la γ-sécrétase, bloquant ainsi la production d’Aβ au profit d’une accumulation d’APP-CTF
(
Figure 1
)
. Par des techniques de fractionnements subcellulaires et d’imagerie confocale, nous avons montré la présence et l’accumulation des APP-CTF dans les mitochondries, associées à une fragmentation du réseau mitochondrial et à une désorganisation et une localisation des crêtes à la périphérie de la matrice mitochondriale. Cette observation a été étayée par le blocage de la β-sécrétase (réduisant à la fois la production de l’Aβ et du fragment C99). Celui-ci prévient en effet la fragmentation des mitochondries, rétablit la densité de la matrice mitochondriale et normalise l’organisation des crêtes [
8
].
Parallèlement à l’altération de la structure des mitochondries, nous avons observé que les cellules de la lignée SH-SY5Y (APPswe) présentent plusieurs signes d’un dysfonctionnement mitochondrial se manifestant par une diminution de la quantité de la sous-unité NDUFB8 (
NADH:ubiquinone oxidoreductase subunit B8
) du complexe I de la chaîne respiratoire mitochondriale, associée à une baisse de son activité, une diminution du potentiel de membrane mitochondrial (ΔΨm), et une augmentation de la production des espèces réactives de l’oxygène dans la mitochondrie. L’utilisation d’inhibiteurs de la β-sécrétase et de la γ-sécrétase nous a permis de discriminer les effets dépendant du peptide Aβ (dépolarisation de la membrane mitochondriale) de ceux dépendant à la fois de l’Aβ et des APP-CTF (déficit du complexe I de la chaîne respiratoire mitochondriale). Par ailleurs, nous avons montré que l’accumulation des APP-CTF dans les mitochondries, indépendamment de l’Aβ, exacerbe la production des espèces réactives de l’oxygène. Enfin, grâce à l’analyse d’un modèle cellulaire exprimant le fragment C99 de l’APP de façon inductible (cellules SH-SY5Y C99), nous avons confirmé l’impact des APP-CTF sur les dysfonctions mitochondriales. Ce modèle montre en effet une accumulation des APP-CTF dans la mitochondrie, un défaut de l’expression et de l’activité du complexe I de la chaîne respiratoire, et une surproduction des espèces réactives de l’oxygène [
8
].
|
L’accumulation des fragments APP-CTF induit une défaillance de la mitophagie, indépendamment de l’Aβ
L’absence d’un phénotype apoptotique dans les cellules SH-SY5Y APPswe et SH-SY5Y C99 traitées avec l’inhibiteur de la γ-sécrétase nous a orientés vers l’étude de la mitophagie dans ces cellules. Par des approches biochimiques, associées à un fractionnement subcellulaire, nous avons quantifié différents marqueurs moléculaires de la mitophagie et avons analysé les différentes étapes du processus mitophagique par l’utilisation de différentes sondes fluorescentes et de l’imagerie. Dans les cellules SH-SY5Y APPswe, nous avons observé les premières étapes du processus mitophagique, caractérisé par un enrichissement en protéine PINK1 (
PTEN-induced kinase 1
) dans la fraction mitochondriale, par le recrutement dans la mitochondrie de la parkine, une ubiquitine ligase, et par la conversion de la forme cytosolique LC3-I de la protéine MAP1LC3 (
microtubule-associated protein 1A/1B-light chain 3
) en LC3-II, la forme recrutée à la membrane des autophagosomes. Nos résultats indiquent cependant l’existence d’un blocage du processus mitophagique, révélé par l’absence de dégradation de la protéine SQSTM1/p62 (séquestosome 1 ou protéine de liaison à l’ubiquitine p62) et par l’accumulation de plusieurs protéines mitochondriales (TIMM23, TOMM20, HSP60 et HSP10). Cette défaillance de la mitophagie a été confirmée par la mise en évidence d’un défaut d’adressage et de fusion des mitochondries aux lysosomes. Nous avons ensuite montré que l’accumulation des APP-CTF, indépendamment de l’Aβ, exacerbe la défaillance de la mitophagie dans les cellules SH-SY5Y APPswe et SH-SY5Y C99 [
8
].
|
L’accumulation des fragments APP-CTF entraîne une altération de la structure des mitochondries et une défaillance de la mitophagie dans des modèles murins de la maladie d’Alzheimer
Dans une étude précédente [
9
], nous avions rapporté une accumulation précoce des fragments APP-CTF (dès l’âge de 3 mois) dans la structure hippocampique du cerveau de souris triple transgéniques (3xTgAD) portant la mutation familiale Met146Val dans le gène codant PS1 et surexprimant les protéines humaines APPswe et Tau mutée (Tau
Pro301Lys
) sous le contrôle du promoteur Thy1.2. Ces souris développent tardivement des plaques séniles (entre 6 et 12 mois) et des NFT (à l’âge de 15 mois). Nos travaux et ceux d’autres équipes ont montré par la suite l’implication des APP-CTF dans le défaut de l’autophagie et dans le déficit synaptique et cognitif [
10
,
11
]. Nous avons montré l’existence d’une accumulation des APP-CTF dans la fraction mitochondriale chez des souris 3xTgAD jeunes (ne présentant pas encore de plaques séniles et n’ayant pas de peptide Aβ détectable), exacerbée par le traitement par l’inhibiteur de la γ-sécrétase. L’accumulation des APP-CTF induit une altération de la structure des mitochondries se manifestant par une matrice mitochondriale peu dense et par une désorganisation et une localisation des crêtes à la périphérie de la matrice mitochondriale. Ces défauts de la structure des mitochondries sont visibles dès trois mois chez des souris exprimant spécifiquement le fragment C99 par transduction virale (souris AAV-C99). Cette altération de la structure des mitochondries est accompagnée d’une mitophagie défaillante dans les deux modèles murins après le traitement avec l’inhibiteur de la γ-sécrétase, démontrant le lien entre l’accumulation des APP-CTF
in vivo
et une accumulation de mitochondries dysfonctionnelles [
8
].
Nous avons ensuite analysé la structure des mitochondries et la mitophagie dans le modèle 3xTgAD à un stade tardif. Une accumulation des APP-CTF, ainsi que les marqueurs histologiques caractéristiques de la maladie d’Alzheimer (plaques séniles et NFT), ont été observés dans les cellules de ce modèle, comparativement aux cellules murines double transgéniques (2xTgAD) qui accumulent les APP-CTF mais ne présentent pas les marqueurs histologiques liés à l’Aβ et pTau [
9
]. Nous avons montré l’existence, dans les deux modèles, d’une accumulation des APP-CTF dans la fraction mitochondriale, associée à une augmentation de la taille des mitochondries et à une organisation anormale de leurs crêtes. Ces résultats démontrent formellement que l’accumulation des APP-CTF est suffisante pour induire des altérations de la structure mitochondriale. Néanmoins, la comparaison de ces deux modèles murins a révélé la contribution tardive de l’Aβ dans l’activation du processus mitophagique chez les souris 3xTgAD âgées [
8
].
|
L’accumulation des APP-CTF est corrélée avec un défaut de la mitophagie dans les cerveaux de patients atteints de la maladie d’Alzheimer
L’analyse biochimique
post-mortem
des cerveaux de patients atteints de formes non familiales de la maladie d’Alzheimer à des stades avancés démontre une accumulation des APP-CTF (C99 et C83) et de l’Aβ dans la fraction mitochondriale, couplée à un défaut de la mitophagie caractérisé par une baisse des quantités de PINK1 et de parkine dans la mitochondrie, une augmentation du ratio LC3-II/LC3-I et de la protéine SQSTM1/p62. Nous avons rapporté une corrélation significative entre les niveaux du fragment C99 et les variations des marqueurs mitophagiques analysés, tandis que ces corrélations sont seulement partielles avec les taux d’Aβ et de pTau. Ce résultat a permis de valider, dans des échantillons humains, les résultats obtenus précédemment dans des modèles d’étude cellulaires et animaux mimant des formes génétiques de la maladie d’Alzheimer.
|
Les résultats de notre étude montrent qu’indépendamment de l’action de l’Aβ, l’accumulation des fragments APP-CTF conduit à une détérioration de la structure et du fonctionnement des mitochondries, et à un blocage du processus de dégradation des mitochondries par mitophagie
(
Figure 2
)
[
8
]. L’accumulation de mitochondries défectueuses associée à la perturbation de la mitophagie est commune à différentes maladies neurodégénératives, telles que la maladie de Parkinson, la maladie de Huntington, la sclérose latérale amyotrophique, et la maladie d’Alzheimer. Le rétablissement d’une fonction mitophagique normale pourrait donc être envisagé comme un nouvel objectif thérapeutique dans la maladie d’Alzheimer et dans d’autres maladies neurodégénératives.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
De Strooper
B
,
Karran
E
.
The cellular phase of Alzheimer’s disease.
.
Cell.
2016;
;
164
:
:603.
–
615
.
2.
Nhan
HS
,
Chiang
K
,
Koo
EH
.
The multifaceted nature of amyloid precursor protein and its proteolytic fragments: friends and foes.
.
Acta Neuropathol.
2015;
;
129
:
:1.
–
19
.
3.
Onishi
M
,
Yamano
K
,
Sato
M
,
et al.
Molecular mechanisms and physiological functions of mitophagy.
.
EMBO J.
2021;
;
40
:
:e104705.
.
4.
Atamna
H
,
Frey
WH
,
2nd
.
Mechanisms of mitochondrial dysfunction and energy deficiency in Alzheimer’s disease.
.
Mitochondrion.
2007;
;
7
:
:297.
–
310
.
5.
Manczak
M
,
Park
BS
,
Jung
Y
,
Reddy
PH
.
Differential expression of oxidative phosphorylation genes in patients with Alzheimer’s disease: implications for early mitochondrial dysfunction and oxidative damage.
.
Neuromolecular Med.
2004;
;
5
:
:147.
–
162
.
6.
Reddy
PH
,
Oliver
DM
.
Amyloid beta and phosphorylated Tau-induced defective autophagy and mitophagy in Alzheimer’s disease.
.
Cells.
2019;
;
8
:
:488.
.
7.
Del Prete
D
,
Suski
JM
,
Oules
B
,
et al.
Localization and processing of the amyloid-beta protein precursor in mitochondria-associated membranes.
.
J Alzheimers Dis.
2017;
;
55
:
:1549.
–
1570
.
8.
Vaillant-Beuchot
L
,
Mary
A
,
Pardossi-Piquard
R
,
et al.
Accumulation of amyloid precursor protein C-terminal fragments triggers mitochondrial structure, function, and mitophagy defects in Alzheimer’s disease models and human brains.
.
Acta Neuropathol.
2021;
;
141
:
:39.
–
65
.
9.
Lauritzen
I
,
Pardossi-Piquard
R
,
Bauer
C
,
et al.
The β-secretase-derived C-terminal fragment of βAPP, C99, but not Aβ, is a key contributor to early intraneuronal lesions in triple-transgenic mouse hippocampus.
.
J Neurosci.
2012;
;
32
:
:16243.
–
1655a
.
10.
Lauritzen
I
,
Pardossi-Piquard
R
,
Bourgeois
A
,
et al.
Intraneuronal aggregation of the β-CTF fragment of APP (C99) induces Aβ-independent lysosomal-autophagic pathology.
.
Acta Neuropathol.
2016;
;
132
:
:257.
–
276
.
11.
Hung
COY
,
Livesey
FJ
.
Altered gamma-secretase processing of APP disrupts lysosome and autophagosome function in monogenic Alzheimer’s disease.
.
Cell Rep.
2018;
;
25
:
(3647–60)
:e2.
.
|