L’hypertension pulmonaire (HTP) se caractérise par une augmentation persistante de la pression artérielle pulmonaire moyenne (PAPm) au repos, mesurée par cathétérisme cardiaque droit. La PAPm normale étant de 14 mmHg avec une déviation standard de 3 mmHg, l’HTP est présente lorsque la PAPm est strictement supérieure à 20 mmHg [ 1 ]. Les HTP pré-capillaires sont définies par l’association d’une PAPm supérieure à 20 mmHg, d’une pression artérielle pulmonaire d’occlusion normale, moins de 15 mmHg, et de résistances vasculaires pulmonaires supérieures à 3 mmHg/L/min (c’est-à-dire 3 unités Wood [UW], soit 240 dynes.s.cm -5 ) [ 1 ]. Elles se distinguent des HTP post-capillaires, qui sont le plus souvent dues à la répercussion sur la circulation pulmonaire d’une insuffisance cardiaque gauche caractérisée par une pression artérielle pulmonaire d’occlusion supérieure à 15 mmHg et des résistances vasculaires pulmonaires inférieures à 3 UW [ 1 ].
La classification des HTP permet de définir des groupes de patients partageant des caractéristiques physiopathologiques, cliniques et thérapeutiques. Cette classification a été mise à jour en 2018 à l’occasion du sixième congrès mondial de l’HTP ( Tableau I ) [ 1 ].
Tableau I.
Classification des hypertensions pulmonaires.
VIH : virus de l’immunodéficience humaine (d’après [
1
]).
| ||||||||||||||||||
Les HTP du groupe 1 correspondent à l’hypertension artérielle pulmonaire (HTAP), qui est une maladie vasculaire pulmonaire rare, dont la prévalence est estimée de 15 à 50 cas par million d’habitants en France (incidence annuelle de 6 cas par million d’habitants) [ 1 , 2 ]. Cette maladie s’explique par la survenue progressive d’un remodelage artériel touchant principalement les petites artères pulmonaires dont le diamètre est inférieur à 500 µm [ 3 ]. Ces anomalies structurelles et fonctionnelles progressives entraînent une résistance à l’écoulement sanguin et une HTP pré-capillaire avec augmentation persistante de la post-charge du ventricule droit, aboutissant à une insuffisance cardiaque droite. En l’absence de traitement efficace, cela se traduit par un essoufflement progressif à l’effort puis au repos, des malaises et des syncopes. Malgré les progrès thérapeutiques récents, il faut souligner que l’HTAP reste une maladie grave et incurable nécessitant une prise en charge spécialisée, et qui menace la vie du malade à court ou moyen terme [ 4 ]. L’objectif du traitement est l’amélioration des symptômes, de la capacité à l’effort, des paramètres hémodynamiques, et, bien sûr, de la qualité de vie et de la survie [ 5 ]. Tous les médicaments actuellement disponibles ont pour cible l’une des trois voies principales à l’origine de la dysfonction endothéliale artérielle pulmonaire impliquant la prostacycline, l’endothéline-1 et le monoxyde d’azote [ 5 ]. Ces traitements, qui ont une action principalement vasodilatatrice, ont permis une amélioration de la survie des patients souffrant d’HTAP, dont la médiane de survie est passée de 28 mois à 7 ans au cours des trente dernières années [ 4 , 5 ]. Néanmoins, les traitements actuels de l’HTAP (prostacycline et ses dérivés, agoniste du récepteur de la prostacycline, antagonistes des récepteurs de l’endothéline, inhibiteurs de la phosphodiestérase 5 et stimulateurs de la guanylate cyclase) ne permettent pas d’inverser le remodelage artériolaire pulmonaire responsable de la maladie. Le pronostic de l’HTAP reste donc péjoratif et, en cas de forme avancée de la maladie, la transplantation pulmonaire reste la seule perspective d’issue favorable [ 4 ]. Pour cette raison, les équipes de recherche tentent de décrypter finement les mécanismes cellulaires et moléculaires de l’HTAP afin de proposer des innovations thérapeutiques visant à réduire la prolifération vasculaire pulmonaire en complément des traitements vasodilatateurs disponibles [ 3 ].
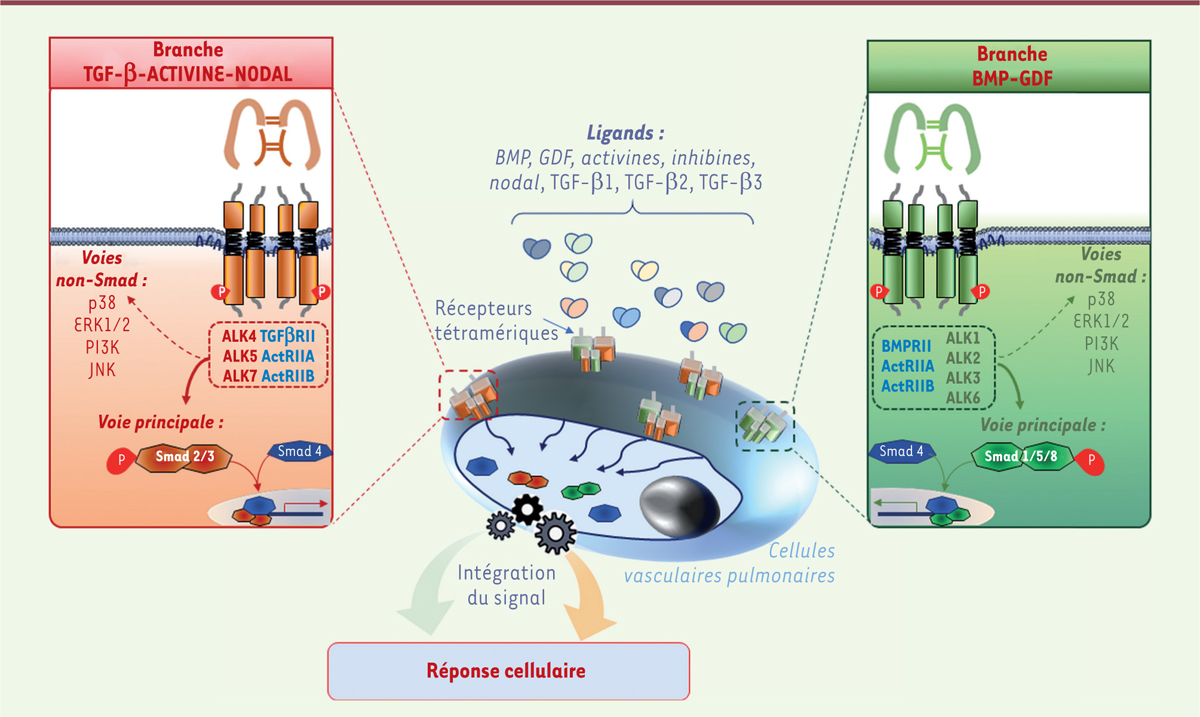
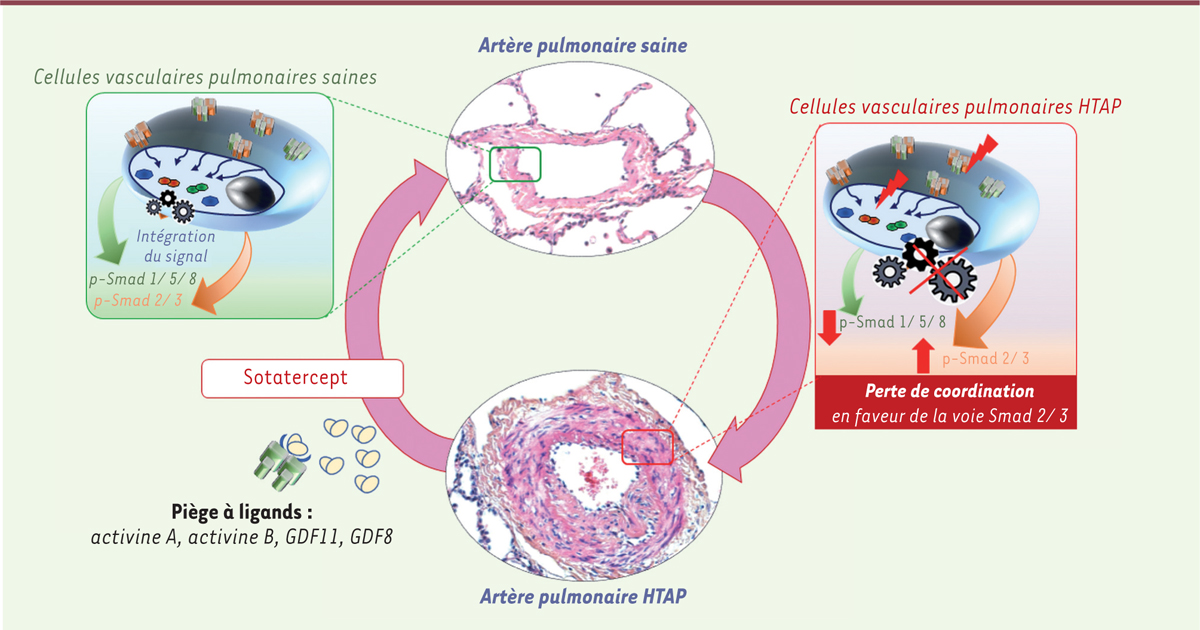
La démonstration que des mutations du gène BMPR2, codant le BMPR-II ( bone morphogenetic protein receptor type II ), sont les principales causes des formes familiales d’HTAP a permis de développer de nouvelles hypothèses physiopathologiques et de proposer de nouvelles cibles thérapeutiques [ 6 , 7 ]. Le BMPR-II est un récepteur de la superfamille du TGF-β ( transforming growth factor-β ), dont la signalisation implique les protéines Smad 1/5/8. Son activation permet de limiter la prolifération cellulaire et donc l’accumulation des cellules vasculaires dans les parois des artères pulmonaires [ 6 , 7 ]. Pour cela, l’intégration correcte, dans les cellules vasculaires pulmonaires, du signal Smad 1/5/8, déclenché par les ligands de la branche BMP ( bone morphogenetic protein ) - GDF ( growth differentiation factor ), et du signal Smad 2/3, déclenché par les ligands de la branche TGF-β - activine - nodal, est cependant essentielle ( Figure 1 ) . En effet, une mauvaise intégration des signaux déclenchés par les protéines BMP et GDF une fois liés à leurs récepteurs tétramériques, par rapport à ceux émanant de la branche TGF-β - activine - nodal, peut lever un frein physiologique et perturber l’homéostasie des vaisseaux du poumon ( Figure 2 ) [ 6 ]. Récemment, il est apparu que lorsque la voie du BMPR-II était dysfonctionnelle, et donc que le signal Smad1/5/8 de la branche BMP - GDF était en partie perdu, le retrait des ligands du récepteur de l’activine de type IIA (ActRIIA pour activin receptor type IIA ) pouvait limiter l’emballement de la prolifération cellulaire [ 8 ]. Cela aboutit à un rétablissement de la coordination et du dialogue entre les branches BMP – GDF et TGF-β – activine – nodal, et ainsi, à l’atténuation de l’accumulation de cellules vasculaires dans les parois des petites artères pulmonaires ( Figure 2 ) [ 6 , 8 ]. Des mécanismes semblables entrent aussi en jeu dans les autres formes d’HTAP sans mutation identifiée du gène BMPR2 [ 6 – 8 ].
| Figure 1.
Un dialogue permanent entre les deux branches de la superfamille du TGF-β dans les cellules vasculaires pulmonaires est essentiel à l’homéostasie vasculaire.
Les cellules vasculaires pulmonaires sont en permanence exposées à différents ligands qui vont déclencher des signaux intracellulaires et recruter des protéines spécialisées de la famille des Smad (voie principale), et activer des voies indépendantes des Smad (voies non-Smad). Les ligands de la branche TGF-β – activine – nodal (TGF-β1, TGF-β2, TGF-β3, activine-A, activine-B, activine-AB, BMP3, GDF-1, GDF-3, GDF-8, GDF-9, GDF-10, GDF-11 et le facteur nodal) induisent un signal via les Smad-2/3 en se liant à des récepteurs tétramériques spécifiques composés de deux récepteurs de type II (TGFβRII, ActRIIA, ActRIIB) et deux récepteurs de type I (ALK4, ALK5 et ALK7). Les ligands de la branche BMP – GDF (BMP-2, BMP-4, BMP-5, BMP-6, BMP-7, BMP-8, BMP-9, BMP-10, BMP-15, GDF-5, GDF-6, GDF-7, GDF-15, et l’hormone anti-müllérienne), qui transmettent un signal via les Smad-1/5/8, se lient à d’autres récepteurs tétramériques spécifiques composés de deux récepteurs de type II (BMPRII, AMHRII ActRIIA, ActRIIB) et de deux récepteurs de type I (ALK1, ALK2, ALK3 ou ALK6). L’intégration des différents signaux intracellulaires transmis par chacun des récepteurs tétramériques va déterminer la réponse spécifique de la cellule, qui sera la plus adaptée à l’environnement cellulaire dans lequel celle-ci se situe à l’instant donné.
|
| Figure 2.
Le dialogue perturbé entre les deux branches de signalisation de la superfamille du TGF-β au cours de l’hypertension artérielle pulmonaire peut être ciblé par de nouvelles approches thérapeutiques.
L’HTAP se caractérise par des altérations de la voie de signalisation du BMPR-II dans les cellules vasculaires pulmonaires, conduisant à une perte de coordination en faveur des Smad 2/3, ce qui va provoquer un emballement de la prolifération cellulaire. La capture de l’activine A, de l’activine B, du GDF-11 et du GDF-8 par le sotatercept va limiter l’accumulation des cellules vasculaires dans les parois des petites artères pulmonaires en rétablissant le frein physiologique à la prolifération que fournit le signal de la branche BMP-GDF
via
les Smad 1/5/8.
|
À partir de cette découverte majeure, les efforts se sont donc concentrés sur des approches permettant de corriger les défauts de signalisation de la branche BMP – GDF ou de limiter la perte de coordination en faveur de la voie Smad 2/3 [ 6 , 8 – 10 ]. Dans ce contexte, il a été proposé d’explorer le potentiel thérapeutique du sotatercept, un biomédicament formé de la fusion de la partie extracellulaire du récepteur ActRIIA et du fragment constant d’une immunoglobuline humaine d’isotype G1 (IgG1) [ 9 , 10 ]. Cette molécule hybride fonctionne comme un piège séquestrant les ligands de forte affinité pour ActRIIA (l’activine A, l’activine B, le GDF-8, le GDF-11, etc.), ce qui va rétablir le frein à la prolifération fourni par le signal de la branche BMP – GDF via les Smad 1/5/8, et ainsi limiter l’accumulation des cellules vasculaires dans les parois des petites artères pulmonaires ( Figure 2 ) [ 8 – 10 ]. L’objectif de cette approche est donc de renouer le dialogue entre les deux branches de la superfamille du TGF-β et de rétablir l’homéostasie vasculaire pulmonaire. Des études précliniques ont montré un effet bénéfique de cette approche, in vitro , sur la prolifération des cellules endothéliales et musculaires lisses des artères pulmonaires, et in vivo , dans des modèles animaux d’HTP, avec une diminution du remodelage vasculaire pulmonaire et une amélioration hémodynamique [ 10 ]. Le sotatercept ayant déjà été testé chez des sujets sains et dans certaines maladies hématologiques, les données encourageantes dans le domaine de l’HTAP ont conduit à l’essai clinique de phase II PULSAR (NCT03496207) [ 9 ]. Cet essai multicentrique, randomisé, en double-aveugle, a évalué la tolérance et l’efficacité du sotatercept après 24 semaines de traitement de l’HTAP, chez des patients en dyspnée de classe fonctionnelle II ou III, selon la classification de la New York Heart Association (NYHA), et recevant déjà au long cours des traitements de l’HTAP. Dans cet essai, les patients ont reçu soit le sotatercept, à la dose de 0,3 mg/kg ou 0,7 mg/kg, soit un placebo, par voie sous-cutanée, toutes les 3 semaines. Le critère de jugement principal était le changement des résistances vasculaires pulmonaires au cathétérisme cardiaque droit après 24 semaines de traitement. En une année, 106 patients ont été inclus dans 43 centres. Les patients (âge moyen 48 ans, 87 % de femmes) avaient principalement des HTAP idiopathiques, héritables ou associées à des connectivites, comme la sclérodermie, de gravité modérée à sévère (53 % en classe fonctionnelle NYHA II, et avec des résistances vasculaires pulmonaires de 779 dynes.s.cm -5 ) ; 56 % des patients recevaient déjà trois traitements de l’HTAP [ 9 ]. Après 24 semaines, les résistances vasculaires pulmonaires se sont vues diminuer de 162 dynes.s.cm -5 dans le groupe traité par sotatercept à la dose de 0,3 mg/kg, et de 256 dynes.s.cm -5 dans le groupe traité par sotatercept à la dose de 0,7 mg/kg, alors qu’elles diminuaient de 16 dynes.s.cm -5 dans le groupe placebo, une différence statistiquement significative en faveur de chacun des groupes traités par sotatercept comparé au groupe placebo [ 9 ]. Cette différence était surtout due à une baisse de la PAPm et était même observée dans le sous-groupe de patients recevant déjà un traitement maximal de l’HTAP (une trithérapie). Une amélioration du test de marche de six minutes et une diminution du biomarqueur de la fonction cardiaque NT-proBNP (fragment N-terminal du précurseur du peptide natriurétique de type B) ont également été observées dans les groupes traités par sotatercept. En revanche, aucune différence pour les scores de qualité de vie a été notée entre les groupes. Les effets indésirables du sotatercept les plus fréquents étaient une thrombocytopénie (diminution du nombre de thrombocytes/plaquettes dans le sang) et une polyglobulie (augmentation anormale du nombre de globules rouges et de la concentration de l’hémoglobine dans le sang), en particulier à la dose de 0,7 mg/kg [ 9 ]. Ces effets secondaires hématologiques étaient attendus, en particulier l’augmentation du taux d’hémoglobine circulante, qui est survenue chez trois patients. Un patient est décédé d’arrêt cardiaque dans le groupe traité par sotatercept à la dose de 0,7 mg/kg.
Cet essai est le premier à montrer un effet positif d’un traitement ciblant la superfamille des récepteurs du TGF-β, en association aux traitements habituels de l’HTAP [ 9 ]. La persistance de l’effet du traitement dans le temps pourra être étudiée, grâce à la période d’extension de 18 mois prévue dans l’essai PULSAR. Après le succès de cet essai clinique de phase II, les données d’efficacité et de sécurité seront à confirmer, sur des critères de jugement principaux cliniques (test de marche de six minutes, temps de détérioration clinique, hospitalisation et mortalité), et sur des effectifs de patients plus importants, dans des études de phase III programmées ou en cours (études STELLAR [NCT04576988], HYPERION, [NCT04811092] et ZENITH [NCT04896008]) 1, . D’ores et déjà, ces travaux constituent une avancée prometteuse dans le traitement de cette maladie grave. Cibler une voie causale du remodelage vasculaire pulmonaire constitue un véritable espoir dans le traitement de l’HTAP et pourrait ouvrir la voie à de nouvelles approches thérapeutiques reposant sur la compréhension des anomalies structurales et/ou fonctionnelles des molécules de la superfamille du TGF-β au cours de l’HTAP [ 6 , 8 , 10 ]. Les résultats des études en cours préciseront la place de cette approche dans l’arsenal thérapeutique, en complément des traitements actuels de l’HTAP.