Au jour embryonnaire E13,5, 85 % des souris mutantes homozygotes
Lmna
H222P/H222P
présentent une dilatation des oreillettes, et 40 % une dilatation du ventricule gauche. De plus, ces souris ont des défauts de septation ventriculaire, une hypertrabéculation, une diminution de la contractilité, et présentent une diminution de l’épaisseur de la paroi des ventricules. Ce modèle murin reproduit donc, dès les stades embryonnaires, la cardiomyopathie dilatée sévère des patients atteints de DMED, ce qui témoigne du caractère congénital de cette laminopathie [
9
].
De même, pour les cellules souches embryonnaires
Lmna
H222P/+
différenciées vers les trois feuillets embryonnaires (ectoderme, endoderme, et mésoderme) au sein de corps embryonnaires, on observe un retard de la différenciation du mésoderme cardiogénique, avec une contraction des cardiomyocytes débutant plus tardivement (
i.e
., après 14 jours de culture) que lorsque des cellules non porteuses de la mutation (début de la contraction après 7 jours) sont utilisées. De plus, les cellules
Lmna
H222P/+
différenciées en cardiomyocytes présentent une désorganisation sarcomérique, ainsi qu’un défaut du couplage excitation-contraction révélé par une moindre amplitude des oscillations calciques [
9
].
Nous avons ensuite analysé le transcriptome cardiaque des souris
Lmna
H222P/+
et
Lmna
H222P/H222P
à E13.5, et avons mis en évidence, chez les souris mutantes homozygotes, une anomalie de la transcription de 1 747 gènes. En particulier, plusieurs gènes impliqués dans la trabéculation (
Notch
,
BMP10
), dans le couplage excitation-contraction (
Cav1
,
RyR2, Pln
), ou dans la myofibrillogenèse (
Myl2
,
Myl7
) étaient significativement moins exprimés chez ces souris. L’analyse du transcriptome des cellules souches embryonnaires
Lmna
H222P/+
en cours de différenciation a révélé une dérégulation précoce, au stade du mésendoderme : diminution de la transcription de gènes impliqués dans la transition épithélio-mésenchymateuse nécessaire à la formation du mésoderme (
Twist, Snail1
), ou dans la cardiogenèse précoce (
Mef2c
,
Nkx2.5
,
Mesp1
,
Fgf8
,
Tbx5
,
Isl1
), et augmentation de la transcription de
Brachyury
et du gène codant la E-cadhérine [
9
]. La dérégulation de ces gènes pendant l’embryogenèse peut expliquer les malformations cardiaques et leurs conséquences chez des patients DMED.
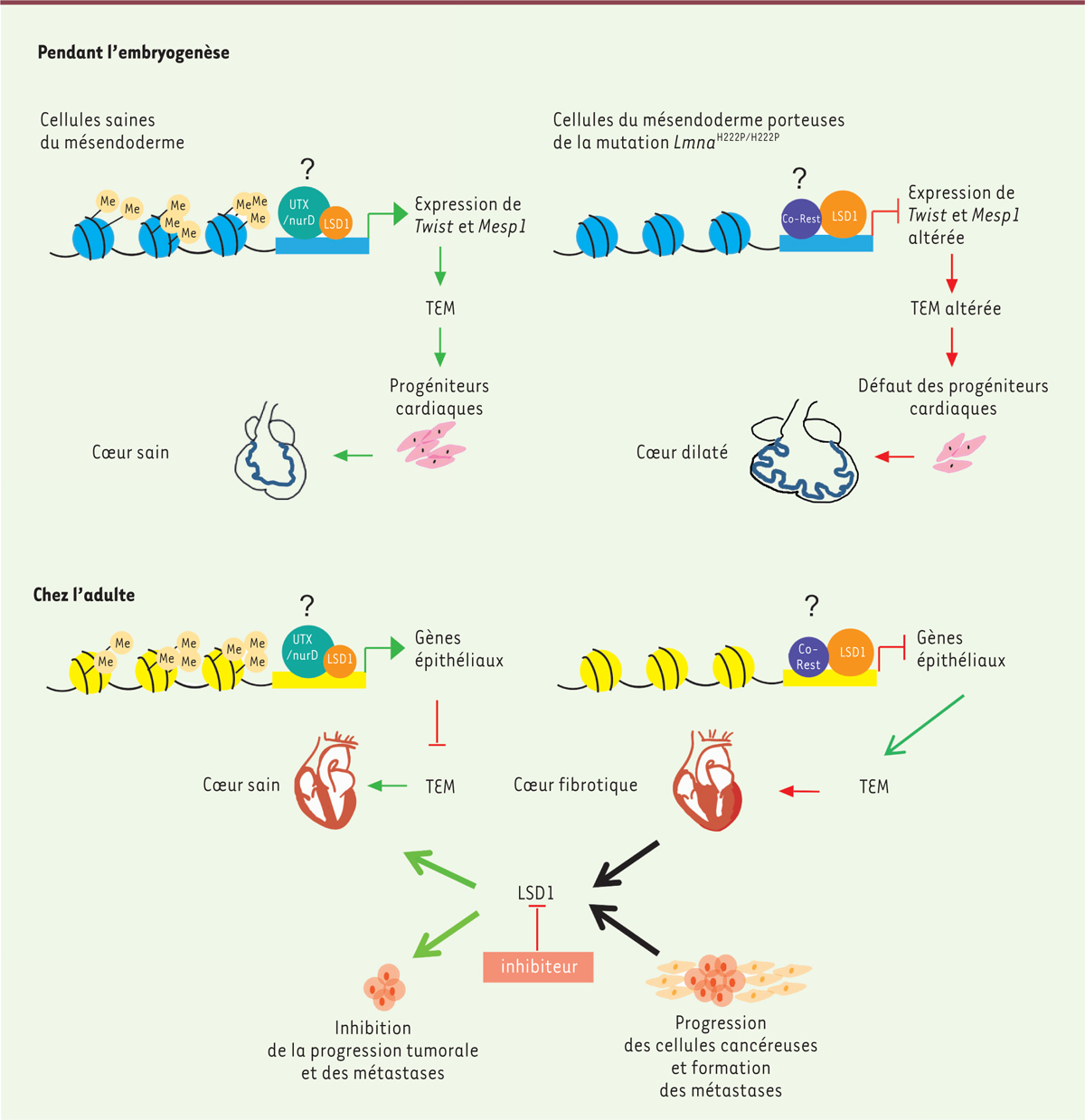
Une augmentation de l’expression du gène codant la E-cadhérine et une diminution de l’expression de
Twist
,
Snail1
et
Mesp1
ayant été observées dans les cellules souches embryonnaires
Lmna
H222P/+
en cours de différenciation, nous avons étudié, dans ces cellules, le profil épigénétique des régions régulatrices de ces gènes. Les régions amplificatrices et promotrices du gène codant la E-cadhérine présentaient un enrichissement des marques épigénétiques H3K4me1 et H3K27ac, permettant une activation plus intense de ce gène. À l’inverse, dans les régions amplificatrices de
Twist
et
Mesp1
, nous avons détecté une diminution de la marque H3K4me1, qui rend compte de la diminution d’expression de ces gènes [
9
].
La dérégulation de la marque H3K4me1 nous a conduits à analyser l’expression de la déméthylase de l’histone LSD1 (
lysine-specific histone demethylase 1A
). Elle est augmentée dans les corps embryonnaires
Lmna
H222P/+
, ce qui expliquerait l’effacement de H3K4me1 sur les régions régulatrices des gènes impliqués dans la transition épithélio-mésenchymateuse [
9
]. Incidemment, la formation des métastases de carcinomes implique également une transition épithélio-mésenchymateuse et LSD1, qui, dans ce cas, favorise cette transition [
10
].
Sous l’effet d’un inhibiteur pharmacologique de LSD1 développé pour le traitement du cancer ou de petits ARN interférents inhibant la traduction du gène codant LSD1, les cellules souches embryonnaires
Lmna
H222P/+
en train de se différencier retrouvent une empreinte H3K4me1 normale dans les régions régulatrices de
Twist
et de
Mesp1
. De plus, les gènes
Myl2
et
Myl4
, impliqués dans la myofibrillogenèse, sont de nouveau exprimés. Une meilleure organisation sarcomérique et une augmentation des corps embryonnaires montrant des zones contractiles sont aussi observées [
9
].
Le traitement de souris gestantes avec l’inhibiteur de LSD1 (1 mg/kg) aux stades embryonnaires E7,5 et E8,5 a considérablement amélioré le phénotype des embryons mutants homozygotes : ils ne présentent plus de dilatation des cavités cardiaques pendant la vie fœtale ou post-natale, et ont une meilleure contractilité du myocarde, semblable à celle des souris hétérozygotes. L’administration d’un inhibiteur de LSD1 à la femelle gestante permet la correction des défauts épigénétiques causés par la mutation His222Pro de
LMNA
chez le fœtus, améliore la cardiogenèse, et rétablit le fonctionnement cardiaque [
9
].
Cependant, des considérations éthiques concernant l’administration d’un tel traitement à une femme enceinte pour protéger son fœtus de la cardiomyopathie nous ont conduits à tester directement une thérapie du nouveau-né atteint. Chez les mammifères, les cardiomyocytes conservent une capacité de prolifération pendant plusieurs jours ou pendant plusieurs semaines après la naissance, voire pendant six mois chez les Hommes [
11
,
12
]. Nous avons traité les souriceaux mutants homozygotes avec l’inhibiteur de LSD1, 1 jour et 3 jours après leur naissance. À l’âge de 6 mois, les souris traitées à la naissance avaient une morphologie cardiaque normale, avec une diminution de la fibrose du myocarde (quantifiée comme étant seulement de 6 %) par rapport aux souris non-traitées (fibrose à 32 %) [
9
]. Il semble donc important de diagnostiquer le plus tôt possible les laminopathies humaines causant des défauts cardiaques, afin de pouvoir les traiter dès les premières semaines de vie post-natale, lorsque les cardiomyocytes prolifèrent encore [
12
].