| |
| Med Sci (Paris). 37(8-9): 814–816. doi: 10.1051/medsci/2021127.
Plasticité des voies de mort cellulaire programmée dans la lutte contre
Salmonella
Un arsenal de possibilités pour se défendre ! Gabriel Chemin,1a Antoine De Giacomoni,1b and Pierre-Emmanuel Joubert2c 1Master 2 Immunologie Intégrative et Systémique (I2S), Parcours Immunologie, Mention BMC, Sorbonne Université
,
Paris
,
France
.
2Équipe 13 « Inflammation, Cancer et Complément », Inserm UMRS 1138, Centre de recherche des Cordeliers
,
15 rue de l’École de Médecine
,
75006Paris
,
France
.
MeSH keywords: Apoptose, Salmonella, génétique |
La salmonellose est une infection causée par des bactéries du genre
Salmonella
et est à l’origine d’intoxications alimentaires provoquant des crampes au ventre, des diarrhées et/ou de la fièvre [
1
]. Les bactéries du genre
Salmonella
sont des bactéries facultativement anaérobies à Gram négatif, en forme de bâtonnets flagellés, qui infectent principalement les phagocytes, dans lesquels ils prolifèrent [
2
]. L’élimination de cette bactérie dans l’organisme requiert la mort des cellules infectées, notamment par l’activation de voies de mort cellulaire programmée telles que l’apoptose, la pyroptose ou la nécroptose [
3
].
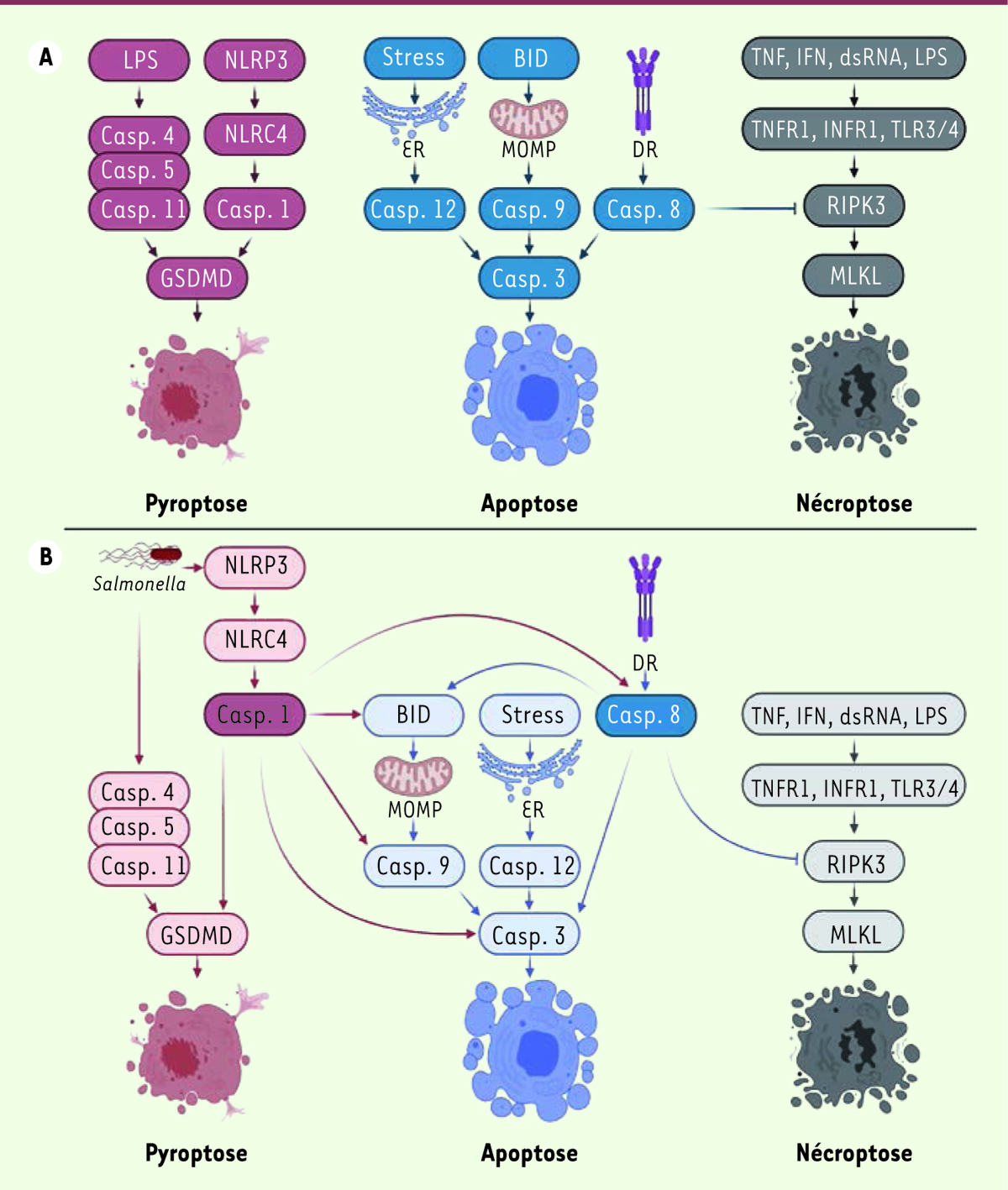
L’apoptose est associée à plusieurs processus cellulaires différents. C’est également un système de défense contre certains pathogènes [
4
]. Les effecteurs de ce processus biologique sont nombreux et induisent l’activation de protéines de la famille des caspases (casp)
(
Figure 1A
)
. Trois voies principales induisent l’apoptose : 1) une voie extracellulaire (ou voie extrinsèque) liée à l’interaction d’un ligand spécifique avec un récepteur de mort cellulaire membranaire induisant l’activation de la casp 8 ; 2) une voie intracellulaire (ou voie intrinsèque) provoquée par la perméabilisation de la membrane externe des mitochondries et induisant l’activation de la casp 9 ; et 3) une voie intracellulaire induite par l’augmentation du stress du réticulum endoplasmique, provoquant l’activation de la casp 12. Toutes ces voies conduisent à l’activation de la casp 3, provoquant la stimulation de l’endonucléase CAD (
caspase-activated DNase
) et la dégradation de l’ADN chromosomique [
4
].
 | Figure 1.
Plasticité des mécanismes d’induction de mort cellulaire des cellules infectées par des bactéries. A.
Représentation schématique des cascades d’événements menant aux différents processus de mort cellulaire étudiés (pyroptose, apoptose et nécroptose).
B.
Représentation schématique de la plasticité des processus de mort cellulaire due à la caspase 1 lors d’une infection par
Salmonella
. Cette figure permet de visualiser l’interconnectivité des processus de mort cellulaire, permettant à la cellule de s’adapter lorsque l’une des voies n’est pas fonctionnelle. Casp : caspase ; NLRC4 :
NLR family CARD domain-containing protein 4
; GSDMD : gasdermine D ; BID :
BH3-interacting-domain death agonist
; LPS : lipopolysaccharide ; NLRP3 :
NOD-like receptor family, pyrin domain-containing 3
; ER:
endoplasmic reticulum
; MOMP :
mitochondrial outer membrane permeabilization
; DR :
death receptor
; TNF :
tumor necrosis factor
; TNFR1 :
TNF receptor 1
; IFN : interféron ; IFNR1 :
IFN receptor 1
; dsRNA :
double stranded RNA
; TLR :
Toll-like receptor
; RIPK :
receptor-interacting serine/threonine-protein kinase
; MLKL :
mixed lineage kinase domain-like pseudokinase
.
|
La pyroptose est un processus qui repose sur la gasdermine D (GSDMD), un substrat de la casp 1 et du complexe formé par les casp 4, 5 et 11
(
Figure 1A
)
. Les casp 4, 5 et 11 jouent un rôle important dans la détection intracellulaire des LPS (lipopolysaccharides) bactériens. L’activation de la casp 1 s’effectue par le biais de l’inflammasome et de NLRP3 (
NOD-like receptor family, pyrin domain-containing 3
). Les casp 1, 4, 5 et 11 vont interagir avec la GSDMD qui va alors former des pores dans la membrane de la cellule et provoquer sa lyse [
5
].
La nécroptose est une voie de mort cellulaire indépendante des caspases qui remplace l’apoptose lorsque celle-ci est inactive. Cette voie est principalement induite par la présence de TNF-a (
tumor necrosis factors alpha
) mais peut aussi être induite par des interférons (alpha, bêta ou gamma), de l’ARN double brin ou des LPS. L’activation de cette voie implique le recrutement de RIPK (
receptor-interacting serine/threonine-protein kinase
) 3 et la formation du complexe MLKL (
mixed lineage kinase domain-like pseudokinase
), qui va former des pores dans la membrane et induire la lyse de la cellule. La nécroptose s’accompagne d’une sécrétion important de cytokines et l’activation des signaux de danger, induisant une réaction inflammatoire.
|
Les mécanismes de mort cellulaire mis en jeu
Des chercheurs se sont intéressés aux mécanismes de mort cellulaire mis en jeu pour éliminer
Salmonella
[
7
]. Lors d’une infection chez des souris, la quantité de bactéries augmente dans l’organisme pendant trois semaines, avant de chuter brutalement au moment où le système immunitaire est en mesure de contrôler l’infection. Étant donné qu’un des mécanismes anti-infectieux mis en place par l’hôte est l’induction d’une mort cellulaire des macrophages infectés par la bactérie, les chercheurs ont analysé la survie et le contrôle de l’infection chez des souris après un blocage spécifique des différentes voies de mort cellulaire programmée. Ils ont ainsi montré que le blocage de la pyroptose (par inactivation des gènes codant les casp 1 et 11) n’a pas d’impact sur la charge bactérienne et sur la survie des souris. De même, l’inhibition de la casp 12 (très proche de la casp 11 en termes de composition en acides aminés) n’influence pas le titre bactérien chez les souris déficientes pour la pyroptose. Une seconde expérience, consistant à bloquer l’apoptose et la nécroptose (en inactivant respectivement les gènes codant la casp 8 et RIPK3), a montré des résultats similaires. En fait, seul le blocage simultané des trois voies (pyroptose, apoptose et nécroptose) altère la défense de l’hôte contre la bactérie. En effet, chez des souris dont les gènes codant les casp 1, 8, 11, 12 et RIPK3 ont été invalidés, la quantité de bactéries est significativement plus élevée aux semaines 2 et 3 et les souris sont plus rapidement malades.
Étant donné que
Salmonella
infecte préférentiellement les phagocytes, les auteurs se sont intéressés plus spécifiquement à l’étude des macrophages. Des macrophages isolés de la moelle osseuse de souris dont les différents gènes codant les caspases ont été invalidés, ont été infectés
in vitro
par
Salmonella
et leur mort cellulaire a été étudiée 24 heures après infection. Les résultats obtenus confirment les observations précédentes : il est nécessaire de bloquer simultanément l’apoptose, la pyroptose et la nécroptose (macrophages casp1
-/-
11
-/-
12
-/-
8
-/-
RIPK3
-/-
) pour empêcher la mort des cellules infectées. Les cellules mutées ont ensuite été traitées avec des drogues activant directement l’apoptose (MCL-1i : S63845, BCL-2i : ABT199 et BCL-XLi : A1331852) afin de vérifier que la perte de ces différents activateurs de la mort cellulaire n’a pas pour conséquence une perte de capacité de cette mort, et agit seulement sur l’activation de ces voies. Les cellules ainsi traitées étant mortes, la perte des caspases 1, 11, 12 et 8 et de RIPK3 est donc critique pour l’activation de la mort cellulaire, mais n’entraîne pas de dysfonctionnement du processus lorsque celui-ci est activé artificiellement. Ce dernier test montre ainsi que c’est bien le blocage simultané des 3 voies qui est critique pour la mort cellulaire programmée, et non un dysfonctionnement de celles-ci. Cette première série d’expériences prouve que les cellules infectées par
Salmonella
adaptent leurs processus de mort cellulaire pour éradiquer efficacement le pathogène et qu’il n’y a pas de voie de mort cellulaire unique pour éliminer efficacement les cellules infectées.
|
Le rôle essentiel de la caspase 1 dans la plasticité de la mort cellulaire
Afin d’identifier les protéines indispensables à cette plasticité de mort cellulaire dans ce modèle, une étude plus approfondie a été réalisée pour déterminer le rôle des différentes caspases. Lors d’une infection par
Salmonella
, des macrophages traités avec un inhibiteur non spécifique de caspases (l’inhibiteur pan-caspases Emricasan) présentent une cinétique de mortalité similaire à celle de macrophages dont les gènes codant les casp 1, 11 et 12 ont été invalidés. Étant la seule voie de mort cellulaire fonctionnelle en l’absence de caspase, la nécroptose est donc responsable de la mort des macrophages traités avec l’inhibiteur Emricasan, et, potentiellement, des macrophages déficients pour les gènes codant les casp 1, 11, 12. Lorsque les macrophages n’expriment plus RIPK3, en plus de casp 1, 11 et 12, ils sont protégés de la mort induite par l’infection. Cette observation confirme que la nécroptose est bien responsable de la mort des macrophages casp 1
-/-
11
-/-
12
-/-
.
Les différentes voies de mort cellulaire sont initiées par des activateurs spécifiques. Cependant, il existe des interconnections entre les voies de signalisation impliquées dans les différents types de mort cellulaire. Il a été montré, par exemple, que la casp 8, qui est une protéine clef dans l’induction de l’apoptose, peut aussi activer la pyroptose par l’intermédiaire de la GSDMD [
8
]. Dans l’étude présentée ici, les auteurs ont obtenu des résultats suggérant une capacité d’activation croisée de différentes voies de mort cellulaire par la casp 1. En effet, des macrophages infectés par
Salmonella
, n’exprimant plus la casp 8, RIPK3 et GSDMD, meurent avec la même cinétique que des cellules déficientes seulement pour la pyroptose, suggérant ainsi qu’en l’absence d’apoptose extrinsèque, de nécroptose ou de pyroptose, une voie de mort cellulaire alternative est mobilisée. La présence des casp 3, 7 et 9 et de Bid sous forme clivée (donc activée) dans cette condition expérimentale suggère que les cellules infectées sont mortes
via
la voie intrinsèque de l’apoptose (indépendante de la casp 8). Or, des études précédentes avaient montré que la casp 1 peut activer la voie intrinsèque en stimulant la protéine Bid puis la casp 9 [
9
]
(
Figure 1B
)
.
Cette étude met également en évidence une nouvelle voie d’induction de la casp 9, étant donné que des cellules n’exprimant plus casp 8, RIPK3, GSDMD et Bid sont également sensibles à l’apoptose induite par l’infection par
Salmonella
, démontrant ainsi une activation de la casp 9 non régulée par Bid. En comparant ces résultats à ceux obtenus avec des macrophages n’exprimant plus les casp 1, 8, 11 et 12, et RIPK3, il apparaît que l’activation de l’apoptose peut alors dépendre de la présence des casp 1, 11 et 12. Étant donné qu’il a été démontré précédemment que la casp 12 n’a pas d’effet sur la mort cellulaire dans ce modèle, et que la casp 11 n’a qu’un effet mineur, les auteurs supposent que c’est la casp 1 qui induit l’apoptose dans les macrophages infectés dans ces conditions.
Des études complémentaires ont montré que la casp 1 est également capable d’induire directement une apoptose extrinsèque, en présence de la casp 8, et indépendamment de l’activation de la casp 9. La mort cellulaire programmée des macrophages infectés par
Salmonella
est donc possible même en l’absence des effecteurs connus de l’apoptose, de la pyroptose et de la nécrose, tant que les casp 1 et 8 sont présentes.
|
Les résultats obtenus dans cette étude révèlent ainsi l’existence dans les macrophages d’un système d’induction de mort cellulaire complexe et très efficace pour éliminer le pathogène
Salmonella typhimurium (
Figure 1B
)
. Ce système, capable d’adapter le type de mort cellulaire, est le témoin d’une co-évolution entre l’organisme et
Salmonella
. Il en résulte un mécanisme de mort cellulaire à la plasticité impressionnante. On peut imaginer que cette incroyable plasticité de mort cellulaire est non seulement un enjeu majeur contre
Salmonella
, mais également contre d’autres pathogènes intra-cellulaires, voire extra-cellulaires, qui ont aussi évolué de façon à altérer la mort cellulaire programmée des cellules infectées. Bien comprendre les tenants et les aboutissants de cette lutte serait déterminant pour développer des thérapies contre un grand nombre de bactéries. Toutefois, le défi est encore de taille, étant donné que la relation entre ce système et les pathogènes n’a pas encore été élucidé chez l’homme.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
De Cesare
A.
Salmonella in foods: a reemerging problem.
.
Adv Food Nutr Res.
2018;
;
86
:
:137.
–
179
.
2.
Kurtz
JR
Goggins
JA
McLachlan
JB
Salmonella infection: interplay between the bacteria and host immune system.
.
Immunol Lett.
2017;
;
190
:
:42.
–
50
.
3.
Gog
JR
Murcia
A
Osterman
N
et al.
Dynamics of Salmonella infection of macrophages at the single cell level.
.
JR Soc Interface.
2012;
;
9
:
:2696.
–
2707
.
4.
Elmore
S.
Apoptosis: a review of programmed cell death.
.
Toxicol Pathol.
2007;
;
35
:
:495.
–
516
.
5.
Shi
J
Gao
W
Shao
F
Pyroptosis: gasdermin-mediated programmed necrotic cell death.
.
Trends Biochem Sci.
2016;
;
42
:
:245.
–
254
.
6.
Green
DR
The coming decade of cell death research: five riddles.
.
Cell.
2019;
;
177
:
:1094.
–
1107
.
7.
Kupz
A
Scott
TA
Belz
GT
et al.
Contribution of Thy1
+
NK cells to protective IFN-γ production during Salmonella typhimurium infections
.
.
Proc Natl Acad Sci USA.
2013;
;
110
:
:2252.
–
2257
.
8.
Mascarenhas
DPA
Cerqueira
DM
Pereira
MSF
et al.
Inhibition of caspase-1 or gasdermin-D enable caspase-8 activation in the Naip5/NLRC4/ASC inflammasome.
.
PLoS Pathog.
2017;
;
13
:
:e1006502.
.
9.
Heilig
R
,
Dilucca
M
,
Boucher
D
, et al.
Caspase-1 cleaves Bid to release mitochondrial SMAC and drive secondary necrosis in the absence of GSDMD.
.
Life Sci Alliance.
2020;
;
3
:
:e202000735.
.
|