| |
| Med Sci (Paris). 37(8-9): 811–813. doi: 10.1051/medsci/2021126.Une banque d’organoïdes pour aider les enfants atteints d’un cancer du rein Séverine Grinberg,1a Isaure Rous,1b and Jérôme Cartry2c 1Master 2 Immunologie Translationnelle et Biothérapies (ITB), Parcours Immunologie, Mention BMC, Sorbonne Université
,
Paris
,
France
.
2
Inserm U1279,
Collective Invasion
(Fanny Jaulin), Institut Gustave Roussy
,
France
.
MeSH keywords: Biobanques, Enfant, Humains, Tumeurs du rein, Organoïdes, Médecine de précision, génétique |
Depuis les premières études du cancer chez l’enfant, qui datent de la deuxième moitié du XIX
e
siècle, de multiples sous-types de cancers ont été mis en évidence, conduisant à l’élaboration de stratégies thérapeutiques variées. Malgré un taux de guérison en considérable augmentation ces dernières décennies, les différents cancers pédiatriques restent la deuxième cause de mortalité chez l’enfant de plus de un an en France, après les accidents [
1
]
1
. Parmi les différents types de cancers de l’enfant, le cancer du rein est un des plus prépondérants, représentant 7 % des tumeurs infantiles. On distingue plusieurs types de tumeurs, qui présentent des profils génétiques, histologiques et d’agressivité très variés. Les tumeurs de Wilms représentent 90 % des tumeurs rénales infantiles. Parmi les 10 % restants, on trouve les tumeurs rhabdoïdes malignes (MRTK), les carcinomes des cellules rénales (RCC), et de nombreux sous-types cancéreux à l’incidence très faible.
Le problème majeur de ces cancers est qu’il n’existe que très peu de modèles expérimentaux permettant de représenter leur diversité génétique et phénotypique. Les quelques modèles murins de cancers du rein infantiles sont rarement aussi complexes et hétérogènes que les cancers humains, ce qui peut conduire à des résultats biaisés. La recherche et la découverte d’innovations thérapeutiques sont donc considérablement ralenties. Pour répondre à ces défis, l’équipe de Jarno Drost, dans l’unité de recherche dirigée par Hans Clevers (Institut Oncode, Pays-Bas), a travaillé sur la mise en place d’une banque d’organoïdes à partir de tissus tumoraux et sains issus de biopsies et de chirurgies rénales [
2
].
|
Établissement d’une banque d’organoïdes dérivés de tumeurs du rein de jeunes patients
Les organoïdes sont des structures cellulaires tridimensionnelles qui reproduisent les caractéristiques des tissus dont les cellules sont originaires. Ils conservent de façon stable les caractéristiques phénotypiques et génétiques des tissus parentaux, qu’ils soient sains ou pathologiques [
3
]. Une fois formés, les organoïdes peuvent être conservés et multipliés en laboratoire, ce qui permet de mener des expérimentations très exhaustives. Un autre de leurs avantages majeurs est leur résistance à la cryo-préservation. Il est donc possible de les conserver et de les échanger entre laboratoires. Depuis le début des années 2010 et le travail pionnier de l’équipe de Hans Clevers sur les organoïdes intestinaux, le nombre de tissus pour lesquels des banques d’organoïdes ont été générées ne cesse d’augmenter (
→
).
(→) Voir la série (en cours) « Organoïdes,
m/s
2019-2021
En 2020, l’équipe de Jarno Drost a développé un protocole permettant de constituer une banque d’organoïdes à partir de prélèvements tumoraux issus de jeunes patients atteints d’un cancer du rein [
3
]. Les échantillons tumoraux ont été récupérés, soit par biopsie, soit à partir de la pièce opératoire des patients opérés pour des néphrectomies. Les contrôles (tissu sain) provenaient de pièce en périphérie, non tumorales. Dans cette étude, les échantillons tumoraux ont été soumis à une digestion mécanique et enzymatique pour isoler les cellules cancéreuses. Afin de limiter l’anoïkose, une forme spécifique d’apoptose induite par la séparation des cellules et due à un défaut d’interaction entre les cellules et les protéines de la matrice extracellulaire, un inhibiteur de la kinase associée à Rho (ROCK) a été utilisé. Son efficacité a été démontrée sur des cultures de cellules souches embryonnaires humaines et dans des conditions de stress. Il a été utilisé dans l’étude pour augmenter la survie des cellules rénales obtenues après dissociation des tissus tumoraux et sains [
4
].
Les cellules cancéreuses isolées ont été mises en culture dans un gel qui mime l’environnement extracellulaire des cellules ; cellules et gel sont ensuite recouverts d’un milieu nutritif. Les premiers organoïdes ont été observés à partir du septième jour. Ils sont amplifiés tous les 10 à 14 jours. Les taux d’expansion varient en fonction des types de tumeurs. En suivant ce protocole, 54 organoïdes tumoraux et 47 organoïdes de tissus sains correspondants ont été obtenus. Cette banque d’organoïdes, la première concernant des tumeurs pédiatriques, couvre un large spectre de tumeurs rénales infantiles. |
Caractéristiques phénotypiques et génétiques des organoïdes
Afin de vérifier que les organoïdes générés peuvent être utilisés dans l’étude des cancers du rein pédiatriques, ceux-ci ont été comparés à leur tumeur d’origine d’un point de vue phénotypique et génétique
(
Figure 1
)
.
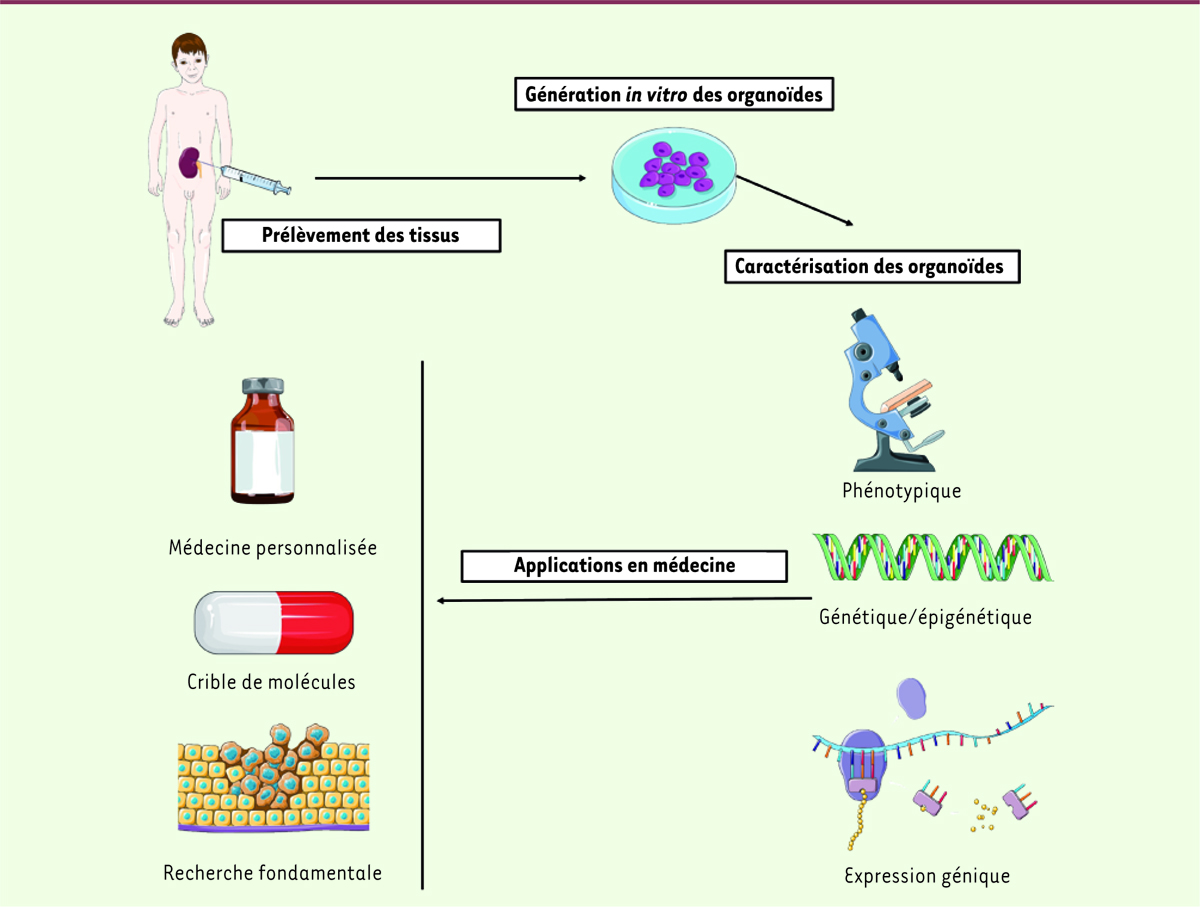
 | Figure 1.
Formation et caractérisation d’une banque d’organoïdes de tissus rénaux et potentielles utilisations en médecine.
Les organoïdes sont générés
in vitro
à partir du tissu tumoral prélevé sur des patients atteints d’un cancer du rein pédiatrique, puis caractérisés sur les plans phénotypique et génétique. Cette caractérisation permet d’analyser leur degré de similarité par rapport à la tumeur d’origine et leur représentativité de l’hétérogénéité tumorale des cancers du rein pédiatriques. Les organoïdes sont des modèles expérimentaux attractifs pour la recherche fondamentale, l’élaboration de nouvelles stratégies thérapeutiques (crible de médicaments) et pour développer des approches de médecine personnalisée (figure réalisée grâce à la banque d’images Smartservier
https://smart.servier.com
).
|
L’analyse histologique des organoïdes par coloration à l’hématoxyline/éosine a révélé des caractéristiques histologiques identiques à celles des tissus tumoraux dont ils dérivent. En effet, les trois types cellulaires attendus, cellules épithéliales, stromales et blastemales [
5
], sont retrouvés.
Par imagerie en trois dimensions à haute résolution, utilisant des rapporteurs fluorescents combinés à des marquages par des anticorps spécifiques, réalisée sur deux lignées d’organoïdes dérivés de cellules tumorales, les chercheurs ont mis en évidence, au sein de ces organoïdes, la même architecture cellulaire que celle présente dans les tumeurs. Cela confirme la ressemblance phénotypique des organoïdes de type Wilms avec les tumeurs « parentales ».
Pour confirmer le fait que les organoïdes générés constituent d’excellents avatars de la tumeur d’origine, les chercheurs ont réalisé un séquençage en cellules uniques de l’ARN. Ils ont ainsi mis en évidence une ségrégation des différents organoïdes en fonction de leur appartenance au tissu d’origine. Ces différents résultats confirment donc le maintien au sein des organoïdes des caractéristiques phénotypiques et des profils d’expression génique de la tumeur d’origine. Les auteurs ont également observé l’expression, au sein des organoïdes tumoraux, de marqueurs spécifiques de certains types cellulaires présents au sein des tumeurs de type Wilms, à savoir EPCAM (
epithelial cell adhesion molecule
) pour les cellules épithéliales, le collagène pour les cellules stromales, et une combinaison de ces marqueurs et de marqueurs de type progéniteurs pour les cellules blastomales [
5
]. Toutes ces données confirment que les organoïdes obtenus à partir de cellules tumorales dérivées de tumeurs de Wilms sont phénotypiquement proches de ces tumeurs. Les organoïdes de types MRTK et RCC étudiés à l’aide de différents marquages cellulaires montrent également des caractéristiques similaires aux tissus « parentaux ».
Les tumeurs de type Wilms possèdent un fond génétique très varié [
6
]. Afin d’analyser la diversité des mutations et des altérations géniques présentes dans les organoïdes de type Wilms, un séquençage entier du génome (WGS pour
whole genome sequencing
) de ces organoïdes tumoraux a été réalisé et les résultats obtenus ont été comparés à ceux des organoïdes des tissus sains correspondants. Plusieurs mutations ont été identifiées au sein des organoïdes tumoraux : des gains et pertes de portions chromosomiques ainsi que d’autres modifications fréquemment retrouvées dans les tumeurs de type Wilms, notamment la mutation de WT1 (
Wilms tumor 1
), premier gène impliqué dans la tumorigenèse [
7
]. D’autres mutations touchant les gènes oncogéniques typiques des tumeurs de type Wilms ont également été trouvées au sein des organoïdes tumoraux (à la différence des organoïdes issus de tissus sains), ce qui souligne leur caractère pathologique. Les mutations retrouvées par WGS ont ensuite été comparées à celles correspondant aux tumeurs pédiatriques du rein au sein de la base de données COSMIC (
catalogue of somatic mutations in cancer
)
2
qui recense les altérations génomiques d’un grand nombre de tumeurs. Cette comparaison a permis de confirmer que les mutations observées au sein des organoïdes tumoraux représentent un large panel des signatures typiques des tumeurs de Wilms, des tumeurs MRTK et RCC.
Enfin, les auteurs ont observé que les organoïdes de type Wilms présentent plusieurs mécanismes pour maintenir leur potentiel de réplication, notamment, comme les tumeurs
in vivo
, une surexpression d’IGF2 (
insulin growth factor 2
) [
8
], ce qui confirme la similarité des organoïdes et des tissus tumoraux. Les profils épigénétiques, analysés
via
l’étude de la méthylation de l’ADN, sont également conservés.
|
Utilisation des banques d’organoïdes La banque d’organoïdes de tumeurs du rein construite par Jarno Dorst est donc représentative de l’hétérogénéité des types de cancer du rein chez l’enfant. Elle peut être utilisée en recherche fondamentale et pour des études précliniques, comme pour le développement de traitements moins toxiques, en comparant les effets de médicaments candidats sur les organoïdes tumoraux et ceux issus de tissus sains, le but de ces expériences de criblage étant d’obtenir des molécules actives sur les cellules tumorales sans être toxiques pour les tissus sains.
D’un point de vue plus fondamental, la banque d’organoïdes peut permettre de mieux comprendre le cancer du rein pédiatrique et d’étudier les mécanismes mutationnels à l’origine de la tumorigenèse. Plusieurs types de cancers sont, par ailleurs, liés à des infections. Les organoïdes pourraient être mis en présence de pathogènes pour étudier leur l’impact sur le processus de tumorigenèse [
3
].
Il est également possible d’utiliser les organoïdes en médecine personnalisée. Pour chaque jeune patient souffrant d’un cancer du rein, les organoïdes tumoraux correspondants pourraient être générés afin d’étudier
in vitro
l’effet d’un panel de médicaments candidats qui pourraient par la suite lui être administrés.
À l’avenir, cette technique pourrait être améliorée par l’inclusion de cellules immunitaires, qui constituent une composante majeure du microenvironnement tumoral et qui représentent donc une cible pour le développement de nouvelles thérapies [
9
].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Pui
CH
Gajjar
AJ
Kane
JR
et al.
Challenging issues in pediatric oncology.
.
Nat Rev Clin Oncol.
2011;
;
8
:
:540.
–
549
.
2.
Calandrini
C
,
Schutgens
F
,
Oka
R
, et al.
An organoid biobank for childhood kidney cancers that captures disease and tissue heterogeneity.
.
Nat Commun.
2020;
;
11
:
:1310.
.
3.
Drost
J
Clevers
H
Organoids in cancer research.
.
Nat Rev Cancer.
2018;
;
18
:
:407.
–
418
.
4.
Watanabe
K
Ueno
M
Kamiya
D
et al.
A ROCK inhibitor permits survival of dissociated human embryonic stem cells.
.
Nat Biotechnol.
2007;
;
25
:
:681.
–
686
.
5.
Rivera
MN
Haber
DA
Wilms’ tumour: connecting tumorigenesis and organ development in the kidney.
.
Nat Rev Cancer.
2005;
;
5
:
:699.
–
712
.
6.
Deng
C
Dai
R
Li
X
Liu
F
Genetic variation frequencies in Wilms’ tumor: A meta-analysis and systematic review.
.
Cancer Sci.
2016;
;
107
:
:690.
–
699
.
7.
Gadd
S
Huff
V
Walz
AL
et al.
A Children’s Oncology Group and TARGET initiative exploring the genetic landscape of Wilms tumor.
.
Nat Genet.
2017;
;
49
:
:1487.
–
1494
.
8.
Treger
TD
Chowdhury
T
Pritchard-Jones
K
Behjati
S
The genetic changes of Wilms tumour.
.
Nat Rev Nephrol.
2019;
;
15
:
:240.
–
251
.
9.
Yuki
K
,
Cheng
N
,
Nakano
M
,
Kuo
CJ
.
Organoid Models of Tumor Immunology.
.
Trends Immunol.
2020;
;
41
:
:652.
–
64
.
|