| |
| Med Sci (Paris). 37(8-9): 802–805. doi: 10.1051/medsci/2021107.Les gènes des enfants de Tchernobyl Chroniques génomiques Bertrand Jordan1* 1UMR 7268 ADÉS, Aix-Marseille, Université /EFS/CNRS ; CoReBio PACA, case 901, Parc scientifique de Luminy
,
13288Marseille Cedex 09
,
France MeSH keywords: Accident nucléaire de Tchernobyl, Enfant, Catastrophes, Humains, Japon, Armes nucléaires, Séquençage du génome entier |
L’explosion du réacteur n° 4 de la centrale de Tchernobyl, survenue au petit matin du 26 avril 1986 près de la ville de Pripiat, en Ukraine, a porté un coup d’arrêt durable au développement de l’énergie nucléaire. Il s’est agi d’un accident majeur qui a provoqué la libération d’importantes quantités d’éléments radioactifs dans l’atmosphère, entraînant une très large contamination de l’environnement, ainsi que de nombreuses maladies et décès, survenus immédiatement ou à terme du fait des irradiations ou des contaminations. Le nombre de décès survenus chez les « liquidateurs »
1,
et dans la population locale irait de quelques centaines à quelques milliers selon l’Organisation mondiale de la santé (OMS)
2
, beaucoup plus selon certaines estimations. La contamination du lait par l’iode 131 (répandue sur les pâturages par l’explosion de la centrale) a provoqué un peu moins de 10 000 cancers de la thyroïde chez les enfants et adolescents. Au-delà des décès de « liquidateurs » fortement irradiés, c’est l’effet sanitaire le mieux établi de cet accident [
1
]
3
(
→
).
(→) Voir la Synthèse de M. Schlumberger et B. Le Guen,
m/s
n° 8-9, août-septembre 2012, page 746
Une étude toute récente détaille les caractéristiques de ces cancers [
2
]. On évoque aussi, depuis le début, la possibilité de mutations génétiques induites par la radioactivité, aboutissant à un taux important de nouvelles mutations chez les enfants de parents irradiés lors (ou dans les suites) de l’accident, mais les données étaient jusqu’alors fragmentaires et contradictoires. La question des conséquences génétiques chez l’homme d’une irradiation accidentelle est importante et a suscité bien des controverses [
3
,
4
]. Le suivi très précis des survivants de Hiroshima et Nagasaki [
4
,
5
] (
→
) aurait pu permettre de trancher la question, mais les travaux nécessaires n’ont pas encore été menés : seule une étude effectuée par séquençage intégral sur trois trios (père, mère, enfant) a été publiée jusqu’ici [
6
]. Elle conclut à l’absence d’effets génétiques détectables, mais l’effectif analysé est vraiment trop faible pour permettre de trancher la question.
(→) Voir le Repère de B. Jordan,
m/s
n° 2, févier 2018, page 171
|
Le « bruit de fond » des mutations de novo
Les mutations nouvellement apparues chez l’enfant proviennent d’évènements qui se sont produits dans les gonades paternelles ou maternelles. De nombreuses études ont été menées pour évaluer ce taux de mutation en l’absence d’influences mutagènes particulières, d’abord par des approches indirectes puis, plus récemment, par séquençage intégral de l’ADN de trios familiaux : on compare alors la séquence de l’ADN des enfants à celle des parents pour détecter les différences, qui correspondent à des mutations
de novo
intervenues dans les cellules germinales des parents et qui ont été transmises aux enfants. Les résultats sont convergents et indiquent que le nombre de mutations
de novo
varie selon les individus entre 50 et 100 [
7
,
8
], correspondant à un taux de mutation d’environ 10
-8
par nucléotide et par génération. Ces nouvelles mutations détectées chez les enfants n’ont presque toujours aucun effet délétère, car la probabilité qu’elles affectent un gène et perturbent gravement sa fonction est très faible
4
. Le nombre de ces nouvelles mutations augmente avec l’âge du père (environ 10 mutations supplémentaires par décennie) et, moins sensiblement, avec l’âge de la mère. Au total, on peut donc estimer qu’une augmentation de quelques unités du nombre de mutations
de novo
serait détectable dans une étude bien menée – c’est-à-dire un séquençage de bonne qualité d’une grande série de trios parents/enfant. On a sans doute un peu oublié que c’était la motivation principale du programme
Génome humain
, tel qu’il avait été présenté par Charles DeLisi, à l’époque directeur du bureau de la recherche en santé et environnement du Département américain de l’énergie (
DOE, Department of Energy
). L’objectif était de détecter les éventuelles mutations
de novo
présentes chez les enfants des personnes irradiées lors de l’explosion des bombes d’Hiroshima et de Nagasaki [
9
]. On peinait déjà à mettre en évidence de telles altérations par les méthodes alors disponibles, et DeLisi escomptait qu’un projet de séquençage du génome humain permettrait de trancher en comparant les séquences d’ADN des parents irradiés et des enfants. Ce n’est que tout récemment que les techniques issues du programme
Génome
sont devenues, trente-cinq ans plus tard, capables de répondre à cette question…
|
Les éléments d’une nouvelle étude sur les enfants de Tchernobyl
C’est dire l’importance de la publication récente dans la revue
Science
d’une étude capable de répondre à cette question [
10
]. Fruit d’une collaboration entre laboratoires des États-Unis, d’Ukraine, de Russie et du Japon, elle présente les résultats d’un travail mené par séquençage intégral (
WGS, whole genome sequencing
) sur 130 enfants et leurs parents. Son titre est sans ambigüité : «
Lack of transgenerational effects of ionizing radiation exposure from the Chernobyl accident »
. Les données obtenues justifient-elle vraiment ce titre ? C’est ce que nous allons examiner dans la présente chronique.
L’effectif qui fait l’objet de cette étude est important : 105 trios mère/mère/enfant(s) totalisant 130 enfants nés entre 1987 et 2002. Les parents ont fait partie des « liquidateurs » qui sont intervenus sur la centrale après l’accident, ou sont des personnes évacuées de la zone de Pripiat et qui ont été irradiées du fait de leur présence près de la centrale dans les jours qui ont suivi l’accident et/ou de leur consommation de produits contaminés par la radioactivité. Les doses reçues par chaque parent ont été évaluées, grâce à une analyse détaillée des activités et des déplacements de chaque personne au sein de la zone concernée. Cette évaluation fait l’objet d’un article séparé [
11
] et semble avoir été effectuée de manière très sérieuse, comprenant une interview de chaque parent, plusieurs questionnaires détaillés, et une reconstruction des doses reçues selon des méthodes éprouvées [
12
]. Les doses absorbées sont exprimées en milliGray (mGy), unité d’énergie absorbée ; compte tenu du type de radiation (rayons X, gamma et bêta), 1 mGy correspond à 1 mSv (millisievert), unité d’effet biologique
5
. Rappelons que l’exposition naturelle (rayons cosmiques) est de l’ordre de 1 mSv par an, que la dose maximum pour les travailleurs de l’industrie nucléaire est de 20 mSv par an, que les premiers effets biologiques apparaissent après une irradiation de 100 mSv en une fois, et que la LD50 (dose létale pour 50 % des individus) est de l’ordre de 3 500 mSv (ou 3 500 mGy). Pour les parents des trios considérés ici, les doses paternelles reçues avant la conception vont de 0 à 4 080 mGy (une valeur très élevée), la médiane des doses paternelles est de 29,3 mGy et seuls 17 pères ont reçu plus de 1 000 mGy. Pour les mères, les doses reçues vont de 0 à 550 mGy (médiane 2,1 mGy) et seules deux mères ont été exposées à plus de 500 mGy. On a donc un échantillon assez large, dans lequel un petit nombre de personnes ont reçu des irradiations élevées ou très élevées. Si l’irradiation des parents augmente le taux de nouvelles mutations chez les enfants, on devrait observer une augmentation nette en fonction de la dose reçue, les parents très faiblement ou pas du tout irradiés servant en quelque sorte de témoins internes.
Le séquençage de ces ADN représente un effort non négligeable, puisqu’il s’agit de 340 séquences complètes (105 séquences paternelles + 105 maternelles + 130 d’enfants), qui plus est de très bonne qualité, puisqu’il faut pouvoir détecter un petit nombre de nouvelles mutations supplémentaires. Il a été effectué au
Broad Institute
(États-Unis), un des grands centres internationaux de séquençage, avec une redondance moyenne de 80X, c’est-à-dire que chaque nucléotide de la séquence a été lu 80 fois, valeur nettement supérieure au standard généralement respecté de 30 fois. Une analyse bioinformatique sophistiquée a ensuite été pratiquée pour comparer les séquences à l’intérieur de chaque trio et, ainsi, découvrir les nouvelles mutations présentes chez l’enfant, en éliminant au maximum les faux positifs qui pourraient résulter d’erreurs de séquençage ou d’autres causes. Cette étape est essentielle puisqu’il s’agit de détecter une éventuelle petite augmentation du nombre de ces mutations. Nous verrons que les résultats fournissent un contrôle interne rassurant sur la validité des chiffres obtenus.
|
Des résultats très nets et tout à fait crédibles
Je me limiterai ici aux résultats concernant les mutations
de novo
ponctuelles (remplacement d’un nucléotide par un autre), les plus simples à décrire ; l’analyse d’autres types de mutations (délétions notamment) donne des résultats comparables. En accord avec la littérature [
7
,
8
], les auteurs détectent de 50 à 100 mutations
de novo
dans les différents trios, avec une valeur moyenne d’environ 75. Un contrôle très utile consiste à examiner si le nombre de ces nouvelles mutations augmente avec l’âge des parents, et notamment du père comme cela a déjà été rapporté [
7
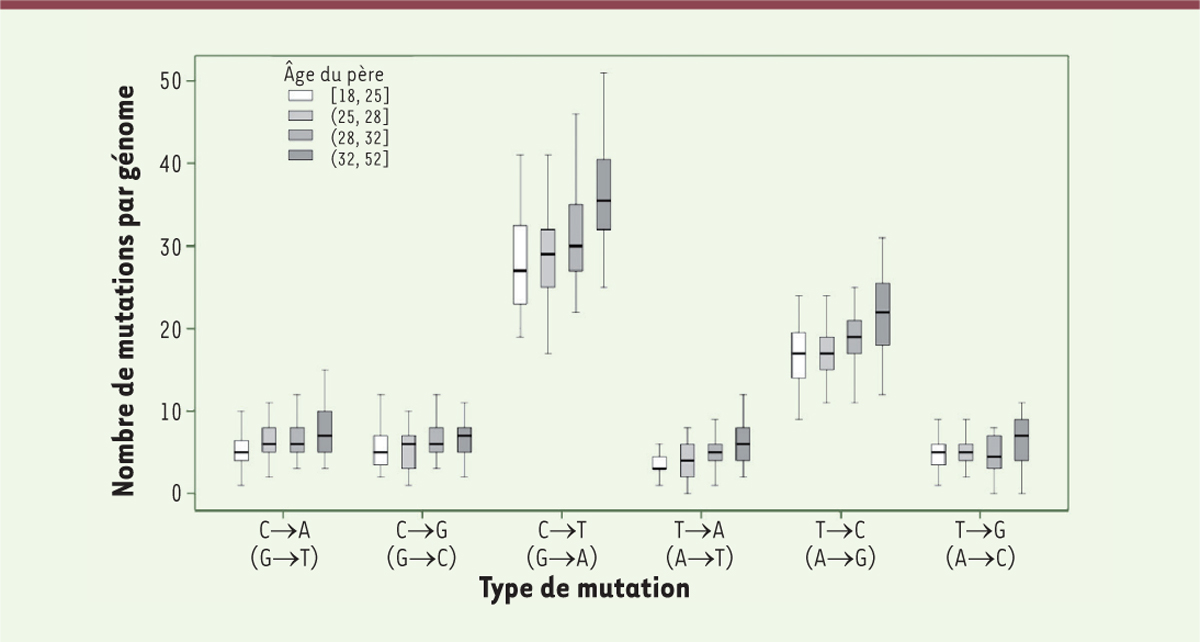
]. Comme le montre la
Figure 1
, cette dépendance est bien retrouvée : même si la dispersion des valeurs individuelles est importante, l’augmentation avec l’âge paternel est clairement visible. C’est rassurant quant à la possibilité de détecter une éventuelle augmentation des mutations
de novo
due à l’irradiation.
 | Figure 1.
Nombre de nouvelles mutations détectées chez l’enfant en fonction de l’âge du père
. Dans ce graphique, on distingue les différents types de mutations ponctuelles ; pour chacune d’elles, la nuance du grisé de la boîte varie en fonction de l’âge du père (de gauche à droite, de 18-25 ans à 32-52 ans). L’augmentation liée à l’âge est nettement visible (extrait partiel et modifié de la figure S4 du supplément de [
10
]).
|
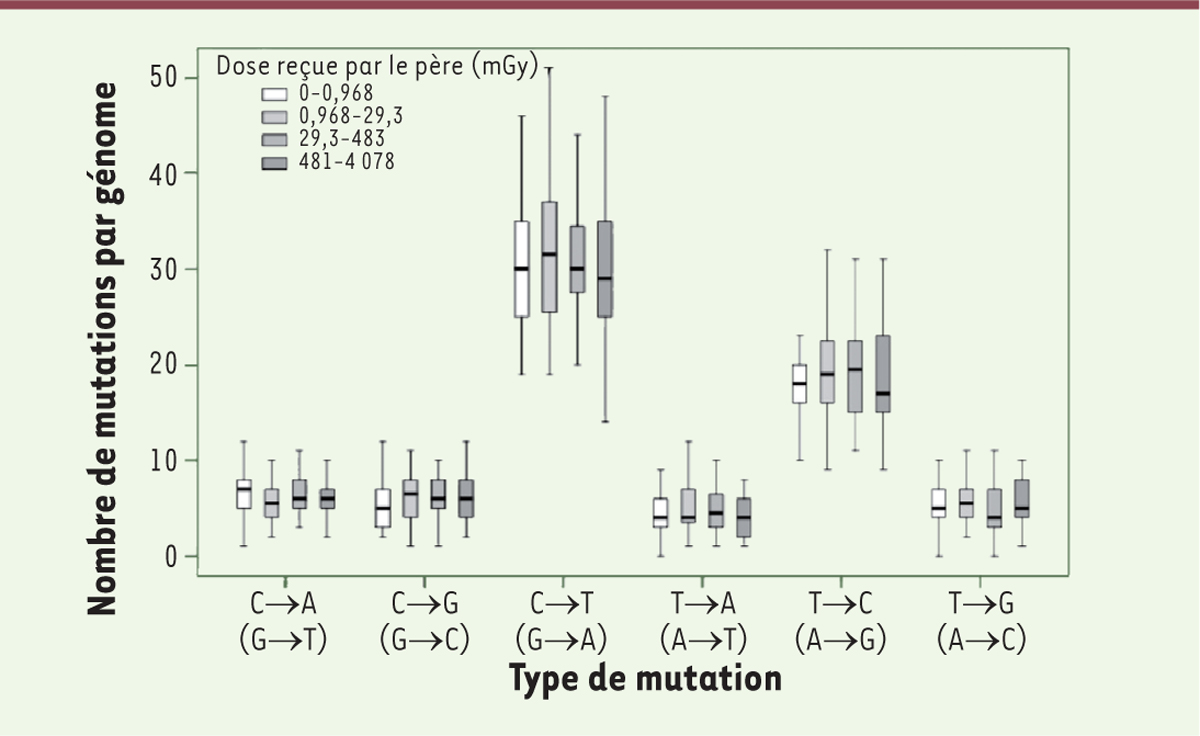
Il est temps maintenant d’examiner la dépendance des nouvelles mutations par rapport à l’irradiation des parents. La
Figure 2
se passe presque de commentaires.
 | Figure 2.
Nombre de nouvelles mutations détectées chez l’enfant, en fonction de l’irradiation reçue par le père
. Comme pour la figure précédente, on distingue les différents types de mutations ponctuelles. Cette fois, les boîtes sont teintées en fonction de la dose reçue par le père, soit de gauche à droite : 0-0,968 mGy, 0,968-29,3 mGy (29,3 mGy est la valeur médiane), 29,3 à 463 mGy et 481-4 078 mGy. On voit que, même pour le dernier quartile, il n’y a pas d’augmentation nette (extrait partiel et modifié de la figure S3 du supplément de [
10
]).
|
Sur cette figure, les doses d’irradiation ont été réparties en quatre quartiles (correspondant à quatre populations de même effectif), mais même pour celui qui correspond à des doses très élevées, on n’observe pas d’augmentation du nombre de mutations
de novo
. Les résultats concernant les mères sont similaires, avec une augmentation due à l’âge plus faible et toujours aucun effet détectable de l’irradiation reçue. On peut donc conclure que, même à des doses importantes (approchant ici la LD50 pour certains pères), l’irradiation des parents n’augmente pas le nombre de nouvelles mutations apparaissant chez les enfants – en somme, comme le dit le titre de l’article, il n’y a pas d’effet trans-générationnel de l’exposition aux radiations dans l’accident de Tchernobyl. Conclusion solide qui, rappelons-le, va à l’encontre d’une opinion généralement admise et met à mal des fantasmes largement répandus [
3
]…
|
35 ans plus tard, la question est réglée
Il est clair que la catastrophe de Tchernobyl a eu des conséquences sociétales, sanitaires et économiques terribles. Elle a causé des centaines ou des milliers de décès, une vague de cancers pédiatriques et la stérilisation durable d’un territoire étendu. Mais l’un des effets les plus effrayants, l’induction de nombreuses mutations délétères chez les enfants de parents irradiés, s’avère absent (ou à tout le moins indétectable). L’article de Yeager
et al.
[
10
] en apporte une preuve solide, qui vient confirmer les études précédentes tant sur les enfants de Tchernobyl que sur les survivants des bombes d’Hiroshima et Nagasaki [
5
]. Cela semble contradictoire avec les études sur l’animal, qui mettent en évidence une nette augmentation du nombre de mutations dans la descendance d’animaux irradiés [
13
], mais il faut noter que, dans ces expériences, les irradiations sont plus importantes (3 000 mGy pour l’article cité). On peut aussi penser que les mécanismes de réparation de l’ADN doivent être plus efficaces chez l’homme que chez la souris, en raison de notre longévité très supérieure. Une accumulation relativement rapide d’erreurs de réplication de l’ADN non réparées n’a pas de conséquence grave pour un organisme dont la durée de vie est limitée à une ou deux années, mais serait catastrophique pour notre espèce : c’est le cas pour les personnes atteintes du syndrome de Werner, dont la cause est une anomalie de ce système de réparation [
14
] (
→
).
(→) Voir la Chronique génomique de B. Jordan,
m/s
n° 4, avril 2021, page 413
Quoi qu’il en soit, l’objectif que visait Charles deLisi en 1985 [
9
] est finalement atteint, grâce à des progrès techniques dont il n’imaginait sûrement pas l’ampleur…
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Schlumberger
M
,
Le Guen
B
.
Accident de centrale nucléaire et risque de cancer de la thyroïde : les conséquences sanitaires de Tchernobyl.
.
Med Sci (Paris).
2012;
;
28
:
:746.
–
756
.
2.
Morton
LM
,
Karyadi
DM
,
Stewart
C
,
et al.
Radiation-related genomic profile of papillary thyroid cancer after the Chernobyl accident.
.
Science.
2021;
;
372
:
:eabg2538.
.
3.
Ibuse
M
.
Pluie noire.
.
Paris:
:
Gallimard;
,
1966
,
1972 (réédition collection Folio, 2005).
:
:384.
p.
4.
Jordan
BR
.
The Hiroshima/Nagasaki survivor studies: discrepancies between results and general perception.
.
Genetics.
2016;
;
203
:
:1505.
–
1512
.
5.
Jordan
B
.
Les survivants d’Hiroshima/Nagasaki et leur descendances : les enseignements d’une étude épidémiologique à long terme.
.
Med Sci (Paris).
2018;
;
34
:
:171.
–
178
.
6.
Horai
M
,
Mishima
H
,
Hayashida
C
,
et al.
Detection of de novo single nucleotide variants in offspring of atomic-bomb survivors close to the hypocenter by whole-genome sequencing.
.
J Hum Genet.
2018;
;
63
:
:357.
–
363
.
7.
Kong
A
,
Frigge
M
,
Masson
G
,
et al.
Rate of de novo mutations and the importance of father’s age to disease risk.
.
Nature.
2012;
;
488
:
:471.
–
475
.
8.
Jónsson
H
,
Sulem
P
,
Kehr
B
,
et al.
Parental influence on human germline de novo mutations in 1,548 trios from Iceland.
.
Nature.
2017;
;
549
:
:519.
–
522
.
9.
Cook-Deegan
R
.
Genes and the Bomb.
. In:
Gene wars.
.
New York-London:
:
Norton and Cie;
,
1994
:
:92.
–
106
.
10.
Yeager
M
,
Machiela
MJ
,
Kothiyal
P
,
et al.
Lack of transgenerational effects of ionizing radiation exposure from the Chernobyl accident.
.
Science.
2021;
;
372
:
:725.
–
9
.
11.
Chumak
V
,
Bakhanova
E
,
Kryuchkov
V
,
et al.
Estimation of radiation gonadal doses for the American-Ukrainian trio study of parental irradiation in Chornobyl cleanup workers and evacuees and germline mutations in their offspring.
.
J Radiol Protect.
2021
. doi:
10.1088/1361-6498/abf0f4
.
12.
Kryuchkov
V
,
Chumak
V
,
Maceika
E
,
et al.
Radrue method for reconstruction of external photon doses for Chernobyl liquidators in epidemiological studies.
.
Health Phys.
2009;
;
97
:
:275.
–
298
.
13.
Adewoye
AB
,
Lindsay
SJ
,
Dubrova
YE
,
Hurles
ME
.
The genome-wide effects of ionizing radiation on mutation induction in the mammalian germline.
.
Nat Commun.
2015;
;
6
:
:6684.
.
14.
Jordan
B
.
Vers une thérapie génique pour la progéria ?
Med Sci (Paris).
2021;
;
37
:
:413.
–
6
.
|