| |
| Med Sci (Paris). 37(8-9): 779–784. doi: 10.1051/medsci/2021116.La contraception d’urgence Une longue histoire Kamila Kolanska,1 Philippe Faucher,2,3 Émile Daraï,1 Philippe Bouchard,4 and Nathalie Chabbert-Buffet1,2,3* 1Service de gynécologie obstétrique et médecine de la reproduction, AP-HP, Sorbonne Université, Hôpital Tenon
,
4 rue de la Chine
,
75020Paris
,
France 2Service de gynécologie- obstétrique, AP-HP, Sorbonne Université, Hôpital Trousseau
,
26 avenue du Dr Arnold Netter
,
Paris
,
France 3Fédération de régulation des naissances de l’Est parisien, AP-HP, Sorbonne Université
,
Paris
,
France 4Clinique Hartmann
,
26 boulevard Victor Hugo
,
92200Neuilly-sur-Seine
,
France |
Vignette (© Inserm/Universcience/CNDP/Picta productions-Véronique Kleiner).
La contraception d’urgence, encore appelée contraception du lendemain ou contraception post-coïtale, fait appel à un ensemble de méthodes qui peuvent être utilisées dans l’urgence pour prévenir la possible survenue d’une grossesse non désirée, après un rapport sexuel non protégé (pour revue voir [
1
]). Il s’agit donc d’une méthode de contraception d’appoint, dont l’utilisation est supposée être occasionnelle et non régulière. Le terme de
contraception d’urgence
est ainsi préférable à celui de
contraception du lendemain
qui pourrait laisser penser que son utilisation est à envisager le lendemain du rapport, et non à appliquer « en urgence », dès la constatation du rapport non protégé. Cette contraception peut être utilisée dans plusieurs cas : après une rupture de préservatif, à la suite d’un rapport sexuel non protégé, d’une mauvaise utilisation d’un moyen régulier de contraception, ou bien sûr, dans le cas de rapports non consentis.
Le premier cas de contraception d’urgence, documenté en 1964 aux Pays-Bas, est d’ailleurs celui d’une jeune fille de 13 ans à laquelle ont été administrés des œstrogènes, après un viol collectif, alors qu’elle était en milieu de cycle menstruel [
2
]. À cette même époque, une étude clinique réalisée à l’Université de Yale (États-Unis) [
3
] avait examiné l’effet d’œstrogènes de synthèse, le diéthylstilbestrol
1
(25-50 mg/j) ou l’éthinylestradiol (0,5-2 mg/j), pendant quatre à six jours après le rapport sexuel. Mais les études cliniques utilisant les concepts encore actuels de contraception d’urgence n’ont été conduites qu’une dizaine d’années plus tard, au Canada, par Abraham A. Yuzpe
et al.
, qui laissera son nom au protocole utilisant une combinaison œstroprogestative [
4
], et en Amérique du sud, par Erich von Kesserü
et al.
, avec des progestatifs seuls [
5
]. En 1979, Jack Lippes
et al.
décrivaient pour la première fois une autre méthode dans le cadre de la contraception d’urgence : l’utilisation d’un dispositif intra-utérin (DIU) au cuivre [
6
].
Au début des années 1990, des données relatives à l’utilisation de modulateurs sélectifs du récepteur de la progestérone (les SPRM pour
selective progesterone receptor modulators
) pour une contraception d’urgence sont apparues. L’étude de référence, conduite par Anna Glasier et David Baird, à Edimbourg (Royaume-Uni) [
7
], avait pour but de comparer une prise unique de mifépristone (un stéroïde de synthèse, aussi appelé RU486), à la dose de 600 mg, à l’association éthinylestradiol (100 µg par prise) – norgestrel (1 mg par prise), qui demandait deux prises à 12 h d’intervalle. Le RU486 (initialement appelé RU 38 486)
2,
avait été découvert en 1981 par une équipe de chercheurs des laboratoires Roussel-Uclaf, Roger Deraedt, Daniel Philibert, Germain Costerousse et Georges Teutsch, qui recherchaient des anti-glucocorticoïdes
3,
,
4,
,
5
, dont certains s'avérèrent être également des anti-progestérone. Étienne-Émile Baulieu, alors conseiller de Roussel-Uclaf, et qui, de son côté, travaillait avec son équipe de l'Inserm sur les fonctions de la progestérone [
8
], fit alors tester avec succès à Genève l'activité d'interruption de grossesse du RU 486 chez onze femmes enceintes, test dont les résultats positifs furent présentés à l'Académie des sciences le 19 avril 1982 [
9
]. Près de dix ans plus tard, en 1991, l'étude d'Anna Glasier et David Baird rapportait la première exploration d’une contraception d’urgence en mono-prise. En 2006, Mitchell D. Creinin
et al.
publiaient la première étude d’un nouveau SPRM, l’ulipristal acétate, utilisé dans le contexte d’une contraception d’urgence. Cette molécule est encore actuellement commercialisée en France et dans le reste du monde [
10
]. Les SPRM venaient ainsi compléter l’offre de contraception d’urgence sans œstrogènes. Ils apportaient la possibilité d’une contraception d’urgence hormonale, efficace jusqu’à la 120
e
heure après le rapport, tout comme le DIU au cuivre, mais moins contraignante. L’évolution vers une contraception d’urgence dépourvue d’œstrogènes, afin de limiter les effets secondaires induits par ces hormones et les contre-indications vasculaires, et son corollaire, la mise à disposition de molécules sans prescription médicale, sont ainsi devenus les piliers de la panoplie actuelle de la contraception d’urgence.
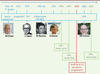 | Figure 1.
La contraception d’urgence : principales dates, premières études, et avancées majeures.
CU : contraception d’urgence ; UPA : ulipristal acétate ; DIU : dispositif intra-utérin ; LNG : lévonorgestrel.
|
Ce bref survol historique de la contraception d’urgence révèle les tendances qui ont guidé le développement pharmacologique des molécules utilisées : la perspective générale d’amélioration de la tolérance à ces produits et l’accroissement de leur accessibilité par les femmes. Ce développement a été relativement lent. Il s’est en effet heurté, notamment, à des difficultés sociétales mais aussi politiques. Alors que la contraception régulière a été reconnue et acceptée dès les années 1960, bien que les conditions de délivrance restassent contraintes, les réticences à proposer des méthodes évoquant une contragestion
6
, voire une interruption de grossesse, se révélèrent nombreuses.
Le concept de contraception intra-utérine, dispositif implanté dans l’utérus afin de limiter la nidation, est apparu dans les années 1900 [
11
]. Son utilisation régulière a été mise en place dès les années 1920 [
12
]. Il y eut toutefois un arrêt à son utilisation, entre la Seconde Guerre mondiale et la fin des années 1950, en raison du risque infectieux qui pouvait lui être associé à cette époque [
13
]. Ce dispositif ne sera ainsi proposé en contraception d’urgence qu’à partir de la fin des années 1970.
L’acceptation des modulateurs sélectifs du récepteur de la progestérone (SPRM) à des fins d’utilisation comme contraceptifs d’urgence sera également complexe. En effet, la mifépristone ou RU 486, chef de file de ces molécules [
7
,
9
], avait pour indication une interruption de grossesse. Le titre du commentaire de David A. Grimes et Rebecca J. Cook relatif à l’article d’Anna F. Glasier
et al.
[
14
], paru dans le
New England Journal of Medicine
en 1992 : «
Mifepristone (RU 486)-un abortif pour prévenir l’avortement
? » [
15
], est révélateur des questionnements de l’époque. En 1988, le laboratoire Roussel-Uclaf tentera de retirer du marché cette molécule qu’il commercialisait alors pour l’indication d’interruption de grossesse. Il sera contraint par le ministre de la Santé de l’époque, Claude Évin, de remettre à disposition de la population cette molécule que le ministre considérait comme «
devenue la propriété morale des femmes, pas seulement la propriété de la société pharmaceutique
». Aux États-Unis, l’administration Bush empêchera longtemps toute recherche sur les SPRM et la contraception.
|
La contraception d’urgence par dispositif intra-utérin (DIU) et son évolution
Le DIU au cuivre peut être inséré pour prévenir une grossesse jusqu’au moment de l’implantation de l’œuf (soit cinq à sept jours après l’ovulation). Si une femme a eu un rapport sexuel trois jours avant son ovulation, le DIU au cuivre peut prévenir une possible grossesse s’il est implanté jusqu’à dix jours après le rapport sexuel [
1
], voire à tout moment du cycle [
16
]. Cependant, en raison des difficultés pour déterminer le jour de l’ovulation, et du fait des réticences liées à une potentielle interruption d’une grossesse débutante, il est généralement recommandé d’utiliser le DIU au cuivre seulement jusqu’à cinq jours après le rapport sexuel. L’effet de l’implant sur le développement possible d’une grossesse, malgré sa présence, a été évalué dans une méta-analyse regroupant 42 études portant sur 7 034 femmes chez lesquelles un DIU au cuivre avait été implanté dans le cadre d’une contraception d’urgence : seules dix grossesses ont été observées. Ce qui représente un taux d’échec de 0,14 % ([IC] 95 % : 0,08-0,25) [
17
], montrant ainsi l’efficacité de cette méthode.
Les deux types de DIU disponibles (au cuivre et au lévonorgestrel) peuvent contribuer à réduire la pénétration du sperme dans le col utérin. Ils induisent dans l’endomètre une réaction inflammatoire pour l’un, ou un environnement hormonal pour l’autre, qui résultent en l’inhibition de l’implantation de l’œuf dans l’utérus. Le DIU au cuivre a également un effet toxique sur les gamètes, ce qui augmente son efficacité dans le cadre de la contraception d’urgence [
18
].
La contraception d’urgence par DIU au cuivre reste pourtant relativement peu utilisée en France (24 % des contraceptifs d’urgence), notamment en raison de la nécessité de l’intervention d’un professionnel de santé, de la limitation de son usage aux femmes ayant déjà eu des enfants, jusqu’en 2004 [
19
], et de la crainte du risque infectieux [
20
]. La démocratisation de son utilisation chez les femmes nullipares, et les recommandations pour la pratique clinique du Collège national des gynécologues et obstétriciens français (CNGOF) en 2018, qui ont simplifié les modalités de pose du DIU [
21
], pourraient néanmoins permettre d’accroître le recours à cette modalité de contraception d’urgence.
Cette méthode de contraception d’urgence permet également d’instaurer, chez la femme qui la reçoit, une contraception au long cours. Le DIU au cuivre n’est cependant pas adapté à toutes les femmes, notamment parce qu’il augmente le risque de saignements plus abondants lors des règles, un inconvénient qui peut cependant être prévenu par l’utilisation d’un DIU comme le DIU au lévonorgestrel, qui est hormonal et n’induit pas d’inflammation.
Jusqu’à présent, le DIU au lévonorgestrel a été étudié dans le cadre de la contraception d’urgence uniquement en association avec une prise de la même molécule par voie orale. Des résultats très satisfaisants ont été obtenus avec cette méthode [
22
], mais des études supplémentaires sont nécessaires. Un essai clinique, mis en place par l’université d’Utah, aux États-Unis, afin de comparer le DIU au lévonorgestrel seul, sans apport de la molécule par voie orale, et le DIU au cuivre, est en cours (ClinicalTrials.gov Identifier: NCT02175030). Des premiers résultats semblent montrer l’absence de différence d’efficacité entre les deux dispositifs [
23
].
|
La contraception d’urgence hormonale et son évolution La méthode Yuzpe, pionnière de la contraception d’urgence hormonale
La première contraception d’urgence hormonale utilisée en routine a été l’association décrite par Yuzpe de deux molécules, l’éthinylestradiol (EE) et le norgestrel [
4
], dans le but de bloquer et retarder le pic pré-ovulatoire de LH (hormone lutéinisante), et donc l’ovulation, grâce aux fortes doses de stéroïdes utilisées. Comme pour toutes les méthodes de contraception hormonale d’urgence, l’efficacité de cette association diminue avec le temps entre le rapport sexuel à risque et la prise du traitement. Il est ainsi recommandé de prendre ce traitement au plus tard 72 h après le rapport non désiré ou pour lequel la procréation n’est pas souhaitée [
24
]. Les modalités initiales de cette contraception consistaient en la prise de quatre comprimés d’un œstroprogestatif (le Stédiril®) alors disponible en France, et, jusqu’en 2016, associant l’éthinylestradiol (50 µg) et le norgestrel (500 µg), en deux prises, espacées de 12 h. Un conditionnement spécifique, constitué de 4 comprimés sous blister (Tétragynon
®
), a, par la suite, été commercialisé, mais il a été retiré de la vente en France en 2005 du fait de ses effets secondaires. Le principal inconvénient de cette formulation était la survenue de nausées (50 % des femmes) et de vomissements (20 %). Cela pouvait nécessiter la prise de deux nouveaux comprimés afin de compenser la perte. L’association d’antiémétiques permettait néanmoins de réduire ces effets secondaires, respectivement de 27 % pour les nausées et 64 % pour les vomissements [
25
]. Il faut noter que ces associations œstroprogestatives n’étant pas en vente libre, les consultations dans les services d’urgences, à toute heure, se sont vues multipliées afin que les femmes reçoivent une prescription dans l’urgence, faute d’anticipation. Les contre-indications vasculaires, en raison des doses élevées d’éthinylestradiol, responsable de thromboses, nécessitaient d’être respectées par les médecins prescripteurs, bien que ces événements vasculaires aient été en fait très rares, comme l’indique une étude menée au Royaume-Uni, qui rapporte six accidents thrombotiques artériels ou veineux pour quatre millions d’utilisatrices du régime de Yuzpe [
26
].
Depuis la commercialisation des contraceptifs d’urgence sans œstrogènes, qui se sont révélés aussi efficaces [
27
], mieux tolérés et quasi sans contre-indication, le régime de Yuzpe a naturellement été de moins en moins prescrit en France, jusqu’au retrait du Tétragynon
®
.
Lévonorgestrel, la fin des effets secondaires et des contre-indications, et le libre accès
Le lévonorgestrel est le seul progestatif qui ait été validé pour la contraception d’urgence. Initialement, le protocole utilisant cette molécule consistait en la prise de deux doses de 0,75 mg, à 12 h d’intervalle. Le taux d’échec de cette procédure, évalué dans l’étude princeps [
27
], était de 1,1 %. Le schéma a cependant été simplifié, avec une prise unique de 1,5 mg. Ce protocole s’est avéré aussi efficace que le protocole initial [
28
], mais beaucoup plus simple d’utilisation. Il est également nettement mieux toléré que la méthode originale de Yuzpe (avec une réduction du risque de nausée de 58 % et de vomissements de 77 %) [
29
].
La bonne tolérance du lévonorgestrel et l’absence de contre-indication absolue ont ainsi conduit à sa mise en vente libre en France en juin 1999, faisant franchir une nouvelle étape majeure dans l’accessibilité de la contraception d’urgence. Il présente cependant quelques inconvénients : un risque d’interaction médicamenteuse, et une possible réduction de son efficacité chez les femmes en surpoids. En effet, le risque de diminution d’efficacité du lévonorgestrel en cas de traitement par des inducteurs des enzymes CYP3A4 (Cytochrome P450 3A4) au cours des quatre dernières semaines avant sa prise, a conduit l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) à préconiser, en 2017, en cas de ce type de traitement, soit une utilisation d’une contraception d’urgence non hormonale, c’est-à-dire le DIU au cuivre, soit, si cette solution n’est pas possible, de doubler la dose standard de lévonorgestrel, de 1,5 mg à 3 mg. D’autres traitements peuvent également influer sur l’efficacité du lévonorgestrel. Rappelons en effet que les suppléments à base de plantes, comme le millepertuis, fortement dosés (plus de 1 mg par jour) en leur molécule active, l’hyperforine, peuvent également être à l’origine de tels effets [
30
]. Chez les femmes présentant un surpoids important, l’efficacité du lévonorgestrel est aussi potentiellement diminuée [
31
] ; la contraception d’urgence devra alors s’effectuer avec un autre choix.
Le mécanisme d’action du lévonorgestrel, dans le cadre d’une contraception d’urgence, repose sur son effet sur le décalage de l’ovulation [
32
]. Son efficacité reste cependant limitée à une administration strictement pré-ovulatoire. En effet, lorsqu’il est pris en présence d’un follicule dominant d’une taille comprise entre 12 et 17 mm, il inhibe l’ovulation dans 96 % des cas. Mais dès que le taux de LH (hormone lutéinisante)
7
a commencé d’augmenter [
33
], le lévonorgestrel est sans effet. Lorsque le follicule dominant atteint 18 à 20 mm (avec une ovulation attendue dans les 48 heures), il ne prévient en effet l’ovulation que dans 12 % des cas [
34
]. Prescrit au long cours, il agit sur la glaire cervicale, altérant la pénétration des spermatozoïdes, mais cet effet n’a pas été confirmé en contraception d’urgence.
Ulipristal acétate et mifépristone : une bonne tolérance et une efficacité majorée
La mifépristone et l’ulipristal acétate ont été évalués et sont utilisés à travers le monde pour la contraception d’urgence. L’ulipristal acétate est la seule molécule commercialisée en France dans l’indication de contraception d’urgence, depuis 2009, et autorisée à la vente sans prescription en 2015. Le principal mécanisme d’action de cette molécule, dans le contexte de la contraception d’urgence, semble être plus une interférence avec l’ovulation qu’un effet anti-implantatoire [
35
]. L’efficacité de ces deux molécules, aux doses de 25 à 50 mg pour la mifépristone, et de 30 mg pour l’ulipristal acétate, est équivalente ou supérieure à celle du lévonorgestrel [
33
] durant les premières heures suivant le rapport à risque de grossesse. L’ulipristal acétate, administré avant le début du pic de LH, retarde ou inhibe la rupture folliculaire, dans 100 % des cycles d’ovulation [
36
]. Il reste efficace lorsqu’il est administré après le début du pic de LH, retardant l’ovulation dans 79 % des cycles (
vs
14 % pour le lévonorgestrel et 10 % pour le placebo). En revanche, une fois le pic de LH atteint, l’ulipristal acétate, comme le lévonorgestrel, n’a plus d’effet sur l’ovulation. Dans un modèle murin, l’ulipristal acétate inhibe, au niveau ovarien, l’expression de gènes impliqués dans l’ovulation, gènes qui sont régulés par le récepteur de la progestérone [
36
]. À la dose utilisée en contraception d’urgence, l’ulipristal acétate n’a pas d’effet significatif sur la maturation sécrétoire de l’endomètre [
37
]. Il n’inhibe pas l’implantation de l’embryon dans un modèle humain
in vitro
[
38
]. Enfin, les études cliniques et de pharmacovigilance ne montrent pas d’augmentation du risque de fausse couche lors des grossesses survenues après prise d’ulipristal acétate en contraception d’urgence [
39
].
Le profil de tolérance de l’ulipristal acétate et de la mifépristone est équivalent à celui du lévonorgestrel [
29
]. Par rapport au lévonorgestrel, leur efficacité est allongée, jusqu’à 120 h après le rapport [
40
]. Néanmoins, une prise aussi précoce que possible reste préférable, l’efficacité de ces molécules diminuant avec le délai de prise après le rapport [
41
]. Chez les femmes en surpoids, contrairement à celle du lévonorgestrel, leur efficacité est maintenue, faisant préférer l’ulipristal acétate dans ce cas [
21
,
31
].
L’un de problèmes posés par ce mode de contraception d’urgence est la survenue d’un retard, parfois de plus de 7 jours, des règles suivantes. Cela peut constituer une source d’anxiété pour les femmes. La prise d’une contraception progestative, immédiatement après une contraception d’urgence, est également susceptible de diminuer l’efficacité de l’ulipristal acétate [
42
]. Il est donc recommandé aux femmes, sous contraception hormonale régulière, d’utiliser, si besoin est, une contraception d’urgence à base de lévonorgestrel plutôt que d’ulipristal acétate. Il est aussi déconseillé de débuter une contraception régulière juste après une contraception d’urgence par ulipristal acétate [
21
].
|
Perspectives : une contraception d’urgence efficace après l’initiation de l’ovulation ?
La prostaglandine E2 (PGE2) est un régulateur intra-folliculaire essentiel de l’ovulation ; des taux élevés de PGE2 intra-folliculaires sont en effet nécessaires à l’ovulation. Sa production et son métabolisme impliquent le contrôle de l’expression de nombreuses protéines, la localisation subcellulaire des enzymes qui la produisent, une synthèse et un métabolisme coordonnés, et un transport intra- et extracellulaire pour faciliter son action et sa dégradation (pour revue voir [
43
]).
Les anti-inflammatoires non stéroïdiens (AINS) de seconde intention, qui inhibent l’activité de l’enzyme à l’origine de la synthèse de la PGE2, la cyclooxygénase de type 2 (COX2), peuvent être à l’origine d’une inhibition de la rupture folliculaire, chez la souris [
44
], mais aussi chez les primates [
45
]. Chez la femme, ces AINS peuvent également provoquer une anomalie de la rupture folliculaire. Une étude pilote a en effet montré que le méloxicam, un AINS ciblant spécifiquement COX2, peut augmenter l’efficacité du lévonorgestrel en contraception d’urgence, notamment lorsque le processus ovulatoire a débuté [
46
]. Les inhibiteurs de cyclooxygénases sont en cours d’évaluation, en association avec le lévonorgestrel (ClinicalTrials.gov Identifier: NCT03614494). Les autres molécules participant à la synthèse et au métabolisme de la PGE2 pourraient également représenter des cibles potentielles pour la contraception [
43
].
|
Malgré les nombreuses avancées qui ont permis à la contraception d’urgence de devenir une méthode complémentaire pour limiter les risques de grossesse non désirée, son impact attendu sur le taux d’interruption volontaire de grossesse n’a pas été atteint [
1
], alors même que son accès a été largement facilité par la vente sans prescription médicale et sa mise à disposition dans les collèges. Des progrès nécessaires restent donc à réaliser pour mieux comprendre l’utilisation ou la non utilisation de la contraception d’urgence par les femmes. De nombreux freins, du côté des utilisatrices mais aussi des professionnels de santé, ont été identifiés [
1
]. Ils nécessitent d’être ôtés, afin que les femmes et les couples profitent de cet outil supplémentaire de lutte contre les grossesses non désirées.
La contraception d’urgence évolue constamment pour devenir plus accessible et mieux tolérée. Des progrès techniques mais aussi sociologiques restent néanmoins nécessaires pour accroître son efficacité et son acceptabilité. |
|
Footnotes |
1.
Faucher
P
.
Contraception d’urgence.
.
EMC-Gynécologie.
2018;
;
700-A-50
:
:1.
–
9
.
2.
Haspels
AA
.
Emergency contraception: a review.
.
Contraception.
1994;
;
50
:
:101.
–
108
.
3.
Morris
JM
,
Van
Wagenen G
.
Compounds interfering with ovum implantation and development. III. The role of estrogens.
.
Am J Obstet Gynecol.
1966;
;
96
:
:804.
–
801
.
4.
Yuzpe
AA
,
Thurlow
HJ
,
Ramzy
I
,
Leyshon
JI
.
Post coital contraception: a pilot study.
.
J Reprod Med.
1974;
;
13
:
:53.
–
61
.
5.
Kesserü
E
,
Larrañaga
A
,
Parada
J
.
Postcoital contraception with DLnorgestrel.
.
Contraception.
1973;
;
7
:
:367.
–
379
.
6.
Lippes
J
,
Tatum
HJ
,
Maulik
D
,
Sielezny
M
.
Postcoital copper IUDs.
.
Adv Plan Parent.
1979;
;
14
:
:87.
–
94
.
7.
Glasier
A
,
Thong
KJ
,
Dewar
M
,
et al.
Postcoital contraception with mifepristone.
.
Lancet.
1991;
;
337
:
:1414.
–
1415
.
8.
Finidori-Lepicard
J
,
Schorderet-Slatkine
S
,
Hanoune
J
,
Baulieu
EE
.
Steroid hormone as regulatory agent of adenylate cyclase. Inhibition by progesterone of the membrane-bound enzyme in Xenopus lævis oocytes.
.
Nature.
1981;
;
292
:
:255.
–
256
.
9.
Herrmann
W
,
Wyss
R
,
Riondel
A
,
Philibert
D
,
Teutsch
G
,
Sakiz
E
,
Baulieu
EE
.
The effects of an antiprogesterone steroid in women: interruption of the menstrual cycle and of early pregnancy.
.
CR Séances Acad Sci III.
1982;
;
294
:
:933.
–
938
.
10.
Creinin
MD
,
Schlaff
W
,
Archer
DF
,
et al.
Progesterone receptor modulator for emergency contraception: a randomized controlled trial.
.
Obstet Gynecol.
2006;
;
108
:
:1089.
–
1097
.
11.
Richter
R.
.
Ein mittelzur verhue-turng der konzeption.
.
Deutsch Med Wschr.
1909;
;
35
:
:1525.
–
1527
.
12.
Margulies
L.
.
History of intrauterine devices.
.
Bull NY Acad Med.
1975;
;
51
:
:662.
–
667
.
13.
Burnhill
MS
.
The rise and fall and rise of the IUD.
.
Am J Gynecol Health.
1989;
;
3
:
:6.
–
10
.
14.
Glasier
A
,
Thong
KJ
,
Dewar
M
,
et al.
Mifepristone (RU 486) compared with high-dose estrogen and progestogen for emergency postcoital contraception.
.
N Engl J Med.
1992;
;
327
:
:1041.
–
1044
.
15.
Grimes
DA
,
Cook
RJ
.
Mifepristone (RU 486) - an abortifacient to prevent abortion?
.
N Engl J Med.
1992;
;
327
:
:1088.
–
1089
.
16.
Turok
DK
,
Godfrey
EM
,
Wojdyla
D
,
et al.
Copper T380 intrauterine device for emergency contraception: highly effective at any time in the menstrual cycle.
.
Hum Reprod.
2013;
;
28
:
:2672.
–
2676
.
17.
Cleland
K
,
Zhu
H
,
Goldstuck
N
,
et al.
The efficacy of intrauterine devices for emergency contraception: a systematic review of 35 years of experience.
.
Hum Reprod.
2012;
;
27
:
:1994.
–
2000
.
18.
Black
KI
.
Developments and challenges in emergency contraception.
.
Best Pract Res Clin Obstet Gynaecol.
2009;
;
23
:
:221.
–
231
.
19.
INPES (Institut national de prévention et d’éducation pour la santé), AFSSAPS (Agence française de sécurité sanitaire des produits de santé), ANAES (Agence nationale d’accréditation et d’évaluation en santé).
.
Stratégies de choix des méthodes contraceptives chez la femme. Recommandations pour la pratique clinique.
.
Paris:
:
Agence Nationale d’Accréditation et d’Évaluation en Santé;
,
2004
:
:234.
p.
20.
Mishell
DR
,
Jr.
Intrauterine devices: mechanisms of action, safety, and efficacy.
.
Contraception.
1998;
;
58
:
:S45.
–
S53
.
21.
Chabbert-Buffet
N
,
Marret
H
,
Agostini
A
,
et al.
Contraception : recommandations pour la pratique clinique du CNGOF.
.
Gynecol Obstet Fertil Senol.
2018;
;
46
:
:760.
–
776
.
22.
Turok
DK
,
Sanders
JN
,
Thompson
IS
,
et al.
Preference for and efficacy of oral levonorgestrel for emergency contraception with concomitant placement of a levonorgestrel IUD: a prospective cohort study.
.
Contraception.
2016;
;
93
:
:526.
–
532
.
23.
Turok
DK
,
Gero
A
,
Simmons
RG
,
et al.
Levonorgestrel vs copper intrauterine devices for emergency contraception.
.
N Engl J Med.
2021;
;
384
:
:335.
–
44
.
24.
Trussell
J
,
Ellertson
C
,
Stewart
F
.
The effectiveness of the Yuzpe regimen of emergency contraception.
.
Fam Plann Perspect.
1996;
;
28
:
:58.
–
56
.
25.
Rodriguez
MI
,
Godfrey
EM
,
Warden
M
,
Curtis
KM
.
Prevention and management of nausea and vomiting with emergency contraception: a systematic review.
.
Contraception.
2013;
;
87
:
:583.
–
589
.
26.
Glasier
A.
.
Emergency postcoital contraception.
.
N Engl J Med.
1997;
;
337
:
:1058.
–
1064
.
27.
Task Force on Postovulatory Methods of Fertility Regulation.
Randomised controlled trial of levonorgestrel versus the Yuzpe regimen of combined oral contraceptives for emergency contraception.
.
Lancet.
1998;
;
352
:
:428.
–
433
.
28.
Von Hertzen
H
,
Piaggio
G
,
Ding
J
,
et al.
Low dose mifepristone and two regimens of levonorgestrel for emergency contraception: a WHO multicentre randomised trial.
.
Lancet.
2002;
;
360
:
:1803.
–
1810
.
29.
Thomin
A
,
Keller
V
,
Daraï
E
,
et al.
Consequences of emergency contraceptives: the adverse effects.
.
Expert Opin Drug Saf.
2014;
;
13
:
:893.
–
902
.
30.
Nicolussi
S
,
Drewe
J
,
Butterweck
V
,
et al.
Clinical relevance of St. John’s wort drug interactions revisited.
.
Br J Pharmacol.
2020;
;
177
:
:1212.
–
26
.
31.
Glasier
A
,
Cameron
ST
,
Blithe
D
,
et al.
Can we identify women at risk of pregnancy despite using emergency contraception? Data from randomized trials of ulipristal acetate and levonorgestrel.
.
Contraception.
2011;
;
84
:
:363.
–
367
.
32.
Croxatto
HB
,
Brache
V
,
Pavez
M
,
et al.
Pituitary-ovarian function following the standard Levonorgestrel emergency contraceptive dose or a single 075-mg dose given on the days preceding ovulation.
.
Contraception.
2004;
;
70
:
:442.
–
450
.
33.
Brache
V
,
Cochon
L
,
Deniaud
M
,
et al.
Ulipristal acetate prevents ovulation more effectively than levonorgestrel: analysis of pooled data from three randomized trials of emergency contraception regimens.
.
Contraception.
2013;
;
88
:
:611.
–
618
.
34.
Marions
L
,
Cekan
SZ
,
Bygdeman
M
,
et al.
Effect of emergency contraception with levonorgestrel or mifepristone on ovarian function.
.
Contraception.
2004;
;
69
:
:373.
–
377
.
35.
Gemzell-Danielsson
K
,
Mandl
I
,
Marions
L
.
Mechanisms of action of mifepristone when used for emergency contraception.
.
Contraception.
2003;
;
68
:
:471.
–
476
.
36.
Nallasamy
S
,
Kim
J
,
Sitruk-Ware
R
,
Bagchi
M
,
Bagchi
I
.
Ulipristal blocks ovulation by inhibiting progesterone receptor-dependent pathways intrinsic to the ovary.
.
Reprod Sci.
2013;
;
20
:
:371.
–
381
.
37.
Stratton
P
,
Levens
ED
,
Hartog
B
,
Piquion
J
,
Wei
Q
,
Merino
M
,
Nieman
LK
.
Endometrial effects of a single early luteal dose of the selective progesterone receptor modulator CDB-2914.
.
Fertil Steril.
2010;
;
93
:
:2035.
–
2041
.
38.
Berger
C
,
Boggavarapu
NR
,
Menezes
J
,
Lalitkumar
PG
,
Gemzell-Danielsson
K
.
Effects of ulipristal acetate on human embryo attachment and endometrial cell gene expression in an in vitro co-culture system.
.
Hum Reprod.
2015;
;
30
:
:800.
–
811
.
39.
Levy
DP
,
Jager
M
,
Kapp
N
,
Abitbol
JL
.
Ulipristal acetate for emergency contraception: postmarketing experience after use by more than 1 million women.
.
Contraception.
2014;
;
89
:
:431.
–
433
.
40.
Glasier
AF
,
Cameron
ST
,
Fine
PM
,
et al.
Ulipristal acetate versus levonorgestrel for emergency contraception: a randomised non-inferiority trial and meta-analysis.
.
Lancet.
2010;
;
375
:
:555.
–
562
.
41.
Moreau
C
,
Trussell
J
.
Results from pooled Phase III studies of ulipristal acetate for emergency contraception.
.
Contraception.
2012;
;
86
:
:673.
–
680
.
42.
Brache
V
,
Cochon
L
,
Duijkers
IJ
,
et al.
A prospective, randomized, pharmacodynamic study of quick-starting a desogestrel progestin-only pill following ulipristal acetate for emergency contraception.
.
Hum Reprod.
2015;
;
30
:
:2785.
–
2793
.
43.
Duffy
DM
.
Novel contraceptive targets to inhibit ovulation: the prostaglandin E2 pathway.
.
Hum Reprod Update.
2015;
;
21
:
:652.
–
670
.
44.
Wang
PH
,
Horng
HC
,
Chen
YJ
,
et al.
Effect of a selective nonsteroidal anti-inflammatory drug, celecoxib, on the reproductive function of female mice.
.
J Chin Med Assoc.
2007;
;
70
:
:245.
–
248
.
45.
McCann
NC
,
Lynch
TJ
,
Kim
SO
,
et al.
The COX-2 inhibitor meloxicam prevents pregnancy when administered as an emergency contraceptive to nonhuman primates.
.
Contraception.
2013;
;
88
:
:744.
–
748
.
46.
Massai
MR
,
Forcelledo
ML
,
Brache
V
,
et al.
Does meloxicam increase the incidence of anovulation induced by single administration of levonorgestrel in emergency contraception?
.
A pilot study. Hum Reprod.
2007;
;
22
:
:434.
–
439
.
|