| |
| Med Sci (Paris). 37(8-9): 759–772. doi: 10.1051/medsci/2021094.COVID-19, des vaccins à la vitesse de l’éclair Yanis Feraoun,1 Pauline Maisonnasse,1 Roger Le Grand,1 and Anne-Sophie Beignon1* 1Immunologie des maladies virales, auto-immunes, hématologiques et bactériennes (IMVA-HB), Département IDMIT (Infectious Disease Models and Innovative Therapies), UMR 1184, Université Paris-Saclay, Unité Inserm 1184, CEA
,
18 route du Panorama
,
92265Fontenay-aux-Roses
,
France |
Vignette (Photo © Philippe Roingeard et Sébastien Eymieux, Université de Tours, France).
Le nouveau coronavirus SARS-CoV-2 (
severe acute respiratory syndrome-coronavirus 2
) provoque la maladie COVID-19 (
coronavirus disease 2019
). Depuis la déclaration de l’Organisation mondiale de la santé (OMS) le 11 mars 2020 indiquant que la COVID-19 pouvait être qualifiée de pandémie, et malgré des mesures sanitaires sans précédent adoptées dans le monde entier, le Centre pour la science des systèmes et l’ingénierie (
Center for Systems Science and Engineering
[CSSE]
)
de l’université Johns Hopkins à Baltimore, aux États-Unis, dénombrait, au 26 mai 2021, 167 971 509 cas confirmés de COVID-19 et 3 488 625 morts dans le monde, dont 5 671 892 cas et 109 054 décès en France [
1
].
Les difficultés majeures rencontrées pour contrôler la circulation de ce virus et ainsi limiter la propagation des infections et la maladie (ses formes sévères, longues ou mortelles) sont à l’origine d’une crise inédite des services de soins. Elles sont dues au mode de transmission aéroportée du virus et à la contagiosité des patients infectés qui l’ignorent, sujets asymptomatiques et futurs malades symptomatiques avant l’apparition de tout symptôme. Pour rompre la chaîne de transmission du virus, le dépistage et l’isolement des patients et des cas contact (les personnes ayant été en contact avec une personne infectée) se sont avérés efficaces, mais il est difficile de maintenir cette stratégie sur le long terme.
D’une façon générale, la vaccination, qui consiste à immuniser les individus contre l’agent infectieux responsable de la maladie, présente de nombreux avantages pour lutter contre les épidémies : c’est une stratégie de prévention de masse, réalisable à un coût supportable pour la société, et qui protège à moyen ou long terme, en fonction de la durée de la mémoire immunitaire que le vaccin induit. Après une seule année de mise au point et de développement, une durée aussi courte étant sans précédent dans l’histoire du développement d’un vaccin, plusieurs vaccins se sont révélés être efficaces contre la maladie COVID-19 induite par le SARS-CoV-2, et ont reçu en urgence une autorisation de mise sur le marché (AMM) conditionnelle
1
par les autorités de santé pour vacciner les populations, tandis que plusieurs autres sont en cours d’évaluation au moment de l’écriture de cet article.
Cette revue fait le point actuel (fin avril 2021) sur les vaccins autorisés ou proches de l’être
2
, les raisons de leur développement rapide, leurs modes d’action et leurs caractéristiques, et présente les nombreuses questions qui restent en suspens.
|
Un développement accéléré des vaccins
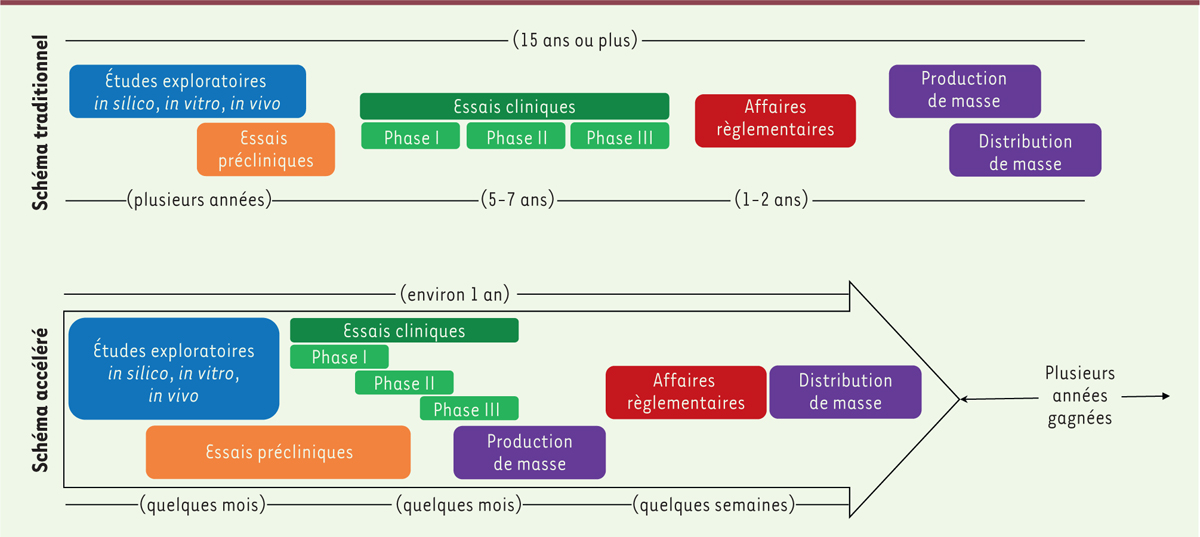
Le développement d’un vaccin comprend différentes étapes, qui demandent habituellement une quinzaine d’années avant sa mise sur le marché. Cette longue durée de développement est due aux nombreuses études précliniques menées chez l’animal, suivies d’études cliniques chez l’homme, allant d’études de phase I à des études de phase III. De plus, des études de pharmacovigilance sont requises une fois l’autorisation de mise sur le marché du vaccin obtenue, afin de confirmer son innocuité et son efficacité
(
Figure 1
)
.
 | Figure 1.
Comparaison des schémas de développement de vaccins traditionnels et accélérés.
Le développement de vaccins traditionnels prend une quinzaine d’années, entre les phases de découverte précoces et la production de masse. Le développement de vaccins contre le SARS-CoV-2 suit un calendrier accéléré. Des essais de phases I et II ont rapidement été lancés. Les essais de phase III ont été lancés après l’analyse intermédiaire des résultats des essais de phases I et II, avec plusieurs étapes d’essais cliniques menées en parallèle. La production à grande échelle de plusieurs candidats vaccins a commencé en prenant des risques industriels et financiers importants, avant même leur autorisation de mise sur le marché. Les procédures réglementaires ont également été accélérées.
|
Pour répondre à l’urgence sanitaire mondiale pour lutter contre la pandémie de COVID-19, des efforts sans précédent de collaboration entre laboratoires, ainsi que de très importants efforts financiers, ont été déployés afin d’accélérer la mise au point et l’évaluation de vaccins candidats. La mise au point de ces vaccins a aussi été facilitée par les résultats obtenus lors d’essais effectués antérieurement avec des vaccins élaborés contre deux autres coronavirus ayant précédemment causé des épidémies de pneumopathies graves, le SARS-CoV-1 et le MERS-CoV (pour
Middle East Respiratory Syndrome CoronaVirus
ou coronavirus du syndrome respiratoire du Moyen-Orient). Cette mise au point a également bénéficié de développements techniques majeurs en vaccinologie, issus de recherches visant à développer des vaccins contre d’autres microorganismes pathogènes émergents, voire contre des cancers (mise au point de vaccins à ARNm, de vaccins à vecteur viral, ou utilisation de nouveaux adjuvants).
La séquence du génome viral a été publiée le 24 janvier 2020 [
2
] et différents modèles animaux susceptibles au virus infectant l’homme et qui reproduisent la pathogenèse de l’infection humaine ont alors été mis au point extrêmement rapidement pour évaluer des traitements et des stratégies de prévention [
3
]. Les essais cliniques de phase III de ces vaccins candidats (qui évaluent leur efficacité et le rapport bénéfices/risques sur de grandes cohortes d’individus), habituellement entrepris seulement après l’obtention des résultats des essais cliniques de phases I/II (qui évaluent l’innocuité et l’immunogénicité des vaccins et définissent la dose à utiliser lors de la phase III), ont débuté dès l’analyse des résultats intermédiaires des phases I/II. En complément de ces essais cliniques contrôlés et randomisés, un modèle d’infection expérimentale contrôlée de volontaires sains (18-30 ans) par le SARS-CoV-2 a par ailleurs récemment été approuvé au Royaume-Uni
3,
, afin de mieux comprendre la pathogenèse de la maladie
4
, une approche qui a fait l’objet de nombreux débats bioéthiques.
|
Quelle immunité induire ?
Un vaccin idéal devrait empêcher, pour toute la vie, à un prix abordable pour la société et en une seule injection, toute infection par le virus ciblé, même asymptomatique, quels que soient l’âge et l’état de santé de la personne vaccinée. L’objectif minimal, initialement fixé par l’OMS, la FDA (
Food and Drug Administration
) américaine et l’AEM (Agence européenne des médicaments) en Europe, était de disposer d’un vaccin sûr et en quantités suffisantes pour vacciner largement et rapidement la population, et capable de réduire d’au moins de moitié les hospitalisations dues à la maladie. Cette dernière année a montré que cet objectif pouvait être sans doute atteint en un court laps de temps. Il est cependant évident que les recherches doivent être poursuivies, afin d’atteindre ce vaccin idéal, sachant que si un vaccin bloquait efficacement la transmission du virus, cela protègerait même les sujets non vaccinés, dans le cas d’une couverture vaccinale suffisante de la population.
Seuls les anticorps dits neutralisants, qui empêchent l’entrée du virus dans les cellules cibles en se liant à la protéine virale responsable de la fixation du virus aux cellules, conduisent à une immunité dite « stérilisante » : ces anticorps protègent l’individu de toute infection, car ils bloquent l’entrée du virus dans les cellules. Néanmoins, les anticorps dits non neutralisants, y compris ceux qui reconnaissent d’autres antigènes viraux, ainsi que d’autres acteurs de la réponse immunitaire antivirale, comme les lymphocytes T CD8
+
(qui reconnaissent les cellules infectées et les détruisent), contribuent aussi à la protection contre la maladie.
Comprendre les différences entre marqueurs immunologiques que l’on observe à la suite d’une exposition à un pathogène, et les mécanismes immunologiques qui sont corrélés à la protection contre la maladie et contre la réinfection, est un élément très important pour le développement rationnel d’un vaccin, mais cela s’avère assez complexe.
Dans le cas de l’infection par le SARS-CoV-2, les mécanismes immunitaires mis en jeu contre la transmission du virus, l’infection des cellules et le développement de la maladie ne sont pas clairement identifiés. Les patients qui guérissent de la maladie COVID-19 développent une réponse immunitaire, marquée par l’activation de lymphocytes B qui, différenciés en plasmocytes, produisent alors des anticorps dirigés contre le spicule du virus (la protéine S ou
spike
) et contre d’autres protéines virales, mais aussi par la stimulation de lymphocytes T CD4
+
spécifiques et de lymphocytes T CD8
+
cytotoxiques pour les cellules infectées. On sait aussi désormais que la mémoire immunitaire induite par l’infection naturelle par le virus est maintenue pendant au moins 8 mois [
4
]. Elle semble être protectrice contre une réinfection. Mais la durée de cette protection reste inconnue, et nous ignorons toujours si cette réponse est stérilisante. De plus, de nombreuses questions restent à ce jour sans réponse, comme celle de savoir si la présence d’anticorps neutralisants suffit à bloquer l’infection et celle de définir le titre minimal de ces anticorps qui confère une protection, ou celle de savoir si d’autres fonctions de ces anticorps sont impliquées dans la résistance à l’infection. Le rôle joué par les lymphocytes T reste également à déterminer. Si les anticorps neutralisants s’avéraient insuffisants ou insuffisamment persistants pour maintenir la résistance au virus, les lymphocytes T mémoire résidents dans le tractus respiratoire pourraient participer à la protection contre une réinfection, directement [
5
], mais aussi indirectement, en coopérant avec les lymphocytes B pour que ces derniers produisent de nouveaux anticorps.
Un vaccin efficace contre l’infection par le SARS-CoV-2 pourrait induire une immunité comparable à celle induite par une infection naturelle par le virus, mais elle pourrait aussi offrir une protection différente, et en particulier plus large,
via
d’autres mécanismes. La majorité des vaccins visent à induire des anticorps neutralisant l’entrée du SARS-CoV-2 dans les cellules cibles, en empêchant les interactions entre sa protéine d’enveloppe, la protéine S, et son récepteur cellulaire, ACE2 (
angiotensin-converting enzyme 2
), qui est exprimé par les cellules de l’hôte, notamment par les cellules épithéliales nasales, les cellules de la trachée et les pneumocytes. Il est donc important de développer des vaccins capables d’induire une réponse immunitaire muqueuse forte, qui permette de bloquer la pénétration du virus dans ces cellules, dès son entrée dans les voies respiratoires, sa principale porte d’entrée dans l’organisme.
|
Les vaccins contre la COVID-19
Le 6 avril 2021, l’OMS comptabilisait plus de 200 vaccins en développement préclinique, 86 en développement clinique, dont 23 en phases II/III ou III, et 12 autorisés à l’échelle mondiale pour la vaccination de la population [
6
,
7
]. Du jamais vu !
Cela s’explique sans aucun doute par les efforts de développement considérables qui ont été fournis par les laboratoires, mais également par la forte sensibilité du virus aux anticorps neutralisants qui a été constatée. Si l’on compare cette mobilisation à celle réalisée pour lutter contre l’infection par le VIH (virus de l’immunodéficience humaine), le premier essai clinique d’un vaccin contre ce virus avait été réalisé en 1987, le virus ayant été identifié en 1983. L’investissement des laboratoires à cette époque a pourtant été sans équivalent dans l’histoire des vaccins (à ce jour, un millier de candidats vaccins ont été évalués chez l’homme, dont 6 en phases IIb/III). Pourtant, aucun ne s’est révélé efficace, essentiellement en raison des propriétés de ce virus qui lui permettent d’échapper aux anticorps neutralisants et, également, en raison de la complexité des mécanismes de l’immunité mis en jeu lors de cette infection.
Les vaccins développés contre la COVID-19 reposent sur des approches diversifiées
(
Tableau I
)
. Les résultats des essais cliniques sur leur efficacité ont été publiés pour les vaccins à ARN messager (ARNm) produits par
Pfizer/BioNTech
(BTN162b ou Comirnaty®) [
8
] et par
Moderna
(mRNA-1273) (co-développé avec l’Institut national des maladies allergiques et infectieuses [
National Institute of Allergy and Infectious Diseases, NIAID
] des Instituts nationaux de la santé [
National Institutes of Health, NIH
] américains) [
9
], et pour le vaccin d’
Oxford/AstraZeneca
(AZD1222, ChAdOx1-S, ou Covishield® ou VAXZEVRIA®) utilisant comme vecteur un adénovirus (AdV) de chimpanzé (ChAdV) [
10
], de même pour celui produit par le
Gamaleya Research Institute
en Russie (Sputnik V) utilisant deux AdV humains (HAdV) de sérotypes 26 et 5 [
11
] et pour le vaccin de
Janssen/Johnson & Johnson
(Ad26.COV2.S), qui utilise l’AdV humain de sérotype 26 [
12
]
(
Tableau II
)
. Mais pour d’autres vaccins, autorisés dans certains pays, comme les vaccins inactivés de
Sinovac Biotech
(CoronaVac) et
Sinopharm
(BBIBP-CorV), deux entreprises localisées en République populaire de Chine, les données d’efficacité restent pour l’instant discutées
5
.
Tableau I.
| Plateforme |
Avantages |
Inconvénients |
Exemples |
|
Vaccin à ARNm
*
|
Nombreuses possibilités d’« ingénierie » génétique pour élaborer des antigènes vaccinaux sophistiqués
Facilité de production à large échelle, à un coût raisonnable, et de manière totalement synthétique sans avoir recours à des cultures cellulaires, ce qui accroit leur pureté et innocuité
Pouvoir immunogène élevé et moins réactogène que les vaccins à vecteurs viraux
Possibilité d’auto-amplification (
self amplifying RNA vaccines
) qui permettrait d’éviter les rappels
|
Fragilité des ARNm et difficulté de leur conservation nécessitant des températures très basses
Coût plus élevé que d’autres types de vaccins
Jamais testé précédemment sur l’ensemble de la population |
Vaccins candidats contre la rage, la grippe, le virus Zika, le cytomégalovirus |
|
Vaccin utilisant des adénovirus
|
Production à grande échelle possible
Induction de fortes réponses lymphocytaires B et T |
Éventuelle pré-immunité contre certains adénovirus (AdV) chez une partie de la population
Réactogénicité
Jamais testé précédemment sur l’ensemble de la population |
Vaccins candidats contre le MERS-CoV, le VIH/sida, le virus Ebola, le virus respiratoire syncitial, de l’hépatite C, de la grippe, le Chikungunya, et contre certains cancers |
|
Vaccin protéique
|
Plateforme couramment utilisée (pour le virus de l’hépatite B)
Méthodes de production bien maîtrisées et ne nécessitant pas de manipuler le virus
Preuve d’efficacité contre différentes maladies infectieuses et d’innocuité pour différentes catégories de population, y compris les personnes âgées, les enfants et les femmes enceintes, approche intéressante pour étendre la vaccination à certaines classes d’âge et aux personnes vulnérables |
Plusieurs rappels peuvent être nécessaires pour stimuler le système immunitaire
Doivent généralement être combinés avec des adjuvants
Le spicule de SARS-CoV-2 est difficile à produire et purifier, ce qui augmente le coût de production et limite pour le moment les possibilités d’une production rapide à grande échelle |
Vaccins contre l’hépatite B, le paludisme (RTS,S)
Vaccins candidats contre le VIH/sida |
|
Vaccin à ADN
|
Production simple et à grande échelle
Excellente stabilité |
Faible immunogénicité – Jamais testé précédemment sur l’ensemble de la population
Pour être efficaces, des méthodes particulières de délivrance et d’adressage, comme des nanoparticules et l’électroporation, sont nécessaires |
Vaccins candidats contre le VIH/sida, le virus Zika, de la Dengue, de la grippe, le paludisme, le HSV-2 et contre certains cancers |
|
Vaccin utilisant un virus inactivé
|
Très communément utilisé
Développement simple
Réponse immunitaire plus complète que celle des vaccins ne ciblant qu’un seul antigène, donc meilleure protection attendue, notamment en cas de mutation du virus |
Nécessité de manipuler le virus et de travailler en laboratoire de niveau de sécurité adapté
Rendement de production dépendant du virus
Nécessite généralement un ou des rappels
Doit être utilisé avec des adjuvants |
Vaccins contre l’hépatite A, la grippe, la poliomyélite |
| Plateforme |
Avantages |
Inconvénients |
Exemples |
|
Vaccin utilisant un virus vivant atténué
|
Longue histoire d’utilisation réussie
Initie une réponse en mimant une infection par le virus naturel et en exposant un maximum d’antigènes
Rentable pour la production de masse
Immunisation à dose unique
Protection forte et à long terme
Ne nécessite pas d’adjuvants
Peut engendrer une protection croisée contre d’autres pathogènes par induction d’immunité entraînée
Peut être administré par voie muqueuse |
Utilisation limitée chez les immunodéprimés en raison de potentiels problèmes de sécurité
Nécessité de manipuler le virus et de travailler en laboratoire de niveau 3
Rendement de production dépendant du virus
La conservation peut être moins simple que celles des vaccins inactivés ou protéiques |
Vaccins contre la fièvre jaune, la rougeole, la varicelle/zona, la tuberculose (BCG) |
Les caractéristiques des différentes plateformes vaccinales utilisées pour les vaccins contre la COVID-19.
*Les premières générations de vaccins à ARNm ont eu une utilisation limitée du fait de leur dégradation rapide à température ambiante et par les enzymes de l’hôte, et de la forte réponse IFN de type I de l’organisme après injection, qui diminuait leur traduction en protéines. Des «
ruses techniques
» récentes ont permis en partie de contrer ce pouvoir immunogène intrinsèque des ARNm, ainsi que leur dégradation, et d’augmenter la capture peu efficace des ARNm par les cellules, notamment en modifiant les nucléosides et en incorporant l’ARNm modifié dans des nanoparticules lipidiques. Ces progrès techniques expliquent le succès des vaccins à ARNm dans la course contre la COVID-19. Les problèmes de stabilité ne sont pas encore totalement résolus. MERS-CoV : coronavirus du syndrome respiratoire du Moyen-Orient.
|
Tableau II.
| Type |
ARNm |
Adénovirus |
Inactivé |
Protéique |
| Nom du vaccin |
Comirnaty |
mRNA-1273 |
Sputnik V |
VaxZevria |
Ad26COV2.S |
CoronaVac |
BBIBP-CorV |
NVX-CoV2373 |
|
| Entreprise / Université |
Pfizer BioNTech |
Moderna NIAID |
Gamaleya Research Institute |
AstraZeneca Oxford |
Johnson & Johnson |
Sinovac |
Sinopharm |
Novavax |
|
| Vecteur |
Nanoparticule lipidique |
Nanoparticule lipidique |
AdV5 puis AdV26 |
ChAdOx1 |
AdV26 |
Aucun |
Aucun |
Aucun |
|
| Cible |
Spicule entier / préfusion* |
Spicule entier / préfusion* |
Spicule entier native |
Spicule entier native |
Spicule entier / préfusion* |
Virus entier |
Virus entier |
Spicule entier / préfusion* recombinant stabilisé et sous forme de nanoparticule |
|
| Adjuvant |
Aucun |
Aucun |
Aucun |
Aucun |
Aucun |
Alum |
Alum |
Matrix-M |
|
| Dose |
30 μg |
100 μg |
10
11
PV
|
5 × 10
10
PV
|
10
11
PV
|
3 ou 6 μg |
5 μg |
5 μg |
|
| Injections |
2 |
2 |
2 |
2
£
|
1 |
2 |
2 |
2 |
| Semaines d’intervalle |
3 |
4 |
3 |
4-12 |
|
2 ou 4 |
2 ou 3 |
3 |
|
| Voie |
Intramusculaire |
Intramusculaire |
Intramusculaire |
Intramusculaire° |
Intramusculaire |
Intramusculaire |
Intramusculaire |
Intramusculaire |
|
| Conservation |
4 °C : 5 jours – 80 °C : 6 mois |
4 °C : 30 jours – 20 °C : 6 mois |
4 °C |
4 °C : 6 mois |
4 °C |
- |
- |
- |
|
|
Données disponibles sur les phases III d’essais cliniques
|
|
| Références essais |
NCT04368728 |
NCT04470427 |
NCT04530396 |
ISRCTN89951424 |
NCT04505722 |
NCT04456595 |
NCT04560881 |
NCT04611802 |
|
|
|
|
NCT04324606 |
|
|
NCT04510207 |
NCT04583995 |
|
|
|
|
NCT04400838 |
|
|
|
NCT04533399 |
|
|
|
|
NCT04444674 |
|
|
|
|
| Dates des essais |
Juillet-Nov 2020 |
Juillet-Oct 2020 |
Sept-Nov 2020 |
Avril-Nov 2020 |
Sept 2020-Jan 2021 |
En cours |
En cours |
En cours |
| N= |
43 548 |
30 420 |
21 977 |
11 636 |
39 321 |
– |
– |
– |
| Multinational |
Oui |
Non, États-Unis |
Non, Moscou |
Oui |
Oui |
Non, Brésil |
Oui |
Oui |
| Contre placebo |
Oui |
Oui |
Oui |
Oui |
Oui |
Oui |
Oui |
Oui |
| Double-aveugle |
Oui |
Oui |
Oui |
Oui |
Oui |
Oui |
Oui |
Non |
| Critère d’efficacité principal |
COVID-19 (infection symptomatique) 7 jours après la 2
e
dose
|
COVID-19 (infection symptomatique) 14 jours après la 2
e
dose
|
COVID-19 (infection symptomatique) 21 jours après la 1
re
dose
|
COVID-19 (infection symptomatique) 14 jours après la 2
e
dose
|
COVID-19 modérée à sévère 28 jours après immunisation
◊
|
COVID-19 (infection symptomatique) 14 jours après la 2
e
dose
|
COVID-19 (infection symptomatique) 14 jours après la 2
e
dose
|
COVID-19 (infection symptomatique) 7 jours après la 2
e
dose
|
| Efficacité |
95 % |
94,1 % |
91,6 % |
70,4 %
§
|
66,1 % |
– |
– |
– |
| Référence |
[
8
]
|
[
9
]
|
[
11
]
|
[
10
]
|
[
12
]
|
|
|
|
|
| Effets secondaires sévères y compris rares et très rares |
Anaphylaxie
#
|
Anaphylaxie
#
|
Aucun déclaré au mois d’avril 2021 |
Thromboses atypiques très rares chez des individus principalement de moins de 60 ans |
Thromboses atypiques très rares chez des individus prin- cipalement de moins de 60 ans |
Aucun déclaré au mois d’avril 2021 |
Aucun déclaré au mois d’avril 2021 |
Aucun déclaré au mois d’avril 2021 |
|
|
Efficacité clinique contre les variants
|
|
| B.1.1.7 |
85 % |
|
|
70,4 % (comparé à 81,5 % contre les lignées non-B.1.1.7) |
74,4 % |
|
|
|
| B.1.351 |
|
|
|
10,4 % |
52 % |
|
|
|
| P.2 |
|
|
|
|
66,2 % |
|
|
|
| Référence |
[
58
]
|
|
|
[
60
,
61
]
|
[
12
]
|
|
|
|
|
|
Efficacité de neutralisation
in vitro
relative à la souche ancestrale
[
39
]
|
|
| B.1.1.7 |
Baisse de 2x |
Baisse de 1,8x |
nt |
nt |
nt |
nt |
nt |
Baisse de 1,8x |
| B.1.351 |
Baisse de 6,5x |
Baisse de 8,6x |
nt |
Baisse de 86x à 100x |
nt |
nt |
Baisse de 1,6x |
nt |
| B.1.1.28.1 |
Baisse de 6,5x |
Baisse de 4,5x |
nt |
nt |
nt |
nt |
nt |
nt |
Précisions sur certains vaccins contre la COVID-19 actuellement autorisés ou à un stade avancé d’étude clinique.
nt : non testé ; PV : particules virales ; RBD : domaine de la protéine virale S se liant au récepteur cellulaire ACE2 ; - : information non disponible. *Le spicule entier est stabilisé dans une forme qui mime sa conformation naturelle lors de son attachement à la cellule avant fusion de l’enveloppe du virus avec la membrane cellulaire, première étape du processus d’infection. #Les cas d’anaphylaxie, qui se traitent efficacement, interviennent dans moins de 10 cas par million de doses et pourraient être liés à la présence d’anticorps dirigés contre le polyéthylène glycol (PEG) présents dans les nanoparticules lipidiques. Néanmoins, cela reste à être démontré.
§
Des limites méthodologiques n’avaient pas permis de déterminer avec précision l’efficacité suivant les classes d’âge. Toutefois, des données récentes du
Public Health Scotland
issues de la campagne de vaccination en Écosse montrent que ce vaccin réduit de 81 % le risque d’hospitalisation chez les plus de 80 ans.
£
La France recommande désormais d’utiliser les vaccins à ARNm disponibles pour l’administration de la 2
e
dose chez les personnes de moins de 55 ans ayant reçu une 1
re
dose du vaccin VAXZEVRIA®, avec un intervalle de 12 semaines entre les doses. °Une nouvelle formulation permettant une administration par voie intranasale est en cours d’évaluation. ◊L’efficacité a également été testée contre les infections asymptomatiques sur la base d’une séroconversion mesurée par dosage immunologique des anticorps dirigés contre la protéine N du SARS-CoV-2, absente du vaccin, 71 jours après immunisation. Elle s’élève à 65,5 % [
12
].
|
Les mécanismes moléculaires et cellulaires mis en jeu dans l’induction de la réponse immunitaire innée, puis de la réponse acquise, diffèrent entre les vaccins [
13
-
15
]. Cela explique des différences quantitatives et qualitatives d’efficacité et d’innocuité, qui peuvent être difficiles à prévoir, et justifient d’évaluer tous les candidats lors d’essais précliniques puis cliniques et, en cas de résultats en-deçà des objectifs visés, l’abandon de leur développement. Il est par ailleurs difficile de comparer les efficacités des différents vaccins, puisque les essais réalisés ont impliqué différentes populations immunisées à différents moments de la pandémie, en présence ou non de variants viraux, et que les méthodes d’analyse ne sont pas rigoureusement identiques.
Dans la suite de cette revue, nous détaillons les différents types de vaccins dont les avantages et les inconvénients sont présentés dans le
Tableau I
. Les caractéristiques des vaccins approuvés, ou dont les dossiers de demande d’autorisation sont actuellement en cours d’examen par la FDA et/ou l’AEM sont répertoriées dans le
Tableau II
.
|
Étudiés et testés depuis plusieurs années dans le cadre de différentes stratégies vaccinales, les vaccins à ARNm utilisent les acides ribonucléiques messagers (ARNm) viraux. D’une façon générale, les ARNm sont le matériel génétique intermédiaire dans le processus d’expression des gènes. Dans nos cellules, les ARNm sont produits par transcription à partir de notre ADN et sont traduits en protéines. La première description de traduction d’une protéine réussie
in vivo
après injection de l’ARNm la codant date de 1990 [
16
]. Ce succès sera suivi, en 1993, par l’utilisation
in vivo
, dans un modèle murin, d’ARNm codant la nucléoprotéine du virus influenza encapsulé dans des liposomes, pour induire une immunité
via
la génération de lymphocytes T CD8
+
spécifiques du virus, ouvrant la voie à une utilisation vaccinale des ARNm [
17
].
L’ARNm contenu dans les vaccins anti-COVID-19 est produit par la transcription
in vitro
avec l’ARN polymérase T7, d’une séquence d’ADN (synthétique ou clonée dans un ADN plasmidique) codant la protéine S du virus. L’ARNm étant d’une façon générale très instable, diverses modifications ont été introduites dans la structure de celui-ci pour accroître cette stabilité. Cet ARNm est ensuite formulé dans des nanoparticules lipidiques (
lipid nanoparticles, LNP
) qui seront injectées. Suite à cette injection, les cellules, en particulier les cellules immunitaires présentant l’antigène (ou CPA) de la personne vaccinée qui ont ingéré les particules contenant cet ARNm, le traduisent grâce à leur machinerie cellulaire. La protéine antigénique virale (dans le cas des vaccins Comirnaty et mRNA-1273, le spicule du SARS-CoV-2) ainsi produite dans ces cellules va permettre à ces dernières de déclencher une réponse immunitaire spécifique. Les vaccins à ARNm sont particulièrement efficaces pour activer les lymphocytes B situés dans les centres germinatifs des ganglions lymphatiques, et induire leur différenciation en plasmocytes
6
producteurs d’anticorps ayant une longue durée de vie, ainsi qu’en lymphocytes B mémoire spécifiques du virus [
18
].
Bien qu’aucun vaccin à ARNm n’ait été autorisé avant la pandémie de COVID-19, le pouvoir immunogène et l’innocuité de ces nouveaux vaccins avaient cependant été démontrés précédemment dans des essais cliniques de phase I contre la rage et la grippe [
19
,
20
]. Les vaccins à ARNm de
Pfizer/BioNTech
et de
Moderna
(NIAID), prototypes de cette nouvelle génération de vaccins, ont rapidement été autorisés (AMM conditionnelles) et sont désormais utilisés dans de nombreux pays pour lutter contre la pandémie de COVID-19.
|
Les vaccins fondés sur les adénovirus
Ces vaccins sont fondés sur des virus différents du SARS-CoV-2 et sont utilisés comme vecteurs de délivrance de l’ADN codant la protéine S du SARS-CoV-2. Il s’agit d’adénovirus (AdV) modifiés génétiquement, dans lesquels la séquence d’ADN codant la protéine S a été introduite, mais qui ne peuvent se répliquer du fait de la délétion de certaines séquences de leurs génomes impliquées dans la réplication. Ces vecteurs adénoviraux sont en fait dérivés de virus qui nous causent des rhumes saisonniers ; ils sont donc capables d’infecter les cellules humaines, mais ils ont été rendus inoffensifs. Le matériel génétique de ces AdV sera utilisé comme matrice pour faire produire la protéine S du SARS-CoV-2 par les cellules qu’ils infectent. Ces 20 dernières années, cette stratégie a été évaluée contre plusieurs maladies infectieuses, lors d’essais précliniques et cliniques. Elle permet d’induire des réponses anti-virales
via
des lymphocytes B producteurs d’anticorps et des lymphocytes T cytotoxiques capables de détruire les cellules infectées, spécifiques des protéines virales codées par l’adénovirus utilisé et qui sont produites par les cellules infectées. Cette stratégie s’est avérée prometteuse lors de nombreux essais, malgré un échec constaté pour un candidat vaccin contre le virus d’immunodéficience humaine (VIH) [
21
]. Cependant, une partie de la population, du fait des infections saisonnières causées par les adénovirus dont ils sont dérivés, possède une immunité préexistante contre certains de ces vecteurs adénoviraux, comme l’AdV de sérotype 5 (AdV5). Cette immunité peut partiellement neutraliser ces adénovirus, limitant ainsi leur efficacité. Afin de contourner cette réponse immunitaire naturelle anti-AdV5, des adénovirus de sérotypes plus rares (comme l’AdV26) ou infectant d’autres espèces de primates, comme le chimpanzé (ChAd), peuvent être utilisés. Plusieurs vaccins fondés sur des AdV ont été développés contre la COVID-19 et sont autorisés dans plusieurs pays. Les AdV utilisés peuvent être différents selon ces vaccins : l’HAdV5nCov pour la firme chinoise
CanSino Biologics
[
22
], les HAdV26 et 5 pour le vaccin du
Gamaleya Research Institute
russe (Gam-Covid-Vac, ou Sputnik V) [
11
], le ChAdOx1 pour le vaccin développé par l’université britannique d’Oxford et la firme anglo-suédoise
AstraZeneca
(Covishield®) [
10
], et l’AdV26.COV2.S pour la filiale pharmaceutique de la compagnie américaine
Johnson & Johnson, Janssen
[
23
]. Un vaccin élaboré par
ReiThera
en Italie, utilisant un AdV de gorille (GRAdCOV2), a passé avec succès les essais cliniques de phase I (en janvier 2021). Il devrait prochainement entrer en phases II et III.
Les schémas vaccinaux diffèrent : une seule injection dans le cas de l’HAdV26 de
Johnson & Johnson, Janssen,
deux injections répétées du même vaccin dans le cas du ChAd
d’Oxford/AstraZeneca
(on parle alors de primo-vaccination suivie de rappel homologue), et deux injections d’AdV de sérotypes différents (HAdV26 et HAdV5) mais codant le même antigène, dans le cas du Sputnik V du
Gamaleya Research Institute
(on parle alors de primo-vaccination suivie de rappel hétérologue). Répéter l’immunisation a pour but d’augmenter le nombre de répondeurs parmi les vaccinés. Le choix de la dose unique pour le vaccin
Johnson & Johnson, Janssen
a été guidé par les résultats des essais cliniques de phases I/II qui comparaient une ou deux doses [
24
,
25
]. Toutefois, sur la base de résultats récents obtenus dans un modèle de primates non humains [
26
], un essai vaccinal actuellement en cours (NCT04614948) vise à évaluer un schéma vaccinal comprenant deux doses. Le changement de vecteur vaccinal, comme dans le cas du vaccin Sputnik V, entre la primo-vaccination et le rappel, vise à contourner l’immunité anti-vecteur mise en place après la primo-vaccination, afin d’avoir un rappel plus efficace.
|
Ce type de vaccin utilise le virus SARS-CoV-2 comme principe actif, mais inactivé. Il n’est donc plus infectieux, mais présente la plupart des caractéristiques antigéniques du virus infectieux malgré cette inactivation. Ces vaccins sont fabriqués en faisant d’abord produire le virus
in vitro
par des cellules, généralement des cellules Vero (des cellules de rein de singe vert africain). Les virus ainsi produits sont alors inactivés, généralement par la chaleur [
27
,
28
]. Ces vaccins engendrent une réponse immunitaire dirigée contre toutes les protéines virales conservées lors de l’inactivation, réponse qui est donc plus large que celle induite par les vaccins n’utilisant qu’une partie des antigènes viraux. L’entreprise chinoise
Sinovac Biotech
a rapidement lancé des essais cliniques avec un vaccin inactivé [
29
]. D’autres entreprises et universités chinoises, indiennes et kazakhes se sont engagées dans la fabrication de ce type de vaccins. La société nantaise
Valneva
a développé également un vaccin utilisant un virus SARS-CoV-2 inactivé chimiquement par la b-propiolactone, ce qui permet de préserver la structure 3D initiale de la protéine S, et ayant une forte densité de cette protéine à sa surface (VLA2001). Ce vaccin est produit en Écosse par les cellules Vero. Le vaccin contient en outre deux adjuvants
7
, l’alum et le CpG 1018, ce qui favorise et améliore une réponse immunitaire de type Th1. Cette société franco-autrichienne a annoncé le 1
er
février 2021 que le gouvernement britannique venait d’exercer son option pour la fourniture de 40 millions de doses de vaccin supplémentaires, qui viennent s’ajouter aux 60 millions de doses déjà commandées.
|
Ces vaccins reposent, pour la plupart, sur l’utilisation de la protéine de spicule (S), ou de la région de cette protéine impliquée dans l’attachement du virus à son récepteur cellulaire, le RBD (
receptor-binding domain
), comme immunogène. Ces protéines et peptides (RBD) sont produits
in vitro
sous la forme de molécules recombinantes, par transfection du matériel génétique viral codant la séquence protéique dans différents types de cellules : des cellules d’insectes, de mammifères, de levures, de plantes, ou des bactéries comme
Escherichia coli
. Le type de cellules utilisées influence le rendement de la production de la protéine, mais détermine aussi les modifications post-traductionnelles que cette dernière est susceptible de subir, en particulier la N-glycosylation. Plusieurs vaccins utilisant des protéines recombinantes sont en cours de développement préclinique et certains sont déjà en essai clinique [
7
], dont celui de
Novavax
[
30
] et, bien qu’ayant pris du retard, celui de
Sanofi
, allié à
Glaxo Smith Kline
(GSK), qui repose sur la production de la protéine S recombinante dans des cellules d’insecte par un système de baculovirus (un virus à ADN spécifique des insectes). Pour induire une réponse rapide et efficace, ces vaccins nécessitent généralement un adjuvant et des rappels. Il est aussi possible d’accroître l’amplitude et la durée de la réponse induite par ces protéines, par exemple en associant, par recombinaison génétique, la séquence de l’antigène viral à celle de molécules permettant d’améliorer le ciblage de la protéine recombinante vers des cellules spécialisées dans l’initiation de la réponse immunitaire, comme les cellules dendritiques (DC). Une telle approche est développée en France par l’Institut de recherche vaccinale (VRI, Vaccine Research Institute), sous l’égide de l’ANRS Maladies infectieuses émergentes et l’UPEC (Université Paris-Est Créteil). Elle consiste à « greffer » à la séquence de l’antigène viral, un anticorps dirigé contre une molécule présente à la surface des DC, comme CD40
8,
, afin que la protéine virale soit spécifiquement dirigée vers ces cellules et présentée efficacement aux lymphocytes T pour initier une réponse immunitaire adaptative aboutissant à la production de lymphocytes T cytotoxiques et d’anticorps par les plasmocytes. Des essais réalisés chez le primate non humain ont récemment montré l’efficacité de cette stratégie
9
, et des essais de phases I/II sont en cours de mise en place.
Utilisées comme support pour la présentation de protéines virales, les nanoparticules, dont certaines peuvent mimer une structure virale (VLP pour
virus-like particle
), sont également évaluées dans des essais cliniques. Cette approche est développée par plusieurs équipes, comme celle de l’Institut de biologie structurale et de la direction de la recherche technologique du CEA, qui élabore des nanostructures de lipides synthétiques afin d’y insérer des protéines du spicule ou d’y encapsuler des vaccins à ADN.
|
Les autres types de vaccins D’autres types de vaccins utilisant divers vecteurs viraux, non réplicatifs ou réplicatifs, des vaccins vivants atténués, ou des vaccins à ADN, sont également en cours de développement.
Par exemple, certains sont dérivés de virus causant d’autres maladies. Ils sont modifiés pour exprimer le spicule du SARS-CoV-2. L’évaluation de l’un d’eux, fondé sur l’utilisation du vaccin contre la rougeole comme vecteur d’expression, développé par l’Institut Pasteur, a été arrêtée après des essais cliniques de phase I. Un autre, utilisant le virus influenza de la grippe comme vecteur, est en essai clinique de phase I. D’autres vaccins contre la COVID-19 utilisant des virus animaux qui ne se répliquent pas chez l’homme, comme le VSV (
vesicular stomatitis virus
), un arbovirus transmis au bétail pouvant être potentiellement utilisé pour les administrations intranasales, ou le horsepox, virus responsable de la variole des équidés, ou le NDV (
Newcastle disease virus
), virus de la peste aviaire, sont en cours de développement [
7
,
31
]
10
.
Des vaccins utilisent le SARS-CoV-2 lui-même, mais génétiquement modifié pour que sa réplication, et donc la maladie, soient réduites, sans pour autant diminuer la réponse immunitaire qu’il induit. Le virus est dans ce cas « atténué », grâce à sa production dans des conditions de température ou dans des types cellulaires défavorables, ou par l’introduction de mutations génétiques dans une séquence clé pour sa réplication [
32
,
33
].
Des vaccins dits vaccins à ADN sont également en cours d’élaboration. Ils sont fondés sur une séquence d’ADN (cloné dans un plasmide produit par des bactéries comme
E. coli
) codant la protéine S du virus, directement injectée par transfection dans des cellules de l’hôte, qui le transcrivent alors en un ARNm traduit en protéine S. Quatre vaccins à ADN contre le SARS-CoV-2, dont un est développé par l’Institut Pasteur, sont actuellement en phases I/II d’essais.
|
De nouveaux concepts en immunologie
De nouveaux concepts ont été également explorés dans le cadre de la lutte contre l’infection par le SARS-CoV-2. Il s’agit d’approches d’immunostimulation qui pourraient favoriser la résistance de l’hôte à l’infection. L’une des hypothèses testées consiste en l’induction d’une mémoire immunitaire différente de la mémoire « classique », qui est spécifique d’un antigène et due aux lymphocytes B et T. Son principe est d’induire une mémoire immunitaire dans les cellules impliquées dans l’immunité innée, comme les monocytes et les neutrophiles [
34
]. Ce concept, appelé
trained immunity
, ou immunité entraînée, est apparu récemment en immunologie. Les cellules innées appelées « entraînées », longtemps après activation avec certains stimulus inflammatoires, répondent mieux que des cellules naïves qui n’ont pas été « entraînées », à un nouveau stimulus, qui peut être différent du premier. Elles assurent ainsi une première ligne de défense qui se révèle plus efficace. Elles pourraient également améliorer la mise en place de la deuxième ligne de défense acquise, assurée par les lymphocytes et spécifique de l’antigène. Les effets non spécifiques observés avec certains vaccins qui protègent au-delà des microorganismes pathogènes contre lesquels ils ont été développés, pourraient résulter en partie de l’induction d’une telle immunité « entraînée » [
35
]. D’abord mise en évidence en réponse aux b-glucanes, des structures sucrées retrouvées dans la paroi des levures comme
Candida albicans
, cette immunité, qui repose sur des modification épigénétiques, a été retrouvée après activation de cellules innées par le bacille de Calmette-Guérin (BCG), utilisé pour prévenir la tuberculose. Des résultats encourageants d’un essai clinique, réalisé avant la pandémie, montrent que des personnes âgées étaient mieux protégées contre plusieurs types d’infections, en particulier respiratoires, dans l’année qui suit leur vaccination par le BCG [
36
]. Plusieurs essais sont en cours pour déterminer si le BCG confère effectivement une protection contre la COVID-19.
|
Les variants du SARS-CoV-2
Le SARS-CoV-2, comme d’autres virus dont le génome est constitué d’un ARN, est la cible de mutations lors de sa réplication [
37
]. Aléatoires, certaines de ces mutations peuvent lui permettre d’échapper à la réponse immunitaire, et peuvent améliorer la réplication virale, par exemple en modifiant la protéine S du virus responsable de sa liaison aux cellules de l’hôte. Actuellement, il est néanmoins difficile de prévoir si les vaccins qui ont été développés continueront d’être protecteurs vis-à-vis de ces nouveaux et futurs variants viraux. L’apparition récente des variants B.1.1.7, au Royaume-Uni, B.1.351, en Afrique du Sud, et B.1.1.28.1 (P1) au Brésil est ainsi préoccupante, en raison de leurs nombreuses mutations, essentiellement dans le gène codant leur spicule, mais aussi en raison de leur capacité de transmission, qui s’avère accrue par rapport au virus originel. Les variants « d’Afrique du Sud » (B.1.351) et « brésilien » (B.1.1.28.1) sont d’autant plus préoccupants qu’ils montrent,
in vitro
, une relative résistance à la neutralisation par les anticorps isolés de patients convalescents infectés par les virus à l’origine de la pandémie qui circulaient en 2019 et 2020 [
38
]
11,
. Ils sont également résistants à l’action des sérums des sujets vaccinés avec les vaccins qui ciblent le SARS-CoV-2 originel [
39
]. Il est donc probable que les vaccins initiaux nécessiteront d’être actualisés périodiquement, sans doute comme c’est le cas pour le vaccin contre la grippe saisonnière. Les industriels commencent déjà à évaluer des vaccins dirigés contre certains de ces variants [
40
].
Contrairement aux anticorps, les réponses lymphocytaires T induites lors de l’infection ou après vaccination [
41
-
43
] ne semblent pas cibler, par leur TCR (récepteur antigénique des lymphocytes T), les régions antigéniques qui sont mutées dans les protéines exprimées par les nouveaux variants [
44
]
12
. Cela suggère que ces cellules exercent une pression immunitaire sur le virus qui serait moindre que celle des anticorps. Leur rôle dans la protection pourrait donc être moins importante. Pourtant les lymphocytes T, en particulier les lymphocytes T CD8
+
, qui ont un rôle dans l’immunité antivirale en détruisant les cellules infectées porteuses d’antigènes viraux, semblent importants dans la réponse contre le SARS-CoV-2. Cela a en effet été montré par des expériences dans lesquelles ces cellules ont été déplétées chez des macaques convalescents, sept semaines après leur première infection, et chez lesquels une forte diminution de la protection induite par l’immunisation naturelle contre la ré-infection a été observée [
45
].
Les lymphocytes T pourraient également servir de deuxième ligne de défense contre la réplication incontrôlée d’un variant viral qui aurait échappé à la neutralisation par les anticorps (ou lorsque la réponse humorale diminue avec le temps). Des vaccins induisant de fortes réponses lymphocytaires T et ciblant des antigènes viraux autres que la protéine S, la nucléocapside et la protéine d’enveloppe, par exemple, pourraient donc s’avérer d’un intérêt majeur pour la protection contre les variants présents et à venir. Des vaccins pan-coronavirus, induisant des anticorps neutralisants à large spectre et/ou dirigés contre des épitopes T conservés entre virus, sont d’ailleurs en cours de développement. Quel que soit le virus, celui-ci ne mute que s’il se réplique et se transmet. C’est pourquoi il est particulièrement important de vacciner rapidement et massivement la population afin de « prendre les variants de vitesse ». |
Une maladie exacerbée par la vaccination ?
Des craintes d’une possible exacerbation de la maladie chez les individus vaccinés (
vaccine-associated enhanced disease
ou VAED), comme cela a été observé historiquement pour certains virus pathogènes comme le virus respiratoire syncitial (VRS) ou le virus West Nile, ont été exprimées à propos du SARS-CoV-2. Des effets de type VAED ont en effet été observés pour d’autres coronavirus dans des études réalisées chez l’animal, qu’il s’agisse d’une infection naturelle chez le chat par des coronavirus félins, ou lors d’essais précliniques de vaccination contre le SARS-CoV-1 [
46
] ou le MERS-CoV (coronavirus du syndrome respiratoire du Moyen-Orient) [
47
]. Différents mécanismes pourraient être impliqués. Une forte réponse lymphocytaires T CD4
+
de type Th2 pourrait limiter la réponse des lymphocytes T CD8
+
capables d’éliminer les cellules infectées. Une réponse humorale produisant une faible quantité d’anticorps neutralisants pourrait également faciliter l’infection des cellules plutôt que l’empêcher. Dans ce mécanisme, appelé
Antibody-Dependent Enhancement
ou ADE, des anticorps spécifiques d’antigènes viraux, qui reconnaissent le virus sans pour autant le neutraliser, favoriseraient sa fixation à des cellules exprimant des récepteurs pour la région Fc des immunoglobulines (RFc) chargées de l’éliminer par phagocytose, comme les macrophages. Le virus ainsi fixé à la membrane de la cellule
via
l’anticorps, pourrait l’infecter plutôt que d’être phagocyté et détruit. Ce processus augmenterait le taux d’infection des cellules cibles, et pourrait inhiber la réponse antivirale des cellules innées alors infectées. Il pourrait également accentuer la réponse inflammatoire en stimulant les cellules innées et interférer avec la balance Th1/Th2, qui est en partie sous le contrôle de ces cellules. Le complément pourrait également accroître les effets de ces anticorps responsables d’une ADE, comme cela avait été montré dans l’infection par le VIH. L’analyse des données actuelles chez l’homme ne suggère cependant pas de risques de VAED avec les vaccins contre le SARS-CoV-2, ceux-ci n’augmentant pas, mais réduisant l’infection et la maladie des personnes vaccinées. Il reste néanmoins important de surveiller les réponses des sujets qui ont été vaccinés contre le virus originel et qui sont réinfectés par les nouveaux variants viraux qui ne seraient pas neutralisés.
|
Changer la dose et le calendrier de vaccination et combiner différents vaccins ?
Les premiers essais cliniques ont testé l’efficacité et l’innocuité des vaccins à ARNm, des vaccins utilisant les vecteurs adénoviraux (ChAdOX1 et HAdV26/HAdV5) à une dose déterminée
13
et suivie d’un rappel vaccinal dans un délai unique. Dans l’urgence d’une vaccination de grande ampleur, la possibilité de réduire les doses injectées, de retarder le rappel de vaccination ou d’utiliser un vaccin différent pour le rappel pour accroître rapidement le nombre d’individus vaccinés, en attendant la montée en puissance des capacités de production a été envisagée.
Les essais de phase IIII qui ont été réalisés n’étaient pas conçus pour évaluer l’efficacité de protection avec une seule dose de vaccin, à l’exception du vaccin de
Janssen
(
Johnson&Johnson
). Cependant, le suivi des populations déjà vaccinées a montré que les vaccins à ARN de
Pfizer/BioNTech
et de
Moderna
, NIAID offrent une protection précoce et importante contre l’infection, dès 12 et 14 jours après une primovaccination. Retarder le rappel de vaccination permettrait de vacciner plus de personnes et ainsi de réduire plus rapidement le nombre de malades et de décès. Ce délai de revaccination pourrait également permettre de moduler la réponse immunitaire secondaire et donc d’améliorer l’efficacité de protection, en améliorant l’intensité et/ou la qualité des réponses immunitaires, comme le montrent des études réalisées chez l’homme et chez l’animal avec différents types de vaccins [
14
,
15
,
48
,
49
], mais sans que les mécanismes ne soient encore très bien compris. En effet, la fréquence, le phénotype et les fonctions des lymphocytes B et T mémoire initialement sensibilisés dépendent de la date de leur rencontre initiale avec l’antigène (y compris leur capacité à être restimulés et à engendrer des cellules sécrétrices d’anticorps/effectrices et mémoire après un rappel) [
50
-
52
]. Par ailleurs, le délai entre les immunisations joue aussi un rôle clé (en plus de la nature du vaccin) sur la présence au moment du rappel de vaccination de cellules innées entrainées, induites par la primo-vaccination, au moment du rappel de vaccination, et sur la participation de ces cellules à une meilleure restimulation des cellules mémoire primaires [
53
,
54
]. Avec le vaccin d’
Oxford/AstraZeneca
, utilisant un adénovirus comme vecteur, l’efficacité après une seule dose est de 76 %, du jour 22 après injection au jour 90 [
10
]. L’efficacité du vaccin s’avère supérieure avec un rappel tardif : 81,3 % pour un rappel après plus de 12 semaines, contre 55,1 % pour un rappel réalisé à moins de 6 semaines après la première injection [
55
]. Un essai clinique évaluant une primo-vaccination suivie d’un rappel hétérologue avec le vaccin d’
Oxford/AstraZeneca
et celui de
Pfizer/BioNTech
, dans différents ordres, et à différents intervalles, devrait être entrepris prochainement. Il s’agit là de pallier les manques de doses de vaccins, mais aussi de répondre aux problèmes de thrombopénie et de thrombose de type « thrombopénie induite par l’héparine » après injection de vaccins utilisant des adénovirus (
Oxford/AstraZeneca
,
Janssen/Johnson & Johnson
). Le rappel utilisant un vaccin à ARNm permettrait sans doute de minimiser ces effets secondaires, même si ceux-là sont très rares et ne touchent que peu de personnes (1 pour 1 000 000).
|
Le développement rapide des vaccins en réponse à la pandémie de COVID-19 a été un succès sans précédent. Les observations réalisées à la suite des infections naturelles ou des vaccinations ont montré que les anticorps neutralisants étaient déterminants pour la protection contre la maladie. Le taux d’anticorps anti-virus nécessaires pour une protection optimale n’est pas encore clairement défini et la persistance dans le temps de ces anticorps n’est pas connue à ce jour.
Les vaccins à ARNm, qui représentent une première dans la conception de nouveaux vaccins, se sont révélés efficaces contre l’infection symptomatique par le SARS-CoV-2, comme l’ont montré les essais cliniques de phase III et les observations en « vie réelle ». Des études récentes montrent qu’ils protègent également de l’infection asymptomatique et plus généralement de l’infection [
56
-
58
]. L’impact que les vaccins auront sur la pandémie ne dépend pas seulement de leur efficacité de protection, qui est aussi fonction de la population vaccinée considérée (selon les comorbidités, l’âge, la grossesse ou l’allaitement) [
59
]
14
. Il repose également sur leur efficacité contre les variants viraux actuels mais aussi à venir, sur la durée de protection qu’ils induisent, et sur leur innocuité à long terme. Le nombre de personnes et la vitesse à laquelle elles seront vaccinées est un élément clé de la réussite face à cette pandémie. Or, au 5 février 2021, 75 % des vaccinations mondiales avaient été réalisées dans 10 pays, alors que 130 pays n’avaient inoculé aucun vaccin contre la COVID-19.
À l’échelle mondiale, la production du nombre de doses nécessaires pour vacciner l’ensemble de la population (tout en maintenant la production des autres vaccins…), les coûts de production et de vente, mais aussi les problèmes stratégiques de conservation des vaccins (notamment la température très basse nécessaire pour conserver les vaccins à ARN) sont également des paramètres à prendre en considération pour une lutte efficace contre la maladie et un accès équitable, mondial, et rapide aux vaccins. Le manque de données sur la transmission secondaire du virus par les sujets qui ont déjà été vaccinés, mais qui seraient infectés sans développer de symptômes, impose pour le moment que, même après la vaccination, les gestes barrières, qui limitent la propagation du virus, restent nécessaires.
Bien que très efficaces, les vaccins gagnants de cette première étape de la lutte contre la COVID-19 restent perfectibles. L’induction d’une immunité muqueuse et/ou T CD8
+
efficace et la prolongation des réponses immunitaires dans le temps à l’aide d’adjuvants restent un défi.
|
Anne-Sophie Beignon a participé au développement préclinique de vaccins fondés sur les vecteurs lentiviraux avec Pierre Charneau, de 2005 à 2012, à l’Institut Pasteur, et est co-inventeure de plusieurs brevets sur des vaccins. Elle bénéficie d’une subvention pour ses recherches sur les vaccins induisant une mémoire innée du programme Sanofi Innovation Award Europe 2020.
Yanis Feraoun, Pauline Maisonnasse, Roger Le Grand déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
2.
Zhu
N
,
Zhang
D
,
Wang
W
,
et al.
A novel coronavirus from patients with pneumonia in China, 2019.
.
N Engl J Med.
2020;
;
382
:
:727.
–
33
.
3.
Muñoz-Fontela
C
,
Dowling
WE
,
Funnell
SGP
,
et al.
Animal models for COVID-19.
.
Nature.
2020;
;
586
:
:509.
–
15
.
4.
Dan
JM
,
Mateus
J
,
Kato
Y
,
et al.
Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection.
.
Science.
2021
;
:371.
.
5.
Snyder
ME
,
Farber
DL
.
Human lung tissue resident memory T cells in health and disease.
.
Curr Opin Immunol.
2019;
;
59
:
:101.
–
108
.
8.
Polack
FP
,
Thomas
SJ
,
Kitchin
N
,
et al.
Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine.
.
N Engl J Med.
2020;
;
383
:
:2603.
–
15
.
9.
Baden
LR
,
El Sahly
HM
,
Essink
B
,
et al.
Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine.
.
N Engl J Med.
2021;
;
384
:
:403.
–
16
.
10.
Voysey
M
,
Clemens
SAC
,
Madhi
SA
,
et al.
Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK.
.
Lancet.
2021;
;
397
:
:99.
–
111
.
11.
Logunov
DY
,
Dolzhikova
IV
,
Shcheblyakov
DV
,
et al.
Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia.
.
Lancet.
2021;
;
397
:
:671.
–
81
.
12.
Sadoff
J
,
Gray
G
,
Vandebosch
A
,
et al.
Safety and efficacy of single-dose Ad26.COV2.S vaccine against Covid-19.
.
N Engl J Med.
2021
; doi:
10.1056/NEJMoa2101544
.
13.
Pulendran
B
,
Ahmed
R
.
Immunological mechanisms of vaccination.
.
Nat Immunol.
2011;
;
12
:
:509.
–
517
.
14.
Sallusto
F
,
Lanzavecchia
A
,
Araki
K
,
et al.
From vaccines to memory and back.
.
Immunity.
2010;
;
33
:
:451.
–
463
.
15.
Siegrist
CA
.
2 - Vaccine immunology.
. In :
Plotkin
SA
,
Orenstein
WA
,
Offit
PA
, editors
Vaccines.
. 6
th
ed.
London:
:
W.B. Saunders;
,
2013
:
:14.
–
32
.
16.
Wolff
JA
,
Malone
RW
,
Williams
P
,
et al.
Direct gene transfer into mouse muscle in vivo.
.
Science.
1990;
;
247
:
:1465.
–
1468
.
17.
Martinon
F
,
Krishnan
S
,
Lenzen
G
,
et al.
Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA.
.
Eur J Immunol.
1993;
;
23
:
:1719.
–
1722
.
18.
Lederer
K
,
Castaño
D
,
Gómez Atria
D
,
et al.
SARS-CoV-2 mRNA vaccines foster potent antigen-specific germinal center responses associated with neutralizing antibody generation.
.
Immunity.
2020;
;
53
:
:1281.
–
1295.e5
.
19.
Alberer
M
,
Gnad-Vogt
U
,
Hong
HS
,
et al.
Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial.
.
Lancet.
2017;
;
390
:
:1511.
–
1520
.
20.
Feldman
RA
,
Fuhr
R
,
Smolenov
I
,
et al.
mRNA vaccines against H10N8 and H7N9 influenza viruses of pandemic potential are immunogenic and well tolerated in healthy adults in phase 1 randomized clinical trials.
.
Vaccine.
2019;
;
37
:
:3326.
–
3334
.
21.
Buchbinder
SP
,
Mehrotra
DV
,
Duerr
A
,
et al.
Efficacy assessment of a cell-mediated immunity HIV-1 vaccine (the Step Study): a double-blind, randomised, placebo-controlled, test-of-concept trial.
.
Lancet.
2008;
;
372
:
:1881.
–
1893
.
22.
Zhu
FC
,
Guan
XH
,
Li
YH
,
et al.
Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial.
.
Lancet.
2020;
;
396
:
:479.
–
88
.
23.
Mercado
NB
,
Zahn
R
,
Wegmann
F
,
et al.
Single-shot Ad26 vaccine protects against SARS-CoV-2 in rhesus macaques.
.
Nature.
2020;
;
586
:
:583.
–
8
.
24.
Stephenson
KE
,
Le Gars
M
,
Sadoff
J
,
et al.
Immunogenicity of the Ad26.COV2.S vaccine for COVID-19.
.
JAMA.
2021;
;
325
:
:1535.
–
44
.
25.
Sadoff
J
,
Le Gars
M
,
Shukarev
G
,
et al.
Interim results of a Phase 1–2a trial of Ad26.COV2.S Covid-19 vaccine.
.
N Engl J Med.
2021
;
NEJMoa2034201.
. doi:
10.1056/NEJMoa2034201
.
26.
Solforosi
L
,
Kuipers
H
,
Jongeneelen
M
,
et al.
Immunogenicity and efficacy of one and two doses of Ad26.COV2.S COVID vaccine in adult and aged NHP.
.
J Exp Med.
2021;
;
218
:
:e20202756.
.
27.
Wang
H
,
Zhang
Y
,
Huang
B
,
et al.
Development of an inactivated vaccine candidate, BBIBP-CorV, with potent protection against SARS-CoV-2.
.
Cell.
2020;
;
182
:
:713.
–
21.e9
.
28.
Gao
Q
,
Bao
L
,
Mao
H
,
et al.
Development of an inactivated vaccine candidate for SARS-CoV-2.
.
Science.
2020;
;
369
:
:77.
–
81
.
29.
Zhang
Y
,
Zeng
G
,
Pan
H
,
et al.
Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18–59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial.
.
Lancet Infect Dis.
2021;
;
21
:
:181.
–
92
.
30.
Keech
C
,
Albert
G
,
Cho
I
,
et al.
Phase 1–2 trial of a SARS-CoV-2 recombinant spike protein nanoparticle vaccine.
.
N Engl J Med.
2020;
;
383
:
:2320.
–
32
.
31.
Rohaim
MA
,
Munir
M
.
A scalable topical vectored vaccine candidate against SARS-CoV-2.
.
Vaccines (Basel).
2020;
;
8
:
:472.
.
32.
Talon
J
,
Salvatore
M
,
O’Neill
RE
,
et al.
Influenza A and B viruses expressing altered NS1 proteins: a vaccine approach.
.
Proc Natl Acad Sci USA.
2000;
;
97
:
:4309.
–
4314
.
33.
Broadbent
AJ
,
Santos
CP
,
Anafu
A
,
et al.
Evaluation of the attenuation, immunogenicity, and efficacy of a live virus vaccine generated by codon-pair bias de-optimization of the 2009 pandemic H1N1 influenza virus, in ferrets.
.
Vaccine.
2016;
;
34
:
:563.
–
570
.
34.
Curtis
N
,
Sparrow
A
,
Ghebreyesus
TA
,
et al.
Considering BCG vaccination to reduce the impact of COVID-19.
.
Lancet.
2020;
;
395
:
:1545.
–
1546
.
35.
de Bree
LCJ
,
Koeken
VACM
,
Joosten
LAB
,
et al.
Non-specific effects of vaccines: current evidence and potential implications.
.
Semin Immunol.
2018;
;
39
:
:35.
–
43
.
36.
Giamarellos-Bourboulis
EJ
,
Tsilika
M
,
Moorlag
S
,
et al.
Activate: randomized clinical trial of BCG vaccination against infection in the elderly.
.
Cell.
2020;
;
183
:
:315.
–
23.e9
.
38.
Wang
Z
,
Schmidt
F
,
Weisblum
Y
,
et al.
mRNA vaccine-elicited antibodies to SARS-CoV-2 and circulating variants.
.
Nature.
2021;
;
592
:
:616.
–
22
.
39.
Abdool Karim
SS
,
Oliveira
T
de
.
New SARS-CoV-2 variants - clinical, public health, and vaccine implications.
.
N Engl J Med.
2021
;
NEJMc2100362.
.
40.
National Institute of Allergy and Infectious Diseases (NIAID).
.
Phase 1, open-label, randomized study of the safety and immunogenicity of a SARS-CoV-2 variant vaccine (mRNA-1273.351) in naïve and previously vaccinated adults.
.
clinicaltrials.gov, 2021.
.
41.
Sahin
U
,
Muik
A
,
Derhovanessian
E
,
et al.
COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses.
.
Nature.
2020;
;
586
:
:594.
–
9
.
42.
Jackson
LA
,
Anderson
EJ
,
Rouphael
NG
,
et al.
An mRNA Vaccine against SARS-CoV-2 - Preliminary report.
.
N Engl J Med.
2020;
;
383
:
:1920.
–
31
.
43.
Ewer
KJ
,
Barrett
JR
,
Belij-Rammerstorfer
S
,
et al.
T cell and antibody responses induced by a single dose of ChAdOx1 nCoV-19 (AZD1222) vaccine in a phase 1/2 clinical trial.
.
Nat Med.
2021;
;
27
:
:270.
–
8
.
44.
Woldemeskel
BA
,
Garliss
CC
,
Blankson
JN
.
SARS-CoV-2 mRNA vaccines induce broad CD4
+
T cell responses that recognize SARS-CoV-2 variants and HCoV-NL63
.
.
J Clin Invest.
2021
;
:149335.
.
45.
McMahan
K
,
Yu
J
,
Mercado
NB
,
et al.
Correlates of protection against SARS-CoV-2 in rhesus macaques.
.
Nature.
2021;
;
590
:
:630.
–
4
.
46.
Bolles
M
,
Deming
D
,
Long
K
,
et al.
A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge.
.
J Virol.
2011;
;
85
:
:12201.
–
12215
.
47.
Agrawal
AS
,
Tao
X
,
Algaissi
A
,
et al.
Immunization with inactivated Middle East respiratory syndrome coronavirus vaccine leads to lung immunopathology on challenge with live virus.
.
Hum Vaccin Immunother.
2016;
;
12
:
:2351.
–
2356
.
48.
Roozendaal
R
,
Hendriks
J
,
Effelterre
T
van
,
et al.
Nonhuman primate to human immunobridging to infer the protective effect of an Ebola virus vaccine candidate.
.
npj Vaccines.
2020;
;
5
:
:1.
–
11
.
49.
Ledgerwood
JE
,
Zephir
K
,
Hu
Z
,
et al.
Prime-boost interval matters: a randomized phase 1 study to identify the minimum interval necessary to observe the H5 DNA influenza vaccine priming effect.
.
J Infect Dis.
2013;
;
208
:
:418.
–
422
.
50.
Martin
MD
,
Badovinac
VP
.
Defining memory CD8 T cell.
.
Front Immunol.
2018;
;
9
:
:2692.
.
51.
Weisel
F
,
Shlomchik
M
.
Memory B cells of mice and humans.
.
Annu Rev Immunol.
2017;
;
35
:
:255.
–
284
.
52.
Taylor
JJ
,
Jenkins
MK
,
Pape
KA
.
Heterogeneity in the differentiation and function of memory B cells.
.
Trends Immunol.
2012;
;
33
:
:590.
–
597
.
53.
Palgen
J-L
,
Tchitchek
N
,
Rodriguez-Pozo
A
,
et al.
Innate and secondary humoral responses are improved by increasing the time between MVA vaccine immunizations.
.
NPJ Vaccines.
2020;
;
5
:
:1.
–
16
.
54.
Palgen
JL
,
Feraoun
Y
,
Dzangué-Tchoupou
G
,
et al.
Optimize prime/boost vaccine strategies: trained immunity as a new player in the game.
.
Front Immunol.
2021;
;
12
:
:612747.
.
55.
Voysey
M
,
Costa Clemens
SA
,
Madhi
SA
,
et al.
Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials.
.
Lancet.
2021;
;
397
:
:881.
–
91
.
56.
Thompson
MG
,
Burgess
JL
,
Naleway
AL
,
et al.
Interim estimates of vaccine effectiveness of BNT162b2 and mRNA-1273 COVID-19 vaccines in preventing SARS-CoV-2 infection among health care personnel, first responders, and other essential and frontline workers - Eight U.S. locations, December 2020-March 2021.
.
MMWR Morb Mortal Wkly Rep.
2021;
;
70
:
:495.
–
500
.
57.
Amit
S
,
Regev-Yochay
G
,
Afek
A
,
et al.
Early rate reductions of SARS-CoV-2 infection and COVID-19 in BNT162b2 vaccine recipients.
.
Lancet.
2021;
;
397
:
:875.
–
7
.
58.
Hall
VJ
,
Foulkes
S
,
Saei
A
,
et al.
COVID-19 vaccine coverage in health-care workers in England and effectiveness of BNT162b2 mRNA vaccine against infection (SIREN): a prospective, multicentre, cohort study.
.
Lancet.
2021
;
S0140–6736(21)00790-X.
.
59.
Rottenstreich
A
,
Zarbiv
G
, Oiknine-
Djian
E
,
et al.
Efficient maternofetal transplacental transfer of anti- SARS-CoV-2 spike antibodies after antenatal SARS-CoV-2 BNT162b2 mRNA vaccination.
.
Clin Infect Dis.
2021
;
:ciab266.
.
60.
Madhi
SA
,
Baillie
V
,
Cutland
CL
,
et al.
Efficacy of the ChAdOx1 nCoV-19 Covid-19 vaccine against the B.1.351 variant.
.
N Engl J Med.
2021
;
NEJMoa2102214.
.
61.
Emary
KRW
,
Golubchik
T
,
Aley
PK
,
et al.
Efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine against SARS-CoV-2 variant of concern 202012/01 (B.1.1.7): an exploratory analysis of a randomised controlled trial.
.
Lancet.
2021;
;
397
:
:1351.
–
62
.
|