| |
| Med Sci (Paris). 37(8-9): 719–721. doi: 10.1051/medsci/2021106.Troubles des conduites alimentaires Rôle des interneurones cholinergiques du striatum Salah El Mestikawy1,2 and Mathieu Favier1* 1Département de psychiatrie, Institut universitaire en santé mentale Douglas, Université McGill
,
6875 boulevard Lasalle
,
H4H 1R2Montréal, Québec
,
Canada
.
2Sorbonne université, Université Pierre et Marie Curie UMR 119 - CNRS UMR 8246 - Inserm U1130, Neurosciences Paris Seine – Institut de biologie Paris Seine
,
Paris
,
France
.
MeSH keywords: Agents cholinergiques, Neurones cholinergiques, Corps strié, Troubles de l'alimentation, Habitudes, Humains, Interneurones, génétique |
Les troubles des conduites alimentaires tels que l’anorexie mentale, la boulimie ou l’hyperphagie boulimique sont des maladies psychiatriques graves [
1
]. L’anorexie mentale est difficile à traiter, en particulier chez l’adulte, et présente le taux de mortalité (5 à 10 %) le plus élevé de tous les troubles mentaux [
2
]. L’anorexie mentale se caractérise par une restriction persistante de l’apport alimentaire (anorexie mentale de type restrictif) ou par une consommation excessive de nourriture suivie d’épisodes de purge. La boulimie mentale et l’hyperphagie boulimique se définissent par la consommation d’une grande quantité de nourriture sur une courte période de temps, accompagnée d’une perte de contrôle sur la prise alimentaire. Les troubles des conduites alimentaires sont fréquemment associés à un manque de flexibilité cognitive, à une perturbation du système de la récompense, ou à un trouble obsessionnel-compulsif. L’incapacité des patients à interrompre le comportement alimentaire anormal en dépit de ses conséquences négatives suggère une base commune avec d’autres troubles compulsifs [
3
]. Malgré la gravité de ces troubles des conduites alimentaires, il n’existe actuellement aucun traitement biologique spécifique.
Chez l’homme ou chez la souris, chaque action reflète un équilibre entre deux types d’apprentissages : les comportements dirigés par un but et les comportements habituels (habitudes) [
4
]. Les comportements dirigés par un but sont observés lorsque les individus sont engagés dans une action visant à atteindre un objectif spécifique. Dans ce cas, la sélection de l’action est régie par son résultat. Les comportements dirigés par un but se caractérisent par une prise en compte des conséquences futures et une flexibilité adaptative aux changements de l’environnement. La répétition, avec succès, des comportements dirigés par un but entraîne une automatisation de ces comportements et la formation d’habitudes, qui sont donc façonnées par l’expérience passée. Contrairement aux comportements dirigés par un but, les habitudes sont découplées du résultat et sont enclenchées par les stimulus environnementaux. Elles se caractérisent par l’efficacité et la rigidité [
4
]. L’automaticité des habitudes permet au cerveau de libérer des ressources attentionnelles et décisionnelles, mais elle peut également être préjudiciable, menant à l’apparition de comportements automatiques inadaptés, qui peuvent aboutir à des troubles compulsifs [
5
]. Nous avons cherché à déterminer si un déséquilibre entre les comportements dirigés par un but et les comportements habituels pouvait être un facteur de vulnérabilité dans les troubles des conduites alimentaires [
6
,
7
].
|
Rôle des habitudes dans les troubles des conduites alimentaires
Dans la première partie de notre étude, nous avons utilisé une tâche neurocognitive informatisée pour évaluer la formation des habitudes chez l’homme [
8
]. Nous avons constaté qu’un sous-groupe de patients souffrant d’anorexie mentale de type restrictif était plus enclin à un comportement habituel que le groupe des sujets sains. De plus, la tendance exacerbée à former des habitudes était corrélée à un déficit de flexibilité cognitive chez ces patients.
Afin de déchiffrer les mécanismes neurobiologiques qui sous-tendent une dérégulation de la formation des habitudes et l’apparition de troubles du comportement alimentaire, nous avons également utilisé différents modèles de souris. Le striatum dorso-médial (noyau caudé chez l’homme) est crucial pour l’acquisition des comportements flexibles dirigés par un but, alors que le striatum dorso-latéral (putamen chez l’homme) contrôle l’expression des comportements habituels rigides [
4
]. La neurotransmission dopaminergique joue un rôle essentiel dans la transition des comportements dirigés par un but vers les habitudes [
9
,
10
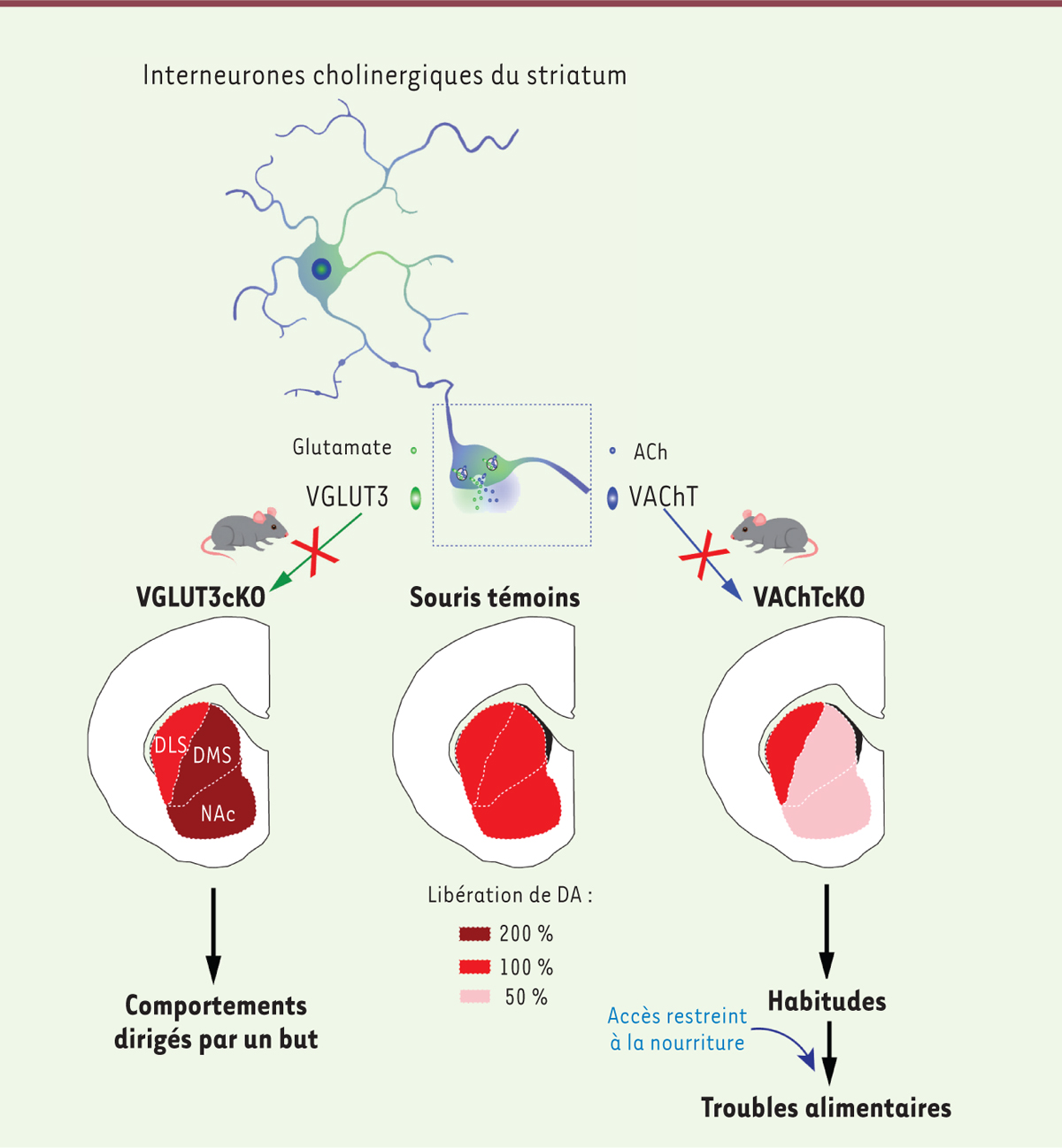
]. Les interneurones cholinergiques sont également des modulateurs majeurs du réseau striatal. En revanche, leur rôle dans la transition des comportements dirigés par un but vers les habitudes et dans les troubles du comportement alimentaire était mal connu. Ces interneurones ont une particularité remarquable : ils expriment à la fois le transporteur vésiculaire de l’acétylcholine (VAChT) et le transporteur vésiculaire du glutamate de type 3 (VGLUT3), et possèdent donc la capacité d’utiliser comme neurotransmetteur non seulement l’acétylcholine, mais aussi le glutamate.
Nous avons utilisé deux modèles de souris génétiquement modifiées n’exprimant plus VAChT (souris VAChTcKO) ou VGLUT3 (souris VGLUT3cKO) dans les interneurones cholinergiques du striatum
(
Figure 1
)
. La perte de VGLUT3, qui bloque la libération de glutamate par ces interneurones, favorise les comportements dirigés par un but et n’a pas d’effet sur le comportement alimentaire des souris. En revanche, l’inactivation de la libération d’acétylcholine par ces interneurones chez les souris VAChTcKO induit un déficit de flexibilité comportementale et accélère la formation d’habitudes. De plus, ces souris présentent des comportements alimentaires de type boulimique ou anorexique
(
Figure 1
)
. Il est important de noter que les troubles compulsifs du comportement alimentaire de ces souris ne sont observés que dans des conditions environnementales stressantes, telles qu’un accès restreint à la nourriture, et sont absents dans les conditions habituelles d’élevage des souris dans des cages standard avec un accès
ad libitum
à la nourriture.
 | Figure 1.
Contrôle de la transmission dopaminergique par les interneurones cholinergiques du striatum et équilibre entre comportements dirigés par un but et comportements habituels.
Les sous-compartiments du striatum représentés dans ce schéma sont le noyau accumbens (NAc), impliqué dans les comportements guidés par la récompense, le striatum dorso-médian (DMS, ou noyau caudé chez l’homme), impliqué dans les comportements dirigés par un but, et le striatum dorso-latéral (DLS, ou putamen chez l’homme), impliqué dans les habitudes. Les régions cérébrales qui contrôlent le comportement suivent donc une transition progressive du NAc vers le DMS, puis vers le DLS. Cette transition est parallèle à la bascule d’un comportement volontaire de recherche de récompense vers des comportements compulsifs, et elle est finement contrôlée par la dopamine. Chez les souris mutantes VGLUT3cKO, privées du transporteur vésiculaire de type 3 du glutamate dans les interneurones cholinergiques du striatum, la libération de dopamine (DA) est augmentée dans le NAc et le DMS, mais reste inchangée dans le DLS (par rapport aux souris témoins). Ces souris sont résistantes à la formation d’habitudes et favorisent les comportements dirigés par un but. En revanche, chez les souris mutantes VAChTcKO, privées du transporteur vésiculaire de l’acétylcholine (ACh) dans ces interneurones, la libération de dopamine est réduite d’environ 50 % à 70 % dans le NAc et le DMS, et n’est toujours pas modifiée dans le DLS. Le déséquilibre de la neurotransmission dopaminergique dans le NAc et le DMS par rapport au DLS conduit à une transition accélérée des comportements dirigés par un but vers les habitudes. Dans des conditions normales (accès
ad libitum
à la nourriture), les souris VAChTcKO se nourrissent de manière similaire aux souris témoins. À l’inverse, des conditions stressantes comme, par exemple, un accès restreint à la nourriture, entraînent l’apparition des comportements alimentaires compulsifs inadaptés (anorexie ou boulimie) chez ces souris mutantes.
|
|
Rôle de la transmission dopaminergique striatale dans les troubles des conduites alimentaires
Chez les souris VAChTcKO, nous avons observé que la libération de dopamine était diminuée dans le striatum dorso-médial, mais restait inchangée dans le striatum dorso-latéral. Cette observation suggérait qu’un déséquilibre de la transmission dopaminergique entre les différents sous-compartiments du striatum était à l’origine de la formation excessive d’habitudes et des comportements alimentaires compulsifs observés chez ces souris
(
Figure 1
)
. Enfin, l’augmentation du tonus cholinergique ou de la neurotransmission dopaminergique par l’administration d’un inhibiteur de l’acétylcholine estérase (donépézil) ou d’un précurseur de la dopamine (L-DOPA), respectivement, a permis de réduire significativement les symptômes anorexiques des souris VAChTcKO.
|
Ces travaux mettent en évidence des mécanismes neuronaux sous-jacents aux troubles des conduites alimentaires. Ils identifient la coexistence d’une neurotransmission par l’acétylcholine et par le glutamate dans certains interneurones du striatum comme une cible potentielle pour corriger les comportements habituels excessifs et les comportements alimentaires pathologiques. Ils ouvrent la voie à l’identification d’un sous-groupe spécifique de patients souffrant de troubles du comportement alimentaire qui pourraient bénéficier de thérapies ciblées innovantes. L’efficacité du donépézil chez des patients souffrant d’anorexie mentale sera d’ailleurs prochainement évaluée, dans le cadre d’une collaboration avec l’équipe médicale du Pr Philip Gorwood (Clinique des maladies mentales et de l’encéphale, Hôpital Sainte-Anne, Paris). Enfin, les mécanismes découverts dans cette étude pourraient également permettre d’améliorer la compréhension et la prise en charge d’autres maladies impliquant un dysfonctionnement de la formation des habitudes, comme l’addiction ou les troubles obsessionnels compulsifs. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Fairburn
CG
Harrison
PJ
Eating disorders.
.
Lancet.
2003;
;
361
:
:407.
–
416
.
2.
Arcelus
J
Mitchell
AJ
Wales
J
Nielsen
S
Mortality rates in patients with anorexia nervosa and other eating disorders. A meta-analysis of 36 studies.
.
Arch Gen Psychiatry.
2011;
;
68
:
:724.
–
731
.
3.
Godier
LR
Park
RJ
Compulsivity in anorexia nervosa: a transdiagnostic concept.
.
Front Psychol.
2014;
;
5
:
:778.
.
4.
Balleine
BW
O’Doherty
JP
Human and rodent homologies in action control: corticostriatal determinants of goal-directed and habitual action.
.
Neuropsychopharmacology.
2010;
;
35
:
:48.
–
69
.
5.
Belin
D
Belin-Rauscent
A
Murray
JE
Everitt
BJ
Addiction: failure of control over maladaptive incentive habits.
.
Curr Opin Neurobiol.
2013;
;
23
:
:564.
–
572
.
6.
Steinglass
J
Walsh
BT
Habit learning and anorexia nervosa: a cognitive neuroscience hypothesis.
.
Int J Eat Disord.
2006;
;
39
:
:267.
–
275
.
7.
Favier
M
,
Janickova
H
,
Justo
D
, et al.
Cholinergic dysfunction in the dorsal striatum promotes habit formation and maladaptive eating.
.
J Clin Invest.
2020;
;
130
:
:6616.
–
30
.
8.
Ersche
KD
Gillan
CM
Jones
PS
et al.
Carrots and sticks fail to change behavior in cocaine addiction.
.
Science.
2016;
;
352
:
:1468.
–
1471
.
9.
Belin-Rauscent
A
Everitt
BJ
Belin
D
Intrastriatal shifts mediate the transition from drug-seeking actions to habits.
.
Biol Psychiatry.
2012;
;
72
:
:343.
–
345
.
10.
Wickens
JR
Horvitz
JC
Costa
RM
Killcross
S
Dopaminergic mechanisms in actions and habits.
.
J Neurosci.
2007;
;
27
:
:8181.
–
8183
.
|