| |
| Med Sci (Paris). 37(6-7): 684–686. doi: 10.1051/medsci/2021086.La séparase, protéine-clé de la mitose Une nouvelle cible thérapeutique anti-cancéreuse ? Elyes Aouadi,1a Marie Fornier,1b Axel Gosseye,1c Camila Castillo-Ferrer,2,3d and Véronique Frachet2,3e 1Master 2 Sciences du vivant, Parcours IMaGHE, Université Paris, Sciences et Lettres (PSL), École pratique des hautes études (EPHE)
,
75014Paris
,
France
.
2Institut pour l’avancée des biosciences, Inserm U1209, UMR CNRS 5309, université Grenoble Alpes
,
38700La Tronche
,
France
.
3EPHE, université PSL
,
4-14 rue Ferrus
,
75014Paris
,
France
.
MeSH keywords: Protéines du cycle cellulaire, Humains, Mitose, Tumeurs, Separase, génétique, traitement médicamenteux |
Le cycle cellulaire joue un rôle essentiel dans le développement embryonnaire ou le renouvellement tissulaire. Sa dérégulation est impliquée dans certains processus pathologiques, dont le cancer. La cellule dispose donc de différents systèmes de régulation, comme les complexes cyclines-CDK (kinase dépendante des cyclines), qui contrôlent l’exécution des différentes phases du cycle. Plusieurs « points de contrôle » permettent aussi à la cellule de vérifier que chaque phase se déroule normalement et de stopper le cycle en cas d’erreur. Ainsi, le SAC (
spindle assembly checkpoint
) est un mécanisme de surveillance qui bloque l’anaphase tant que tous les chromosomes ne sont pas correctement attachés et alignés sur le fuseau mitotique. Il évite les erreurs de ségrégation en laissant le temps aux chromosomes d’établir des attachements corrects avec les microtubules [
1
]. Si un seul chromosome n’est pas correctement attaché au moment de l’anaphase, les kinétochores
1
activent le SAC, qui bloque la progression du cycle cellulaire. En cas d’activation prolongée du SAC, les cellules se « suicident » en entrant en apoptose, soit directement depuis le stade mitose (mort mitotique), soit en interphase après sortie de la mitose (
mitotic slippage
).
Lors de la métaphase, la cycline B/CDK1 est activée et va phosphoryler le complexe APC (
anaphase-promoting complex
). APC est un complexe multiprotéique à activité ubiquitine ligase, dont la spécificité de substrat est contrôlée par CDC20 (
cell division cycle 20
) et CDH1 (
cadherin-1
). La liaison de tous les chromosomes aux microtubules induit l’activation du complexe APC/CDC20 qui va ubiquitinyler la sécurine, puis la cycline B, conduisant à leur dégradation par le protéasome. La sécurine est une protéine présente dans le cytoplasme, qui forme un complexe avec la séparase (une cystéine endopeptidase). La formation de ce complexe bloque le site actif de la séparase [
2
]. Le passage de la métaphase à l’anaphase est déclenché par la dégradation de la sécurine qui permet ainsi l’activation de la séparase qui clive alors la cohésine, responsable de la cohésion des chromatides
(
Figure 1A
)
. La dégradation de la cycline B va, quant à elle, entraîner la formation du complexe APC/CDH1 et ainsi mettre un terme à la mitose [
3
].
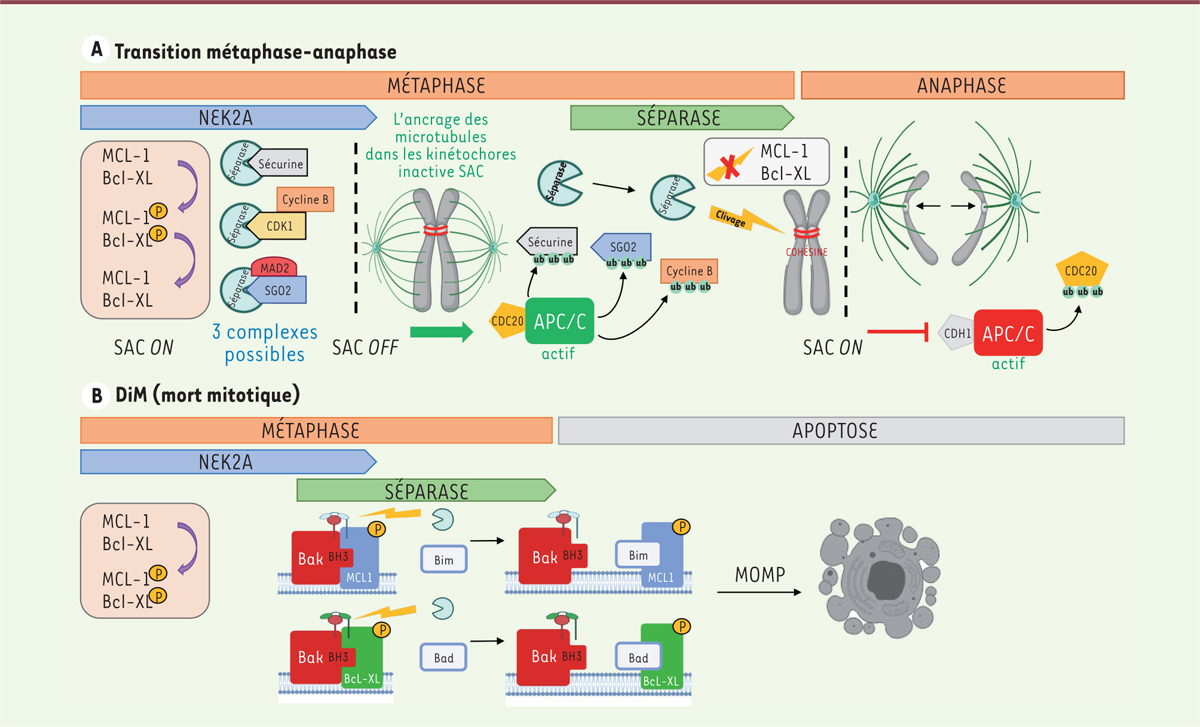
 | Figure 1.
Rôle de la séparase lors de la mitose et de la mort mitotique. A.
L’activité de la séparase est contrôlée par son association à différents partenaires (sécurine, CDK1-cycline B ou MAD2-SGO2), qui sont ubiquitinylés par APC, puis dégradés pendant la métaphase. La séparase est alors activée et clive la cohésine, déclenchant la transition métaphase-anaphase.
B..
Lors d’une accélération accidentelle de la mitose, la phosphorylation de MCL-1 et de Bcl-XL par NEK2 a lieu, alors que la séparase est déjà active, ce qui entraîne leur clivage par la séparase sous forme de fragments apoptogéniques. Il y alors déclenchement de la MOPM qui conduit à l’apoptose. APC
: anaphase-promoting complex ;
CDK1
: cyclin-dependent kinase 1 ;
SAC :
spindle assemby checkpoint ;
MOMP :
mitochondrial outer membrane permeabilization.
|
Récemment, l’équipe de S. Hellmuth et O. Stemmann a publié deux articles révélant un nouveau mécanisme de régulation de la séparase, ainsi qu’un rôle inattendu de cette protéine dans la protection contre le cancer. Ils ont en effet démontré l’existence d’un système de contrôle de l’activité de la séparase indépendant de la sécurine [
4
]. Par ailleurs, un domaine protéolytique C-terminal caspase-
like
a été identifié sur la séparase, bien qu’il n’ait jamais été fonctionnellement lié à l’apoptose. Ces auteurs se sont donc interrogés sur un éventuel lien entre séparase et apoptose, qui est elle-même régulée par une balance entre les membres pro- et anti-apoptotiques de la famille Bcl-2 (
B-cell lymphoma 2
) [
5
]. Ces facteurs pro-apoptotiques sont responsables de la perméabilisation de la membrane externe mitochondriale (MOMP) qui provoque la libération du cytochrome C dans le cytosol, et ainsi permet l’activation des caspases [
6
].
|
Existence d’un mécanisme de contrôle de la séparase indépendant de la sécurine
La séparase se lie à plusieurs protéines durant le cycle cellulaire, comme MAD2 (
mitotic arrest deficient 2
) et les protéines de la famille des shugoshines (SGO1 et SGO2). MAD2 est une protéine du point de contrôle du fuseau mitotique. Elle inhibe APC en empêchant son interaction avec CDC20 tant que tous les kinétochores ne sont pas reliés aux microtubules, bloquant ainsi la transition en anaphase. SGO1 et SGO2 sont impliquées dans la protection des cohésines lors de la méiose [
7
]. SGO2 est retrouvée au niveau des kinétochores et interagit avec MAD2.
Grâce à des expériences d’immunoprécipitation effectuées avec des lysats de cellules bloquées en mitose, les auteurs ont pu montrer que le mutant SGO2/R153D (arginine 153 remplacée par un aspartate), qui ne peut plus lier MAD2, est incapable d’interagir avec la séparase. Par contre, la forme SGO2/N58I (asparagine 58 remplacée par une isoleucine), qui ne peut interagir avec la protéine phosphatase 2A (PP2A), se lie toujours à MAD2 et à la séparase. Il existe donc un complexe séparase/MAD2/SGO2, indépendant de la sécurine. Ce complexe contrôle l’activité de la séparase, car on observe que le taux de chromatides sœurs séparées prématurément est très élevé lorsque SGO2 est inhibée ou lorsqu’on empêche l’interaction entre MAD2 et SGO2. La protéine MAD2 est alors nécessaire à l’interaction entre SGO2 et la séparase, et cette interaction joue le même rôle que la sécurine. Dans les cellules, on trouve donc trois complexes différents mutuellement exclusifs : le complexe cycline B-CDK1/séparase, le complexe SGO2-MAD2/séparase et le complexe sécurine/séparase, qui permettent de séquestrer la séparase tout au long du cycle, sauf au moment de l’anaphase
(
Figure 1A
)
.
Cette étude présente un nouveau modèle de régulation de l’activité de la séparase, SAC-dépendant, mais sécurine-indépendant, qui passe par la formation d’un complexe SGO2-MAD2/séparase. Ce dernier se dissocie sous l’action de TRIP13 (une ATPase, aussi appelée
pachytene checkpoint protein 2 homolog
) et p31
comet
(aussi appelée
MAD2L1-binding protein
), en provoquant un changement conformationnel de MAD2 permettant la libération et l’activation de la séparase, qui va alors cliver la cohésine. Il reste à déterminer pourquoi les cellules ont développé des mécanismes qui pourraient paraître redondants, si ce n’est que la voie SGO2-MAD2 est indépendante du protéasome et pourrait être une voie alternative en cas de dysfonctionnement de la sécurine ou du protéasome.
|
Un nouveau mécanisme de protection contre le cancer
Les auteurs ont ensuite examiné les conséquences d’une co-déplétion de SGO2 et de la sécurine. Dans ce cas, les cellules entrent en phase M avec une séparase déjà active. Cela provoque une séparation précoce des chromatides, un arrêt prolongé en mitose et, finalement, l’entrée des cellules en mort mitotique. Or, leurs précédents travaux avaient montré que MCL1 (
myeloid cell leukemia 1
) et Bcl-XL (des membres de la famille Bcl-2), substrats des caspases, sont impliqués dans la mort mitotique. Dans leur deuxième article, les auteurs montrent que MCL-1 et Bcl-XL peuvent également être clivés par la séparase,
via
son domaine caspase-like, au niveau d’un site distinct de celui reconnu par la caspase 3. Cette coupure affecte les interactions de ces deux protéines avec les autres membres de la famille Bcl-2. MCL1 est habituellement capable de se lier à l’agent pro-apoptotique Bak et de l’inhiber. Or, dans sa forme tronquée par la séparase, MCL-1 se lie préférentiellement à Bim et entraîne la libération de Bak. Cela conduit à la formation de pores Bax/Bak initiant la MOMP
(
Figure 1B
)
. De même, la forme Bcl-XL, clivée par la séparase, se lie à Bad plutôt qu’à Bak. De façon inattendue, les travaux présentés dans cet article montrent que le clivage de MCL-1 et Bcl-XL par la séparase rend ces deux protéines apoptogéniques, alors qu’elles ont normalement une fonction anti-apoptotique. Heureusement, la mort cellulaire n’est pas déclenchée dès l’activation de la séparase. NEK2A (
NIMA-related kinase 2
), une sérine-thréonine protéine kinase présente seulement durant les phases précoces de la mitose, phosphoryle MCL-1 et Bcl-XL. Seule la phosphorylation de ces substrats permet leur interaction avec la séparase. L’inhibition précoce artificielle du SAC (par déplétion de MAD2) entraîne une accélération de la mitose et un chevauchement spatio-temporel des activités enzymatiques de NEK2A et de la séparase. La phosphorylation de MCL1 et Bcl-XL entraîne leur clivage par la séparase, ce qui cause la mort cellulaire par apoptose au cours des premiers stades de la phase M
(
Figure 1B
)
.
L’ensemble de ces résultats démontre donc l’existence d’un nouveau mécanisme de surveillance de la mitose. NEK2A et la séparase vérifient conjointement l’intégrité du SAC et éliminent les cellules dont le SAC est défectueux, afin d’éviter la multiplication de cellules présentant une ségrégation des chromosomes incorrecte. Les travaux de Hellmuth et Stemmann révèlent un nouveau mécanisme qui pourrait être impliqué dans le cancer. La séparase jouerait un rôle central protecteur contre les cellules cancéreuses en transformant des protéines habituellement protectrices (MCL1 et Bcl-XL) en agents pro-apoptotiques. |
Une nouvelle piste thérapeutique pour le traitement des cancers ?
Ces résultats novateurs laissent penser que les cellules tumorales déficientes pour le SAC ont trouvé un moyen de contourner le clivage de MCL1. Effectivement, dans certaines cellules tumorales SAC-déficientes, MCL1 est résistante au clivage par la séparase, même en présence de NEK2A. Même si des formes mutantes de MCL1 dans les cancers sont rares, la mutation majoritaire (délétion de l’acide glutamique 171), conduit à l’expression d’une forme résistante au clivage par la séparase. De plus, la surexpression de la protéine MCL1 pourrait être un mécanisme utilisé par les tumeurs solides pour échapper à certaines chimiothérapies anticancéreuses [
8
]. De nouvelles stratégies thérapeutiques permettant de favoriser la conversion de MCL1 et Bcl-XL (qui sont souvent surexprimées dans les cellules cancéreuses) en facteurs pro-apoptotiques pourraient donc être envisagées.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Lara-Gonzalez
P
,
Westhorpe
FG
,
Taylor
SS
The spindle assembly checkpoint.
.
Curr Biol.
2012;
;
22
:
:R966.
–
R980
.
2.
Rosen
LE
,
Klebba
JE
,
Asfaha
JB
,
et al.
Cohesin cleavage by separase is enhanced by a substrate motif distinct from the cleavage site.
.
Nat Commun.
2019;
;
10
:
:5189.
.
3.
Suryadinata
R
,
Sadowski
M
,
Sarcevic
B
Control of cell cycle progression by phosphorylation of cyclin-dependent kinase (CDK) substrates.
.
Biosci Rep.
2010;
;
30
:
:243.
–
255
.
4.
Hellmuth
S
,
Gómez
-
HL
,
Pendás
AM
,
et al.
Securin-independent regulation of separase by checkpoint-induced shugoshin-MAD2.
.
Nature.
2020;
;
580
:
:536.
–
41
.
5.
Hellmuth
S
,
Stemmann
O
.
Separase-triggered apoptosis enforces minimal length of mitosis.
.
Nature.
2020;
;
580
:
:542.
–
47
.
6.
Martinou
JC
,
Youle
RJ
Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics.
.
Dev Cell.
2011;
;
21
:
:92.
–
101
.
7.
McGuinness
BE
,
Hirota
T
,
Kudo
NR
,
et al.
Shugoshin prevents dissociation of cohesin from centromeres during mitosis in vertebrate cells.
.
PLoS Biol.
2005;
;
3
:
:e86.
.
8.
Whitaker
RH
,
Placzek
WJ
Regulating the BCL2 family to improve sensitivity to microtubule targeting agents.
.
Cells.
2019;
;
8
:
:346.
.
|