| |
| Med Sci (Paris). 37(6-7): 674–676. doi: 10.1051/medsci/2021076.Une intégrine participe à la différenciation des cellules souches selon l’élasticité de la matrice extracellulaire Antoine Debiesse1* and Eve-Isabelle Pécheur2** 1Master 2 Biologie du cancer, Université Claude Bernard Lyon 1
,
France
.
2Centre de recherche en cancérologie de Lyon, UMR CNRS 5286/Inserm U1052, Université de Lyon
,
28 rue Laënnec
,
69008
,
Lyon
,
France
.
MeSH keywords: Différenciation cellulaire, Élasticité, Matrice extracellulaire, Intégrines |
Les cellules souches (CS) sont dotées d’une capacité d’auto-renouvèlement et de différenciation, leur permettant d’assurer, notamment, l’homéostasie tissulaire. Chez l’homme, les cellules souches hématopoïétiques (CSH), connues depuis longtemps et bien décrites, donnent naissance aux lignées myéloïde et lymphoïde qui forment et régénèrent le système immunitaire et le sang. Les CS adultes « nourrissent » de nombreux épithéliums. Néanmoins, suite à un stimulus oncogène, ces cellules peuvent aussi se transformer en CS cancéreuses. Les propriétés de ces cellules sont modulées par le microenvironnement (ou niche) dans lequel elles se trouvent [
1
]. Celui-ci est constitué de cellules stromales ou mésenchymateuses (cellules de soutien migratoire et nourricier), de cellules endothéliales (formant les vaisseaux sanguins), de cellules immunitaires (macrophages résidents tissulaires) et de la matrice extracellulaire (MEC) qui forme un continuum autour des cellules. Dans cette niche, les CS sont soumises à des signaux biochimiques (cytokines, facteurs de croissance) et biophysiques (forces biomécaniques, stress compressif). Les signaux biochimiques engagent diverses voies de signalisation, comme Notch, Wnt, et celle des BMP (
bone morphogenetic proteins
), qui ont été décrites pour réguler notamment le devenir des CSH [
2
]. Les forces biomécaniques sont de nature intrinsèque, en provenance de la MEC ou des jonctions intercellulaires, et extrinsèque, résultant de phénomènes de cisaillement, de traction ou de compression, reliés à une charge externe [
3
].
L’une de ces forces est l’élasticité de la MEC : lorsque les interactions entre cellules et MEC augmentent, celle-ci devient plus rigide. Il en est de même lorsque l’homéostasie tissulaire est rompue, par exemple au cours d’une maladie fibrosante. Le dialogue cellules/MEC se fait grâce aux intégrines, des protéines enchâssées dans la membrane cellulaire [
4
]. L’intégration des signaux biophysiques repose, quant à elle, sur des voies de mécano-transduction [
3
]. Le mécanisme moléculaire de régulation du comportement des CS par l’élasticité de la MEC reste néanmoins encore mal caractérisé.
|
La proportion d’intégrine b1 activée est plus importante sur un substrat souple ; b1 est internalisée par endocytose dépendante de la cavéoline
Les BMMSC (
bone marrow mesenchymal stem cells,
ou cellules souches mésenchymateuses de la moelle osseuse) sont susceptibles de se différencier soit vers un lignage neurogénique, soit vers une lignage ostéogénique, selon les stimulus auxquels elles sont soumises [
5
]. Pour évaluer l’influence des stimulus biomécaniques, des BMMSC ont été cultivées sur des substrats d’élasticité variable. Ces substrats sont composés de mélanges d’acrylamide et de bis-acrylamide en proportions différentes. Après polymérisation par photoactivation, les gels ainsi formés sont recouverts d’une pellicule de collagène I, afin de permettre l’adhérence des cellules. Les caractéristiques macro- et microscopiques de ces matrices sont analysées, et leur élasticité mesurée. Cette mesure se fait en appliquant une pression à la surface de ces substrats qui engendre une certaine proportion d’étirement, ce qui permet de calculer le module élastique de Young [
6
]
1
.
Les auteurs de l'étude ont observé une activation plus importante des intégrines exprimées par les BMMSC (en particulier la sous-unité b1), lorsque ces dernières sont cultivées sur un substrat reproduisant une « MEC souple », par rapport à la condition dans laquelle les CS sont cultivées sur un substrat « MEC rigide » [
4
].
À noter que la quantité totale (activée et non activée) de b1 reste identique sur les deux substrats : seule la proportion de b1 activée est plus importante sur un substrat « MEC souple ». Sur ce substrat, la b1 activée est internalisée par les cellules, ce qui permet d’établir un lien entre élasticité du substrat et distribution de l’intégrine à la surface des cellules. Cette internalisation fait intervenir des radeaux lipidiques, des zones membranaires dont la composition lipidique est particulière. En effet, la destruction de ces radeaux, par la MBCD (méthyl-b-cyclodextrine), se traduit par un blocage de l’internalisation de l’intégrine b1. Ces zones membranaires ont aussi comme caractéristique d’être enrichies en cavéoline, une protéine assurant l’internalisation de différentes molécules et récepteurs de surface par endocytose. L’extinction de l’expression de la cavéoline, par une stratégie d’ARN interférent, bloque également l’internalisation de l’intégrine b1, indiquant que celle-ci s’effectue par une endocytose dépendant de la cavéoline, à partir des radeaux lipidiques membranaires. |
L’internalisation de l’intégrine b1 par la cavéoline contribue au devenir des CS via l’élasticité du substrat, et implique la voie de signalisation BMP
Les CS qui ont été étudiées, les BMMSC, sont susceptibles de se différencier, notamment vers un lignage neuronal. Cette différenciation s’accompagne de l’apparition de protéines signant ce lignage, comme la nestine, MAP2 (
microtubule-associated protein 2
) et NFL (neurofilament à chaîne légère), et n’est observée que sur un substrat « MEC souple ». La destruction des radeaux lipidiques par la MBCD, de même que l’extinction de la cavéoline par ARN interférent, ou l’inhibition directe de l’internalisation de b1 par un anticorps bloquant, arrêtent la différenciation des BMMSC, ce qui démontre que le mécanisme de différenciation repose sur l’internalisation de l’intégrine b1.
Cette internalisation se fait conjointement à celle d’un récepteur des BMP, BMPRIa, qui forme un complexe avec l’intégrine b1. Le transport accru de BMPRIa vers des compartiments intracellulaires aboutit à l’inhibition de la voie de signalisation à laquelle participe BMP, ce qui se traduit par une diminution de la phosphorylation des protéines Smad 1/5/8, les effecteurs de cette voie [
4
]. La destruction des radeaux lipidiques par la MBCD et l’extinction de l’expression de l’intégrine b1 par ARN interférent, réduisent l’internalisation de BMPRIa sur un substrat « MEC souple ». Inversement, l’extinction de BMPRIa induit une différenciation des BMMSC vers le lignage neuronal, sur substrats souple ou rigide. L’internalisation de l’intégrine β1 impliquant la cavéoline, stimulée par le substrat « MEC souple », contribuerait ainsi à la différenciation vers un lignage neuronal,
via
l’inhibition de la voie BMP/Smad
(
Figure 1
)
.
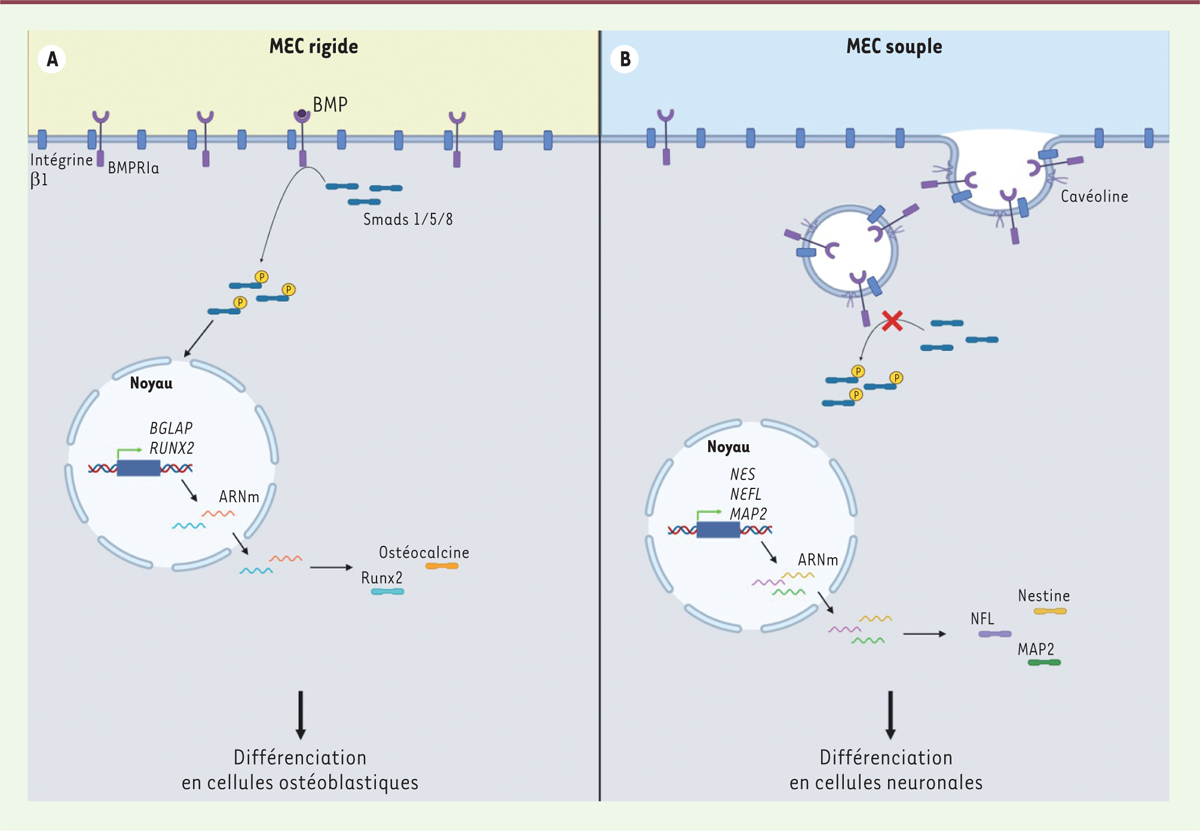
 | Figure 1.
L’élasticité de la MEC influence la différenciation des BMMSC. A.
Différenciation en lignée ostéogénique des BMMS sur une MEC rigide. Sur une MEC rigide, BMP se fixe sur son récepteur BMPRIa, conduisant à la phosphorylation des protéines Smads 1/5/8 (P-Smad). Les P-Smad (Smad phosphorylées) vont migrer vers le noyau, ce qui permet la synthèse de l’ostéocalcine et de Runx2, et la différenciation des BMMSC en cellules ostéoblastiques [
4
,
5
].
B.
Différenciation en lignée neuronale des BMMSC sur une MEC souple. Sur une MEC souple, les BMPRIa sont endocytés de manière dépendante des cavéolines, ce qui empêche la phosphorylation des protéines Smad. Les BMMSC vont alors se différencier en cellules neuronales et exprimer des protéines spécifiques de ce lignage (nestine, MAP2, NFL) [
4
]. BMP :
bone morphogenetic proteins
; BMPRIa :
bone morphogenetic protein receptor type Ia
; BMMSC : cellules souches mésenchymateuses de la moelle osseuse ; MEC : matrice extracellulaire.
|
D’autres voies de signalisation sont impactées par l’élasticité de la MEC comme, par exemple, la voie Wnt. De même que BMP/Smad, la voie de signalisation Wnt joue un rôle-clé dans l’homéostasie des CS. Selon qu’elle dépende ou non de la b-caténine, elle est dite canonique ou non-canonique. Dans la voie canonique, des facteurs Wnt se fixent sur le récepteur Frizzled, ce qui,
in fine
, induit la translocation nucléaire de la b-caténine qui déclenche alors dans le noyau son programme transcriptionnel, en formant un complexe actif avec LEF (
lymphoid enhancer factor
) et TCF (
T-cell factor
) [
7
]. Sur « MEC rigide », les quantités de b-caténine et de Wnt dans les cellules BMMSC sont plus élevés que sur « MEC souple ». Il en est de même pour les quantités de BMP [
8
]. L’accumulation et l’activation de la b-caténine sur « MEC rigide » dépendent de signaux qui impliquent les intégrines, notamment α1β1 et α10β1, et aboutissent à la différenciation de ces cellules vers un lignage ostéogénique. Inversement, l’inhibition de la b-caténine induit une différenciation vers un phénotype neuronal. La voie Wnt/b-caténine, de même que la voie BMP/Smad, contribuent donc à la régulation de la différenciation des BMMSC, qui repose sur des intégrines et est en lien avec l’élasticité de la MEC [
4
,
8
].
L’homéostasie des CS dépend ainsi du dialogue étroit entre différentes voies de signalisation. Les voies BMP/Smad et Wnt/b-caténine apparaissent comme des acteurs majeurs du maintien du phénotype souche des CS. Il reste à définir la raison pour laquelle les intégrines, dont l’intégrine b1, sont davantage activées et internalisées en réponse à un substrat « MEC souple » qu’en réponse à un substrat « MEC rigide ». Sous la membrane cellulaire, un réseau générateur de tensions, composé de fagots d’actine et de moteurs de myosine II, se forme lorsque l’intégrine se lie à la MEC. Plus le nombre de moteurs de myosine II qui se forment est important, plus la tension sur les fagots d’actine augmente, ce qui a pour résultat d’accroître la formation de points de contact – ou adhérences focales – entre intégrines et MEC.
Des calculs théoriques ont permis d’établir que la liaison entre intégrines et MEC est plus facilement dissociée lorsque les cellules sont cultivées sur substrat « MEC souple » [
4
]. Quand la tension augmente, la rupture de l’adhérence focale nécessite un niveau de stress plus faible sur substrat « MEC souple » que sur substrat « MEC rigide ». Cela pourrait contribuer à l’activation de l’intégrine, ainsi qu’à son internalisation, comme cela est observé pour l’intégrine b1.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Wang
X.
Stem cells in tissues, organoids, and cancers.
.
Cell Mol Life Sci.
2019;
;
76
:
:4043.
–
4070
.
2.
Blank
U
,
Karlsson
G
,
Karlsson
S
Signaling pathways governing stem-cell fate.
.
Blood.
2008;
;
111
:
:492.
–
503
.
3.
Vining
KH
,
Mooney
DJ
Mechanical forces direct stem cell behaviour in development and regeneration.
.
Nat Rev Mol Cell Biol.
2017;
;
18
:
:728.
–
742
.
4.
Du
J
,
Chen
X
,
Liang
X
,
et al.
Integrin activation and internalization on soft ECM as a mechanism of induction of stem cell differentiation by ECM elasticity.
.
Proc Natl Acad Sci USA.
2011;
;
108
:
:9466.
–
9471
.
5.
Engler
AJ
,
Sen
S
,
Sweeney
HL
,
Discher
DE
Matrix elasticity directs stem cell lineage specification.
.
Cell.
2006;
;
126
:
:677.
–
689
.
6.
Pelham
RJ
,
Wang
Y
Cell locomotion and focal adhesions are regulated by substrate flexibility.
.
Proc Natl Acad Sci USA.
1997;
;
94
:
:13661.
–
13665
.
7.
Katoh
M
,
Katoh
M
WNT Signaling pathway and stem cell signaling network.
.
Clin Cancer Res.
2007;
;
13
:
:4042.
–
4045
.
8.
Du
J
,
Zu
Y
,
Li
J
,
et al.
Extracellular matrix stiffness dictates Wnt expression through integrin pathway.
.
Sci Rep.
2016;
;
6
:
:20395.
.
|