| |
| Med Sci (Paris). 37(6-7): 618–624. doi: 10.1051/medsci/2021085.La mucoviscidose Du gène à la thérapeutique Claude Férec1* 1Univ Brest, Inserm UMR 1078, Génétique, génomique fonctionnelle et biotechnologies, Établissement français du sang - Bretagne, CHRU Brest
,
22 avenue Camille Desmoulins
,
29238Brest Cedex 3France |
Vignette © Claude Férec. Un peu plus de trente ans… le temps d’une génération. C’est aussi le temps qui a passé depuis la découverte du gène responsable de la mucoviscidose. C’est, aujourd’hui, peu dire que d’affirmer que cette découverte a bouleversé le champ de nos connaissances, de nos perspectives de recherche et de nos prises en charge de cette maladie qui était encore, il y a trente ans, une maladie pédiatrique dont le pronostic était mauvais. L’objectif de cette synthèse est de présenter les avancées qu’ont apportées la médecine et la science dans la connaissance de la physiopathologie de la maladie et de sa prise en charge qui est, à bien des égards, emblématique de la recherche moderne en génétique moléculaire.
En 1989, année de sa découverte, la course au gène responsable de la mucoviscidose avait déjà débuté quatre ans plus tôt. Une première étape avait en effet été franchie dès 1985, grâce à une étude de liaison génétique qui avait localisé un gène associé à la maladie sur le bras long du chromosome 7 [
1
,
2
]. La compétition s’était engagée entre les équipes européennes, coordonnées par Robert Williamson à Londres, et les équipes nord-américaines, coordonnées par Lap Chee Tsui à Toronto. C’est finalement le consortium nord-américain qui publiait en septembre 1989, dans la revue
Science
, trois articles princeps [
3
-
5
] décrivant un clonage positionnel réussi et dévoilant un nouveau gène, le gène
CFTR
(
cystic fibrosis transmembrane conductance regulator
) responsable de la mucoviscidose.
Cette découverte allait marquer d’une pierre blanche l’histoire de la maladie et transformer, en une génération, une maladie presque exclusivement pédiatrique en une maladie chronique de l’adulte, s’accompagnant d’un changement remarquable dans la prise en charge des patients et bouleversant les données épidémiologiques de la mucoviscidose. |
La découverte du gène CFTR et de la protéine CFTR
Le gène
CFTR
est un gène d’assez grande taille, s’étendant sur 180 kilobases (kb) et comprenant 27 exons. Il code une protéine transmembranaire de 1 480 acides aminés. Cette protéine, régulée par l’AMP cyclique, est constituée de deux domaines transmembranaires, de deux domaines cytoplasmiques qui lient les nucléotides (
nucleotide-binding domain
, NBD) et d’un domaine régulateur, le domaine R, une organisation qui apparente cette protéine transporteurs ABC (
ATP-Binding Cassette
) [
5
].
La protéine CFTR est un canal anionique localisé au pôle apical des cellules épithéliales pulmonaires et des glandes sous-muqueuses des voies respiratoires. Elle est présente également au niveau des cellules acineuses du pancréas exocrine, du tractus gastro-intestinal et des glandes sudoripares. Ce canal conduit les ions chlorures et les ions bicarbonates, et joue un rôle clé dans la régulation du volume du liquide qui recouvre la surface des voies aériennes et dans la régulation de sa concentration en sel et de son pH.
La structure de la protéine est aujourd’hui bien connue et les travaux d’Isabelle Callebaut et de Pierre Lehn (Sorbonne université et Muséum national d’histoire naturelle, Paris) y ont très largement contribué [
6
]. Ils ont permis de mieux comprendre les interactions structure/fonction et l’impact de mutations faux sens sur la structure de la protéine.
|
Les mutations du gène CFTR
En octobre 1989, une collaboration internationale se met en place, sous l’égide du généticien canadien Lap Chee Tsui, qui crée un Consortium international d’étude des mutations du gène (
Cystic Fibrosis Gene Mutation Analysis
)
1
dans lequel plus de 100 laboratoires ont colligé en temps réel les résultats de leurs analyses moléculaires et rapporté au fil des mois et des années plus de 2 000 mutations affectant le gène.
Le résultat obtenu était inattendu et le spectre de distribution des allèles mutés du gène
CFTR
était tout à fait particulier, avec une mutation très fréquente, appelée F508del (ou, selon la nomenclature officielle de l’
Human Genome Variation Society
: p.Phe508del)
2
: une délétion de trois nucléotides respectant le cadre de lecture et correspondant à la perte d’une phénylalanine en position 508 de la protéine. Grâce aux travaux d’Emmanuelle Génin (Inserm UMR1078, Brest), nous avons pu proposer que la date d’apparition de cette mutation dans les populations européennes se situait à l’âge de bronze (soit environ – 5 000 ans avant J-C) [
7
]. Aujourd’hui, un avantage sélectif doit rendre compte de la fréquence élevée des hétérozygotes dans nos populations dans lesquelles un sujet sur 30 à 35, selon les régions, est porteur d’une mutation de ce gène. Si l’on s’intéresse au génotype des patients, la mutation F508del est présente sur les chromosomes de deux tiers des sujets dans les populations européennes ; seule la fréquence de quelques mutations dépasse le seuil de 1 % : la mutation G542 (p.Gly542X) ; la mutation G551D (p.Gly551Asp) comme par exemple la mutation 1717-1G>A (c.1585-1G>A) ; et la mutation W1282X (p.Trp1282stop) [
8
].
Nous avons montré qu’il est possible d’identifier la quasi-totalité des mutations dans une population assez large, comme la population bretonne [
9
]. Aujourd’hui, plus de 2 000 mutations dispersées au sein des 27 exons du gène ont ainsi été rapportées ; ce sont, pour l’essentiel, des mutations rares ou uniques et la majorité d’entre elles sont des mutations causales. La fréquence de ces mutations varie beaucoup selon l’origine géographique ou ethnique des patients [
10
,
11
]. Ainsi, la mutation W1282X est la plus fréquente des mutations dans la population juive ashkénaze.
|
De l’impact des mutations sur la fonction de CFTR aux relations génotype/phénotype
L’effet de 412 mutations du gène
CFTR
, parmi les 2 000 identifiées, a été examiné à l’aide de tests fonctionnels qui ont apporté la preuve de leur responsabilité dans la maladie : ces mutations sont décrites au sein du Consortium nord-américain couplant les données moléculaires et les données fonctionnelles
3,
. Une base de données regroupant les génotypes des patients français, « CFTR-France », est par ailleurs entretenue par le laboratoire de génétique de maladies rares de l’université de Montpellier (EA 7402)
4
. Elle permet d’avoir des données précises sur la distribution des mutations dans notre pays [
12
]. Cette base recense toutes les variations causales et non causales de la séquence du gène
CFTR
et les variants non classés (variants de signification inconnue, allèles complexes). Elle intègre également tous les phénotypes associés aux allèles mutants, mais qui ne correspondent pas à la définition de la mucoviscidose (
CFTR-related disorder
ou CFTR-RD), ainsi que les résultats des prédictions informatiques de la pathogénicité des variants.
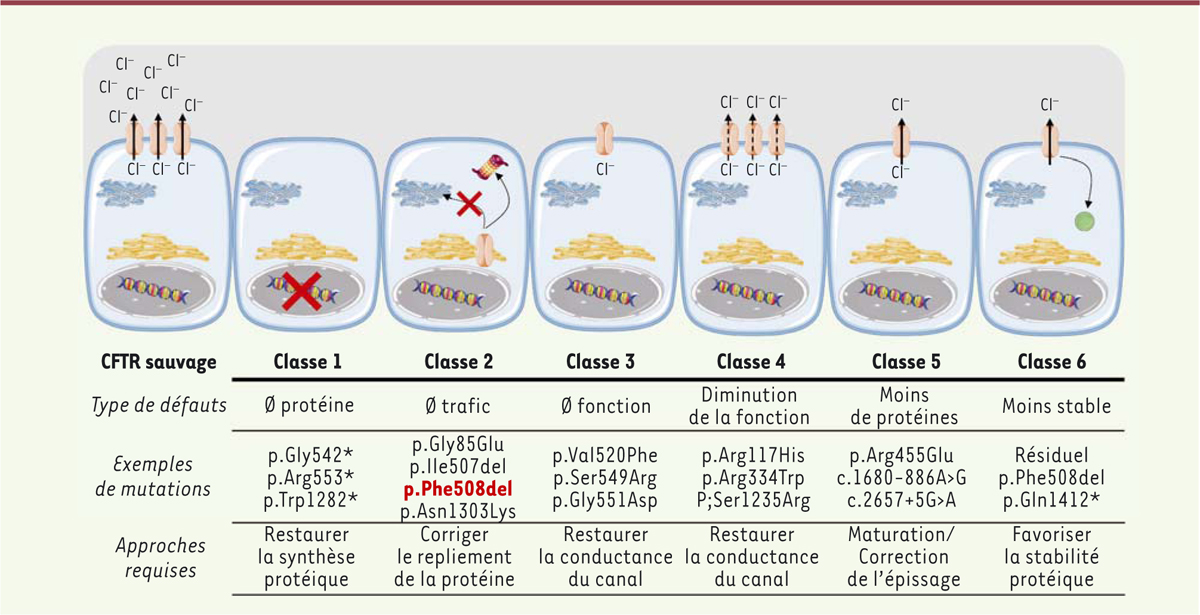
Les mutations recensées ont des impacts variables sur la fonction de la protéine CFTR. Elles ont été réparties en 6 classes [
13
]
(
Figure 1
)
:
 | Figure 1.
Représentation des 6 classes de mutations décrites dans le gène CFTR.
Les principales mutations sont indiquées, avec leurs effets sur la protéine CFTR, ainsi que les approches thérapeutiques requises. *Correspond à l’arrêt de la traduction du fait de la présence d’un codon stop à la place d’un codon codant la glycine (ou l’arginine ou le tryptophane pour les deux autres mutations indiquées).
|
–
Les mutations de classe 1
sont des mutations non-sens ou des insertions/délétions conduisant prématurément à un codon stop donnant naissance à un ARN messager instable, dégradé par NMD (
nonsense-mediated decay
), donc à une absence de synthèse de la protéine CFTR, et, par conséquent, à une absence de son expression à la membrane apicale des cellules épithéliales.
–
Les mutations de classe 2
affectent le repliement et le trafic intracellulaire de la protéine. L’exemple emblématique de ces mutations est la mutation F508del (p.Phe508del) qui est présente en au moins un exemplaire chez 75 % des patients. Le mauvais repliement de la protéine mutée perturbe sa stabilité dans le réticulum endoplasmique et conduit à sa dégradation précoce dans le protéasome. Cette mutation est aussi associée à un défaut de fermeture du canal chlorure et à une diminution de la stabilité de la protéine. Elle est thermosensible : bien que mutée, à la température de 22 °C, la protéine est transportée à la membrane des cellules et est fonctionnelle.
–
Les mutations de classe 3
affectent le contrôle de l’ouverture du canal CFTR. La protéine continue d’être exprimée à la membrane cellulaire. La mutation G551D (p.Gly551Asp) est la plus fréquente de cette classe ; elle est présente chez 2 à 4 % des patients. Elle inactive l’ouverture du canal qui dépend de l’ATP. Ce sont des mutations qualifiées de
gating mutations
ou « mutations fermeture » ; elles sont situées dans les domaines NBD, les sites de liaison de l’ATP.
–
Les mutations de classe 4
sont des mutations faux-sens situées dans le domaine transmembranaire de la protéine. Elles affectent la conductance du canal.
–
Les mutations de classe 5
ont des conséquences sur le niveau d’expression de l’ARN messager (ARNm) et, de fait, diminuent la quantité de protéine CFTR disponible à la membrane de la cellule.
–
Les mutations de classe 6
affectent le domaine C-terminal de la protéine. Elles diminuent la stabilité de la protéine et augmentent son endocytose.
Les mutations de classes 1, 2 et 3 ont un impact majeur sur la fonction de la protéine. Elles sont qualifiées de « sévères ». Par contre, les mutations de classe 4, 5 et 6 ont un effet modéré et permettent souvent de conserver une activité résiduelle de la protéine.
Les années qui ont suivi la découverte du gène ont été consacrées, probablement pour la première fois dans l’histoire de la médecine, à un questionnement passionnant sur les relations entre génotype et phénotype. On a pu ainsi faire « un pas de deux » entre le génotype et l’expression de la maladie [
14
].
Lorsqu’elles sont présentes en deux exemplaires chez un patient, les mutations dites « sévères » sont associées à une insuffisance pancréatique et à une atteinte pulmonaire précoce débutant dans l’enfance. Ce sont des formes de présentation de la maladie qui sont fréquentes et classiques, illustrées par les patients homozygotes pour la mutation F508del. Elles rendent compte dans notre pays de 50 % des sujets atteints de mucoviscidose.
L’association d’une « mutation sévère » et d’une mutation de classe 4, par exemple, se traduit en revanche, par une fonction pancréatique exocrine souvent conservée pendant de nombreuses années. Ces associations sont souvent accompagnées d’une colonisation tardive par la bactérie
Pseudomonas aeruginosa
5
. Chez ces patients, cette expression clinique plus modérée est associée à une espérance de vie plus longue, autour de 50 ans aujourd’hui [
15
].
Il faut garder à l’esprit que les facteurs d’environnement du patient (tabagisme, facteurs socio-économiques, compliance au traitement, etc.), ainsi que d’autres facteurs génétiques (les gènes modificateurs souvent impliqués dans la défense immunitaire ou dans l’inflammation), jouent un rôle important dans la variabilité de l’expression de la maladie. |
Les formes frontières de la maladie
La découverte de la responsabilité du gène
CFTR
dans un certain nombre de maladies d’organe fut une des grandes surprises des années qui ont suivi son identification. L’exemple le plus marquant a été la mise en évidence de son implication dans la stérilité masculine, par absence de canaux déférents. On savait depuis longtemps que 99 % des hommes atteints de mucoviscidose étaient stériles et présentaient une azoospermie excrétoire par absence de canaux déférents [
16
]. C’est une équipe lilloise (Inserm U16-Biochimie des protéines normales et pathologiques) qui, la première, posa la question de la responsabilité du gène
CFTR
dans la forme la plus commune de stérilité masculine [
17
]. À partir d’une petite série de 18 sujets présentant une absence de canaux déférents et suivis en biologie de la reproduction, cette équipe a rapporté que 50 % d’entre eux étaient porteurs d’une mutation F508del de la protéine CFTR. Ces travaux ont ensuite été complétés par ceux d’Arturo Anguiano
et al.
(
Center for Human Genetics
, Boston) [
18
] qui ont rapporté que 40 % de ces hommes stériles étaient des hétérozygotes composites. Il ressort aujourd’hui de différentes méta-analyses que certains variants, comme l’allèle 5T situé en amont de l’exon 9
6
, ou la mutation R117H (p.Arg117His), sont surreprésentés chez ces patients [
19
,
20
].
La responsabilité des mutations du gène
CFTR
comme facteur de susceptibilité à la survenue des pancréatites chroniques chez les patients atteints de mucoviscidose a été bien documentée en 1998 [
21
]. Cette origine génétique des pancréatites chroniques a été confirmée par la suite par de nombreuses équipes [
22
,
23
]. Étonnamment, des travaux récents du groupe de Michael J Welsh (
University of Iowa
) ont montré également, par analyse multivariée à partir de très grandes séries de sujets hétérozygotes obligatoires (les parents d’un enfant atteint), que pancréatites et stérilité masculine survenaient de façon significativement plus élevée chez les patients porteurs de mutations du gène, bien que ces derniers soient considérés
a priori
comme asymptomatiques [
24
].
Ces travaux ont conduit à proposer le concept de CFTR-RD (pour
CFTR-related disorder
) pour qualifier des maladies comme l’absence bilatérale de canaux déférents, ou la survenue de pancréatites aiguës ou chroniques. Ces maladies sont associées à des dysfonctionnements de la protéine CFTR, mais elles ne remplissent pas les critères cliniques et biologiques permettant de poser le diagnostic de mucoviscidose [
25
].
|
De la découverte du gène CFTR au dépistage néonatal systématique…
Dans les années 1990, quelques équipes pionnières, comme celle de Philip M Farrell à l’université du Wisconsin aux États-Unis, ou de Georges Travert en France, avaient mis en place des expériences pilotes de dépistage néonatal reposant sur le dosage de la trypsine immuno-réactive (TIR)
7,
trois jours après la naissance. Ce dosage assez sensible était peu spécifique et la mise en place du dépistage se heurtait à l’époque à un principe
8
, à savoir que l’on ne dépistait pas une maladie si l’on n’avait pas de traitement curatif à proposer. Il est aujourd’hui bien établi que le dépistage en période néonatale améliore le statut nutritionnel des enfants et leur prise en charge rapide en centre spécialisé [
26
]. La découverte des mutations du gène a conduit à proposer de coupler le dosage de la trypsine immuno-réactive à la recherche des mutations fréquentes, ce qui a donné naissance à un test tout à fait performant en termes de sensibilité et de spécificité, bien documenté par les travaux de Virginie Scotet dans une expérience pilote [
27
] (
→
).
(
→
) Voir le numéro thématique La révolution médicale du dépistage néonatal,
m/s
n°5, mai 2021
Grâce au séquençage de nouvelle génération, la capacité d’identifier 99 % des mutations du gène
CFTR
permet, aujourd’hui, d’affiner considérablement le conseil génétique. Cela favorise la mise en place d’un dépistage familial des porteurs de mutations. Tout cela a conduit à une diminution de l’incidence de la maladie estimée aujourd’hui à 1 patient pour 4 500 sujets dans notre pays, et à un changement des données épidémiologiques de la mucoviscidose [
28
].
|
… et à la médecine de précision Pendant de nombreuses années, les seuls traitements proposés aux patients étaient des traitements symptomatiques, combinant antibiothérapie, médications anti-inflammatoires, fluidifiants pulmonaires et kinésithérapie… La découverte du gène en 1989, la connaissance de la protéine, de sa fonction et l’identification des anomalies moléculaires qui l’affectent, ont ouvert de nouveaux champs de recherche et de nouvelles pistes thérapeutiques.
Dès les années 1990, après avoir montré que la transfection du gène
CFTR
non muté dans des cellules lymphoïdes altérées pouvait restaurer la fonction de la protéine [
29
], de nombreux projets de thérapie génique ont vu le jour, suscitant un grand enthousiasme dans la communauté médicale. Des essais de phases I/II, fondés sur l’utilisation d’adénovirus (ou AAV pour
adeno-associated virus
), de lentivirus et, plus récemment, de vecteurs de synthèse [
30
,
31
] transférant le gène « médicament » ont été entrepris.
À cette époque, les travaux reposant sur l’utilisation d’AAV ont montré une tolérance correcte du transgène. Malheureusement, cette thérapie génique s’est traduite par un manque d’efficacité et les résultats des essais de phase III n’ont pas été à la hauteur des espoirs suscités, probablement à cause de l’absence de récepteurs spécifiques du virus utilisé à la surface des cellules épithéliales pulmonaires. Aujourd’hui, des travaux de recherche sont encore nécessaires pour améliorer le ciblage et l’expression du transgène dans les cellules épithéliales, mais l’espoir de pouvoir utiliser un jour la thérapie génique demeure.
Une approche récente, l’approche CRISPR-Cas9, suscite un vif intérêt pour éditer (modifier) le génome. Des travaux ont été réalisés à partir de cellules iPS (
induced pluripotent stem cells
) et la preuve de concept de la correction de plusieurs mutations du gène
CFTR
a été apportée [
32
].
D’autres stratégies thérapeutiques ont été développées. Elles reposent sur la correction de mutations appartenant à la classe 1 (mutations non-sens ou insertions/délétions conduisant prématurément à un codon stop). Des stratégies de correction des codons stop par translecture
9,
ont en effet été appliquées, initialement par l’action d’antibiotiques comme la gentamycine. Cependant, la toxicité de ces antibiotiques les rend peu utilisables en thérapeutique, ce qui a conduit à élaborer des produits de synthèse moins toxiques, comme le PTC 124 (ataluren)
10
, pour lesquels des essais de phase III ont été menés pour la mucoviscidose, mais les bénéfices cliniques sont restés modestes [
33
].
|
La révolution des nouvelles thérapies Des progrès significatifs et très encourageants ont vu le jour il y a une dizaine d’années avec l’utilisation de petites molécules agissant spécifiquement sur la protéine CFTR. Ces composés, appelés modulateurs, peuvent restaurer partiellement la fonction de la protéine et améliorer la situation clinique des patients. Il s’agit d’une action qui vise à corriger la protéine défectueuse en agissant sur sa fonction, sur son repliement ou sur son trafic intracellulaire. Ces petites molécules sont classées en deux groupes : les potentiateurs et les correcteurs. Les potentiateurs
Cette classe de petites molécules regroupe des molécules capables d’interagir avec les protéines CFTR présentant des mutations de classe 3, en particulier la mutation G551D (p.Gly551Asp), et d’augmenter la capacité d’ouverture du canal CFTR. Le chef de file de ces potentiateurs est l’ivacaftor, dont l’action a d’abord été montrée
in vitro
[
34
]. Des essais de phase II et de phase III ont ensuite montré son efficacité chez des patients porteurs de la mutation G551D : chez ces patients, l’ivacaftor augmente en effet le VEMS (volume expiratoire maximal par seconde) d’environ 10 % après 15 jours de traitement, diminue de 55 % les exacerbations pulmonaires et réduit de 48 mmol la concentration de chlore sudoral. La prise de poids des patients est en parallèle de 2,7 kg en moyenne [
35
].
Le Kalideco®, la forme pelliculée de l’ivacaftor, a été le premier modulateur ayant fait ses preuves en clinique. Son action a été étendue aux autres mutations impliquées dans la fermeture du canal, comme par exemple les mutations S549S ou G551S. D’autres molécules potentiatrices ont été découvertes depuis et certaines font l’objet de tests précliniques. Les correcteurs Les correcteurs sont de petites molécules qui améliorent le trafic intracellulaire de la protéine CFTR mutée. Dans la cellule, la protéine transite du réticulum endoplasmique vers la membrane apicale. Au cours de cette migration, elle est soumise à un contrôle de qualité qui identifie les protéines mal repliées. Si tel est le cas, des protéines chaperonnes les prennent en charge afin qu’elles soient dégradées. Les correcteurs améliorent le repliement défectueux des protéines et favorisent leur cheminement vers la membrane. Ils améliorent ainsi la fonction des protéines mutées.
De nombreuses molécules à activité correctrice ont été développées pour corriger le trafic de la protéine CFTR mutée.
Vertex Pharmaceuticals
a ainsi développé un nouveau composé prometteur, le VX-809, ou lumacaftor, et a proposé de l’associer à l’ivacaftor (cette association a été commercialisée sous le nom d’Orkambi®). Deux études de phase III ont été menées pour évaluer l’efficacité et la toxicité de cette combinaison chez des patients homozygotes pour la mutation F508del du gène
CFTR
. Elles ont montré un bénéfice pour les patients, avec une augmentation du VEMS (entre 2,6 et 4 %), et une amélioration significative en termes de gain de poids, de réduction des exacerbations pulmonaires, sans qu’il n’y ait de problème majeur de toxicité. L’Orkambi® a reçu une AMM (autorisation de mise sur le marché) pour le traitement des patients âgés de 12 ans et plus. Cette autorisation a ensuite été étendue aux enfants de 6 à 11 ans [
36
]. Ces résultats, somme toute modestes, obtenus sur les patients homozygotes pour la mutation F508del, ont conduit plusieurs compagnies à développer de nouveaux correcteurs.
Ainsi, le correcteur VX-445 (élexacaftor) a été proposé en plus du traitement déjà prescrit associant ivacaftor et tézacaftor (VX-661) (formulation dénommée Symdeko®) chez les patients homozygotes pour la mutation F508del. Ce « cocktail » de trois composés (ivacaftor-tezacaftor-élexacaftor), commercialisé sous le nom de Trikafta®, qui permet une augmentation de 11 % du VEMS [
37
-
39
], améliore significativement non seulement les patients porteurs d’une ou deux copies de la mutation F508del, mais également les patients hétérozygotes composites porteurs d’un allèle F508del et d’une autre mutation, et dont la protéine CFTR a conservé une activité résiduelle. Il est ainsi envisagé de pouvoir traiter 90 % des patients atteints de mucoviscidose [
40
].
|
Il reste encore du chemin à parcourir pour mieux comprendre la pathogenèse de la maladie et les mécanismes de la colonisation bactérienne associée, afin de découvrir de nouvelles molécules encore plus efficaces et, ainsi, améliorer l’espérance de vie à la naissance des enfants atteints de mucoviscidose, estimée aujourd’hui à une quarantaine d’années. Mais que de chemin parcouru en 30 ans ! Ces allers-retours incessants entre la recherche fondamentale et la recherche clinique ont conduit à de belles avancées en une génération et illustrent parfaitement cette remarquable fertilisation croisée entre la science et la médecine au bénéfice des patients. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Je remercie vivement l’association « Vaincre la Mucoviscidose » et l’association « Gaétan Saleün » pour leur fidèle soutien.
|
Footnotes |
1.
Knowlton
RG
,
Cohen-Haguenauer
O
,
Van Cong
N
,
et al.
A polymorphic DNA marker linked to cystic fibrosis is located on chromosome 7.
.
Nature.
1985;
;
318
:
:380.
–
382
.
2.
Wainwright
BJ
,
Scambler
PJ
,
Schmidtke
J
,
et al.
Localization of cystic fibrosis locus to human chromosome 7cen-q22.
.
Nature.
1985;
;
318
:
:384.
–
385
.
3.
Rommens
JM
,
Iannuzzi
MC
,
Kerem
B
,
et al.
Identification of the cystic fibrosis gene: chromosome walking and jumping.
.
Science.
1989;
;
245
:
:1059.
–
1065
.
4.
Riordan
JR
,
Rommens
JM
,
Kerem
B
,
et al.
Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA.
.
Science.
1989;
;
245
:
:1066.
–
1073
.
5.
Kerem
B
,
Rommens
JM
,
Buchanan
JA
,
et al.
Identification of the cystic fibrosis gene: genetic analysis.
.
Science.
1989;
;
245
:
:1073.
–
1080
.
6.
Mornon
JP
,
Hoffmann
B
,
Jonic
S
,
et al.
Full-open and closed CFTR channels, with lateral tunnels from the cytoplasm and an alternative position of the F508 region, as revealed by molecular dynamics.
.
Cell Mol Life Sci.
2015;
;
72
:
:1377.
–
1403
.
7.
Farrell
P
,
Férec
C
,
Macek
M
,
et al.
Estimating the age of p. (Phe508del) with family studies of geographically distinct European populations and the early spread of cystic fibrosis.
.
Eur J Hum Genet.
2018;
;
26
:
:1832.
–
1839
.
8.
Audrézet
MP
,
Mercier
B
,
Guillermit
H
,
et al.
Identification of 12 novel mutations in the CFTR gene.
.
Hum Mol Genet.
1993;
;
2
:
:51.
–
54
.
9.
Férec
C
,
Audrezet
MP
,
Mercier
B
,
et al.
Detection of over 98% cystic fibrosis mutations in a Celtic population.
.
Nat Genet.
1992;
;
1
:
:188.
–
191
.
10.
Bobadilla
JL
,
Macek
M
,
Fine
JP
,
et al.
Cystic fibrosis: a worldwide analysis of CFTR mutations: correlation with incidence data and application to screening.
.
Hum Mutat.
2002;
;
19
:
:575.
–
606
.
11.
Dörk
T
,
Macek
M
,
Mekus
F
,
et al.
Characterization of a novel 21-kb deletion, CFTRdele2,3(21 kb), in the CFTR gene: a cystic fibrosis mutation of Slavic origin common in Central and East Europe.
.
Hum Genet.
2000;
;
106
:
:259.
–
268
.
12.
Claustres
M
,
Thèze
C
,
Georges
M
des
,
et al.
CFTR-France, a national relational patient database for sharing genetic and phenotypic data associated with rare CFTR variants.
.
Hum Mutat.
2017;
;
38
:
:1297.
–
315
.
13.
Welsh
MJ
,
Smith
AE
.
Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis.
.
Cell.
1993;
;
73
:
:1251.
–
1254
.
14.
Kerem
E
,
Corey
M
,
Kerem
BS
,
et al.
The relation between genotype and phenotype in cystic fibrosis–analysis of the most common mutation (delta F508).
.
N Engl J Med.
1990;
;
323
:
:1517.
–
1522
.
15.
Ferec
C
,
Cutting
GR
.
Assessing the disease-liability of mutations in CFTR.
.
Cold Spring Harb Perspect Med.
2012;
;
2
:
:a009480.
.
16.
Feigelson
J
,
Pecau
Y
,
Shwachman
H
.
Paternity in a patient with mucoviscidosis. Study of genital functions and filiation.
.
Arch Fr Pediatr.
1969;
;
26
:
:937.
–
944
.
17.
Dumur
V
,
Gervais
R
,
Rigot
JM
,
et al.
Abnormal distribution of CF delta F508 allele in azoospermic men with congenital aplasia of epididymis and vas deferens.
.
Lancet.
1990;
;
336
:
:512.
.
18.
Anguiano
A
,
Oates
RD
,
Amos
JA
,
et al.
Congenital bilateral absence of the vas deferens. A primarily genital form of cystic fibrosis.
.
JAMA.
1992;
;
267
:
:1794.
–
1797
.
19.
Chillón
M
,
Casals
T
,
Mercier
B
,
et al.
Mutations in the cystic fibrosis gene in patients with congenital absence of the vas deferens.
.
N Engl J Med.
1995;
;
332
:
:1475.
–
1480
.
20.
Mercier
B
,
Verlingue
C
,
Lissens
W
,
et al.
Is congenital bilateral absence of vas deferens a primary form of cystic fibrosis? Analyses of the CFTR gene in 67 patients.
.
Am J Hum Genet.
1995;
;
56
:
:272.
–
277
.
21.
Cohn
JA
,
Friedman
KJ
,
Noone
PG
,
et al.
Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis.
.
N Engl J Med.
1998;
;
339
:
:653.
–
658
.
22.
Masson
E
,
Chen
JM
,
Audrézet
MP
,
et al.
A conservative assessment of the major genetic causes of idiopathic chronic pancreatitis: data from a comprehensive analysis of PRSS1, SPINK1, CTRC and CFTR genes in 253 young French patients.
.
PLoS One.
2013;
;
8
:
:e73522.
.
23.
Chen
J-M
,
Férec
C
.
Chronic pancreatitis: genetics and pathogenesis.
.
Annu Rev Genomics Hum Genet.
2009;
;
10
:
:63.
–
87
.
24.
Miller
AC
,
Comellas
AP
,
Hornick
DB
,
et al.
Cystic fibrosis carriers are at increased risk for a wide range of cystic fibrosis-related conditions.
.
Proc Natl Acad Sci USA.
2020;
;
117
:
:1621.
–
7
.
25.
Bombieri
C
,
Claustres
M
,
De Boeck
K
,
et al.
Recommendations for the classification of diseases as CFTR-related disorders.
.
J Cyst Fibros.
2011;
;
10
:
:S86.
–
102
.
26.
Farrell
PM
,
Kosorok
MR
,
Rock
MJ
,
et al.
Early diagnosis of cystic fibrosis through neonatal screening prevents severe malnutrition and improves long-term growth. Wisconsin cystic fibrosis neonatal screening study group.
.
Pediatrics.
2001;
;
107
:
:1.
–
13
.
27.
Scotet
V
,
de Braekeleer
M
,
Roussey
M
,
et al.
Neonatal screening for cystic fibrosis in Brittany, France: assessment of 10 years’ experience and impact on prenatal diagnosis.
.
Lancet.
2000;
;
356
:
:789.
–
794
.
28.
Scotet
V
,
L’Hostis
C
,
Férec
C
.
The changing epidemiology of cystic fibrosis: incidence, survival and impact of the cftr gene discovery.
.
Genes.
2020;
;
11
:
:589.
.
29.
Krauss
RD
,
Bubien
JK
,
Drumm
ML
,
et al.
Transfection of wild-type CFTR into cystic fibrosis lymphocytes restores chloride conductance at G1 of the cell cycle.
.
EMBO J.
1992;
;
11
:
:875.
–
883
.
30.
Belmadi
N
,
Midoux
P
,
Loyer
P
,
et al.
Synthetic vectors for gene delivery: an overview of their evolution depending on routes of administration.
.
Biotechnol J.
2015;
;
10
:
:1370.
–
1389
.
31.
Anguela
XM
,
High
KA
.
Entering the modern era of gene therapy.
.
Ann Rev Med.
2019;
;
70
:
:273.
–
288
.
32.
Bellec
J
,
Bacchetta
M
,
Losa
D
,
et al.
CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells.
.
Curr Gene Ther.
2015;
;
15
:
:447.
–
459
.
33.
Kerem
E
,
Konstan
MW
,
De Boeck
K
,
et al.
Ataluren for the treatment of nonsense-mutation cystic fibrosis: a randomised, double-blind, placebo-controlled phase 3 trial.
.
Lancet Respir Med.
2014;
;
2
:
:539.
–
547
.
34.
Van Goor
F
,
Hadida
S
,
Grootenhuis
PDJ
,
et al.
Rescue of CF airway epithelial cell function in vitro by a CFTR potentiator, VX-770.
.
Proc Natl Acad Sci USA.
2009;
;
106
:
:18825.
–
18830
.
35.
Ramsey
BW
,
Davies
J
,
McElvaney
NG
,
et al.
A CFTR potentiator in patients with cystic fibrosis and the G551D mutation.
.
N Engl J Med.
2011;
;
365
:
:1663.
–
1672
.
36.
Wainwright
CE
,
Elborn
JS
,
Ramsey
BW
,
et al.
Lumacaftor-ivacaftor in patients with cystic fibrosis homozygous for Phe508del CFTR.
.
N Engl J Med.
2015;
;
373
:
:220.
–
231
.
37.
Keating
D
,
Marigowda
G
,
Burr
L
,
et al.
VX-445-Tezacaftor-ivacaftor in patients with cystic fibrosis and one or two Phe508del alleles.
.
N Engl J Med.
2018;
;
379
:
:1612.
–
1620
.
38.
Heijerman
HGM
,
McKone
EF
,
Downey
DG
,
et al.
Efficacy and safety of the elexacaftor plus tezacaftor plus ivacaftor combination regimen in people with cystic fibrosis homozygous for the F508del mutation: a double-blind, randomised, phase 3 trial.
.
Lancet.
2019;
;
394
:
:1940.
–
1948
.
39.
Davies
JC
,
Moskowitz
SM
,
Brown
C
,
et al.
VX-659-tezacaftor-ivacaftor in patients with cystic fibrosis and one or two Phe508del alleles.
.
N Engl J Med.
2018;
;
379
:
:1599.
–
1611
.
40.
Middleton
PG
,
Mall
MA
,
Drˇevínek
P
,
et al.
Elexacaftor-tezacaftor-ivacaftor for cystic fibrosis with a single Phe508del allele.
.
N Engl J Med.
2019;
;
381
:
:1809.
–
1819
.
|