| |
| Med Sci (Paris). 37(6-7): 593–600. doi: 10.1051/medsci/2021095.Syndrome de l’intestin irritable Rôle du microbiote intestinal Frédérique Lajoie,1 Guy Rousseau,1 Stéphanie Blanquet-Diot,2 and Lucie Etienne-Mesmin2* 1Département de pharmacologie et physiologie, Faculté de médecine, université de Montréal, CP 6128 - Succursale Centre-ville
,
H3C 3J7Montréal (Québec)
,
Canada 2Université Clermont Auvergne, INRAe, UMR454 MEDIS (microbiologie, environnement digestif et santé)
,
28 place Henri-Dunant
,
63000
,
Clermont-Ferrand
,
France |
Vignette (Photo © Inserm/Haffen, Katy).
Le côlon héberge entre 10
13
à 10
14
bactéries par gramme de contenu luminal. Ces microorganismes commensaux, qui constituent le microbiote intestinal, représentent la communauté microbienne la plus riche et la plus diversifiée que le corps humain héberge [
2
]. Les principales espèces bactériennes coliques sont majoritairement anaérobies strictes, et les phyla qui s’y retrouvent principalement chez un individu sain sont les Firmicutes et les Bacteroidetes, suivis des Proteobacteria, des Actinobacteria et des Verrucomicrobia [
3
] (
→
)
(→) Voir le numéro thématique
Le microbiote cet inconnu qui réside en nous
,
m/s
n° 11, novembre 2016
Le microbiote intestinal consiste en un écosystème dynamique, dont le développement est influencé par de nombreux facteurs : génétique, mode d’accouchement (par voie naturelle ou césarienne), âge, situation géographique, stress, alimentation, exposition à des agents infectieux ou à des polluants, ou encore prise d’antibiotiques [
3
]. La capacité de résilience de ce microbiote intestinal est importante, mais certains stress intenses, ou s’étalant sur de longues périodes, peuvent modifier sa composition et/ou son activité métabolique, induisant une perturbation de la population microbienne que l’on appelle dysbiose [
4
] (
→
).
(→) Voir la Nouvelle de S. Normand
et al
.,
m/s
n° 6-7, juin-juillet 2013, page 586
La dysbiose est généralement associée à une perte de diversité microbienne, marquée par une augmentation de l’abondance des bactéries à potentiel pro-inflammatoire (comme les Enterobacteriaceae), s’accompagnant d’une diminution de l’abondance des bactéries dites bénéfiques (les Firmicutes et les Bacteroidetes). Cet état dysbiotique s’observe dans de nombreuses maladies digestives (maladies inflammatoires chroniques de l’intestin [MICI], cancers colorectaux et syndrome de l’intestin irritable), mais aussi extra-digestives (polyarthrite rhumatoïde, obésité, diabète de type II) [
3
,
4
].
Le syndrome de l’intestin irritable (SII) est le trouble fonctionnel chronique du système gastro-intestinal dont la prévalence est la plus importante. Il se caractérise par une altération de la motilité intestinale, des ballonnements abdominaux et des douleurs viscérales [
5
]. Des travaux conduits au cours des dernières décennies ont permis de mettre en évidence une dysbiose du microbiote intestinal chez les patients atteints de SII, suggérant un rôle de cette perturbation dans la cause et le maintien des symptômes que l’on observe chez les patients
(
Figure 1
)
. Les manifestations cliniques étant variables entre les individus, la maladie a été classée en plusieurs sous-types selon la consistance des selles. Les critères de Rome
1
(les premiers ont été établis en 1992 avec Rome I) sont, à ce jour, les plus utilisés pour effectuer le diagnostic de la maladie [
6
]. Selon la plus récente version (Rome IV en 2016), les douleurs abdominales doivent être récurrentes (au moins une fois par semaine) et les symptômes présents depuis plus de six mois. L’altération des mouvements intestinaux est, quant à elle, évaluée à l’aide de l’échelle de Bristol (élaborée en 1990), qui décrit sept types de selles, dont la consistance passe de dure à liquide. On distingue ainsi des individus qui sont constipés (SII-C), des patients diarrhéiques (SII-D), et ceux qui présentent des selles mixtes (SII-M) ou des selles ne pouvant être classées (SII-U) [
5
,
7
].
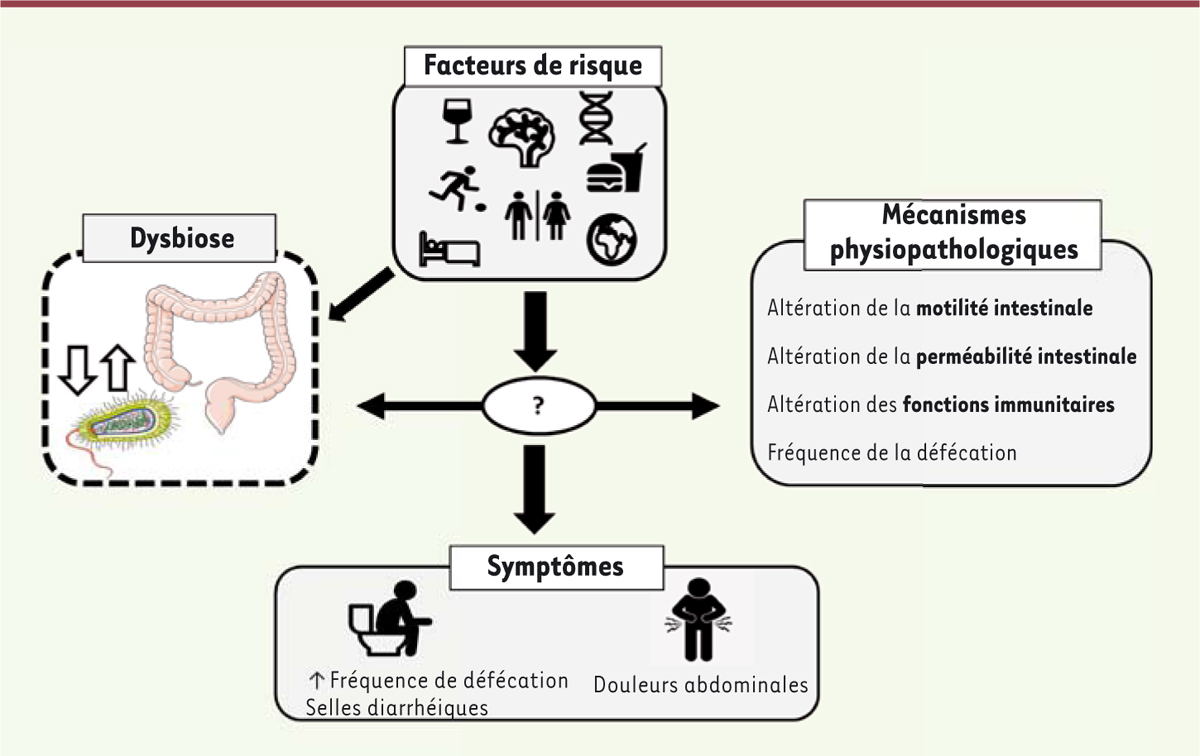
 | Figure 1.
Le syndrome de l’intestin irritable diarrhéique.
Plusieurs facteurs de risque ont un impact sur le développement du syndrome de l’intestin irritable diarrhéique chez l’homme (le sexe, l’âge, l’alimentation, le stress, le sommeil, la localisation géographique, la consommation d’alcool, l’activité physique, la génétique). La dysbiose intestinale (notamment la perte de diversité microbienne) joue un rôle prépondérant dans la prévalence de la maladie, et peut être accentuée par la présence d’un ou plusieurs facteurs de risque. Plusieurs mécanismes physiopathologiques sont communs chez les patients atteints : hypersensibilité colique, altération de la motilité intestinale et altération des fonctions immunitaires. Cependant, il reste à établir si la dysbiose est la cause de l’apparition de ces troubles ou l’inverse. L’ensemble de ces phénomènes sont impliqués dans l’apparition des symptômes gastro-intestinaux (augmentation de la fréquence de défécation, selles molles et douleurs abdominales).
|
|
Le syndrome de l’intestin irritable Épidémiologie et classification Prévalence
Le SII touche environ 11 % de la population mondiale, avec, dans la population française, une prévalence de 4 à 5 % caractérisée par des variations géographiques qui peuvent être causées notamment par le régime alimentaire local [
7
,
8
]. Les manifestations cliniques sont variables entre individus. La maladie est ainsi souvent sous-diagnostiquée, confondue, dans environ 20 % des cas, avec d’autres atteintes du tractus gastro-intestinal (maladie cœliaque, dyspepsie, reflux gastriques, MICI, intolérances alimentaires) [
5
]. Le SII peut également être associé à des symptômes extra-intestinaux récurrents, notamment des troubles psychiatriques (dépression, anxiété) [
5
].
Influence du sexe
Le sexe joue un rôle prépondérant dans l’apparition des symptômes. À travers le monde, la prévalence est de 2 à 2,5 fois plus élevée chez les femmes que chez les hommes [
8
]. Les hormones sexuelles féminines jouent un rôle crucial dans l’incidence de la maladie, principalement par leur action inhibitrice de la contraction des muscles lisses au niveau de l’intestin, ce qui peut ainsi diminuer la motilité intestinale [
8
]. Les œstrogènes, qui stimulent les zones cérébrales impliquées dans les réponses émotionnelles, sont également impliqués dans le maintien de la barrière épithéliale de l’intestin [
9
] : ils augmentent en effet l’expression des protéines de jonction par les cellules intestinales épithéliales et diminuent la production de cytokines pro-inflammatoires par ces cellules [
10
]. La progestérone intervient, quant à elle, principalement au niveau du péristaltisme, par le biais de la sérotonine (ou 5-hydroxytryptamine, 5-HT). Chez la femme, le SII-C (avec constipation) est le sous-type de la maladie le plus fréquent, avec une prévalence des symptômes variant fortement selon la phase du cycle menstruel. Certaines femmes présentent ainsi préférentiellement un profil diarrhéique (SII-D) durant les menstruations. Chez l’homme, au contraire, le type SII-D est le plus fréquent [
8
].
Influence de l’âge
Le syndrome est présent dans tous les groupes d’âge, mais les premiers symptômes se déclarent majoritairement avant 35 ans [
7
,
11
]. Chez la femme, la prévalence est plus élevée entre le début de la puberté et l’âge de 40 ans. Elle diminue ensuite au moment de la ménopause pour atteindre un taux similaire à celui de l’homme, vers 70 ans [
8
]. L’impact de l’âge est moindre chez l’homme, avec une prévalence constante de la maladie entre 20 et 70 ans [
8
].
Les principaux mécanismes physiopathologiques
Le SII est une maladie multifactorielle caractérisée par de multiples altérations fonctionnelles et métaboliques. Bien qu’elles puissent varier entre les sous-types du syndrome, les manifestations physiopathologiques peuvent généralement être regroupées en quelques catégories précises
(
Figure 2
)
, identifiées par : 1) une altération quantitative et qualitative du microbiote intestinal [
5
] ; 2) une hypersensibilité viscérale d’origine colique (ou HSVC) ; 3) une altération de la motilité et de la perméabilité intestinales et des fonctions immunitaires. Jusqu’à présent, certaines associations entre des modifications du microbiote intestinal et les manifestations cliniques ont été rapportées, mais aucun lien de causalité n’a pu être clairement démontré. Toutefois, il apparaît que les interventions qui visent à moduler le microbiote intestinal réduisent certains des symptômes. Elles représentent désormais une piste thérapeutique envisageable.
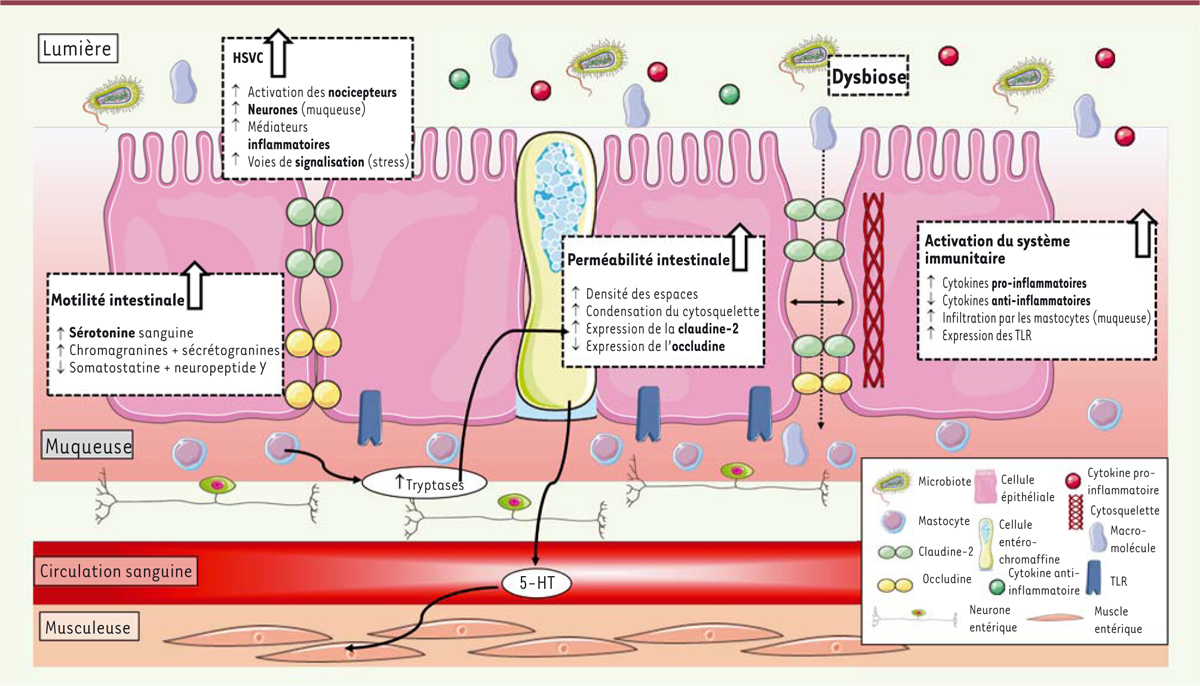
 | Figure 2.
Physiopathologie du syndrome de l’intestin irritable diarrhéique.
Le côlon des patients atteints de SII-D est caractérisé par une augmentation de l’activation du système immunitaire, principalement par une infiltration accrue de mastocytes dans la muqueuse, ainsi que par une augmentation des cytokines pro-inflammatoires et une diminution des cytokines anti-inflammatoires. On retrouve également un plus grand nombre de récepteurs TLR (
Toll-like receptor
). Une hypersensibilité viscérale (HSVC) est également observée chez ces patients, notamment induite par la présence accrue de médiateurs inflammatoires et par une augmentation des voies de signalisation du stress. Ces patients présentent une suractivation des nocicepteurs et une augmentation du nombre de neurones dans la muqueuse intestinale. Les mastocytes produisent un grand nombre de tryptases, qui influencent l’expression des protéines des jonctions serrées (augmentation de claudine-2 et diminution de l’occludine). S’ajoutant à une condensation du cytosquelette, on retrouve une augmentation du nombre des espaces élargis (
gaps
) entre les cellules épithéliales et une perméabilité intestinale altérée, permettant le passage accru de macromolécules. Les éosinophiles (non représentés) présentent également une propension accrue à libérer leurs granules cytoplasmiques, avec une augmentation du taux de corticolibérine dans ces granules qui participe à l’augmentation de l’inflammation et de la perméabilité intestinale. Chez ces patients, une augmentation de la production de sérotonine, qui accentue le péristaltisme des cellules musculaires lisses coliques, est également observée. HSVC : Hypersensibilité viscérale colique ; 5-HT : sérotonine, TLR :
Toll-like receptor.
|
L’hypersensibilité viscérale
L’hypersensibilité viscérale d’origine colique (HSCV) est reconnue comme une caractéristique importante du SII. Elle reposerait, selon certaines études, sur l’activation de nocicepteurs intestinaux [
12
]. Les patients atteints de SII diarrhéique (SII-D) seraient en effet plus sensibles à la distension rectale que des patients présentant un SII-C (constipation). Néanmoins, d’autres études n’ont pas révélé ces différences [
13
,
14
].
L’altération de la motilité intestinale
La motilité intestinale est très perturbée chez les patients SII. Un transit colique accéléré est en effet observé chez les patients diarrhéique (SII-D), ce qui se traduit par une fréquence de défécation très augmentée. Chez certains de ces patients, des taux sériques élevés de sérotonine (5-HT), qui stimule la motilité intestinale [
15
], ont d’ailleurs été mesurés. Les quantités de chromogranines et de sécrétogranines (des peptides induisant la sécrétion d’hormones digestives
2
) sont également altérées chez les patients SII-D. Ainsi, l’expression de la somatostatine et du neuropeptide Y, connus pour faciliter l’absorption des fluides, est diminuée chez ces patients [
1
].
L’altération de la perméabilité intestinale
Une altération de la perméabilité intestinale est retrouvée chez tous les patients souffrant de SII. Dans une étude réalisée par Jean-François Turcotte
et al.
, une augmentation du nombre des espaces élargis (
gaps
) entre les cellules épithéliales de l’intestin a été mise en évidence, mais sans qu’il n’y ait de différences entre les sous-types de SII concernant cette augmentation [
16
]. La présence d’espaces importants entre cellules épithéliales intestinales et une condensation de leur cytosquelette, favorisant un passage excessif de macromolécules, ont confirmé ces observations sur des biopsies de muqueuse intestinale de patients présentant un SII-D [
17
]. L’expression, évaluée par analyse de leurs ARN messagers, de la claudine-2 (augmentation) et de l’occludine (diminution), deux protéines qui contribuent à la formation des jonctions entre cellules, est également altérée chez ces patients.
|
Le microbiote intestinal, la dysbiose et ses implications cliniques Caractérisation du microbiote intestinal
Chez l’homme, la densité et la composition du microbiote dans le tractus digestif dépendent des propriétés physiologiques du segment du tractus gastro-intestinal que les bactéries colonisent (la concentration locale en oxygène, le pH, la disponibilité en substrats). Elles sont ainsi stratifiées à la fois selon un axe longitudinal (de la bouche au rectum) et transversal (de la lumière digestive vers l’épithélium intestinal). Le microbiote intestinal est abondant surtout dans le compartiment colique, où la diversité et la densité de la population bactérienne sont maximales. L’anaérobiose, des concentrations d’acides biliaires très faibles dues à leur réabsorption au niveau de l’intestin grêle distal, le pH plus alcalin et le ralentissement du péristaltisme, favorisent en effet l’installation d’une flore microbienne complexe dans le côlon [
3
].
Composition du microbiote colique
Environ 95 % des genres bactériens sont communs à tous les individus : ils constituent le cœur phylogénétique (ou «
core
» microbiote). Ce cœur pourrait être responsable des fonctions majeures de l’écosystème digestif [
18
]. Il existe cependant une importante variation inter-individuelle, sur laquelle repose l’identité métagénomique de chaque individu. En plus des variations de diversité microbienne longitudinales, il existe également des différences qualitatives et quantitatives transversales entre les communautés colonisant la muqueuse et la lumière colique. La paroi du côlon est recouverte d’une importante couche de mucus directement au contact de la lumière intestinale [
2
]. Le gradient de dioxygène qui s’établit à ce niveau, de même que la biodisponibilité en nutriments (au niveau du mucus), créent un environnement propice au développement de bactéries aérotolérantes et/ou dégradant le mucus, telles que
Lactobacillaceae
,
Lachnospiraceae
,
Ruminococcaceae
,
Bacteroidaceae
et
Verrucomicrobiaceae
[
19
].
Fonctions du microbiote intestinal Le microbiote intestinal occupe une place primordiale dans le métabolisme des macromolécules endogènes et exogènes (composés alimentaires ingérés, composés chimiques et pharmaceutiques issus de l’environnement). Métabolisme des carbohydrates
La capacité de fermentation de polysaccharides complexes est une caractéristique commune à tous les genres bactériens coliques (principalement
Bacteroides, Bifidobacterium, Ruminococcus
et
Roseburia
), mais le type de fibres métabolisées est spécifique à chaque espèce [
2
]. Ces réactions de fermentation conduisent à la production de métabolites, notamment des gaz (principalement de l’hydrogène, du dioxyde de carbone et du méthane, chez les individus dits méthano-excréteurs) et des produits de fermentation finaux, comme les acides gras à chaîne courte (AGCC) que sont l’acétate, le butyrate et le propionate. Ces acides gras constituent une source d’énergie importante pour les cellules épithéliales coliques. Ils participent, comme les Firmicutes, à l’induction de la production et à la sécrétion de sérotonine, qui stimule la motricité intestinale et le transit [
5
].
Métabolisme des sels biliaires
Ce métabolisme, qui débute au niveau des hépatocytes sous l’action de la 7-a-hydroxylase, est à l’origine de la formation d’acides biliaires primaires à partir du cholestérol. La majorité (95 à 97 %) de ces acides biliaires primaires sont réabsorbés au niveau des entérocytes de l’iléon terminal, puis recyclés
via
la circulation entéro-hépatique. Une faible proportion (5 à 10 %) des acides biliaires primaires est déconjuguée par les bactéries intestinales, notamment par des espèces anaérobies appartenant aux genres
Bacteroides
,
Eubacterium
et
Clostridium
, et forment les acides biliaires secondaires, plus hydrophobes, et dont l’excrétion fécale est facilitée
3
.
|
La dysbiose des patients souffrant de SII Profil microbien des patients SII-D
Les recherches des dernières décennies ont révélé une dysbiose intestinale chez les patients atteints de SII. Celle-ci pourrait jouer un rôle important dans le développement de la maladie
(
Figure 3
)
. Les données de la littérature ne s’accordent cependant pas, d’autant qu’une grande différence existe entre les différents sous-types de SII [
20
]. Néanmoins, certaines modifications de microbiote intestinal caractéristiques ont pu être décrites chez les patients SII-D : une diminution globale de la diversité du microbiote intestinal colique luminal (indice Shannon
4,
), associée cependant à une densité de populations bactériennes similaire chez les sujets SII-D et chez les sujets sains [
20
-
22
]. Le microbiote des patients SII-D se caractérise par une diminution de l’abondance des Firmicutes avec, en parallèle, une augmentation relative de l’abondance des Bacteroidetes ; les Lachnospiraceae, les Gammaproteobacteria et les Enterobacteriaceae avec, notamment, l’espèce
Escherichia coli
, sont plus abondantes [
3
,
20
,
23
]. En revanche, une diminution des genres
Clostridium
,
Streptococcus
et
Bifidobacterium
a été mise en évidence chez ces patients [
5
,
24
]. L’espèce bénéfique
Faecalibacterium prausnitzii
, productrice de butyrate, est également diminuée [
20
,
21
], une diminution corrélée à l’augmentation de la sévérité des ballonnements abdominaux [
25
]. La perte de bactéries méthanogènes, qui consomment l’hydrogène, pourrait expliquer partiellement l’excès de gaz et les diarrhées observés chez les patients SII-D [
26
].
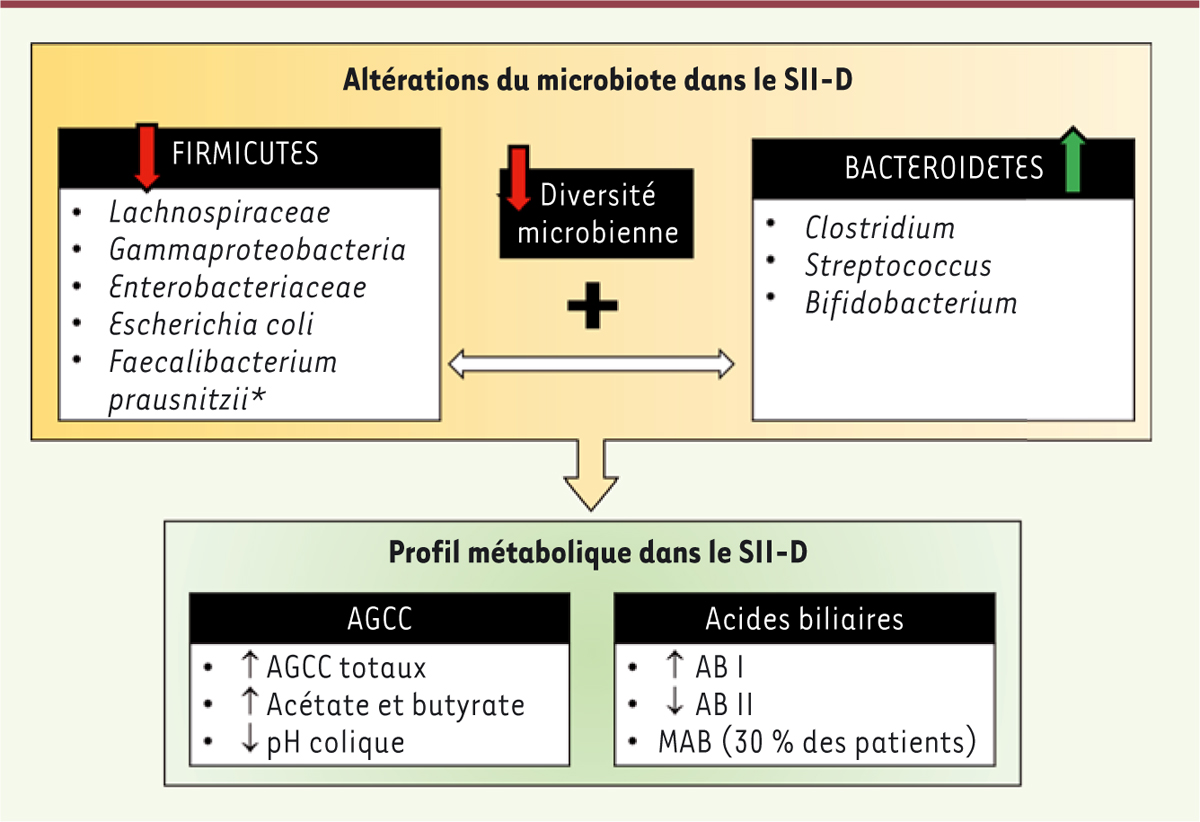
 | Figure 3.
Altérations microbiennes chez les patients atteints du syndrome de l’intestin irritable diarrhéique et profil métabolique associé.
Le microbiote colique des patients atteints du syndrome de l’intestin irritable diarrhéique (SII-D) est caractérisé par une perte de diversité microbienne associée à une diminution globale des Firmicutes, plus précisément des
Lachnospiraceae
,
Gammaproteobacteria
,
Enterobacteriaceae
et de l’espèce
Escherichia coli
. L’espèce
Faecalibacterium prausnitzii
est cependant généralement surreprésentée chez les patients atteints de SII-D, comparativement aux sujets sains. Les Bacteroidetes sont globalement augmentés (surtout les genres
Clostridium
,
Streptococcus
et
Bifidobacterium
). Les bactéries intervenant directement dans le métabolisme des nutriments, le profil métabolique des patients est également altéré, se caractérisant par une augmentation des acides gras à chaîne courte, plus précisément de l’acétate et du butyrate, associée à une baisse du pH colique. Le ratio acides biliaires primaires/acides biliaires secondaires est augmenté, dû en partie à une malabsorption des acides biliaires chez 30 % des patients. AB I : acide biliaire primaire ; AB II : acide biliaire secondaire ; AGCC : acide gras à chaîne courte ; MAB : malabsorption.
|
Acides gras à chaînes courtes et SII-D
Le profil fécal en acides gras à chaînes courtes (AGCC) est très variable chez les patients atteints de SII-D. Aucun consensus n’a été établi concernant la quantité totale, de ces acides gras dans les selles. Giorgio Gargari et
al.
ont cependant montré une différence de leur taux au niveau du côlon chez les patients, en particulier si l’on distingue les sous-types de SII. Chez les patients présentant un SII-D, une augmentation des AGCC coliques totaux, associée à une diminution du pH colique, a en effet été notée, plus précisément en ce qui concerne les proportions d’acétate et de butyrate [
27
].
Acides biliaires et SII-D
Chez les patients atteints de SII, la quantité totale d’acides biliaires excrétée dans les selles reste inchangée par rapport à celle mesurée chez des sujets sains [
24
,
28
]. Néanmoins, Henri Duboc
et al.
ont mis en évidence des taux d’acides biliaires significativement augmentés (pour les acides biliaires primaires) et diminués (pour les acides biliaires secondaires) dans les selles des patients atteints de SII-D, par rapport aux sujets sains
(
Figure 3
)
. Ces altérations métaboliques sont corrélées à la sévérité des symptômes (la fréquence et la consistance des selles), et sont à mettre en relation avec une diminution des réactions de déconjugaison par le microbiote intestinal chez ces patients [
24
]. Soixante-huit pour cent des patients avec un SII-D présentent une augmentation des acides biliaires fécaux totaux, ou une malabsorption des acides biliaires [
29
], ainsi qu’une augmentation de la perméabilité de la paroi intestinale, ce qui provoque des altération de la réabsorption, notamment au niveau de l’iléon terminal. Des modifications de la structure et/ou de la composition du microbiote intestinal, ainsi que le métabolisme des acides biliaires, participeraient ainsi à la pathogenèse du SII-D [
29
].
Hypersensibilité viscérale, perméabilité intestinale et SII-D
Des études récentes, conduites dans des modèles murins d’hypersensibilité viscérale induite et/ou dont la flore a été humanisée avec des selles de patients souffrant de SII-D, ont révélé que l’augmentation de la sensibilité viscérale était directement liée à la présence accrue de
Clostridium sensu stricto
(cluster I), ou de
Fusobacterium nucleatum
[
30
,
31
]. La perméabilité intestinale accrue, qui est retrouvée chez tous les patients atteints de SII, s’améliore avec la prise de
Bifidobacterium longum
et de
Lactobacillus rhamnosus
[
32
]. La prise de
Faecalibacterium prausnitzii
permet également de normaliser la perméabilité colique [
33
]. La diminution de ces bactéries observée chez les patients diarrhéiques pourrait contribuer aux altérations de leur barrière intestinale [
34
].
Sur-activation du système immunitaire et inflammation chez les patients atteints d’un SII-D
La dysbiose microbienne observée chez les patients présentant un SII-D peut également entraîner une activation du système immunitaire, notamment celle des granulocytes éosinophiles, au niveau de la muqueuse intestinale [
35
]. Chez ces patients, les éosinophiles présentent une propension accrue à libérer leurs granules cytoplasmiques, avec une augmentation du taux de corticolibérine dans ces granules. La corticolibérine,
via
son récepteur de type I, est associée aux symptômes des patients atteints d’un SII-D. Elle participe en effet à l’augmentation de l’inflammation et de la perméabilité intestinale, en particulier avec la production de cytokines, comme l’IL(interleukine)-6, le TNF(
tumor necrosis factor
)-α, et l’IL-1β [
35
,
36
]. Les mastocytes présents dans la muqueuse intestinale produisent également un grand nombre de tryptases, qui influencent l’expression des protéines de jonctions serrées. Une augmentation de la densité des espaces entre les cellules épithéliales est ainsi observée chez les patients, induisant une altération de la perméabilité intestinale qui permet le passage accru de macromolécules. L’expression, par les cellules de la paroi colique, de certains récepteurs de l’immunité innée à l’origine d’une réponse inflammatoire, les
Toll-like receptors
(TLR), comme le TLR-4 et le TLR-5, qui reconnaissent des composants bactériens, a été démontrée [
37
]. Les résultats de plusieurs études sont également en faveur d’un rôle possible d’une inflammation de bas grade chez les patients atteints de SII. Celle-ci serait caractérisée par une augmentation de la production de TNF-α, d’IL-6, et par une diminution de celle d’IL-10 (une cytokine anti-inflammatoire), auxquelles la dysbiose pourrait contribuer [
36
-
38
]. L’abondance des Protéobactéries, qui inclut des bactéries pathogènes, est augmentée chez les patients atteints de SII-D. Ces bactéries pourraient ainsi contribuer à cette inflammation [
36
].
|
Traitements et pistes de recherche
Aucun algorithme de diagnostic n’ayant été défini à ce jour, les spécialistes orientent principalement le traitement de la maladie vers le soulagement des symptômes dominants : douleurs abdominales, consistance des selles [
39
]. Aucun traitement n’a démontré une efficacité à long terme, bien que les recommandations associent des traitements pharmacologiques et non pharmacologiques [
3
].
Les traitements pharmacologiques
Les médicaments les plus couramment utilisés dans le traitement du SII sont les antispasmodiques, les antidiarrhéiques, les chélateurs d’acides biliaires (chez les patients atteints de malabsorption des acides biliaires), et les antidépresseurs. Les douleurs abdominales peuvent être contrôlées à court terme par la prise de paracétamol ou d’anti-inflammatoires non stéroïdiens (ibuprofène, aspirine) [
11
]. Un traitement par un antibiotique non absorbable et à large spectre (rifamixine, 550 mg trois fois par jour), durant 2 semaines, est également efficace : une diminution significative des principaux symptômes de SII-D a en effet été observée, par rapport aux patients recevant un placebo, dans deux essais randomisés contrôlés de phase III [
40
]. Ces résultats soutiennent ainsi l’hypothèse qu’une modification du microbiote intestinal pourrait avoir un rôle important dans les SII-D.
Les traitements non pharmacologiques Alimentation et prébiotiques
De nombreux traitements non pharmacologiques font actuellement l’objet d’études pour le traitement du SII. Notamment, plusieurs études se sont focalisées sur une adaptation du régime alimentaire des patients. Une amélioration de leurs symptômes a été obtenue grâce à des régimes réduits en hydrates de carbone à chaîne courte et en polyols, les FODMAP (
fermentable oligo-, di- and mono-saccharides and polyols
), qui sont fréquemment retrouvés dans l’alimentation de type occidental moderne et dans les régimes riches en gluten. Ces FODMAP ne sont pas absorbés par l’intestin grêle. Ils se retrouvent au niveau du côlon où ils sont fermentés par les microorganismes. Dans certaines études réduisant les FODMAP, une diminution de la fermentation colique a pu être observée. Elle se traduit par une réduction de la production de gaz et de la quantité d’eau arrivant au niveau du côlon, limitant ainsi les phénomènes de distension colique et les symptômes d’inconfort digestif associés (ballonnement, douleurs abdominales et diarrhées). Ce régime pauvre en FODMAP peut cependant diminuer la richesse microbienne à long terme. Son innocuité reste donc à démontrer [
41
]. Une autre catégorie d’aliments, des saccharides indigestibles classés comme prébiotiques favorisent la croissance et/ou l’activité de bactéries potentiellement bénéfiques (les bifidobacteries). Des essais testant l’effet d’une prise quotidienne de ces prébiotiques ont révélé une augmentation de la qualité de vie des patients souffrant de SII, associée à une diminution de leurs symptômes typiques (flatulences et douleurs abdominales). Néanmoins, les doses et les durées de traitement restent à établir pour le SII-D [
36
].
Probiotiques.
De nombreuses études cliniques visent à tester l’effet de certaines souches de bactéries sur l’homéostasie intestinale des patients [
5
]. Kenzie Preston
et al.
ont ainsi évalué, dans un essai randomisé contrôlé, différentes souches de
Lactobacillus
(
L. acidophilus
CL1285,
L.
casei
LBC80R et
L. rhamnosus
CLR2) consommées par voie orale à dose quotidienne de 50 x 10
9
UFC (unité formant colonie) par jour. Une amélioration de la qualité de vie a été notée chez les patients souffrant de SII-D (principalement ceux de sexe féminin). Une diminution de la fréquence et une amélioration de la consistance des selles ont également été observées chez les deux sexes [
42
]. D’autres études utilisant diverses combinaisons de probiotiques ont rapporté une diminution des symptômes avec une amélioration de la consistance des selles et de la fonction mucosale chez les patients atteints de SII-D [
29
,
43
]. Il est important de mentionner que tous les probiotiques n’ont pas le même effet, et une meilleure caractérisation de ces effets reste à faire pour bien cibler cette population de patients.
Transplantation de microbiote fécal
La transplantation de microbiote fécal (TMF), qui consiste à rétablir la communauté bactérienne par une transplantation de microbiote provenant de selles d’un individu sain, a été récemment testée dans un essai randomisé contrôlé chez les patients atteints de SII-D et de SII-M (à prédominance diarrhéique, selon Rome III), mais dans une analyse unicentrique effectuée sur un petit groupe d’individus (n=90) [
44
]. Une amélioration significative des symptômes, après trois mois de traitement, a été observée chez les patients transplantés, comparativement au groupe témoin ne recevant pas de transplantation fécale. L’amélioration n’a néanmoins pas été maintenue à long terme [
44
]. À ce jour, aucun essai randomisé contrôlé réalisé sur une cohorte composée exclusivement de patients atteints de SII-D n’a été publié.
|
Le syndrome de l’intestin irritable (SII) est une maladie multifactorielle très répandue dans le monde. Son diagnostic est difficile, le plus souvent par exclusion d’autres maladies digestives. Les profils métaboliques, microbiens et physiologiques variant fortement entre sous-types de SII, il est difficile d’établir un profil caractéristique global de la maladie et de proposer une stratégie thérapeutique unique. Néanmoins, la présence d’une dysbiose intestinale, par perte de diversité microbienne, est une caractéristique commune à tous les sous-types. Plus spécifiquement, chez les patients atteints de SII-D, cette dysbiose se caractérise par une augmentation des Bifidobactéries, au détriment des Firmicutes et des Protéobactéries. Les thérapies actuellement disponibles visent à diminuer la fréquence de défécation, en ciblant les métabolites coliques et les douleurs abdominales. Les travaux les plus récents s’orientent vers un rétablissement de la composition du microbiote intestinal des patients diarrhéiques par des méthodes non pharmacologiques (alimentation, probiotiques et transplantation de microbiote fécal), dont les effets sont bénéfiques, mais sans qu’il soit possible de savoir pour l’instant si la perturbation du microbiote intestinal observée est une conséquence de la maladie ou un facteur déclencheur. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient le Dr Annick Bernallier-Donadille (UMR MEDIS) pour les discussions enrichissantes sur le syndrome de l’intestin irritable, et tous les membres du laboratoire MEDIS et de la duck family pour les discussions sur le microbiote intestinal.
|
Footnotes |
1.
Camilleri
M
.
Intestinal secretory mechanisms in irritable bowel syndrome-diarrhea.
.
Clin Gastroenterol Hepatol.
2015;
;
13
:
:1051.
–
7
;
quiz e61–2.
.
2.
Pereira
FC
,
Berry
D
.
Microbial nutrient niches in the gut.
.
Environ Microbiol.
2017;
;
19
:
:1366.
–
1378
.
3.
Marteau
P
,
Doré
J
.
Le microbiote intestinal, un organe à part entière.
.
Paris:
:
John Libbey Eurotext;
,
2017
,
:338.
p
4.
Normand
S
,
Secher
T
,
Chamaillard
M
.
La dysbiose, une nouvelle entité en médecine ?
.
Med Sci (Paris).
2013;
;
29
:
:586.
–
589
.
5.
Enck
P
,
Aziz
Q
,
Barbara
G
,
et al.
Irritable bowel syndrome.
.
Nat Rev Dis Primers.
2016;
;
2
:
:16014.
.
6.
Lacy
BE
,
Patel
NK
.
Rome criteria and a diagnostic approach to irritable bowel syndrome.
.
J Clin Med.
2017
;
:6.
.
7.
Canavan
C
,
West
J
,
Card
T
.
The epidemiology of irritable bowel syndrome.
.
Clin Epidemiol.
2014;
;
6
:
:71.
–
80
.
8.
Kim
YS
,
Kim
N
.
Sex-gender differences in irritable bowel syndrome.
.
J Neurogastroenterol Motil.
2018;
;
24
:
:544.
–
558
.
9.
Kamm
MA
,
Farthing
MJ
,
Lennard-Jones
JE
.
Bowel function and transit rate during the menstrual cycle.
.
Gut.
1989;
;
30
:
:605.
–
608
.
10.
Van der Giessen
J
,
van der Woude
CJ
,
Peppelenbosch
MP
,
Fuhler
GM
.
A direct effect of sex hormones on epithelial barrier function in inflammatory bowel disease models.
.
Cells.
2019
;
:8.
.
11.
Pietrzak
A
,
Skrzydlo-Radomanska
B
,
Mulak
A
,
et al.
Guidelines on the management of irritable bowel syndrome: in memory of Professor Witold Bartnik.
.
Prz Gastroenterol.
2018;
;
13
:
:259.
–
288
.
12.
Chang
L
,
Heitkemper
MM
,
Wiley
JW
,
Camilleri
M
.
2015 James W. Freston single topic conference: a renaissance in the understanding and management of irritable bowel syndrome.
.
Gastroenterology.
2016;
;
151
:
:e1.
–
e8
.
13.
Delvaux
M
.
Role of visceral sensitivity in the pathophysiology of irritable bowel syndrome.
.
Gut.
2002;
;
51
(
(suppl 1)
):
:i67.
–
i71
.
14.
Zhou
Q
,
Verne
GN
.
New insights into visceral hypersensitivity: clinical implications in IBS.
.
Nat Rev Gastroenterol Hepatol.
2011;
;
8
:
:349.
–
355
.
15.
Camilleri
M
.
Physiological underpinnings of irritable bowel syndrome: neurohormonal mechanisms.
.
J Physiol.
2014;
;
592
:
:2967.
–
2980
.
16.
Turcotte
JF
,
Kao
D
,
Mah
SJ
,
et al.
Breaks in the wall: increased gaps in the intestinal epithelium of irritable bowel syndrome patients identified by confocal laser endomicroscopy (with videos).
.
Gastrointest Endosc.
2013;
;
77
:
:624.
–
630
.
17.
Martinez
C
,
Rodino-Janeiro
BK
,
Lobo
B
,
et al.
miR-16 and miR-125b are involved in barrier function dysregulation through the modulation of claudin-2 and cingulin expression in the jejunum in IBS with diarrhoea.
.
Gut.
2017;
;
66
:
:1537.
–
1538
.
18.
Turnbaugh
PJ
,
Ley
RE
,
Hamady
M
,
et al.
The human microbiome project.
.
Nature.
2007;
;
449
:
:804.
–
810
.
19.
Matsumoto
H
,
Shiotani
A
,
Katsumata
R
, et al.
Mucosa-associated microbiota in patients with irritable bowel syndrome: a comparison of subtypes.
.
Digestion.
2021;
;
102
:
:49.
–
56
.
20.
Carroll
IM
,
Ringel-Kulka
T
,
Siddle
JP
,
Ringel
Y
.
Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome.
.
Neurogastroenterol Motil.
2012;
;
24
:
:521.
–
30-e248
.
21.
Maharshak
N
,
Ringel
Y
,
Katibian
D
,
et al.
Fecal and mucosa-associated intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome.
.
Dig Dis Sci.
2018;
;
63
:
:1890.
–
1899
.
22.
Zhuang
X
,
Tian
Z
,
Li
L
,
et al.
Fecal microbiota alterations associated with diarrhea-predominant irritable bowel syndrome.
.
Front Microbiol.
2018;
;
9
:
:1600.
.
23.
De Palma
G
,
Lynch
MD
,
Lu
J
,
et al.
Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice.
.
Sci Transl Med.
2017;
;
9
:
:eaaf6397.
.
24.
Duboc
H
,
Rainteau
D
,
Rajca
S
,
et al.
Increase in fecal primary bile acids and dysbiosis in patients with diarrhea-predominant irritable bowel syndrome.
.
Neurogastroenterol Motil.
2012;
;
24
:
:513.
–
20-e246-7
.
25.
Li
G
,
Yang
M
,
Jin
Y
,
et al.
Involvement of shared mucosal-associated microbiota in the duodenum and rectum in diarrhea-predominant irritable bowel syndrome.
.
J Gastroenterol Hepatol.
2018;
;
33
:
:1220.
–
1226
.
26.
Pozuelo
M
,
Panda
S
,
Santiago
A
,
et al.
Reduction of butyrate- and methane-producing microorganisms in patients with irritable bowel syndrome.
.
Sci Rep.
2015;
;
5
:
:12693.
.
27.
Gargari
G
,
Taverniti
V
,
Gardana
C
,
et al.
Fecal clostridiales distribution and short-chain fatty acids reflect bowel habits in irritable bowel syndrome.
.
Environ Microbiol.
2018;
;
20
:
:3201.
–
3213
.
28.
Peleman
C
,
Camilleri
M
,
Busciglio
I
,
et al.
Colonic transit and bile acid synthesis or excretion in patients with irritable bowel syndrome-diarrhea without bile acid malabsorption.
.
Clin Gastroenterol Hepatol.
2017;
;
15
:
:720.
–
7e1
.
29.
Zhan
K
,
Zheng
H
,
Li
J
,
et al.
Gut microbiota-bile acid crosstalk in diarrhea-irritable bowel syndrome.
.
Biomed Res Int.
2020;
;
2020
:
:3828249.
.
30.
Li
YJ
,
Li
J
,
Dai
C
.
The role of intestinal microbiota and mast cell in a rat model of visceral hypersensitivity.
.
J Neurogastroenterol Motil.
2020;
;
26
:
:529.
–
38
.
31.
Gu
X
,
Song
LJ
,
Li
LX
,
et al.
Fusobacterium nucleatum causes microbial dysbiosis and exacerbates visceral hypersensitivity in a colonization-independent manner.
.
Front Microbiol.
2020;
;
11
:
:1281.
.
32.
Bonfrate
L
,
Di Palo
DM
,
Celano
G
,
et al.
Effects of Bifidobacterium longum BB536 and Lactobacillus rhamnosus HN001 in IBS patients.
.
Eur J Clin Invest.
2020;
;
50
:
:e13201.
.
33.
Laval
L
,
Martin
R
,
Natividad
JN
,
et al.
Lactobacillus rhamnosus CNCM I-3690 and the commensal bacterium Faecalibacterium prausnitzii A2–165 exhibit similar protective effects to induced barrier hyper-permeability in mice.
.
Gut Microbes.
2015;
;
6
:
:1.
–
9
.
34.
Lopez-Siles
M
,
Martinez-Medina
M
,
Busquets
D
,
et al.
Mucosa-associated Faecalibacterium prausnitzii and Escherichia coli co-abundance can distinguish irritable bowel syndrome and inflammatory bowel disease phenotypes.
.
Int J Med Microbiol.
2014;
;
304
:
:464.
–
475
.
35.
Salvo-Romero
E
,
Martinez
C
,
Lobo
B
,
et al.
Overexpression of corticotropin-releasing factor in intestinal mucosal eosinophils is associated with clinical severity in diarrhea-predominant irritable bowel syndrome.
.
Sci Rep.
2020;
;
10
:
:20706.
.
36.
Chong
PP
,
Chin
VK
,
Looi
CY
,
et al.
The microbiome and irritable bowel syndrome - a review on the pathophysiology, current research and future therapy.
.
Front Microbiol.
2019;
;
10
:
:1136.
.
37.
Shukla
R
,
Ghoshal
U
,
Ranjan
P
,
Ghoshal
UC
.
Expression of Toll-like receptors, pro-, and anti-inflammatory cytokines in relation to gut microbiota in irritable bowel syndrome: the evidence for its micro-organic basis.
.
J Neurogastroenterol Motil.
2018;
;
24
:
:628.
–
642
.
38.
Zhen
Y
,
Chu
C
,
Zhou
S
,
et al.
Imbalance of tumor necrosis factor-alpha, interleukin-8 and interleukin-10 production evokes barrier dysfunction, severe abdominal symptoms and psychological disorders in patients with irritable bowel syndrome-associated diarrhea.
.
Mol Med Rep.
2015;
;
12
:
:5239.
–
5245
.
39.
Lacy
B
,
Ayyagari
R
,
Guerin
A
,
et al.
Factors associated with more frequent diagnostic tests and procedures in patients with irritable bowel syndrome.
.
Therap Adv Gastroenterol.
2019;
;
12
:
:1756284818818326.
.
40.
Pimentel
M
,
Lembo
A
,
Chey
WD
,
et al.
Rifaximin therapy for patients with irritable bowel syndrome without constipation.
.
N Engl J Med.
2011;
;
364
:
:22.
–
32
.
41.
Staudacher
HM
,
Whelan
K
.
The low FODMAP diet: recent advances in understanding its mechanisms and efficacy in IBS.
.
Gut.
2017;
;
66
:
:1517.
–
1527
.
42.
Preston
K
,
Krumian
R
,
Hattner
J
,
et al.
Lactobacillus acidophilus CL1285, Lactobacillus casei LBC80R and Lactobacillus rhamnosus CLR2 improve quality-of-life and IBS symptoms: a double-blind, randomised, placebo-controlled study.
.
Benef Microbes.
2018;
;
9
:
:697.
–
706
.
43.
Kim
HJ
,
Camilleri
M
,
McKinzie
S
,
et al.
A randomized controlled trial of a probiotic, VSL#3, on gut transit and symptoms in diarrhoea-predominant irritable bowel syndrome.
.
Aliment Pharmacol Ther.
2003;
;
17
:
:895.
–
904
.
44.
Johnsen
PH
,
Hilpusch
F
,
Cavanagh
JP
,
et al.
Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial.
.
Lancet Gastroenterol Hepatol.
2018;
;
3
:
:17.
–
24
.
|