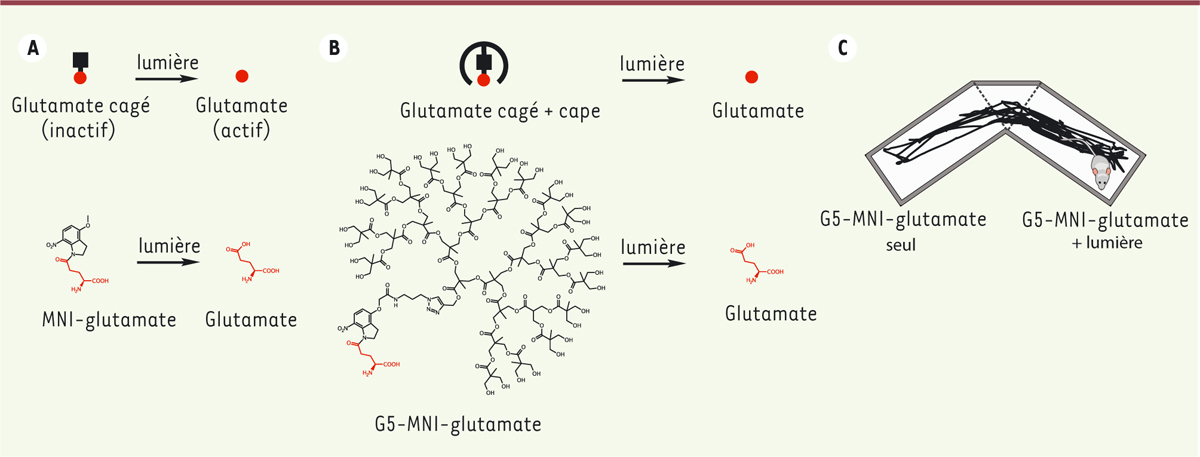
Pour comprendre un processus biologique complexe, il est nécessaire de disposer d’outils permettant de manipuler les différents acteurs moléculaires et cellulaires impliqués. Dans ce contexte, la lumière est un stimulus intéressant pour perturber un système de manière spécifique et avec une grande résolution spatio-temporelle. Le gain de résolution par rapport aux perturbations génétiques ou pharmacologiques classiques résulte du stimulus lui-même - l’illumination -, qui peut être contrôlé avec des résolutions de l’ordre de la milliseconde et de quelques centaines de nanomètres. La lumière possède un autre avantage de taille : sa nature orthogonale 1 , puisque les cellules et tissus des mammifères ne sont en général pas intrinsèquement photosensibles. Le stimulus lumineux permet ainsi d’atteindre une spécificité fonctionnelle, sans effet indésirable sur les fonctions natives de la cellule hôte. Chimistes et biologistes ont donc développé de nombreuses méthodes permettant de rendre les (macro)molécules biologiques photo-contrôlables [ 1 ].
Parmi ces méthodes, les composés cagés sont probablement les outils photochimiques qui ont été les plus utilisés en biologie [ 2 ]. Les composés cagés sont des molécules dont l’activité biologique est masquée par un groupement photo-décomposable (ou photolysable). Sous l’action de la lumière, la cage se décompose, libérant ainsi la biomolécule ( Figure 1A ) . La libération rapide de la biomolécule au sein d’un tissu permet d’assurer un contrôle spatio-temporel efficace, en s’affranchissant des limites inhérentes à la diffusion des molécules. Les composés cagés doivent néanmoins répondre à plusieurs critères indispensables : 1) ils doivent être biologiquement inertes dans l’obscurité avant photolyse, et complètement actifs après irradiation par la lumière ; 2) la cinétique de « décageage » doit être plus rapide que le processus biologique étudié ; et 3) la photolyse doit être efficace, pour minimiser les quantités de composé cagé à utiliser, et éviter ainsi les effets adverses ou l’insolubilité du composé à forte concentration.
| Figure 1.
Photolyse de glutamate chez la souris dans une tâche comportementale. A.
En haut : principe du glutamate cagé. Le glutamate cagé est inactif à l’obscurité. Sous l’action de la lumière, la cage libère le glutamate. En bas : structure chimique et photolyse du MNI-glutamate.
B.
Similaire à
(A)
, pour le G5-MNI-glutamate.
C.
Expérience de préférence de place conditionnée par photolyse de glutamate dans l’aire tegmentale ventrale de la souris. La trajectoire de la souris dans l’environnement est montrée par le trait noir. La souris passe plus de temps dans le compartiment associé à la stimulation lumineuse que dans le compartiment témoin (injection de G5-MNI-glutamate sans stimulation lumineuse).
|
Des biomolécules de tous les types (neurotransmetteurs, ions, messagers secondaires, nucléotides…) et de toutes les tailles (du proton aux protéines) ont été cagées [ 2 ]. Le glutamate cagé est le neurotransmetteur cagé le plus utilisé en neurosciences. Le glutamate est en effet le principal neurotransmetteur excitateur du système nerveux central - quasiment tous les neurones sont excités par le glutamate -, et son relargage rapide par la lumière est particulièrement utile pour stimuler les synapses et cartographier les connections neuronales [ 2 ]. Depuis la première description d’un glutamate cagé, de nombreuses améliorations ont été apportées au chromophore (la cage) afin de renforcer la stabilité à l’hydrolyse (décageage imprévu à l’obscurité), d’augmenter la cinétique et le rendement de photolyse, d’améliorer l’absorption à deux-photons 2 , et de minimiser les effets secondaires de la cage sur les tissus biologiques (pour revue, voir [ 3 ]). Le 4-methoxy-7-nitroindolinyl (MNI)-glutamate ( Figure 1A ) a été développé pour répondre à ces besoins [ 4 , 5 ]. Le MNI-glutamate, commercialement disponible, est notamment sensible à l’activation à deux-photons, ce qui permet une meilleure résolution spatiale de décageage (jusqu’à l’échelle des épines dendritiques) [ 5 ] et une libération de glutamate en profondeur dans les tissus, la lumière infra-rouge proche utilisée pour l’excitation à deux-photons pénétrant mieux dans les tissus biologiques [ 6 ]. Le MNI-glutamate a donc été largement utilisé en physiologie synaptique ex vivo , sur des tranches de cerveau, notamment pour cartographier la distribution tissulaire de récepteurs du glutamate, ou encore pour induire la plasticité synaptique d’épines dendritiques uniques [ 3 ].
Malgré ces avancées majeures en termes de photochimie, le MNI et les autres cages développées pour cager le glutamate ont une limitation majeure : elles ont toutes des propriétés antagonistes des récepteurs GABA A et ne sont donc pas complètement inertes à l’obscurité [ 3 ]. Les tentatives pour diminuer cet effet adverse ont jusqu’ici échoué. Si l’antagonisme des récepteurs GABA A n’est pas nécessairement préjudiciable à l’étude du fonctionnement synaptique dans des tranches de tissu cérébral, il interdit en revanche l’utilisation in vivo , en raison du risque de déclencher des crises d’épilepsies. Nous avons donc développé, en collaboration avec Graham Ellis-Davies ( Mount Sinai school of medicine , New York, États-Unis), un glutamate cagé complètement inerte envers les récepteurs GABA A , et montré qu’il pouvait être utilisé chez la souris pour manipuler des tâches comportementales [ 7 ].
L’idée, pour empêcher le MNI-glutamate d’interagir avec les récepteurs GABA A, a été d’envelopper le groupement MNI dans un dendrimère 3 de cinquième génération (G5), qui agit comme une cape d’invisibilité ( Figure 1B ) . Les dendrimères ont une excellente biocompatibilité, une grande stabilité dans les tampons biologiques, et ils ne présentent aucune toxicité pour les cellules [ 8 ]. Un dendrimère avait d’ailleurs déjà été utilisé avec succès pour rendre un GABA cagé complètement inerte à l’obscurité [ 9 ]. Nous avons montré que le nouveau composé, appelé G5-MNI-glutamate ( Figure 1B ) , possède les mêmes propriétés photochimiques que le composé parent MNI-glutamate, et que le décageage 1-photon sur tranches de cerveau induit des courants glutamatergiques entrants dans les neurones pyramidaux de l’hippocampe similaires à ceux observés avec le MNI-glutamate [ 7 ]. Nous avons ensuite examiné les courants inhibiteurs GABAergiques dans ces neurones, et trouvé que le G5-MNI-glutamate, pour des concentrations allant jusqu’à 1 mM, n’a aucune propriété antagoniste des récepteurs GABA A .
Encouragés par ces résultats, nous avons ensuite testé la possibilité de manipuler un comportement chez la souris par décageage de glutamate. Notre équipe a été pionnière dans le développement de méthodes de photocontrôle des récepteurs naturellement présents dans les neurones [ 10 ]. Pour utiliser le G5-MNI-glutamate, nous avons dû utiliser une sonde opto-fluidique (Doric lenses) qui permet d’injecter le composé cagé dans une région du cerveau tout en illuminant cette région à l’aide d’une fibre optique. Nous avons placé cette sonde opto-fluidique juste au-dessus de l’aire tegmentale ventrale, un noyau dopaminergique impliqué dans l’apprentissage par renforcement, et utilisé la tâche comportementale de préférence de place conditionnée [ 10 ]. C’est une forme de conditionnement pavlovien, qui permet de mesurer l’effet récompensant d’un stimulus donné, par exemple une drogue, une récompense naturelle ou encore une interaction sociale. Dans notre cas, nous avons mesuré le temps que passe la souris dans un compartiment qui a été préalablement associé à un stimulus artificiel, le décageage de glutamate, et l’avons comparé avec le temps passé dans un autre compartiment témoin, où le G5-MNI-glutamate est injecté dans l’aire tegmentale ventrale, mais sans illumination de cette région ( Figure 1C ) . Si le décageage de glutamate dans l’aire tegmentale ventrale est efficace, il devrait conduire à l’activation des neurones dopaminergiques de cette zone, à la production de dopamine, et donc à un conditionnement de l’animal pour le compartiment associé à la stimulation lumineuse. C’est effectivement ce que nous avons observé : les souris passaient en moyenne plus de temps dans le compartiment associé au décageage que dans le compartiment témoin. Le décageage de glutamate a donc permis à la souris d’apprendre à retourner dans le compartiment où ses neurones dopaminergiques ont été stimulés (un apprentissage par renforcement).
Le G5-MNI-glutamate possède donc toutes les qualités photochimiques et pharmacologiques requises pour la manipulation des circuits neuronaux chez la souris dans des tâches comportementales. Contrairement aux techniques optogénétiques de stimulation neuronale, fondées sur l’expression d’opsines microbiennes, le décageage ne nécessite pas de manipulation génétique, et permet donc le photocontrôle de tissus natifs [ 1 ]. Un autre atout de la cape de dendrimère est qu’elle augmente considérablement la solubilité des composés auxquels elle est attachée [ 9 ], un avantage considérable pour les cages, qui sont des composés chimiques généralement hydrophobes. Nous prévoyons la possibilité que la cape de dendrimère soit facilement greffée sur n’importe quel neurotransmetteur cagé, ouvrant la voie à la manipulation optique de l’activité synaptique in vivo .