| |
| Med Sci (Paris). 37(6-7): 585–587. doi: 10.1051/medsci/2021071.Syndrome métabolique Vers une thérapie cellulaire utilisant des adipocytes humains transformés par une technique CRISPR/Cas9 Morgane Baron1,2 and Amélie Bonnefond1,2* 1Inserm UMR1283, CNRS UMR8199, European genomic institute for diabetes (EGID), Institut Pasteur de Lille
,
1 place de Verdun
,
59000Lille
,
France
.
2Université de Lille, CHU de Lille
,
59000Lille
,
France
.
MeSH keywords: Adipocytes, Systèmes CRISPR-Cas, Thérapie cellulaire et tissulaire, Édition de gène, Humains, Syndrome métabolique X, génétique, thérapie |
Le contrôle du métabolisme énergétique implique les adipocytes du tissu adipeux blanc, majoritaire, mais aussi ceux du tissu adipeux brun ou beige, qui expriment le gène
UCP1
(
uncoupling protein 1
) et qui améliorent l’équilibre métabolique en augmentant la dépense énergétique [
1
,
2
] (
→
).
(→) Voir la Nouvelle de D. Ricquier
et al
.,
m/s
n° 5, mai 2002, page 537
Dans l’espèce humaine, le tissu adipeux blanc est réparti dans tout le corps, alors que le tissu adipeux brun est concentré dans des zones limitées de dépôt graisseux profond au niveau des régions cervicale et supra-claviculaire, et de l’espace paravertébral thoracique [
3
] (
→
).
(→) Voir la Synthèse de A. Carrière
et al
.,
m/s
n° 8-9, août-septembre 2009, page 729
L’obésité et le syndrome métabolique constituent actuellement des problèmes majeurs de santé publique, qui justifient une recherche thérapeutique active. Comparée à l’utilisation de molécules thérapeutiques, la thérapie cellulaire offre des avantages majeurs pour traiter certaines maladies, car elle cible des organes et des types cellulaires spécifiques, dans lesquels elle peut activer des communications intercellulaires et entraîner la sécrétion de multiples facteurs actifs, conduisant à des effets thérapeutiques plus globaux et pérennes. Dans un article récent, Wang
et al
. présentent une approche prometteuse par thérapie cellulaire, fondée sur le rôle bénéfique du tissu adipeux brun [
4
].
|
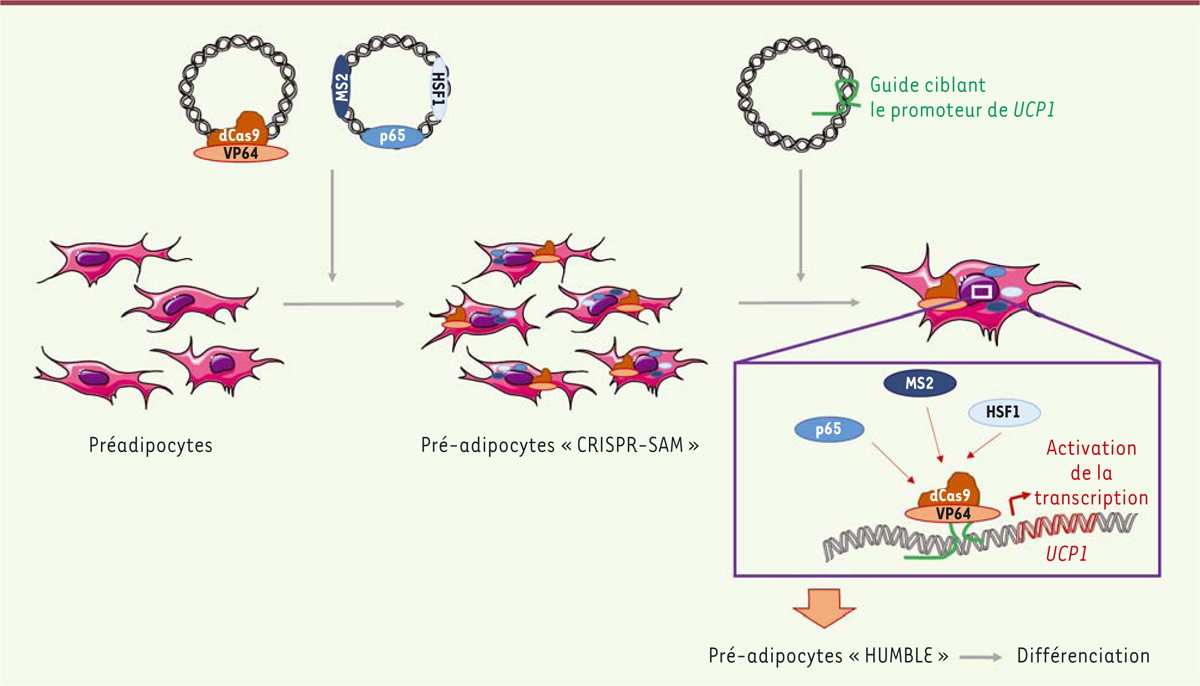
Production d’adipocytes humains surexprimant UCP1 par une méthode dérivée de la technique CRISPR/Cas9
Les auteurs ont transformé des cellules humaines immortalisées à partir de pré-adipocytes blancs en cellules apparentées à des adipocytes bruns, qu’ils ont appelées cellules HUMBLE (
human-brown like
) [
4
]. Pour ce faire, ils ont activé l’expression du gène
UCP1
dans ces cellules immortalisées, en utilisant un système d’activation transcriptionnelle synergique dérivé de la technique CRISPR/Cas9 [
5
] (
→
) dans lequel une enzyme Cas9 modifiée (dCas9), qui ne peut plus couper l’ADN, est couplée à des domaines de transactivation de la transcription ; leur action conjointe est dirigée par un « ARN guide » ciblant le promoteur spécifique d’un gène et qui se lie à dCas9 [
6
]. Ce système, initialement développé dans le laboratoire dirigé par Feng Zhang, joue ainsi le rôle d’un complexe de transcription permettant l’activation de l’expression d’un gène spécifique. Les auteurs ont en fait produit trois types de lentivirus recombinants, permettant une expression stable du gène d’intérêt (ici,
UCP1
) : le premier contenait la séquence codant dCas9, associée à celle codant un activateur transcriptionnel (VP64) permettant le recrutement des facteurs de transcription ; le second contenait la séquence codant une protéine de fusion composée de la protéine d’enveloppe du bactériophage MS2, de la sous-unité p65 du facteur de transcription NFkB, et du domaine d’activation du
heat shock factor 1
(HSF1) ; le troisième codait l’ARN guide ciblant le promoteur du gène
UCP1 (
Figure 1
)
. Des pré-adipocytes blancs humains ont d’abord été infectés avec les deux premiers types de lentivirus, pour obtenir une expression stable de dCas9 associée au complexe de transcription
(
Figure 1
)
. Ces cellules, appelées « CRISPR-SAM » (
synergistic activation mediator
), ont ensuite été infectées avec le lentivirus codant l’ARN ciblant le promoteur de
UCP1
, ce qui a permis d’activer fortement la transcription de ce gène
(
Figure 1
)
. La caractérisation des adipocytes différenciés exprimant
UCP1
(cellules HUMBLE) a montré que ces cellules présentent les propriétés structurelles et fonctionnelles des adipocytes bruns, telles que l’augmentation de l’expression de gènes spécifiques (
SLC2A1
[
GLUT1
],
PPARGC1A
[
PGC1
a],
NRF1
et
CPT1B
), de l’activité mitochondriale et de la thermogenèse.
(→) Voir la Chronique génomique de B. Jordan,
m/s
n° 1, janvier 2021, page 77
 | Figure 1.
Technique CRISPR/dCas9 utilisée pour activer l’expression du gène
UCP1
dans les pré-adipocytes humains.
|
|
Amélioration du métabolisme énergétique chez des souris transplantées avec les cellules HUMBLE
Les pré-adipocytes HUMBLE ont été transplantés dans le tissu sous-cutané thoracique chez des souris immuno-déficientes (souris BALB/c
nude
). Par ailleurs, des pré-adipocytes blancs ou bruns issus du même donneur humain ont été transplantés dans la même zone chez d’autres souris
nude
utilisées comme témoins. Les trois groupes de souris ont été soumises à un régime alimentaire riche en graisses, commencé deux semaines avant la transplantation et durant six semaines. Par rapport aux souris transplantées avec les pré-adipocytes blancs, les souris transplantées avec des pré-adipocytes HUMBLE, comme celles transplantées avec les pré-adipocytes bruns, présentaient une amélioration significative du métabolisme énergétique, avec notamment une réduction de la prise de poids, et une amélioration de la sensibilité à l’insuline, de la tolérance au glucose et de la réponse à une exposition au froid. Ce résultat a été confirmé avec des pré-adipocytes HUMBLE et des pré-adipocytes bruns provenant d’un autre donneur, et également avec des adipocytes HUMBLE matures et des adipocytes bruns matures. Des résultats semblables ont été obtenus avec un régime riche en graisses de plus longue durée, commencé deux semaines avant la transplantation des pré-adipocytes et durant 14 semaines.
Il est remarquable que les pré-adipocytes ou adipocytes matures HUMBLE ou bruns qui ont été transplantés étaient capables d’activer à distance le tissu adipeux brun des souris, et d’y induire ses effets métaboliques bénéfiques, incluant notamment une augmentation de la captation du glucose et une activation du programme de thermogenèse. Pour mieux comprendre cette observation, les auteurs ont réalisé des expériences de co-culture
in vitro
, en mélangeant des adipocytes bruns (issus de cultures primaires de cellules humaines ou murines) avec des adipocytes blancs ou HUMBLE, ou en ajoutant le milieu de culture contenant les facteurs sécrétés par ces cellules. Ils ont alors trouvé que les adipocytes bruns mis en présence des cellules HUMBLE présentaient une augmentation de la captation de glucose et une activation du programme de thermogenèse, qui étaient liées à une élévation du métabolisme des nitrites/nitrates dans les cellules HUMBLE.
In vivo
, l’augmentation de la production de monoxyde d’azote par les cellules HUMBLE a conduit à l’activation à distance du tissu adipeux brun par l’intermédiaire des globules rouges (qui peuvent fixer le monoxyde d’azote), et donc à l’amélioration du métabolisme à l’échelle de l’organisme entier.
Par ailleurs, il a été montré que le sérum des souris transplantées avec les cellules HUMBLE contenait de l’adiponectine humaine, suggérant que ces transplants de cellules HUMBLE se comportaient comme un tissu endocrine capable de sécréter des adipokines et d’autres facteurs dans la circulation sanguine de l’hôte. Ainsi, des transplants de pré-adipocytes humains génétiquement modifiés pour exprimer
UCP1
ont induit, chez les souris hôtes, une activation à distance du tissu adipeux endogène, permettant une amélioration significative du métabolisme énergétique et une activation de la thermogenèse.
|
Les résultats présentés dans cet article ouvrent la voie à une nouvelle stratégie thérapeutique dans l’obésité et la résistance à l’insuline, par inoculation de cellules génétiquement modifiées, afin de favoriser la dépense énergétique chez les individus obèses et d’améliorer leur tolérance au glucose. Une limitation de cette étude est l’utilisation de souris
nude
, afin d’éviter la réaction immunitaire dirigée contre les cellules humaines transplantées. La déficience en cellules immunitaires et en cytokines de ces souris peut en effet avoir biaisé les résultats des tests métaboliques. Afin d’éviter une réaction immunitaire due à l’expression continue, par les cellules transplantées, de dCas9 et des complexes moléculaires associés, un article diffusé en prépublication dans
BioRxiv
présente une nouvelle méthode permettant de délivrer un complexe d’
editing
du génome
ex vivo
, qui induit une extinction quasi-totale de l’expression du gène
NRIP1
(
nuclear receptor-interacting protein 1
) codant un suppresseur de la thermogenèse dans les adipocytes humains
1
.
Par ailleurs, pour produire les cellules HUMBLE, Wang
et al
. ont utilisé des cultures de cellules humaines immortalisées en partant de pré-adipocytes issus de deux individus seulement. Or, afin d’assurer l’innocuité de cette stratégie de thérapie cellulaire, il faudrait pouvoir recourir à des cultures primaires (des cellules non immortalisées), ce qui impliquerait de disposer d’un grand nombre d’individus donneurs et d’adapter le protocole d’
editing
du génome, qui sera probablement moins aisé dans de telles cellules.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Ouellet
V
,
Labbé
SM
,
Blondin
DP
,
et al.
Brown adipose tissue oxidative metabolism contributes to energy expenditure during acute cold exposure in humans.
.
J Clin Invest.
2012;
;
122
:
:545.
–
552
.
2.
Ricquier
D
,
Miroux
B
,
Gonzalez-Barroso
MM
,
Bouillaud
F
Couplage respiratoire.
.
UCP et ion superoxyde. Med Sci (Paris).
2002;
;
18
:
:537.
–
539
.
3.
Carrière
A
,
Jeanson
Y
,
Cousin
B
,
et al.
Le recrutement et l’activation d’adipocytes bruns et/ou BRITE : une perspective réelle pour le traitement des maladies métaboliques ?
.
Med Sci (Paris).
2013;
;
29
:
:729.
–
735
.
4.
Wang
CH
,
Lundh
M
,
Fu
A
,
et al.
CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice.
.
Sci Transl Med.
2020;
;
12
:
:eaaz8664.
.
5.
Jordan
B
.
CRISPR : le Nobel enfin….
Med Sci (Paris).
2021;
;
37
:
:77.
–
80
.
6.
Konermann
S
,
Brigham
MD
,
Trevino
AE
,
et al.
Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex.
.
Nature.
2015;
;
517
:
:583.
–
588
.
|