L’échange d’ADN entre micro-organismes peut conduire à l’acquisition de nouvelles fonctions biologiques. Il permet par exemple à une souche bactérienne d’exploiter de nouvelles voies métaboliques, influençant ainsi les grands cycles biogéochimiques. Il permet également l’acquisition de gènes de virulence ou de gènes de résistance à des antibiotiques, qui peut conduire à l’émergence de souches bactériennes virulentes multirésistantes constituant un défi pour la santé publique.
Alors que la plupart des organismes eucaryotes évoluent par brassage des gènes lors de la formation des gamètes (méiose) et lors de la fécondation, les micro-organismes unicellulaires (notamment bactéries et archées) font évoluer leurs génomes en grande partie via l’acquisition de gènes au cours de leur existence. Ainsi, les bactéries évoluent au travers de mécanismes de transfert horizontal de gènes, dont trois sont connus depuis le début du xx siècle : la transformation naturelle, la conjugaison, et la transduction [ 1 ].
La transformation naturelle a été identifiée à partir de la célèbre expérience de Griffith en 1928 [ 2 ]. Dans cette expérience, où des souris étaient infectées avec des pneumocoques ( Streptococcus pneumoniae ) virulents (souche portant une capsule) ou non virulents (souche non capsulée), l’infection s’est avérée létale aussi bien pour les souris infectées avec des bactéries vivantes capsulées que pour celles infectées avec des bactéries vivantes non capsulées injectées avec une faible quantité de pneumocoques capsulés préalablement tués. Étonnamment, dans les deux cas, on retrouvait des pneumocoques capsulés vivants dans le sang des souris mortes. Dans le second cas, cela impliquait que des bactéries initialement non capsulées étaient devenues capsulées. Cette expérience a marqué le début de la génétique bactérienne. Les microbiologistes comprirent par la suite qu’il s’agissait en fait de l’acquisition de certains gènes par la souche bactérienne non capsulée, lui permettant désormais de synthétiser la capsule, et les rendant ainsi virulentes. En effet, la transformation naturelle correspond précisément à un processus régulé d’acquisition d’ADN libre dans l’environnement.
En 1946, Lederberg et Tatum démontrent l’existence d’un autre mécanisme d’échange de gènes. En étudiant la bactérie Escherichia coli (colibacille), ils comprennent qu’un mécanisme impliquant la présence d’un plasmide permet le transfert de gènes entre deux souches bactériennes différentes [ 3 ]. Il s’agit de la conjugaison bactérienne, qui permet le passage d’ADN d’une souche donneuse à une souche receveuse par le biais d’un pont intercellulaire, un pore de conjugaison codé par ce plasmide « conjugatif ».
Enfin, au début des années 1950, Zinder et Lederberg démontrent que les virus infectant les bactéries peuvent également transmettre des gènes entre souches différentes [ 4 ]. En effet, lors d’un cycle d’infection virale, de l’ADN bactérien peut être empaqueté « par erreur » dans certains virions, en lieu et place de l’ADN viral. Une telle erreur se produit rarement, mais même avec une fréquence de une fois sur cent ou une fois sur mille, elle permet de véhiculer des gènes depuis une souche infectée par le virus (dite donneuse) vers une autre souche (dite receveuse).
Plus récemment, un autre mécanisme permettant de véhiculer des molécules entre cellules a été mis en évidence : les vésicules membranaires extracellulaires [ 5 , 6 ]. Ces vésicules, que produisent la plupart des organismes vivants, pourraient avoir existé dès les origines de la vie [ 7 ]. Ce sont en effet de simples particules sphériques, formées par une membrane lipidique incluant des protéines membranaires de la cellule, et qui contiennent diverses molécules retrouvées dans le cytoplasme (ou dans le compartiment cellulaire à partir duquel est produite la vésicule). Depuis les années 1980, des études chez différents micro-organismes ont montré que ces vésicules peuvent également transporter de l’ADN provenant de la souche bactérienne qui les produit vers d’autres souches. Par exemple, certaines souches pathogènes comme Haemophilus influenzae, Pseudomonas aeruginosa ou Escherichia coli 0157:H7 peuvent transmettre des gènes de virulence ou de résistance à des antibiotiques par l’intermédiaire de ces vésicules membranaires extracellulaires [ 8 - 10 ]. C’est le cas également chez certains Firmicutes , et nous avons montré que des archées hyperthermophiles peuvent également utiliser ce mode de transfert de gènes dans des environnements extrêmes, puisque ces vésicules protègent l’ADN de la dénaturation à haute température [ 11 , 12 ]. Une étude récente a même montré que des vésicules bactériennes permettaient d’introduire de l’ADN dans le noyau de cellules eucaryotes [ 13 ].
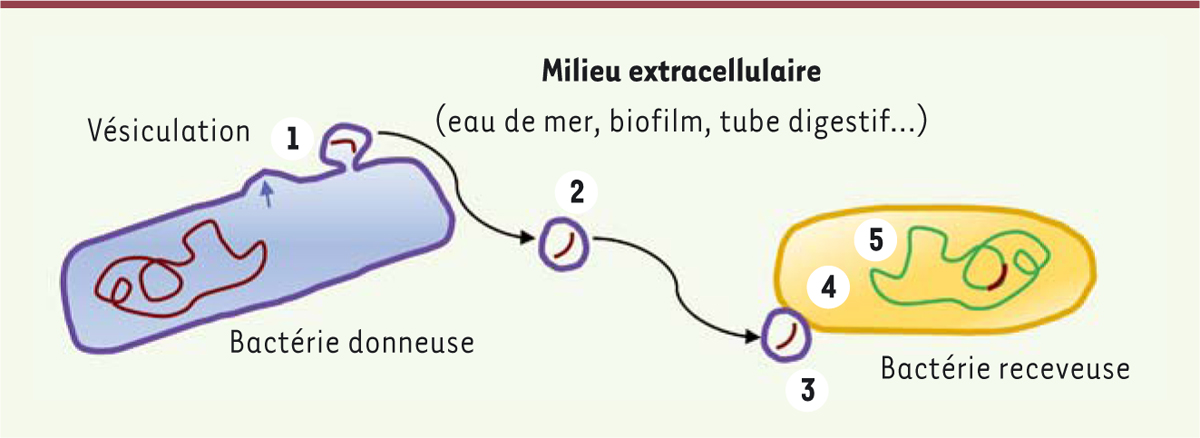
Nous avons récemment proposé de nommer « vésiduction » ce mécanisme apparemment ubiquitaire [ 14 ]. De même que lors de la transduction, l’ADN cellulaire est protégé dans l’environnement par la capside virale qui le transporte, dans la vésiduction, le véhicule protecteur de l’ADN n’est autre que la vésicule membranaire produite par la cellule d’où provient cet ADN. La première étape de ce mécanisme correspond au bourgeonnement d’une vésicule contenant de l’ADN ( Figure 1 ) . Ensuite, la vésicule peut se déplacer librement dans l’environnement, jusqu’à rencontrer une cellule réceptrice. Cette cellule peut appartenir à la même espèce que la cellule productrice, mais peut également en être phylogénétiquement très éloignée. Le rapprochement des membranes de la vésicule et de la cellule réceptrice conduit alors à leur fusion et à l’entrée dans la cellule du matériel biologique contenu dans la vésicule. Comme pour les trois autres mécanismes de transfert de gènes précédemment décrits, les mécanismes de recombinaison génétique peuvent conduire à l’acquisition, par le génome de la cellule receveuse, de gènes ainsi véhiculés par les vésicules extracellulaires. Ainsi, la vésiduction constituerait un quatrième mécanisme général de transfert horizontal de gènes entre micro-organismes. Il reste à comprendre comment ces vésicules extracellulaires sont produites et par quel(s) mécanisme(s) elles reconnaissent la cellule réceptrice. Cette reconnaissance fait sans doute intervenir, au moins dans certains cas, des protéines membranaires enchâssées dans la membrane de la vésicule, qui se lient à d’autres protéines situées à la surface de la cellule réceptrice, de même que les protéines des virions se lient à leurs récepteurs présents à la surface des cellules qu’ils infectent.
| Figure 1.
Vésiduction.
La cellule donneuse produit des vésicules (vésiculation), dont certaines contiennent de l’ADN
(1)
. Cette vésicule migre dans l’environnement
(2)
. Lorsque la vésicule rencontre une cellule présentant certaines protéines permettant son attachement
(3)
, sa membrane peut fusionner avec celle de la cellule receveuse
(4)
. Enfin, les mécanismes de recombinaison cellulaire peuvent induire l’intégration de l’ADN étranger dans le génome de la cellule receveuse
(5)
.
|
Des études environnementales ou sur les microbiotes sont désormais nécessaires afin de mieux évaluer l’importance biologique de ce mécanisme de transfert de gènes. Cependant, on sait déjà, par exemple, que Prochlorococcus , l’un des représentants microbiens les plus répandus dans le plancton océanique, sécrète des quantités importantes de vésicules membranaires [ 15 ]. Cela représenterait jusqu’à 10 28 vésicules produites par jour, soit environ 10 4 à 10 5 tonnes de carbone par jour ! Et ces vésicules contiennent effectivement de l’ADN de Prochlorococcus .
Pour finir, notons que ces vésicules membranaires, au-delà de leur capacité de transfert de matériel génétique par vésiduction, ont en fait des rôles variés en microbiologie [ 7 ]. Certaines peuvent transporter des toxines, et jouer ainsi un rôle dans la pathogénicité d’une souche bactérienne. D’autres ont un rôle connu dans la communication cellulaire, permettant par exemple le transport de molécules de signalisation hydrophobes, dont la diffusion est faible en milieu aqueux. D’autres encore pourraient être impliquées dans le contrôle des infections virales. En effet, les vésicules produites à partir de la membrane cellulaire contiennent souvent des protéines membranaires, parmi lesquelles les récepteurs utilisés par les virus pour infecter les cellules, et peuvent donc servir de leurres pour les virions, permettant ainsi de limiter l’infection.