La maladie de Crohn et la rectocolite hémorragique sont les deux principales maladies chroniques inflammatoires de l’intestin (MICI). Elles se caractérisent par une inflammation sévère de la paroi intestinale, une hyperactivité du système immunitaire digestif, et par des anomalies de la composition du microbiote intestinal. Les MICI sont le plus souvent diagnostiquées chez les personnes âgées de 20 à 30 ans. Leur incidence a augmenté dans le monde au cours des dernières décennies. On estime que plus d’un million de personnes aux États-Unis et 2,5 millions en Europe en sont atteintes. En outre, elles sont apparues dans les pays nouvellement industrialisés d’Asie, d’Amérique du Sud et du Moyen-Orient, où leur incidence en 2025 pourrait approcher celle des pays d’Europe [ 1 ]. Les patients atteints de MICI présentent un risque accru de cancer colorectal par rapport à la population générale [ 2 ]. Ainsi, la découverte d’un traitement efficace des MICI est un enjeu majeur pour les années à venir, car actuellement, il n’existe aucun traitement agissant sur la cause de ces maladies. La prise en charge thérapeutique actuelle vise seulement à atténuer les symptômes de la maladie, en calmant la douleur, souvent intense, en réduisant l’inflammation et la fatigue, et en facilitant la prise alimentaire.
Les MICI, mais également leurs complications, telles que les cancers colorectaux et les infections gastro-intestinales, peuvent, en provoquant des saignements chroniques de la muqueuse du tube digestif, entraîner une anémie par carence martiale (ou sidéropénie), qui nécessite alors une supplémentation en fer, souvent peu efficace. D’autre part, les saignements entraînent une augmentation du fer dans la lumière intestinale, dont les conséquences sur la composition du microbiote intestinal sont inconnues à ce jour. Le fer est un nutriment essentiel à tout organisme vivant, des micro-organismes jusqu’à l’homme. La virulence des bactéries dépend notamment de leur capacité à assimiler le fer de l’hôte qui les héberge [ 3 ] ( → ).
(→) Voir la Synthèse de S. Vaulont et I. Schalk, m/s n° 8-9, août-septembre 2015, page 756
Chez l’homme, le fer est indispensable, non seulement pour le métabolisme cellulaire (en tant que cofacteur de réactions enzymatiques, de la réplication de l’ADN, etc.), mais également pour permettre à l’hémoglobine contenue dans les globules rouges de transporter l’oxygène vers les différents tissus. Si le fer vient à manquer, une anémie apparaît, ce qui peut entraîner une oxygénation insuffisante des tissus. En revanche, une surcharge en fer peut induire des dommages cellulaires, en facilitant la production de formes réactives de l’oxygène (ROS) [ 4 ]. Les taux de fer doivent donc être finement régulés pour éviter les conséquences d’un déficit ou, au contraire, d’une surcharge toxique pour les cellules. L’hepcidine est l’hormone majeure de l’homéostasie du fer dans l’organisme [ 5 ]. Il s’agit d’un petit peptide cationique, de 25 acides aminés, principalement produit par le foie en réponse à la surcharge en fer ou à une inflammation. L’hepcidine agit sur la ferroportine, la seule protéine exportatrice de fer connue, en limitant sa capacité à libérer le fer intracellulaire, soit comme un « bouchon » empêchant l’exportation, soit en induisant sa dégradation [ 6 ]. La ferroportine est principalement exprimée à la surface des macrophages érythrophagocytaires (cellules qui reconnaissent et éliminent les hématies sénescentes), et à la surface baso-latérale des entérocytes du duodénum, où elle facilite le recyclage du fer des globules rouges sénescents et l’importation de fer alimentaire, respectivement [ 7 ]. Il est désormais établi que les maladies de surcharge en fer primaires (hémochromatoses) sont associées à un défaut de production d’hepcidine [ 8 ].
Plusieurs études ont montré que l’hepcidine n’était pas uniquement exprimée par les cellules du foie, mais aussi par celles de nombreux autres tissus. L’hepcidine hépatique est suffisante pour assurer l’homéostasie globale du fer dans des conditions physiologiques [ 9 ], mais la production d’hepcidine par les autres tissus pourrait avoir des rôles locaux, notamment sur les sites inflammatoires ou infectieux [ 10 ]. Afin de comprendre le rôle de l’hepcidine et du fer dans la résolution de l’inflammation intestinale, nous avons étudié, en collaboration avec l’équipe de Gregory Sonnenberg (Weill Cornell Medicine, New York, États-Unis), la contribution de plusieurs sources d’hepcidine dans des modèles murins de MICI et chez des patients atteints de ces maladies [ 11 ].
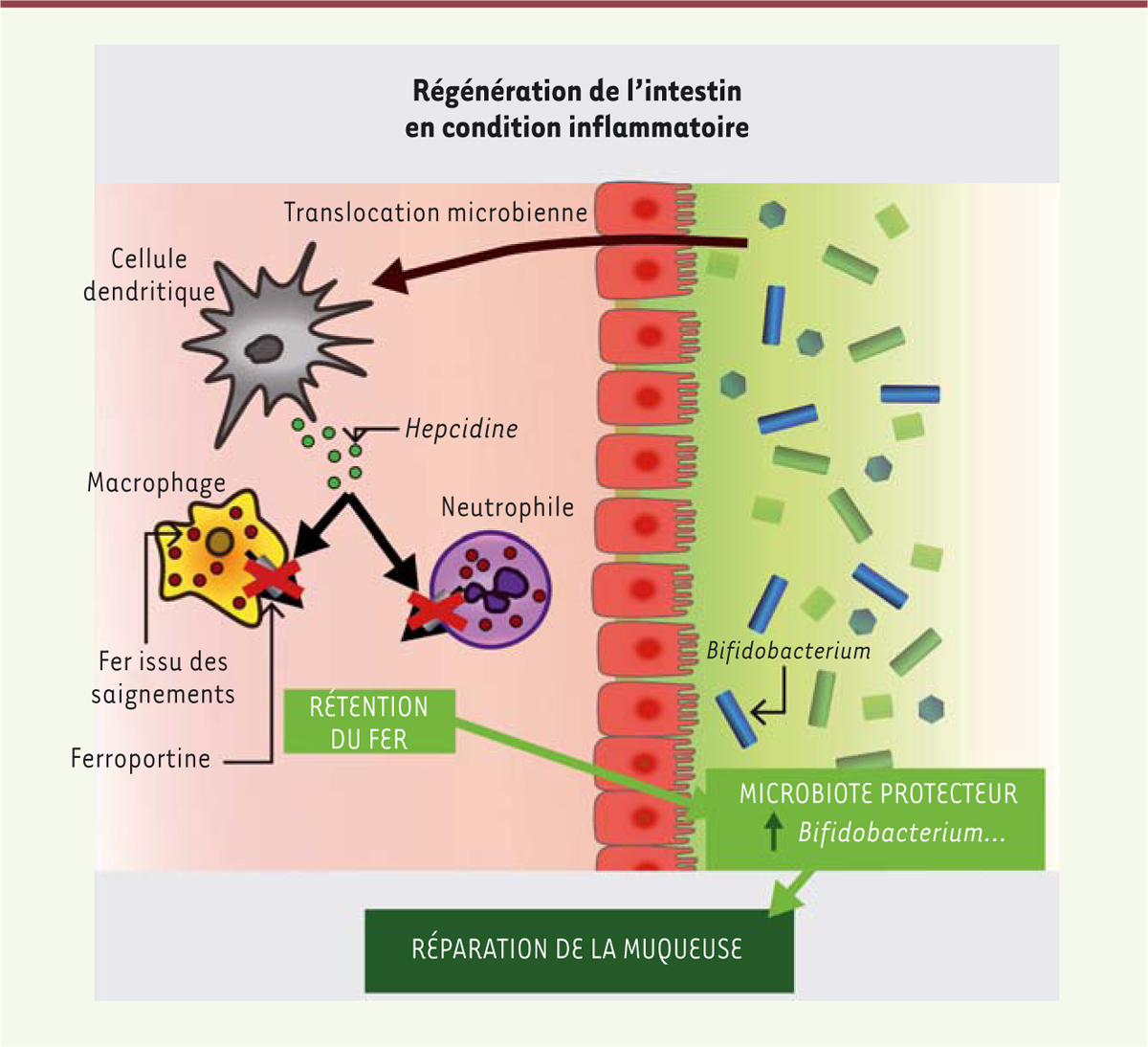
Nous avons montré que des souris mutantes, dépourvues d’hepcidine dans tout l’organisme, présentent une altération de la cicatrisation des muqueuses dans le modèle expérimental de colite induite par le dextran sulfate de sodium (ou DSS en anglais pour dextran sodium sulfate , un modèle couramment employé pour induire une inflammation proche de celle de la colite des patients atteints de maladie de Crohn). En revanche, des souris mutantes, dépourvues d’hepcidine mais uniquement dans le foie, cicatrisent, après exposition au DSS, comme les souris témoins. Par conséquent, une source d’hepcidine non hépatocytaire est nécessaire pour la réparation des muqueuses. Nous avons alors montré que les cellules dendritiques conventionnelles de type 2 étaient la principale source d’hepcidine dans le côlon après une administration de DSS. Les cellules dendritiques conventionnelles intestinales sont également une source importante d’hepcidine chez les individus atteints de MICI. Nous avons donc voulu savoir si cette source intestinale d’hepcidine pouvait être responsable du maintien de la régénération de la muqueuse intestinale. En effet, des souris mutantes dépourvues d’hepcidine uniquement dans les cellules dendritiques conventionnelles ont le même défaut de « réparation » de la muqueuse colique après l’administration de DSS que les souris dépourvues d’hepcidine dans tout l’organisme. Ce résultat nous a permis de conclure que l’hepcidine synthétisée par ces cellules joue un rôle essentiel dans la régénération intestinale. Comme l’hepcidine synthétisée par les cellules du foie favorise la dégradation de la ferroportine, nous avons ensuite voulu savoir si ce transporteur du fer pouvait être également la cible de l’hepcidine produite par les cellules dendritiques conventionnelles dans les conditions d’inflammation intestinale induite expérimentalement. Des souris mutantes exprimant une variante de la ferroportine résistante à l’hepcidine spécifiquement dans les macrophages et les granulocytes neutrophiles présentent, après l’administration de DSS, une régénération de la muqueuse intestinale altérée, ce qui indique que ces cellules sont une cible cruciale de l’hepcidine produite dans l’intestin par les cellules dendritiques conventionnelles. Nous avons alors cherché le mécanisme par lequel l’hepcidine pouvait favoriser la régénération de la muqueuse. Nous avons remarqué que les souris mutantes dépourvues d’hepcidine uniquement dans les cellules dendritiques conventionnelles ont, après l’administration de DSS, des quantités plus élevées de fer non héminique dans la lumière intestinale que les souris témoins. Cela suggère qu’en l’absence d’hepcidine, la rétention, par les macrophages intestinaux, du fer issu des saignements n’est plus possible, ce qui entraîne sa libération dans la lumière intestinale. L’augmentation du fer dans la lumière intestinale de ces souris mutantes est associée à des modifications de la composition de la flore microbienne intestinale (dysbiose), qui conduit à une augmentation du nombre de bactéries agressives infiltrant les tissus, et à une réduction considérable des bifidobactéries, bien connues pour favoriser la régénération intestinale.
En conclusion, notre étude permet de proposer le scénario suivant. En conditions inflammatoires, la barrière intestinale est altérée, induisant des translocations microbiennes. Ces signaux vont induire une production d’hepcidine par les cellules dendritiques conventionnelles intestinales afin de permettre la rétention, par les phagocytes, du fer issu des saignements de la muqueuse intestinale. Cette rétention empêche l’augmentation de la quantité de fer dans la lumière intestinale, favorisant ainsi le maintien d’un microbiote protecteur ( Figure 1 ) . Nous avons par ailleurs constaté que l’administration de déféroxamine, un médicament chélateur des ions Fe 3+ qui empêche les bactéries d’accéder au fer, rétablissait complètement la guérison de la colite induite par l’administration de DSS chez les souris mutantes dépourvues d’hepcidine. Ces résultats plaident contre l’utilisation thérapeutique d’antagonistes de l’hepcidine actuellement envisagée pour limiter l’anémie souvent associée aux MICI. En revanche, ils suggèrent que l’administration locale d’hepcidine chez les individus atteints de ces maladies pourrait être protectrice. Les thérapies actuelles des MICI (corticothérapie et thérapies par anticorps monoclonaux) ne sont pas optimales, en raison de leurs effets secondaires et de la fréquence des échecs du traitement. Ainsi, l’utilisation d’hepcidine comme alternative thérapeutique dans les MICI pourrait se révéler bénéfique pour les patients.