| |
| Med Sci (Paris). 37(6-7): 572–574. doi: 10.1051/medsci/2021067.Une hypoplasie ponto-cérébelleuse causée par l’accumulation d’un inositol phosphate Ekin Ucuncu,1 Karthyayani Rajamani,1 Lydie Burglen,1 Nathalie Boddaert,1 Adolfo Saiardi,1 and Vincent Cantagrel1* 1Université de Paris, Institut Imagine, Laboratoire de génétique des troubles du neurodéveloppement, Inserm UMR 1163
,
24 boulevard du Montparnasse
,
75015Paris
,
France
.
2Centre de référence des malformations et maladies congénitales du cervelet, Département de génétique, AP-HP, Sorbonne université, Hôpital Trousseau
,
75012Paris
,
France
.
3Département de radiologie pédiatrique, Inserm UMR 1163 et U1000, AP-HP, Hôpital Necker-Enfants Malades
,
75015Paris
,
France
.
4MRC Laboratory for Molecular Cell Biology
, University College London
,
WC1E 6BT
,
Londres
,
Royaume-Uni
.
MeSH keywords: Maladies du cervelet, Humains, Inositol phosphates, Imagerie par résonance magnétique, génétique, métabolisme |
Les hypoplasies ponto-cérébelleuses forment un groupe de maladies neurodégénératives périnatales très rares, caractérisées par une hypoplasie ou une atrophie précoce du cervelet et du tronc cérébral, une structure cérébrale impliquée dans des fonctions vitales, notamment la respiration. La dégénérescence débute au cours du développement cérébral, souvent avant la naissance. Elle est responsable d’une microcéphalie, parfois congénitale, mais plus souvent d’apparition progressive. Les développements moteur et cognitif sont altérés dès les premiers mois de vie, et la maladie est le plus souvent mortelle dans l’enfance. Ces maladies sont principalement génétiques et transmises selon un mode autosomique récessif. Près de 20 gènes responsables ont été identifiés à ce jour [
1
,
2
]. La plupart sont impliqués dans l’épissage et la maturation d’ARN codants ou non codants, alors que les autres gènes jouent des rôles différents. Les mécanismes cellulaires et moléculaires responsables de la dégénérescence sont mal compris.
|
Un nouveau gène responsable d’une hypoplasie ponto-cérébelleuse : MINPP1
Nous avons étudié quatre familles dans lesquelles les patients présentaient un phénotype semblable, une hypoplasie ponto-cérébelleuse avec des symptômes graves et généralement progressifs, sans mutation dans les gènes connus. L’existence atypique de signes de dégénérescence des noyaux gris centraux, révélée par l’imagerie par résonance magnétique (IRM) cérébrale de ces patients, a permis de définir un sous-type particulier d’hypoplasie ponto-cérébelleuse
(
Figure 1A
)
. En utilisant une technique de séquençage à haut-débit de l’ADN, des mutations bialléliques entraînant une perte de fonction ont été identifiées dans le gène
MINPP1
(
multiple inositol-polyphosphate phosphatase 1
) chez tous les patients [
3
].
MINPP1
est impliqué dans le métabolisme des inositol phosphates, des molécules impliquées dans la signalisation cellulaire [
4
]. À la différence des phosphoinositides, qui ont une partie lipidique et sont localisés dans les membranes cellulaires [
5
] (
→
), les inositol phosphates sont solubles dans le cytoplasme.
MINPP1
code une enzyme ubiquitaire qui hydrolyse des groupements phosphates de l’inositol hexakisphosphate (IP
6
), ou acide phytique
(
Figure 1B
)
. Dans les graines des plantes, l’acide phytique joue un rôle de réserve de phosphore et d’ions métalliques tels que Mg
2+
, Fe
2+
et Ca
2+
[
6
]. Étonnamment, bien qu’il soit l’inositol phosphate le plus abondant dans les cellules des mammifères, on connaît très mal son rôle dans ces cellules.
(→) Voir la Synthèse de J. Viaud et B. Payrastre, m/s n° 11, novembre 2015, page 996
 | Figure 1.
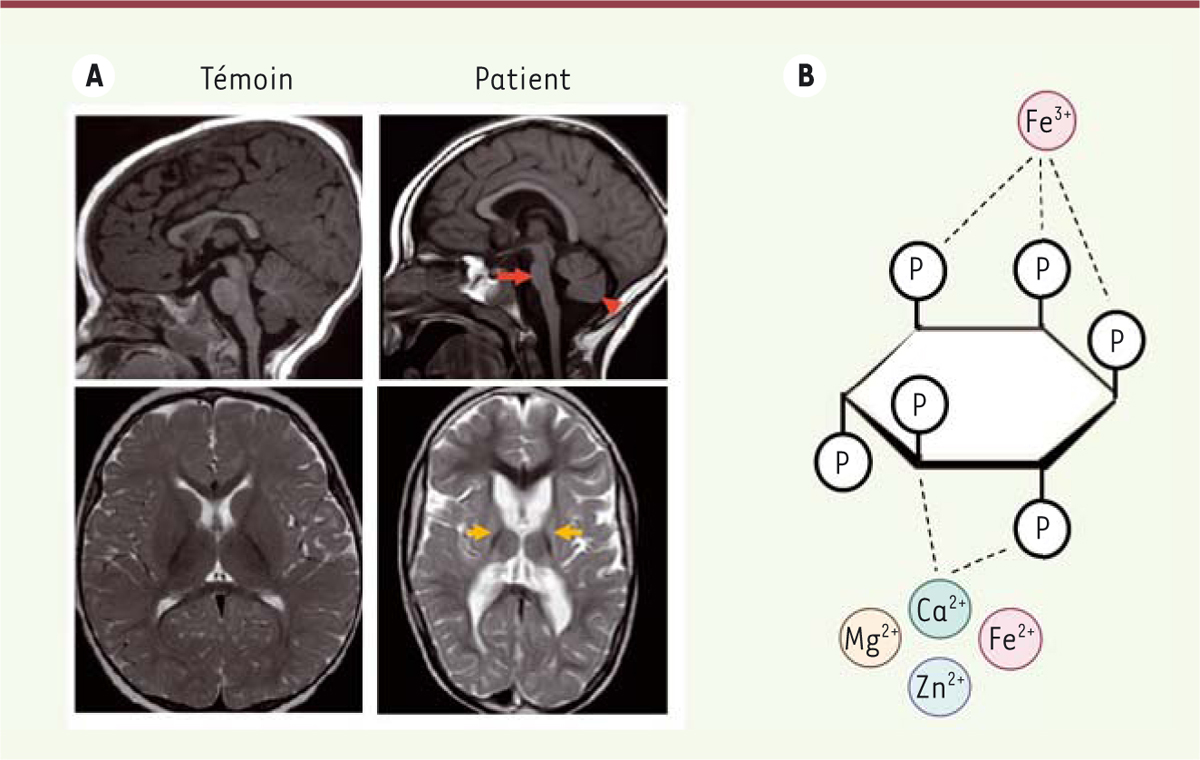
A. Imagerie cérébrale par résonance magnétique chez un patient atteint d’une hypoplasie ponto-cérébelleuse et porteur de mutations bi-alléliques de MINPP1, et chez un individu témoin.
Coupe sagittale (en haut) et axiale (en bas). Les images obtenues chez le patient montrent un degré variable d’hypoplasie du tronc cérébral (flèche rouge) et du cervelet (tête de flèche), associée à une intensité anormale du signal au niveau des noyaux gris centraux (flèches oranges).
B. Représentation schématique de l’acide phytique (IP
6
).
L’acide phytique, avec ses six groupements phosphates (P), se lie fortement aux cations bivalents, tels que Ca
2+
, Mg
2+
ou Fe
2+
.
|
|
Utilisation des cellules souches humaines induites pour modéliser la neurodégénérescence précoce dans la maladie
Afin d’établir un modèle cellulaire pertinent pour l’étude de la maladie, nous avons généré des cellules souches pluripotentes induites humaines (CSPi) à partir de cellules provenant de patients porteurs de mutations de
MINPP1
. Parallèlement, nous avons généré des CSPi invalidées pour
MINPP1
par la technique CRISPR/Cas9. Nous avons ensuite montré que les mutations de
MINPP1
empêchent la différenciation des cellules progénitrices neurales en neurones. Cet effet s’accompagne d’un excès de mort cellulaire par apoptose, qui n’est pas observé pour d’autres types de cellules, ce qui indique que les cellules neurales sont particulièrement sensibles à ce défaut génétique [
3
]. Ainsi, ces résultats ont révélé le rôle critique de
MINPP1
dans la différenciation et la survie neuronales, bien que l’étape où survient la mort cellulaire au cours du processus de différenciation reste à déterminer.
|
MINPP1 est impliqué dans la régulation des concentrations cellulaires d’acide phytique
En collaboration avec l’équipe de l’un d’entre nous (Adolfo Saiardi,
University College London
), nous avons quantifié les niveaux de différents inositols phosphates dans les cellules de plusieurs lignées cellulaires rendues déficientes en MINPP1. Pour cela, un marquage métabolique a été réalisé en cultivant des cellules en présence d’inositol radiomarqué, un précurseur de la synthèse des différents inositol phosphates, qui peuvent ensuite être quantifiés dans les cellules [
7
]. Cette analyse a permis de décrire un profil commun de variation de plusieurs de ces composés en l’absence de MINPP1 : diminution des produits de l’enzyme MINPP1, et surtout franche augmentation de son substrat principal, l’acide phytique, en particulier dans les cellules neurales en cours de différenciation, où sa concentration avait presque doublé [
3
]. Ce résultat, qui confirme le rôle prépondérant de l’enzyme MINPP1 dans la régulation de la concentration intracellulaire d’acide phytique, précédemment décrite comme stable [
4
], nous a amenés à nous interroger sur les conséquences de l’augmentation de la concentration de cet inositol polyphosphate.
|
L’accumulation intracellulaire d’acide phytique perturbe l’homéostasie calcique
L’acide phytique étant un puissant chélateur
1
, nous avons émis l’hypothèse que son accumulation causait un déséquilibre dans l’homéostasie intracellulaire de certains ions, notamment l’ion calcium (Ca
2+
), connus pour leur rôle dans la survie cellulaire et la différenciation neuronale. En accord avec cette hypothèse, la concentration cytoplasmique d’ions Ca
2+
libres (non chélatés), évaluée grâce à l’indicateur fluorescent Fluo-4 AM, s’est révélée fortement réduite dans les cellules d’une lignée cellulaire mutante pour MINPP1. Dans la cellule, Ca
2+
est présent en abondance dans certains organites, notamment dans le réticulum endoplasmique, qui sert de réservoir pour cet ion. Ce réservoir calcique joue un rôle essentiel dans la signalisation cellulaire au cours du développement cérébral, de l’induction neurale [
8
] (
→
) à la différenciation neuronale [
9
]. Or l’enzyme MINPP1 est principalement localisée dans le réticulum endoplasmique. Pour évaluer si ce réservoir de Ca
2+
était particulièrement affecté par les mutations de
MINPP1
, nous avons utilisé la caféine, connue pour déclencher la libération des ions Ca
2+
du réticulum endoplasmique vers le cytoplasme. En réponse à la caféine, les cellules mutantes présentaient une franche diminution de cette mobilisation du Ca
2+
du réticulum endoplasmique par rapport aux cellules témoins, suggérant une réduction importante de la quantité de Ca
2+
stockée dans cet organite. Nous avons pu prévenir l’apparition de ce phénotype anormal en surexprimant MINPP1 dans ces cellules qui en étaient dépourvues, démontrant ainsi la spécificité du phénomène observé. Ces résultats montrent donc que MINPP1, en dégradant l’acide phytique, joue un rôle critique dans l’homéostasie du calcium contenu dans le réticulum endoplasmique
(
Figure 2
)
. Nous avons montré qu’un excès d’acide phytique pouvait également chélater d’autres cations métalliques, comme Fe
3+
[
3
].
(→) Voir la synthèse de M. Moreau
et al
.,
m/s
n° 11, novembe 2020, page 1018
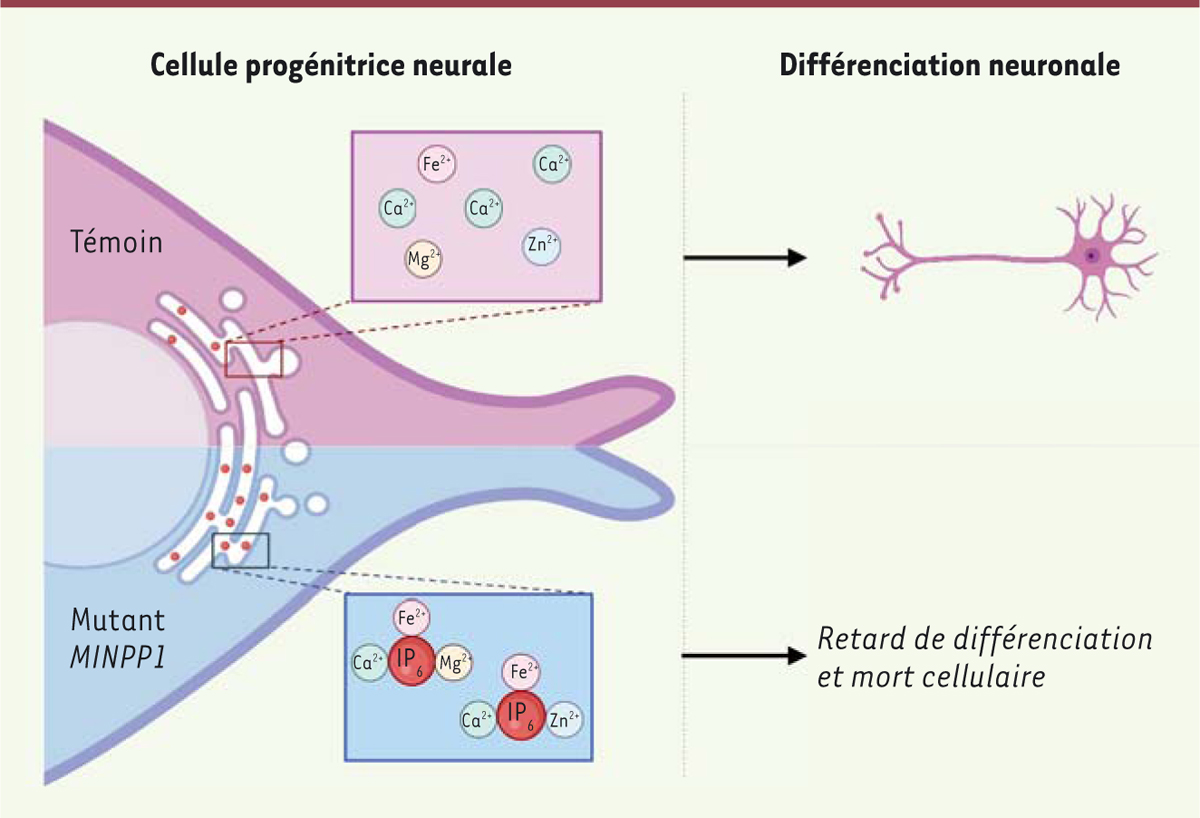
 | Figure 2.
Modélisation de l’accumulation intracellulaire d’acide phytique (IP6) au cours de la différenciation neuronale des cellules progénitrices.
En l’absence de MINPP1, l’augmentation de la concentration d’acide phytique (IP
6
) peut entraîner une chélation des cations intracellulaires bivalents, tels que Ca
2+
, dans le réticulum endoplasmique, et une diminution de la concentration des cations libres. Cette perturbation de l’homéostasie cationique pourrait être à l’origine de la différenciation neuronale anormale et de la mort cellulaire observées au cours de la différenciation des cellules progénitrices neurales porteuses d’une mutation de
MINPP1
.
|
|
Nous avons identifié une nouvelle forme génétique d’hypoplasie ponto-cérébelleuse, ainsi que les mécanismes biochimiques et cellulaires qui y sont associés. Notre étude a révélé, pour la première fois, l’implication d’une anomalie du métabolisme des inositol phosphates dans une maladie du développement. Il reste à comprendre comment l’accumulation intracellulaire d’acide phytique et la chélation qui lui est associée agissent sur la survie neuronale et le développement cérébral
in vivo
. Le Ca
2+
est-il seul en cause ? Est-il possible de corriger le défaut métabolique à l’origine de cette maladie ? L’étude du modèle murin de la maladie que nous avons récemment réalisée pourrait contribuer à mieux comprendre sa pathogénie et apporter certaines réponses à ces questions.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Van Dijk
T
,
Baas
F
,
Barth
PG
,
et al.
What’s new in pontocerebellar hypoplasia? An update on genes and subtypes.
.
Orphanet J Rare Dis.
2018;
;
13
:
:92.
.
2.
Akizu
N
,
Cantagrel
V
,
Schroth
J
,
et al.
AMPD2 regulates GTP synthesis and is mutated in a potentially treatable neurodegenerative brainstem disorder.
.
Cell.
2013;
;
154
:
:505.
–
517
.
3.
Ucuncu
E
,
Rajamani
K
,
Wilson
MSC
,
et al.
MINPP1 prevents intracellular accumulation of the chelator inositol hexakisphosphate and is mutated in pontocerebellar hypoplasia.
.
Nat Commun.
2020;
;
11
:
:6087.
.
4.
Irvine
RF
,
Schell
MJ
Back in the water: the return of the inositol phosphates.
.
Nat Rev Mol Cell Biol.
2001;
;
2
:
:327.
–
338
.
5.
Viaud
J
,
Payrastre
B
Les phosphoinositides : ces lipides qui coordonnent la dynamique cellulaire.
.
Med Sci (Paris).
2015;
;
31
:
:996.
–
1005
.
6.
Raboy
V.
Myo-inositol-1,2,3,4,5,6-hexakisphosphate.
.
Phytochemistry.
2003;
;
64
:
:1033.
–
1043
.
7.
Azevedo
C
,
Saiardi
A
Extraction and analysis of soluble inositol polyphosphates from yeast.
.
Nat Protoc.
2006;
;
1
:
:2416.
–
2422
.
8.
Moreau
M
,
Leclerc
C
,
Néant
I
.
La saga de l’induction neurale : presque un siècle de recherche.
.
Med Sci (Paris).
2020;
;
36
:
:1018.
–
26
.
9.
Ringler
SL
,
Aye
J
,
Byrne
E
,
et al.
Effects of disrupting calcium homeostasis on neuronal maturation: early inhibition and later recovery.
.
Cell Mol Neurobiol.
2008;
;
28
:
:389.
–
409
.
|