Les galectines sont des lectines très conservées dans l’évolution, ayant une forte affinité pour les sucres comportant des motifs β-galactoside, notamment les résidus N-acétyl-lactosamine présents à la fois sur les N-glycanes et les O-glycanes des protéines glycosylées et des glycolipides, grâce à la présence d’un ou deux domaines de reconnaissance des carbohydrates ( carbohydrate recognition domain , CRD) [ 1 , 11 ] ( → ).
(→) Voir la Synthèse de T. Advedissian et al ., m/s n° 5 mai 2015, page 499
La classification des galectines proposée en 1993 est fondée sur leur organisation structurale et comporte trois groupes. La galectine-3 est l’unique membre du groupe dit « chimérique ». Son domaine N-terminal, flexible, est composé de 7 à 14 répétitions en tandem d’un motif riche en résidus proline (Pro) et glycine (Gly) (motif consensus Tyr-Pro-Gly-X 3 -Pro-Gly-Ala, où X 3 indique trois acides aminés quelconques) permettant son homodimérisation et présentant une certaine homologie avec des ribonucléoprotéines. Quant à son domaine globulaire C-terminal, il inclut le CRD, qui contient un motif Asn-Trp-Gly-Arg (NWGR) partagé avec les membres de la famille de la protéine anti-apoptotique Bcl-2 ( B-cell lymphoma 2 ) [ 2 ].
Cette molécule aux multiples fonctions et localisations subcellulaires a fait l’objet d’un grand nombre de publications durant la dernière décennie. La galectine-3 est impliquée dans des processus cellulaires divers [ 3 ], tels que l’apoptose, l’épissage des pré-ARNm, ou la stabilisation des facteurs de transcription sur leurs sites de fixation à l’ADN. Une fois sécrétée, la galectine-3 exerce des effets autocrines ou paracrines pour moduler l’adhérence et la prolifération cellulaires, ou pour stimuler la réponse immunitaire adaptative et la reconnaissance des microorganismes pathogènes. Dans les tissus conjonctifs, elle est impliquée dans l’inflammation, la réparation tissulaire et la fibrose [ 3 ]. La galectine-3 est donc gardienne de l’intégrité tissulaire, notamment en agissant sur le maintien de la forme et de l’organisation des cellules épithéliales [ 4 ].
Le rôle clé de la galectine-3 dans l’homéostasie des endomembranes, récemment mis en évidence, vient s’ajouter à son implication, déjà connue, dans le trafic intracellulaire [ 5 ]. Ainsi, la galectine-3 orchestre des mécanismes séquentiels concertés permettant à la cellule de répondre aux dommages des lysosomes [ 6 ]. Grâce à sa fixation à la membrane des lysosomes altérés, elle synchronise dans un premier temps leur réparation dépendante de la machinerie ESCRT ( endosomal-sorting complex required for transport , impliquée dans le tri et la formation de corps multivésiculaires), puis leur dégradation par autophagie, et, éventuellement, leur remplacement par biogenèse. En s’associant de manière dynamique avec différents partenaires, comme ALIX ou TRIM16, elle enclenche la réparation ou l’élimination des lysosomes. Elle participe ainsi à la mise en place d’une autophagie sélective, qui assure le bon fonctionnement et la coordination du réseau d’organelles, incluant les mitochondries.
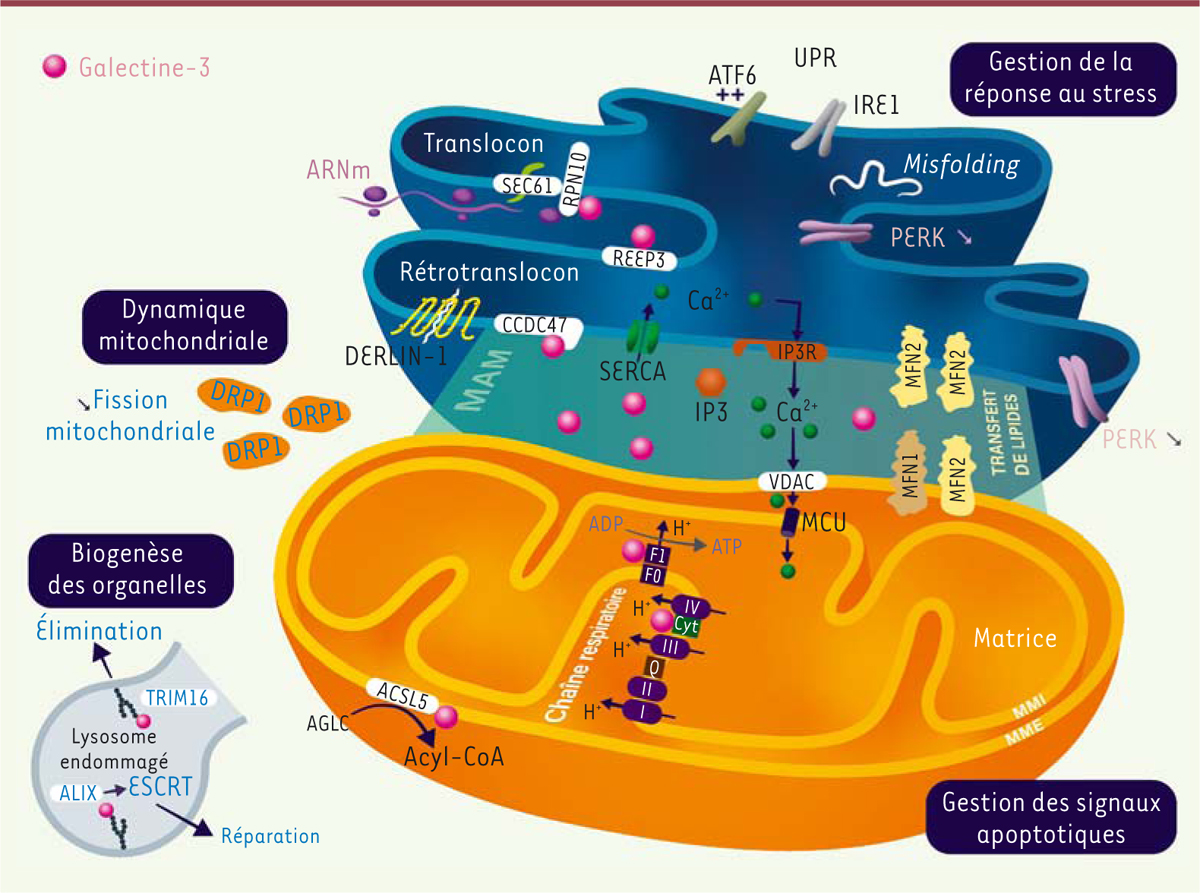
Nous avons récemment découvert une nouvelle conséquence de la translocation de la galectine-3 vers la mitochondrie. En effet, l’absence de galectine-3 induit une augmentation de la phosphorylation oxydante, via une suractivation des complexes I et IV de la chaîne respiratoire, sans altération de l’expression des composants de ces complexes [ 7 ]. La galectine-3, qui interagit avec les sous-unités F O et F 1 de l’ATP synthase présentes dans la membrane interne des mitochondries, pourrait ainsi limiter l’assemblage des complexes mitochondriaux ( Figure 1 ) .
| Figure 1.
Rôles multiples de la galectine-3 dans la réponse au stress, la signalisation apoptotique, la dynamique mitochondriale et la biogenèse des organelles.
Le réticulum endoplasmique (RE) est représenté en bleu et la mitochondrie, avec sa membrane interne (MMI) et sa membrane externe (MME), en orange. La galectine-3 (en rouge) est présente à l’interface entre le réticulum endoplasmique et la mitochondrie, au sein des « membranes associées aux mitochondries » (MAM), qui sont impliquées dans les échanges entre ces deux organelles. Les échanges de calcium (en vert) ont lieu notamment
via
la
sarco/endoplasmic reticulum Ca
2+
-ATPase
(SERCA), le récepteur de l’inositol trisphosphate (IP3R), le canal ionique VDAC (
voltage-dependent anion-selective channel
) ou le transporteur MCU (
mitochondrial calcium uniporter
). Le transfert de lipides s’effectue
via
les mitofusines (MFN1 et MFN2). UPR :
unfolded protein response
; IRE1 :
inositol-requiring enzyme 1
; ATF6 :
activating transcription factor 6
; PERK :
protein kinase R-like endoplasmic reticulum kinase
; SEC61 :
Sec61 translocon complex
; RPN10 :
regulatory particle non-ATPase
; REEP3 :
receptor expression-enhancing protein 3
; CCDC47 :
coiled-coil domain-containing protein 47
; IP3 : inositol triphosphate ; DRP1 :
dynamin-related protein 1
; TRIM16 :
tripartite motif-containing 16
; ESCRT :
endosomal-sorting complex required for transport ;
ADP : adénosine diphosphate ; ATP : adénosine triphosphate ; Cyt : cytochrome C ; Q : coenzyme Q ; ACSL5 :
Acyl-CoA synthetase long chain family member 5
; AGLC : acide gras à longue chaîne.
|
Les multiples sites d’action de la galectine-3 (noyau, réticulum endoplasmique, appareil de Golgi, lysosomes, mitochondries, membrane plasmique) et sa capacité à réguler positivement ou négativement des processus cellulaires variés (métabolisme et cycle cellulaires, transcription et traduction des gènes, trafic des organelles, dialogue entre membranes) lui permettent de coordonner une réponse adaptée au stress cellulaire et de contribuer ainsi à sa résolution, quitte à induire l’autophagie, voire l’apoptose, pour rétablir l’homéostasie du tissu.
Les perturbations de l’expression ou de la localisation subcellulaire de la galectine-3, impliquée dans de nombreuses maladies ( e.g. , insuffisance cardiaque, maladie de Huntington), ont donc des conséquences négatives sur l’homéostasie cellulaire [ 3 ]. Le profil d’expression de la galectine-3 est également altéré dans de nombreux cancers, dont cette molécule pourrait d’ailleurs constituer un biomarqueur. Ces modifications ont des conséquences directes sur la résistance à la chimiothérapie et à l’immunothérapie, sur le maintien des cellules tumorales à l’état de cellules souches, et ainsi sur l’agressivité des tumeurs.