Dès mars 2020, une prépublication 1 faisait état d’un risque d’infection par le virus SARS-CoV-2 ( severe acute respiratory syndrome coronavirus 2 ) moindre pour les personnes de groupe sanguin O, et accru pour les personnes de groupe A, à Wuhan en République populaire de Chine [ 1 ], rappelant une observation concernant l’épidémie de SRAS (syndrome respiratoire aigu sévère) qui avait sévi en 2002-2003 [ 2 ]. Depuis, une quarantaine d’études en provenance de nombreux pays d’Asie, du Moyen-Orient, d’Europe et d’Amérique ont été publiées sur le sujet (voir [ 3 ]). La grande majorité de ces études ont effectivement conclu à l’existence d’associations entre groupes sanguins ABO et, soit le risque d’infection, soit la sévérité de la maladie. Cependant, dans la plupart des cas, ces deux aspects n’ont pas été clairement dissociés et, par ailleurs, quelques études discordantes n’ont décelé aucun effet du polymorphisme ABO. Toutefois, le consensus qui a émergé suggère que le groupe sanguin O aurait un effet protecteur contre la maladie, tandis que les autres groupes sanguins, A, B ou AB (non-O) auraient l’effet inverse. Différentes hypothèses ont été émises pour tenter d’expliquer ces effets opposés.
Une hypothèse permettant d’expliquer un effet protecteur du groupe sanguin O est fondée sur l’existence d’anticorps naturels 2, anti-A et anti-B 3, chez les individus porteurs de ce groupe sanguin. On sait, par exemple, que des anticorps naturels dirigés contre l’antigène a-Gal (galactose-alpha-1,3-galactose), de structure apparentée à celle des antigènes de groupes sanguins ABO, sont capables de neutraliser de nombreux virus enveloppés 4, dans un contexte xénogénique 5 [ 4 ]. Dans le cas du SRAS, nous avions déjà montré que des anticorps anti-A pouvaient spécifiquement inhiber l’interaction entre le récepteur ACE2 ( angiotensin-converting enzyme 2 ) du virus et la protéine S (pour spike , spicule) produite par des cellules infectées et capables de synthétiser l’antigène A [ 5 ]. Le SARS-CoV-2 se réplique principalement dans les cellules épithéliales du nasopharynx, de la trachée, des bronches, ainsi que dans les pneumocytes, des cellules qui expriment toutes à leur surface des antigènes de groupes sanguins, selon le génotype ABO de l’individu. Le domaine S1 de la protéine Spike , qui contient le domaine de liaison du virus à son récepteur ACE2 (RBD pour receptor binding domain ), produit sous forme recombinante dans des cellules transfectées par des gènes codant des glycosyltransférases leur permettant d’exprimer les antigènes A, B ou H (groupe O) des groupes sanguins ABO, porte effectivement les antigènes correspondants [ 6 ]. Il est donc fort probable que, lors d’une infection naturelle, les virions produits par les cellules de la personne infectée expriment ces déterminants antigéniques sur les glycanes présents à la surface de l’enveloppe des virions, en fonction du génotype ABO de cette personne. Les virions expectorés, porteurs de ces antigènes, pourraient alors être neutralisés par les anticorps naturels anti-A ou anti-B de la personne nouvellement infectée lorsque celle-ci en possède.
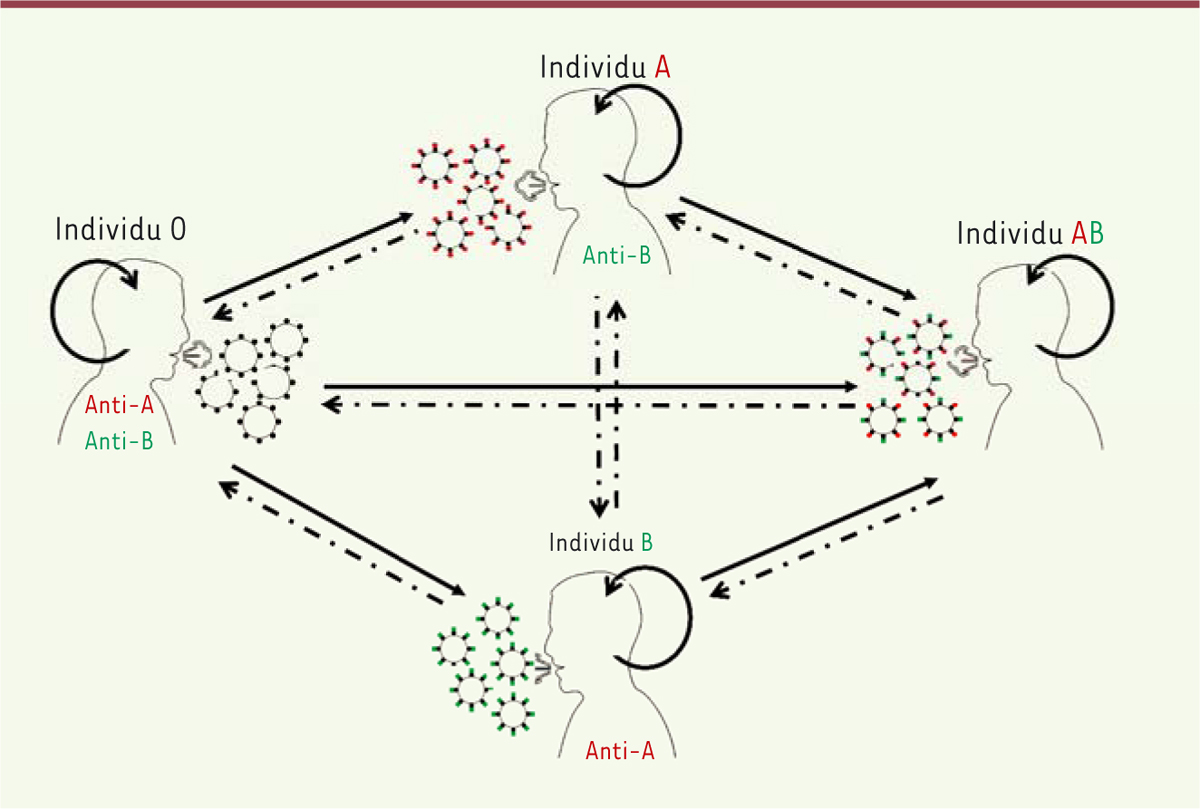
Les personnes de groupe sanguin O, qui possèdent à la fois des anticorps anti-A et anti-B, bénéficieraient donc d’une meilleure protection contre l’infection que les personnes de groupe non-O ( Figure 1 ) . Cependant, les titres d’anticorps 6, anti-A et anti-B sont très variables d’un individu à l’autre, et on peut s’attendre à ce que les personnes qui ne possèdent ces anticorps qu’en faible quantité soient plus à risque que les personnes présentant des titres plus forts. C’est effectivement ce que nous avons montré en comparant les titres d’anticorps anti-A et anti-B entre un groupe de patients symptomatiques pour la COVID-19 (porteurs du virus SARS-CoV-2, confirmés par RT-PCR [ reverse transcription-polymerase chain reaction ]) et un groupe de témoins (asymptomatiques). Les titres d’anticorps naturels, dirigés contre d’autres motifs glycaniques de structure apparentée à celles des antigènes de groupes sanguins, ne sont toutefois pas différents entre les deux groupes, suggérant que les différences observées pour les anticorps anti-A et anti-B ne sont pas pas dues à une diminution générale des taux d’anticorps naturels anti-carbohydrates que ces patients ont développés auparavant [ 6 ].
| Figure 1.
Modèle de transmission du virus en présence d’un effet d’interférence ABO.
Les virions produits par les individus du groupe sanguin O sont dépourvus d’antigènes A ou B, et peuvent être transmis sans restriction, quel que soit le groupe sanguin du receveur (flèches en trait plein). Les virions produits par les individus des groupes sanguins A et B portent les épitopes A ou B (spicules rouges ou verts, respectivement) et les virions produits par les individus du groupe sanguin AB portent les épitopes A et B. La transmission de ces virus est diminuée par la présence d’anticorps anti-A et/ou anti-B chez le receveur (flèches en trait pointillé). La transmission entre individus du même groupe ABO est toujours maximale (flèches circulaires). En présence d’anticorps anti-A et anti-B ayant un titre élevé, les transmissions, représentées par des flèches en trait pointillé, pourraient être complètement éliminées (figure adaptée de [
14
]).
|
De nombreux travaux ont par ailleurs montré que les groupes sanguins ABO avaient une influence sur le risque thrombo-embolique des sujets (pour une revue récente, voir [ 7 ]). Le risque d’infarctus du myocarde, d’ischémie cardiovasculaire, d’athérosclérose vasculaire et de thrombose veineuse est en effet clairement plus élevé pour les personnes de groupe non-O que pour les personnes de groupe O. Ces observations ont été reliées à une quantité du facteur de von Willebrandt – qui joue un rôle important dans le processus de la coagulation 7, – dans la circulation sanguine environ 30 % supérieure chez les personnes des groupes non-O, ce qui les rend plus susceptibles de développer des caillots sanguins. Le facteur de von Willebrandt est fortement glycosylé (par N- et O-glycosylations), et sa clairance, qui dépend largement de sa liaison à des lectines (des protéines participant à l’immunité innée et reconnaissant des motifs glucidiques), est diminuée si des motifs antigéniques A ou B sont présents sur ses chaînes de glycanes. La fonction vasculaire est également affectée par le polymorphisme ABO. Bien que les mécanismes n’en soient pas totalement élucidés, ils impliqueraient les molécules d’adhérence cellulaire, comme ICAM ( intercellular adhesion molecule ) et les P-sélectines et E-sélectines 8 , dont les taux de formes circulantes sont augmentés chez les personnes de groupe A par rapport à ceux observés chez les personnes de groupe O [ 8 ].
Nous avons analysé la littérature portant sur les potentielles associations entre groupes sanguins ABO et COVID-19, à la lumière de ces deux hypothèses, immunologique (anticorps naturels) et physiopathologique (mettant en jeu l’hémostase et une fonction vasculaire), dont les conséquences attendues sont très différentes.
Les effets du groupe sanguin ABO sur l’hémostase et la fonction vasculaire, s’ils sont en cause dans la COVID-19, n’interviendraient que tardivement, dans la forme sévère de la maladie. En accord avec cette hypothèse pathogénique, les études comparant l’évolution clinique de patients hospitalisés, en fonction de leur phénotype ABO, ont effectivement permis d’observer un effet protecteur du groupe O et/ou un effet délétère des autres groupes sanguins [ 3 ]. Toutefois, à l’exception des patients ayant des antécédents d’hypertension artérielle, chez lesquels un risque de décès trois fois supérieur pour les individus de groupe non-O par rapport aux individus de groupe O a été rapporté [ 9 ], l’effet du groupe sanguin ABO sur la sévérité de la COVID-19 apparaît faible.
La plupart des études ont porté sur le risque d’infection des individus selon leur groupe sanguin. Elles ont comparé la fréquence des phénotypes ABO dans un groupe témoin de personnes non infectées par rapport à un groupe de patients affectés par des formes de COVID-19 de sévérité très variable, allant de l’infection asymptomatique aux formes les plus sévères. Dans le contexte de l’hypothèse d’un rôle possible des anticorps anti-ABO sur le risque infectieux, que nous présentons dans la Figure 1 , les fréquences relatives des phénotypes O, A, B et AB dans les populations devraient être déterminantes. Mais ces fréquences sont très variables d’une zone géographique à l’autre. Cependant, les personnes de groupe O s’infectant préférentiellement entre elles, puisqu’aucune protection par les anti-A ou anti-B ne pourra intervenir entre personnes du même groupe, moins elles seront nombreuses dans une population, moins elles risqueront d’être infectées. Cette prédiction est en accord avec les données épidémiologiques montrant que les odds ratios (ou rapports des chances relatives d’infection) du groupe O sont significativement plus faibles dans les pays où ce groupe sanguin est le moins représenté [ 3 ]. Une modélisation mathématique de la transmission du SARS-CoV-2, selon le schéma présenté dans la Figure 1 , permet d’évaluer l’impact théorique du polymorphisme ABO sur l’épidémie [ 10 ]. Ce modèle permet en effet de prédire que plus les situations d’incompatibilité ABO seront fréquentes chez les individus en contact avec les personnes infectées, plus la circulation du virus sera ralentie. En pratique, cette situation existe dans les zones géographiques où les fréquences des groupes sanguins A, B et O sont similaires. Il est ainsi possible de calculer une valeur théorique de la diminution du coefficient de transmission du virus R 0 9 en fonction des fréquences relatives des phénotypes ABO dans une population. Ainsi, dans les pays asiatiques, comme le Japon ou la Corée du Sud, dans lesquels les groupes A, B et O ont des fréquences quasi identiques dans la population, le nombre d’interactions conduisant potentiellement à une transmission infectieuse entre individus en situation d’incompatibilité de groupe sanguin, est maximal. À l’inverse, en Amérique latine, le groupe O est très fortement représenté, jusqu’à 70 % au Pérou ou dans certaines régions du Brésil, tandis que le groupe B est très faiblement présent.
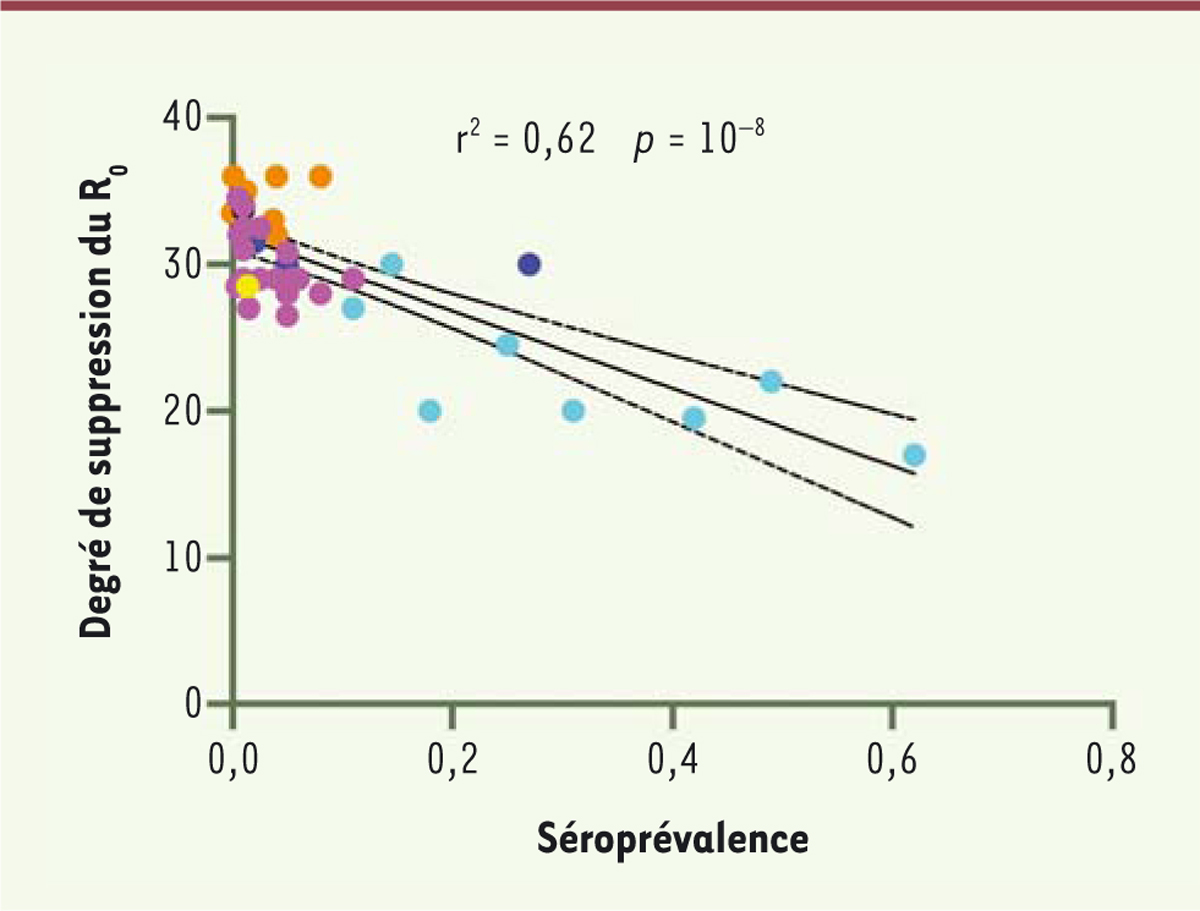
Nous avons donc recherché l’existence d’une éventuelle corrélation entre la diminution théorique du R 0 et l’impact de l’épidémie en fonction de la zone géographique. Pour cela, nous avons utilisé les données de séroprévalence de l’infection par le SARS-CoV-2 (c’est-à-dire la proportion de personnes affectées par le virus dans une population) publiées par O’Driscoll et al. pour un échantillon de 45 pays ou régions [ 11 ]. La Figure 2 montre l’existence d’une forte association entre la séroprévalence et le degré de suppression théorique du R 0 calculé à partir des fréquences des phénotypes ABO dans 41 pays, pour lesquels des données sur ces fréquences sont disponibles et fiables.
| Figure 2.
Analyse de régression entre le degré théorique de suppression du R
0
, calculé à partir de la distribution des phénotypes ABO pour chaque pays, selon le modèle d’Ellis [
10
], et les taux de séroprévalence de l’infection par le virus SARS-CoV-2 correspondant aux estimations médianes calculées par O’Driscoll
et al.
[
11
]. Les points représentent différents pays d’une zone géographique : Amérique du nord (en jaune), Amérique centrale et Amérique du sud (en cyan), Afrique (en bleu), Europe (en magenta), et Asie (en orange). Plus la séroprévalence est élevée, moins le R
0
est diminué.
|
Il est maintenant admis que l’impact de la COVID-19 est également associé à des différences socio-économiques, les populations défavorisées étant plus à risque d’infection [ 12 ]. Dans la mesure où les fréquences des antigènes de groupes sanguins sont également liées à l’histoire de l’espèce humaine, avec ses métissages, elles pourraient donc être également associées à des différences socio-économiques entre individus, résultant de ces migrations. Nous avons donc recherché s’il existait une relation entre les fréquences des groupes sanguins ABO et l’indice de développement humain corrigé des inégalités (ou IDHI) 10, de l’Organisation des Nations unies (ONU). Nous avons trouvé que ces deux variables étaient indépendantes. Par contre, l’IDHI s’est avéré être associé à la séroprévalence, la séroprévalence ayant tendance à être plus basse dans les pays à fort IDHI [ 3 ]. Ainsi, bien que corrélatives et indirectes, ces observations suggèrent que l’interférence ABO pourrait contribuer aux différences d’impact de l’épidémie entre les pays. La diminution du coefficient R 0 de transmission plus ou moins importante selon la zone géographique en fonction des fréquences relatives des groupes sanguins ABO dans la population, pourrait ainsi renforcer de manière variable l’efficacité des mesures de distanciation sociale. Dans ce contexte, les pays asiatiques seraient les plus favorisés, tandis que les pays d’Amérique centrale et d’Amérique du sud seraient particulièrement défavorisés.
Des études complémentaires seront nécessaires pour démontrer formellement l’effet protecteur des anticorps anti-ABO en contexte de transmission « ABO incompatible » entre le donneur et le receveur du virus. Il est à noter que ce mécanisme de protection inné à l’échelle des populations est en grande partie indépendant de la séquence des protéines virales puisqu’il ne porte que sur leur glycosylation. Il pourrait donc s’appliquer à l’ensemble des coronavirus infectant l’homme. L’impact de l’interférence ABO pourrait être optimisé par l’augmentation des titres des anticorps anti-ABO à l’échelle de la population. Pour cela, l’utilisation de bactéries probiotiques exprimant des antigènes de groupes sanguins à leur surface est une des pistes envisageables, puisque les anticorps naturels anti-ABO sont principalement synthétisés en réponse à des bactéries du microbiote [ 13 ].