| |
| Med Sci (Paris). 37(5): 474–481. doi: 10.1051/medsci/2021058.Dépistage de l’hypothyroïdie congénitale Juliane Léger1* 1AP-HP Nord, Université de Paris, Hôpital universitaire Robert Debré, Service d’endocrinologie diabétologie pédiatrique, Centre de référence des maladies endocriniennes rares de la croissance et du développement, Inserm NeuroDiderot UMR 1141
,
48 boulevard Sérurier
,
75019
,
Paris
,
France |
Vignette (© CNCDN). L’hypothyroïdie congénitale (HC) se caractérise par une production insuffisante d’hormones thyroïdiennes entraînant un retard mental sévère et une petite taille lorsqu’elle n’est pas traitée dès les premières semaines après la naissance. La sévérité de ces complications dépend de l’intensité du déficit hormonal. Cette affection est le plus souvent liée à une anomalie de développement de la glande thyroïde qui peut être soit complète (athyréose), soit partielle (ectopie), ou la conséquence d’un déficit de biosynthèse des hormones thyroïdiennes, lorsque la glande thyroïde est en place.
C’est une affection pour laquelle un dépistage systématique est parfaitement justifié. En effet, la maladie est fréquente et sa prise en charge précoce, à l’aide d’un traitement simple et peu coûteux, permet d’éviter des altérations importantes du développement cérébral liées à l’insuffisance de production d’hormones thyroïdiennes pendant la vie fœtale et postnatale. Son diagnostic clinique lors des premières semaines après la naissance est difficile, ce qui explique qu’avant l’ère du dépistage néonatal systématique, le traitement était débuté tardivement. Un test de dépistage fondé sur le dosage de la thyréostimuline ou TSH (
thyroid stimulating hormone
) sur papier buvard a été développé ; il est parfaitement sensible et spécifique. Ce dépistage a été mis en place progressivement dès 1972 en Amérique du Nord, et en Europe dès la fin des années 1970. Il a été généralisé en France en 1979.
Grâce au dépistage néonatal systématique, et donc à la prise en charge thérapeutique précoce dès la période néonatale, le développement physique et psychomoteur des patients est quasiment normal depuis près de 40 ans. Les patients ont à présent une intégration normale au sein de la société, ce qui n’était pas le cas avant l’ère du dépistage néonatal systématique, quand la majorité d’entre eux étaient traités trop tardivement avec, pour conséquence, des séquelles intellectuelles qui pouvaient être importantes [
1
,
2
] .
|
Méthodologie du dépistage Organisation du dépistage systématique
L’anomalie de la glande thyroïde entraîne une baisse du taux des hormones thyroïdiennes circulantes dès la période fœtale. Les premières tentatives de mise au point de systèmes de dépistage se sont naturellement portées sur le dosage de la thyroxine (ou T4). Très vite, cependant, la majorité des pays se sont tournés vers le dosage de la TSH. En effet, à la naissance, le rétrocontrôle entre les hormones thyroïdiennes et la TSH est déjà mis en place, toute baisse de thyroxine due à une anomalie ou un dysfonctionnement de la glande thyroïde s’accompagnant ainsi d’une élévation de la TSH. C’est donc ce paramètre qui est utilisé pour le dépistage. Comme pour les autres dépistages, le prélèvement de sang est réalisé par piqûre du talon au 3
e
jour après la naissance. La TSH est dosée sur l’éluat de sang séché. Malheureusement, les trousses de dosages par immunocapture (ELISA,
enzyme-linked immunosorbent assay
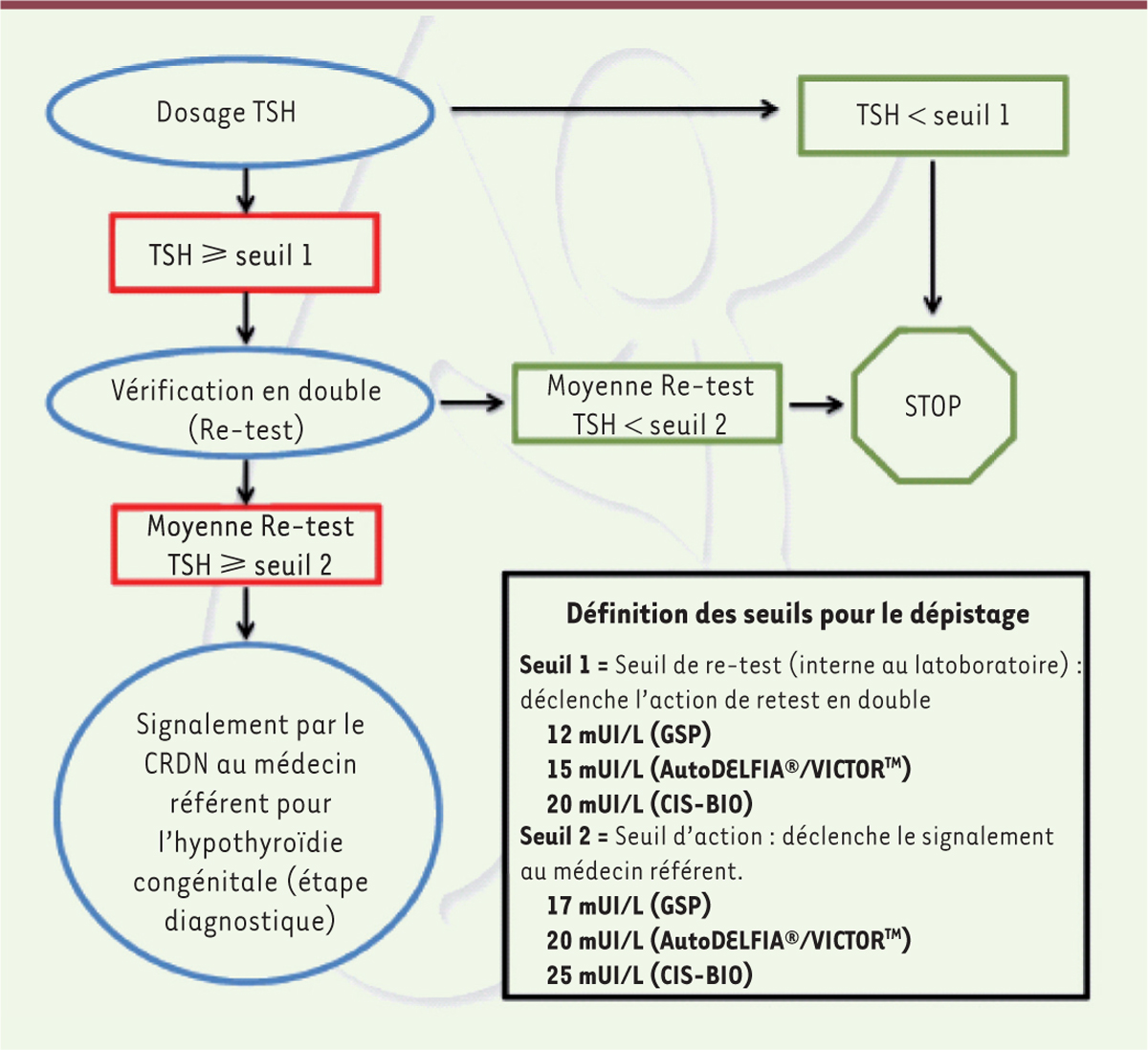
) utilisées ne donnent pas toutes les mêmes valeurs. Comme on peut le voir sur l’arbre décisionnel
(
Figure 1
)
, le seuil de rappel de première intention, c’est-à-dire la valeur de la TSH qui va permettre de suspecter l’hypothyroïdie, varie entre 12 et 20 mUI/L
1
selon l’origine des trousses. Cette valeur seuil déclenche, si elle est dépassée, un 2
e
dosage sur le même papier buvard et si possible le même jour. Tout enfant ayant, avec ce 2
e
test, une TSH élevée, au-dessus d’un seuil situé entre 17 et 25 mUI/L, devra être évalué très rapidement en milieu spécialisé pour confirmer le diagnostic, avec une recherche étiologique et une mise en route précoce du traitement, qui débute actuellement environ 10 jours après la naissance. Cet âge de début de traitement, élément essentiel du succès thérapeutique, a évolué au cours du temps grâce à une amélioration de toute l’organisation logistique du dépistage ; il était aux environs de 23 jours dans les premières années qui ont suivi l’instauration du dépistage. La valeur seuil de TSH pour le dépistage a été progressivement diminuée ces dernières années ; elle était autour de 30 mUI/L en France lors de l’instauration du dépistage, mais avec une méthode de dosage qui était moins sensible. Elle reste actuellement encore discutée et peut être différente selon les pays. En effet, la réflexion sur la valeur seuil oscille entre deux extrêmes puisque son abaissement permet de dépister un plus grand nombre de patients, mais est à l’origine d’un plus grand nombre de faux positifs et probablement aussi d’un plus grand nombre de patients traités pour des formes d’hypothyroïdie qui vont parfois s’avérer transitoires. À l’inverse, une valeur du seuil de rappel trop élevée peut être à l’origine de faux négatifs, ce qui conduit à une absence de diagnostic chez des patients dont la forme d’hypothyroïdie est modérée [
3
-
5
]. Il faut aussi souligner que cette méthode de dépistage par dosage de la TSH ne permet pas de dépister les enfants avec une hypothyroïdie congénitale centrale liée à une insuffisance hypophysaire qui se traduit par un déficit en TSH, une forme beaucoup plus rare, et pour laquelle les concentrations sanguines de TSH ne sont donc pas élevées à la naissance. Quelques rares pays ont fait le choix d’une méthode de dépistage fondée sur le dosage direct de la thyroxine sur le papier buvard.
 | Figure 1.
Arbre décisionnel du dépistage néonatal de l’hypothyroïdie congénitale en France.
TSH :
thyroid stimulating hormone
; CRDN : Centre régional de dépistage néonatal.
|
Depuis le début de l’instauration du dépistage néonatal systématique en France, plus de 10 000 enfants ont pu être diagnostiqués. Ils ont bénéficié d’une prise en charge précoce de leur maladie. Les difficultés du dépistage Le nombre de faux positifs au dépistage par la TSH est faible. Il est lié à l’existence de quelques formes d’hypothyroïdie transitoire, en général compensée avec un taux normal d’hormones thyroïdiennes libres. Ces formes n’ont quasiment pas d’impact sur le long terme pour l’enfant. Elles sont le plus souvent liées à une surcharge iodée, ou à un excès dans le traitement par antithyroïdiens de synthèse pour hyperthyroïdie des mères pendant leur grossesse. Dans ce cas, la concentration de TSH sérique peut être élevée chez l’enfant pendant quelques jours, expliquant qu’il ai été dépisté et traité. Une réévaluation après quelque temps conduit en règle à un arrêt du traitement.
Exceptionnellement, quelques cas de faux négatifs ont été rapportés. Ils étaient le plus souvent dus à des incidents techniques [
6
]. Chez le prématuré et/ou en cas de petit poids de naissance par rapport à l’âge gestationnel, un retard à l’élévation de la TSH lié à une immaturité de l’axe hypothalamus-hypophyse-thyroïde peut cependant survenir et être à l’origine de faux négatifs du dépistage, dans des formes très modérées d’hypothyroïdie. Un second test de dépistage effectué deux semaines après la naissance chez les prématurés et chez les jumeaux, est ainsi préconisé dans certains pays, mais cela reste discuté et n’a pas été généralisé [
7
-
9
]. Ces résultats, et l’absence de dépistage néonatal dans certaines régions défavorisées du monde, doivent conduire à rester vigilant sur les signes pouvant évoquer le diagnostic et à demander un dosage hormonal chez l’enfant au moindre doute. C’est aussi la raison pour laquelle le diagnostic doit être évoqué chez un enfant plus âgé, même si le dépistage avait été réalisé auparavant.
|
Les causes sont multiples. Il peut s’agir d’une anomalie de développement de la glande et, dans ce cas, la thyroïde n’est pas en position normale ou est absente (on dit que la loge thyroïdienne est vide). Dans un certain nombre de cas, il s’agit d’une anomalie de synthèse des hormones thyroïdiennes. Dans ces cas, la glande est en place et a parfois un volume plus important (goitre). D’autres causes ont été identifiées, dont certaines sont transitoires. Les anomalies de développement de la thyroïde
La glande thyroïde se forme principalement à partir d’une ébauche embryonnaire située au niveau de la partie médiane du plancher du pharynx primitif qui deviendra ultérieurement le
foramen cæcum
au niveau de la base de la langue. Cette thyroïde primitive apparaît chez l’homme après la 2
e
semaine de gestation. Elle migrera progressivement dans la partie cervicale antérieure, au niveau de la ligne médiane, le long du tractus thyréoglosse
2
, pour atteindre, au cours de la 7
e
semaine de gestation, sa position définitive au-dessous du cartilage thyroïdien à la face antérieure du cou. Les anomalies du développement de la glande, ou dysgénésies thyroïdiennes, peuvent intéresser tout ce processus migratoire et sont donc très variables
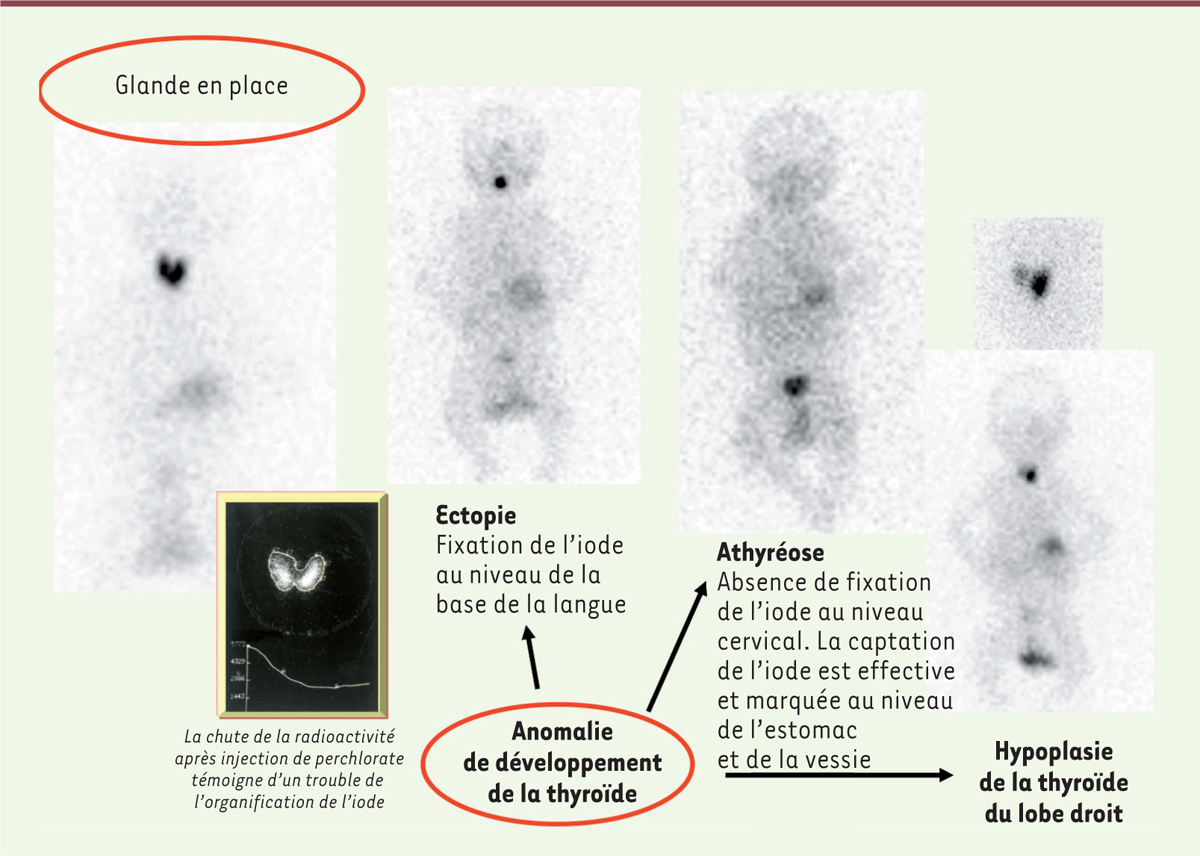
(
Figure 2
)
.
 | Figure 2.
Différents résultats de l’examen par scintigraphie à l’iode 123 permettant le diagnostic de la forme clinique de l’hypothyroïdie congénitale d’origine primitivement thyroïdienne.
|
L’anomalie de développement peut être totale (athyréose ou absence de tissu, avec hypothyroïdie profonde) ou partielle (ectopie thyroïdienne, hémithyroïde avec ou sans isthme, hémi-agénésie d’un lobe). Dans le cas de l’ectopie thyroïdienne, le tissu thyroïdien ectopique se localise généralement au niveau de la base de la langue. D’autres localisations ont été rapportées : dans la langue (parfois asymptomatique), au-dessus, en regard ou au-dessous de l’os hyoïde, ou en regard du cartilage thyroïdien.
Dans certaines formes de dysgénésie thyroïdienne, des anomalies génétiques ont été identifiées, essentiellement dans des formes syndromiques. Les mutations décrites touchent différents gènes :
NKX2.1
(
NK2 homeobox 1
) qui code le facteur-1 de transcription de la thyroïde (TTF-1), et elles s’accompagnent alors de symptômes respiratoires, neurologiques à type d’hypotonie et de mouvements anormaux, et d’une hypothyroïdie ;
FOXE1 (forkhead Box E1)
qui code TTF-2 ;
PAX8 (paired box gene 8)
;
JAG1 (jagged canonical Notch ligand 1)
; le gène codant la boréaline (une protéine régulatrice de la kinase mitotique Aurora-B
)
;
NTN1
(qui code la nétrine 1) ; ou le gène codant le récepteur de la TSH (
TSH-R
). Ces anomalies concernent moins de 5 % des cas d’HC par dysgénésie de la glande thyroïde. L’origine génétique des formes les plus nombreuses reste à élucider [
11
].
L’hypothyroïdie avec glande en place
L’hypothyroïdie congénitale avec glande en place (avec ou sans goitre) est un ensemble hétérogène de maladies, en raison des différentes causes possibles ainsi que du caractère transitoire ou permanent de la maladie. Les troubles de l’hormonosynthèse et les anomalies de l’organification de l’iodure
3,
sont les causes plus fréquentes. Elles peuvent être en relation avec des anomalies du gène
PDS
codant la pendrine (syndrome de Pendred avec surdité
4
), du gène codant la thyréoperoxydase, ou des gènes codant l’une des enzymes du système générateur de l’eau oxygénée, la
dual oxidase 2
(DUOX2) et la
dual oxidase maturation factor 2
(DUOX2A), qui sont indispensables à la réaction chimique impliquée dans l’organification de l’iodure. Les anomalies du gène codant le transporteur des iodures (
NIS
,
sodium-iodide symporter
), ou celles affectant la thyroglobuline ou la désiodination des iodothyronines, peuvent également être impliquées. Lorsque la glande thyroïde est en place et de taille normale ou hypoplasique, des anomalies moléculaires, responsables d’une résistance à la TSH, soit au niveau de son récepteur (mutation inactivatrice du gène
TSH-R
), soit au niveau de sa voie de signalisation (gène
GNAS [guanine nucleotide-binding protein, alpha stimulating]
), doivent être recherchées.
Les autres formes d’hypothyroïdie
Les hypothyroïdies d’origine centrale
5
s’accompagnent d’une glande thyroïde de morphologie normale. Elles peuvent être d’origine hypothalamique ou hypophysaire [
10
]. Les anomalies moléculaires du gène codant la sous-unité β de la TSH ou de celui codant le récepteur de la TRH (
thyreotropin releasing hormone
) sont très rares. Récemment, des mutations des gènes
IGSF1
(
immunoglobulin superfamily member 1
),
TBL1X
(
transducin beta-like 1 X-linked
), et
IRS4
(
insulin receptor substrate 4
) ont été décrites. Les autres formes d’hypothyroïdie centrale plus fréquentes s’accompagnent en règle générale d’autres déficits endocriniens (hormone de croissance, hormone corticotrope, gonadotrophines, prolactine) dont les bases moléculaires restent peu ou pas connues actuellement [
10
,
11
]. Les anomalies du gène codant le récepteur α1 des hormones thyroïdiennes, dont la symptomatologie est associée à des signes d’hypothyroïdie, s’inscrivent dans le cadre des syndromes de résistance aux hormones thyroïdiennes et ne bénéficient pas du dépistage néonatal.
Les hypothyroïdies transitoires
Les causes des formes transitoires actuellement rapportées regroupent essentiellement la surcharge iodée ou, au contraire, la carence en iode, le passage transplacentaire d’anticorps maternels à effet bloquant sur la fonction thyroïdienne (thyroïdite maternelle), ou d’antithyroïdiens de synthèse (maladie de Basedow chez la mère, traitée pendant la grossesse), ainsi que certaines formes de troubles de l’hormonosynthèse thyroïdienne (impliquant les gènes
DUOX2
,
TSH-R
) ou le syndrome de Pendred ou la trisomie 21 [
12
]. Une association entre des concentrations sériques de TSH à la limite supérieure de la norme et des anomalies mineures du neurodéveloppement à l’âge de 5 à 10 ans, a été récemment rapportée par une équipe australienne [
13
]. Néanmoins, une étude récente montre l’absence d’impact de concentrations sériques de TSH faibles (< 15 mUI/L) sur le développement cognitif à long terme [
14
].
|
Prise en charge des patients Éléments du diagnostic L’analyse clinique des enfants qui ont été dépistés permet de retrouver, parfois, des signes discrets mais évocateurs de l’hypothyroïdie : post-maturité, retard à l’élimination du méconium, ictère néonatal prolongé sans cause apparente, de durée égale ou supérieure à huit jours, fontanelle antérieure large, persistance de la fontanelle postérieure (> 5 mm). La taille de ces enfants à la naissance est normale. Selon l’intensité de l’hypothyroïdie, peuvent exister, une hypotonie, une hernie ombilicale, une raucité de la voix, une macroglossie, des marbrures, et une constipation. Les parents ont pu également noter que leur enfant était « bien sage », celui-ci dormant beaucoup et réclamant peu l’allaitement ou les biberons. Ces signes, qui sont loin d’être toujours présents, ne permettent cependant pas un diagnostic suffisamment précoce de la maladie dans la majorité des cas. La palpation du cou permet d’orienter l’étiologie. En effet la découverte d’un goitre sera en faveur d’un trouble de l’hormonosynthèse thyroïdienne, alors que si on ne palpe pas de glande thyroïde, une dysgénésie thyroïdienne sera plutôt évoquée.
Des
examens complémentaires
permettront de confirmer le diagnostic d’hypothyroïdie et de préciser sa cause [
15
] avec :
La mise en évidence de concentrations sériques de TSH très élevées et celles des hormones T4 (thyroxine) et T3 (triiodothyronine) libres abaissées. L’intensité des perturbations hormonales est plus sévère chez les patients avec athyréose (absence totale du tissu thyroïdien). La mesure de la concentration sérique de la thyroglobuline peut aussi contribuer au diagnostic étiologique (elle est effondrée dans les athyréoses ou dans le défaut de biosynthèse de la thyroglobuline, mais normale ou élevée dans les autres cas) ; L’observation d’un retard de maturation osseuse, apprécié sur la radiographie du genou qui montre que les points d’ossification sont absents ou plus petits que la normale pour l’âge (normalement, les points fémoral inférieur et tibial supérieur sont calcifiés et donc bien visibles dès la naissance). La maturation osseuse est le résultat de l’action des hormones thyroïdiennes sur le cartilage du fœtus. Le retard de maturation osseuse reflète donc l’intensité de l’hypothyroïdie pendant la période fœtale ;
L’échographie et la scintigraphie de la glande thyroïde avec l’iode 123 (avec, si nécessaire, la réalisation d’un test au perchlorate
6
lorsque la glande est en place) permettent de préciser la cause de l’hypothyroïdie.
Dans 40 % des cas, on retrouve une thyroïde ectopique et, dans 15 % des cas, une athyréose. Dans les 45 % des cas restants, la thyroïde est en place, avec ou sans goitre
(
Figure 2
)
.
Dans certaines formes familiales d’hypothyroïdie par trouble de l’hormonogenèse, un
diagnostic prénatal
peut être exceptionnellement réalisé, grâce à l’échographie, qui peut montrer l’existence d’un goitre dès 20-25 semaines de grossesse. Un diagnostic positif conduit alors à pratiquer une ponction de sang fœtal afin de doser les hormones thyroïdiennes et de proposer un traitement prénatal par injection de lévothyroxine (L-thyroxine, ou T4 synthétique) dans le liquide amniotique pour limiter l’hypothyroïdie fœtale [
15
]. Un diagnostic génétique moléculaire peut également aider dans certains cas.
Conduite du traitement
Le but du traitement administré aux patients est de normaliser rapidement la concentration sérique des hormones thyroïdiennes afin de permettre un développement physique et mental normal. Si le pronostic à long terme paraît lié à la sévérité initiale de l’hypothyroïdie, la qualité du traitement précoce est l’un des facteurs déterminants de son évolution [
15
-
17
].
Le traitement des enfants par la lévothyroxine est débuté le plus tôt possible (actuellement entre 7 et 15 jours après la naissance). Elle est administrée en une prise quotidienne, à la dose initiale de 8 à 15 µg/kg/j, selon la sévérité de l’hypothyroïdie. Une augmentation rapide des doses peut parfois être nécessaire lorsqu’il existe un retard à la normalisation des hormones après 15 jours de traitement. La solution aqueuse en goutte (1 goutte correspond à 5 µg de la molécule), disponible dans certains pays, est utilisée chez le nourrisson, de préférence au comprimé prescrit en pratique après l’âge de 6 mois.
Les concentrations sériques des hormones thyroïdiennes libres (T3 et T4) se normalisent après 15 jours de traitement, et les taux de TSH, à ce moment, doivent être inférieurs à 20 mUI/L. Ces taux nécessiteront d’être maintenus à des valeurs comprises entre 0,5 et 4 mUI/L, tout en évitant le surdosage du traitement, qui peut aussi se révéler délétère pour le développement de l’enfant [
18
]. Notons cependant qu’au cours de l’évolution du traitement, les valeurs sériques de T4 libre sont importantes, à la limite supérieure de la normale pour l’âge, les concentrations de T3 libre et de TSH restant quant à elles normales. Le délai de normalisation de la concentration sanguine de TSH peut être long (> 15 jours) chez certains patients. Dans certains cas, il peut s’agir d’une insuffisance thérapeutique. Mais une immaturité de l’axe thyréotrope hypothalamo-hypophysaire responsable d’un rétrocontrôle anormal, avec taux de TSH élevé, peut être aussi évoquée. Quoi qu’il en soit, la dose de lévothyroxine administrée nécessite d’être augmentée dans ces cas. L’adaptation de la posologie sera guidée par la surveillance clinique et biologique (tous les 15 jours, jusqu’à la normalisation de la concentration de TSH, puis tous les 2 mois, jusqu’à l’âge de 6 mois, puis trimestrielle jusqu’à l’âge de 1 à 2 ans, et ensuite semestrielle). La posologie de lévothyroxine est en moyenne de 5,5 µg/kg/j vers l’âge de 1 an ; elle varie de 5,5 à 3 µg/kg/j entre l’âge de 2 et 10 ans, et est en moyenne inférieure ou égale à 3 µg/kg/j ensuite.
Cas particulier des formes transitoires d’hypothyroïdie
L’existence de formes transitoires doit être discutée chez tous les enfants dépistés et porteurs d’une glande thyroïde en position normale. Habituellement, accompagnant la croissance du nouveau né, les doses d’hormones thyroïdiennes administrées vont augmenter avec le poids de l’enfant. Si au cours du suivi thérapeutique cette augmentation n’a pas paru nécessaire, chez un enfant avec glande en place, une réduction, voire un arrêt momentané du traitement, peuvent alors être envisagés afin de vérifier, à distance de cet arrêt, le fonctionnement thyroïdien [
15
]. En effet, à l’inverse des formes d’HC avec anomalie de développement de la glande, qui sont toujours des formes permanentes de la maladie, des formes d’hypothyroïdies transitoires sont décrites dans la moitié des cas des formes d’HC avec glande thyroïde en place. Ces formes transitoires ont plus fréquemment des causes environnementales, iatrogéniques (surcharge iodée) ou auto-immunes. Ces dernières années, ces formes apparaissent nettement en augmentation, ce qui justifie la réévaluation systématique, dès la petite enfance, de la fonction thyroïdienne de toutes les HC avec glande en place (avec ou sans goitre) [
15
]. Cette réévaluation peut être assez précoce, dès l’âge de 6 mois en cas de très faible besoin en lévothyroxine (< 3 µg/kg/j) [
19
].
Des mutations inactivatrices du gène codant la thyroïde oxydase (
DUOX2
/
DUOX2A
) ont par ailleurs été mises en évidence chez des sujets qui avaient présenté une hypothyroïdie transitoire [
20
]. Une étiologie génétique pourrait donc être suspectée dans certaines formes d’hypothyroïdie transitoire [
11
]. Des causes environnementales, qui pourraient être liées aux perturbateurs endocriniens, sont également discutées. Ces observations soulignent la nécessité d’une vigilance dans la prise en charge de ces patients.
Contrôle de l’hypothyroïdie pendant la grossesse
Le contrôle de l’hypothyroïdie pendant la grossesse nécessite, comme dans les cas d’hypothyroïdie acquise, une augmentation du traitement, en raison des besoins accrus en thyroxine, dès le 1
e
trimestre de la grossesse. En effet, l’augmentation des concentrations sériques de la
thyroxine-binding globulin
(TBG), en relation avec le fort accroissement des taux d’œstrogènes et du volume plasmatique, conduit à une hausse du pool total de T4 dès le 1
e
trimestre de la grossesse [
21
]. Une adaptation thérapeutique précise et régulière en début de grossesse, et pendant toute sa durée, est donc nécessaire pour maintenir une fonction thyroïdienne normale de la mère. Elle est aussi cruciale pour le développement cérébral du fœtus [
22
]. Celui-ci est, en effet, entièrement dépendant des hormones thyroïdiennes de la mère pendant la première moitié de la gestation, la thyroïde fœtale ne commençant à être fonctionnelle qu’au début de la seconde moitié de la grossesse. Cette adaptation thérapeutique est donc particulièrement importante en début de grossesse. Elle conditionne le bon déroulement de la grossesse et, surtout, le développement cérébral du fœtus [
23
-
25
].
|
Apport épidémiologique du dépistage
En France, le dépistage systématique, qui recouvre désormais 100 % des naissances, a permis de connaître la prévalence de l’hypothyroïdie congénitale, qui est de 1/2 500 naissances. Cette prévalence est retrouvée dans de nombreux pays, mais elle varie aussi selon les ethnies. Elle est plus importante dans les populations asiatiques (1/2 000) et moindre chez les Afro-Américains (1/32 000) [
26
]. L’hypothyroïdie avec glande en place (avec ou sans goitre) représente environ 40 à 50 % des cas d’hypothyroïdies, dont les troubles de l’hormonosynthèse, le plus souvent transmis selon le mode autosomique récessif. Les dysgénésies thyroïdiennes sont fréquentes : elles représentent 50 à 60 % des cas, avec des ectopies de la glande (dans deux tiers des cas) et des athyréoses (dans un tiers des cas). Les hypoplasies de la thyroïde (avec glande en place) sont beaucoup plus rares. Il existe une prépondérance féminine (avec un sex-ratio de 2,7). Les malformations qui sont associées à la maladie sont plus fréquentes que dans la population générale (8,2 % contre 2,5 %). Leur analyse révèle en effet une proportion importante de malformations cardiaques (28 % des malformations). Les autres malformations concernent le système nerveux, la face, l’appareil urogénital, et l’appareil digestif [
27
,
28
].
Une augmentation de l’incidence de l’hypothyroïdie congénitale a été observée ces dernières années dans plusieurs pays, y compris en France. La prévalence de cette affection est en effet passée progressivement de 1/3 500 à 1/2 500 en France (données du Centre National de Coordination du Dépistage Néonatal). Cette augmentation concerne essentiellement les patients avec glande en place, le taux d’incidence des dysgénésies thyroïdiennes restant, quant à lui, stable [
29
,
30
]. L’étude nationale réalisée en collaboration avec l’Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE) et Santé publique France a montré qu’entre 2002 et 2012, l’incidence de l’HC a très significativement (p < 0,001) augmenté, de 7,7 % par an pour les HC avec glande en place. Elle est restée stable pour les HC avec dysgénésies (indépendamment de la technique de dosage de TSH utilisée). Les modifications du seuil de dépistage de la TSH, les différences régionales de méthodes de dosage utilisées, la prématurité, l’analyse des variables recueillies lors du dépistage de l’HC (comme les index de sévérité de l’HC, le sexe ou le poids de naissance) ne permettent pas d’expliquer actuellement cette augmentation de l’incidence des HC avec glande en place. Elle pourrait être en partie liée à l’augmentation des formes transitoires d’HC [
31
].
Les dysgénésies thyroïdiennes ont été considérées comme une affection sporadique, même si quelques formes familiales ont été rapportées de manière isolée. Une enquête, réalisée en France il y a une vingtaine d’années, a en effet montré que 2 % des hypothyroïdies congénitales par dysgénésie de la glande étaient des formes familiales et que, par conséquent, des facteurs génétiques pouvaient être incriminés [
32
]. Des anomalies asymptomatiques de développement de la glande thyroïde ont également été mises en évidence au sein de familles nucléaires (20 % des familles étudiées) dans lesquelles un des membres avait une hypothyroïdie congénitale par dysgénésie thyroïdienne [
33
].
|
Résultats du traitement précoce sur la croissance, le développement psychomoteur et l’état de santé
Le développement physique, la croissance, la puberté, l’état de santé et la fertilité des patients qui ont été traités précocement grâce au dépistage néonatal (DNN) sont normaux [
2
,
34
-
36
]. Une tendance au surpoids, qui nécessite des mesures appropriées, a cependant été observée [
2
]. Une baisse de l’audition a également été rapportée chez certains patients qui présentent les formes les plus sévères, nécessitant une surveillance régulière de leurs capacités auditives [
37
]. L’acquisition de la masse osseuse chez ces enfants est normale, et aucun effet délétère lié à l’administration prolongée de lévothyroxine n’a été observé [
38
]. Le premier objectif du dépistage, à savoir l’amélioration du pronostic mental et moteur de l’enfant, a également été atteint. Les performances scolaires, le niveau d’éducation et l’insertion socio-professionnelle sont normaux chez la majorité des patients traités, et comparables à ceux de la population générale. Néanmoins, des anomalies mineures pendant la petite enfance (retard d’acquisition du langage, troubles de la coordination et de la motricité fine des extrémités, lenteur) et chez le jeune adulte, essentiellement liées à la sévérité initiale de l’hypothyroïdie, ont parfois été rapportées. Ces anomalies doivent être prises en charge précocement pour éviter qu’elles ne soient, à long terme, un handicap pour l’intégration scolaire et sociale ainsi que pour leur qualité de vie [
15
].
Les facteurs qui déterminent le pronostic intellectuel de ces sujets sont la sévérité initiale de l’hypothyroïdie (évaluée sur les valeurs des hormones thyroïdiennes et l’importance du retard de maturation osseuse au moment du diagnostic), l’âge au début du traitement, ainsi que la dose initiale de lévothyroxine utilisée, qui conditionne la rapidité de normalisation de la TSH. La qualité du traitement, tout au long de son évolution, est également très fortement liée au pronostic à long terme et à la qualité de vie [
15
,
36
]. Elle nécessite une éducation thérapeutique adaptée à tous les âges de la vie, avec une vigilance particulière lors de la transition du secteur pédiatrique vers le secteur pour adultes, ainsi qu’une surveillance régulière de l’observance du traitement et des paramètres biologiques, qui doivent être maintenus dans des valeurs normales [
15
,
39
].
|
L’hypothyroïdie congénitale est le plus souvent liée à une anomalie de développement de la glande thyroïde, qui peut être complète (athyréose) ou partielle (ectopie), ou à une anomalie moléculaire affectant la voie de synthèse des hormones thyroïdiennes. Grâce au dépistage systématique, la prise en charge thérapeutique précoce en période néonatale permet un développement normal (physique et psychomoteur) de ces patients. Le pronostic à long terme est fonction de la sévérité de l’hypothyroïdie et, surtout, de la qualité du traitement, qui doit faire l’objet d’une surveillance régulière, afin de maintenir les hormones thyroïdiennes dans des valeurs normales (et de manière plus cruciale, pendant la petite enfance et au moment de la grossesse). Ces dernières années, les progrès de la génétique moléculaire ont permis de comprendre certaines formes d’hypothyroïdie congénitale. L’incidence des formes d’hypothyroïdie avec glande en place et celle des formes transitoires augmente. Observée dans tous les pays, cette augmentation pose question et reste un sujet d’investigation. La généralisation du dépisage néonatal de l’hypothyroïdie congénitale reste un objectif majeur de santé publique dans les pays où ce dépistage n’a pas encore été mis en place [
40
].
|
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Grosse
SD
,
Van Vliet
G
.
Prevention of intellectual disability through screening for congenital hypothyroidism : how much and at what level?
.
Arch Dis Child.
2011;
;
96
:
:374.
–
379
.
2.
Leger
J
,
Ecosse
E
,
Roussey
M
et al.
Subtle health impairment and socioeducational attainment in young adult patients with congenital hypothyroidism diagnosed by neonatal screening : a longitudinal population-based cohort study.
.
J Clin Endocrinol Metab.
2011;
;
96
:
:1771.
–
1782
.
3.
Knowles
RL
,
Oerton
J
,
Cheetham
T
et al.
Newborn screening for primary congenital hypothyroidism : estimating test performance at different TSH thresholds.
.
J Clin Endocrinol Metab.
2018;
;
103
:
:3720.
–
3728
.
4.
Lain
S
,
Trumpff
C
,
Grosse
SD
et al.
Are lower TSH cutoffs in neonatal screening for congenital hypothyroidism warranted?
.
Eur J Endocrinol.
2017;
;
177
:
:D1.
–
D12
.
5.
Van Vliet
G
,
Diaz Escagedo
P
.
Redefining congenital hypothyroidism?
J Clin Endocrinol Metab.
2021;
;
106
:
:e1463.
–
5
.
6.
Leger
J
.
Screening for congenital hypothyroidism in France. Misdiagnosed cases : collaborative study of screening centres in France.
.
Eur J Pediatr.
1990;
;
149
:
:605.
–
607
.
7.
McGrath
N
,
Hawkes
CP
,
Mayne
P
,
Murphy
NP
.
Optimal timing of repeat newborn screening for congenital hypothyroidism in preterm infants to detect delayed thyroid-stimulating hormone elevation.
.
J Pediatr.
2019;
;
205
:
:77.
–
82
.
8.
Medda
E
,
Vigone
MC
,
Cassio
A
et al.
Neonatal screening for congenital hypothyroidism : what can we learn from discordant twins?
.
J Clin Endocrinol Metab.
2019;
;
104
:
:5765.
–
5779
.
9.
Grob
F
,
Van Vliet
G
.
Avoiding the overdiagnosis of congenital hypothyroidism in premature newborns.
.
Pediatrics.
2019;
;
144
:
:e20191706.
.
10.
Persani
L
,
Brabant
G
,
Dattani
M
et al.
2018 European thyroid association (ETA) guidelines on the diagnosis and management of central hypothyroidism.
.
Eur Thyroid J.
2018;
;
7
:
:225.
–
237
.
11.
Peters
C
,
van Trotsenburg
ASP
,
Schoenmakers
N
.
DIagnosis of endocrine disease, congenital hypothyroidism: update and perspectives.
.
Eur J Endocrinol.
2018;
;
179
:
:R297.
–
R317
.
12.
Gaudino
R
,
Garel
C
,
Czernichow
P
,
Leger
J
.
Proportion of various types of thyroid disorders among newborns with congenital hypothyroidism and normally located gland : a regional cohort study.
.
Clin Endocrinol (Oxf).
2005;
;
62
:
:444.
–
448
.
13.
Lain
SJ
,
Bentley
JP
,
Wiley
V
et al.
Association between borderline neonatal thyroid-stimulating hormone concentrations and educational and developmental outcomes : a population-based record-linkage study.
.
Lancet Diabetes Endocrinol.
2016;
;
4
:
:756.
–
765
.
14.
West
R
,
Hong
J
,
Derraik
JGB
,
et al.
Newborn screening TSH values less than 15 mIU/l are not associated with long-term hypothyroidism or cognitive impairment.
.
J Clin Endocrinol Metab.
2020;
;
105
:
:e3329.
–
38
.
15.
Leger
J
,
Olivieri
A
,
Donaldson
M
et al.
European society for paediatric endocrinology consensus guidelines on screening, diagnosis, and management of congenital hypothyroidism.
.
J Clin Endocrinol Metab.
2014;
;
99
:
:363.
–
384
.
16.
Aleksander
PE
,
Bruckner-Spieler
M
,
Stoehr
AM
et al.
Mean high-dose l-thyroxine treatment is efficient and safe to achieve a normal IQ in young adult patients with congenital hypothyroidism.
.
J Clin Endocrinol Metab.
2018;
;
103
:
:1459.
–
1469
.
17.
Alvarez
M
,
Iglesias Fernandez
C
,
Rodriguez Sanchez
A
et al.
Episodes of overtreatment during the first six months in children with congenital hypothyroidism and their relationships with sustained attention and inhibitory control at school age.
.
Horm Res Paediatr.
2010;
;
74
:
:114.
–
120
.
18.
Garcia Morales
L
,
Rodriguez Arnao
MD
,
Rodriguez Sanchez
A
,
et al.
Sustained attention in school-age children with congenital hypothyroidism: Influence of episodes of overtreatment in the first three years of life.
.
Neurologia.
2020;
;
35
:
:226.
–
32
.
19.
Saba
C
,
Guilmin-Crepon
S
,
Zenaty
D
et al.
Early Determinants of thyroid function outcomes in children with congenital hypothyroidism and a normally located thyroid gland : a regional cohort study.
.
Thyroid.
2018;
;
28
:
:959.
–
967
.
20.
Dufort
G
,
Larrivee-Vanier
S
,
Eugene
D
et al.
Wide spectrum of DUOX2 deficiency: From life-threatening compressive goiter in infancy to lifelong euthyroidism.
.
Thyroid.
2019;
;
29
:
:1018.
–
1022
.
21.
Alexander
EK
,
Marqusee
E
,
Lawrence
J
et al.
Timing and magnitude of increases in levothyroxine requirements during pregnancy in women with hypothyroidism.
.
N Engl J Med.
2004;
;
351
:
:241.
–
249
.
22.
Korevaar
TI
,
Muetzel
R
,
Medici
M
et al.
Association of maternal thyroid function during early pregnancy with offspring IQ and brain morphology in childhood: a population-based prospective cohort study.
.
Lancet Diabetes Endocrinol.
2016;
;
4
:
:35.
–
43
.
23.
Leger
J
,
dos Santos
S
,
Larroque
B
,
Ecosse
E
.
Pregnancy outcomes and relationship to treatment adequacy in women treated early for congenital hypothyroidism: a longitudinal population-based study.
.
J Clin Endocrinol Metab.
2015;
;
100
:
:860.
–
869
.
24.
Leger
J
,
Forhan
A
,
Dos Santos
S
et al.
Developmental milestones at one year for the offspring of mothers with congenital hypothyroidism: a population-based study.
.
Eur J Endocrinol.
2018;
;
178
:
:471.
–
480
.
25.
Alexander
EK
,
Pearce
EN
,
Brent
GA
et al.
2017 Guidelines of the American Thyroid association for the diagnosis and management of thyroid disease during pregnancy and the postpartum.
.
Thyroid.
2017;
;
27
:
:315.
–
389
.
26.
Peters
C
,
Brooke
I
,
Heales
S
et al.
Defining the Newborn blood spot screening reference interval for TSH : impact of ethnicity.
.
J Clin Endocrinol Metab.
2016;
;
101
:
:3445.
–
3449
.
27.
Castanet
M
,
Polak
M
,
Bonaiti-Pellie
C
et al.
Nineteen years of national screening for congenital hypothyroidism: familial cases with thyroid dysgenesis suggest the involvement of genetic factors.
.
J Clin Endocrinol Metab.
2001;
;
86
:
:2009.
–
2014
.
28.
Olivieri
A
,
Stazi
MA
,
Mastroiacovo
P
et al.
A population-based study on the frequency of additional congenital malformations in infants with congenital hypothyroidism: data from the Italian registry for congenital hypothyroidism (1991–1998).
.
J Clin Endocrinol Metab.
2002;
;
87
:
:557.
–
562
.
29.
Harris
KB
,
Pass
KA
.
Increase in congenital hypothyroidism in New York State and in the United States.
.
Mol Genet Metabol.
2007;
;
91
:
:268.
–
277
.
30.
Barry
Y
,
Bonaldi
C
,
Goulet
V
,
et al.
Increased incidence of congenital hypothyroidism in France from 1982 to 2012 : a nationwide multicenter analysis.
.
Ann Epidemiol.
2016;
;
26
:
:100.
–
5e1-4
.
31.
Barry
Y GV
,
Coutant
R
,
Cheillan
D
et al.
Hypothyroïdie congenitale en France : analyse des données recueillies lors du dépistage neonatal de 2002 à 2012.
.
Bull Epidemiol Hebd.
2015;
;
15–16
:
:239.
.
32.
Castanet
M
,
Lyonnet
S
,
Bonaiti-Pellie
C
et al.
Familial forms of thyroid dysgenesis among infants with congenital hypothyroidism.
.
N Engl J Med.
2000;
;
343
:
:441.
–
442
.
33.
Leger
J
,
Marinovic
D
,
Garel
C
et al.
Thyroid developmental anomalies in first degree relatives of children with congenital hypothyroidism.
.
J Clin Endocrinol Metab.
2002;
;
87
:
:575.
–
580
.
34.
Hassani
Y
,
Larroque
B
,
Dos Santos
S
et al.
Fecundity in young adults treated early for congenital hypothyroidism is related to the initial severity of the disease: a longitudinal population-based cohort study.
.
J Clin Endocrinol Metab.
2012;
;
97
:
:1897.
–
1904
.
35.
Delvecchio
M
,
Vigone
MC
,
Wasniewska
M
et al.
Final height in Italian patients with congenital hypothyroidism detected by neonatal screening: a 20-year observational study.
.
Ital J Pediatr.
2015;
;
41
:
:82.
.
36.
Leger
J
.
Congenital hypothyroidism: a clinical update of long-term outcome in young adults.
.
Eur J Endocrinol.
2015;
;
172
:
:R67.
–
R77
.
37.
Lichtenberger-Geslin
L
,
Dos Santos
S
,
Hassani
Y
et al.
Factors associated with hearing impairment in patients with congenital hypothyroidism treated since the neonatal period: a national population-based study.
.
J Clin Endocrinol Metab.
2013;
;
98
:
:3644.
–
3652
.
38.
Leger
J
,
Ruiz
JC
,
Guibourdenche
J
et al.
Bone mineral density and metabolism in children with congenital hypothyroidism after prolonged L-thyroxine therapy.
.
Acta Paediatr.
1997;
;
86
:
:704.
–
710
.
39.
Van Trotsenburg
AS
,
Stoupa
A
,
Leger
J
,
et al.
Congenital hypothyroidism: a 2020 consensus guidelines update an endo-European reference network (ERN) initiative endorsed by the European society for pediatric endocrinology and the European society for endocrinology.
.
Thyroid.
2021;
;
31
:
:387.
–
419
.
40.
Ford
G
,
LaFranchi
SH
.
Screening for congenital hypothyroidism: a worldwide view of strategies.
.
Best Pract Res Clin Endocrinol Metab.
2014;
;
28
:
:175.
–
187
.
|