| |
| Med Sci (Paris). 37(5): 441–456. doi: 10.1051/medsci/2021059.Dépistage néonatal en Europe
Évolution au cours de la dernière décennie et analyse de la situation actuelle par la Société internationale de dépistage néonatal
*J. Gerard Loeber,1** Dimitris Platis,2 Rolf H. Zetterström,3 and Peter J.C.I. Schielen1 1International Society for Neonatal Screening (ISNS) Office
,
Bilthoven
,
Pays-Bas 2Department of Newborn Screening, Institute of Child Health
,
Athènes
,
Grèce 3Centre for Inherited Metabolic Disease, Karolinska Institute
,
Stockholm
,
Suède |
Vignette (© CNCDN).
Le dépistage néonatal (DNN), appelé dans certains pays dépistage du nouveau-né ou
newborn screening
(NBS), a débuté en Europe dans les années 1960, lorsque des programmes, initialement limités au dépistage de la phénylcétonurie (PCU), ont été mis en place, par exemple au Royaume-Uni [
1
]. L’identification, dans les années 1930, d’un biomarqueur spécifique (l’acide phényl-pyruvique urinaire) fut la première étape vers un dépistage de la PCU. Cependant, la découverte capitale permettant ce dépistage a été la mise au point par Robert Guthrie [
2
] d’une méthode simple et peu coûteuse utilisant des taches de sang prélevé au talon du nouveau-né et déposé sur un papier buvard. Quelques années plus tard, Jean Dussault décrivait une technique radioimmunologique de dosage des hormones thyroïdiennes dans un éluat de sang séché, permettant le dépistage de l’hypothyroïdie congénitale. Une deuxième maladie était ainsi ajoutée au programme de dépistage [
3
]. La liste des maladies dépistées s’est ensuite allongée progressivement, avec un pic à la fin des années 1990 et la première décennie du
xxi
e
siècle, avec l’introduction de la spectrométrie de masse en tandem (MS/MS), qui a rendu possible le dépistage de 40 à 50 maladies dans une seule goutte de sang [
4
-
6
]. Les ajouts les plus récents au programme de DNN, notamment les dépistages de la mucoviscidose, du déficit immunitaire combiné sévère et de l’amyotrophie spinale, ont été rendus possibles grâce à la génétique moléculaire, utilisée seule ou en complément des techniques classiques.
Les critères de Wilson et Jungner [
7
] ont constitué la première « feuille de route » permettant d’établir une politique de dépistage, en prenant en considération la prévalence de la maladie, son diagnostic, les traitements disponibles, etc. Cependant, les progrès considérables de la génétique moléculaire et la mise au point de nouvelles méthodes analytiques ont permis d’allonger la liste des maladies pouvant être inscrites aux programmes nationaux de dépistage néonatal.
Nous définissons, dans cette revue, l’Europe comme une aire géographique représentant environ 50 pays situés à l’est de l’océan atlantique et à l’ouest de l’Oural et incluant la Russie
(
Figure 1
)
. La Société internationale de dépistage néonatal (ISNS) englobe également dans cette aire géographique cinq anciennes républiques de l’ex-URSS
1
situées à l’est de l’Oural (le Kazakhstan, le Kirghizistan, le Tadjikistan, le Turkménistan et l’Ouzbékistan), considérant leurs liens historiques étroits avec la Russie [
8
]. À la demande d’Israël, les données concernant le dépistage réalisé dans ce pays sont également présentées par l’ISNS. En 2019, la population de l’ensemble de ces pays représentait environ 915 millions d’habitants. Avec un taux de natalité moyen de 11,9 pour 1 000 habitants, cela représente près de 10,9 millions de nouveau-nés par an [
9
,
10
].
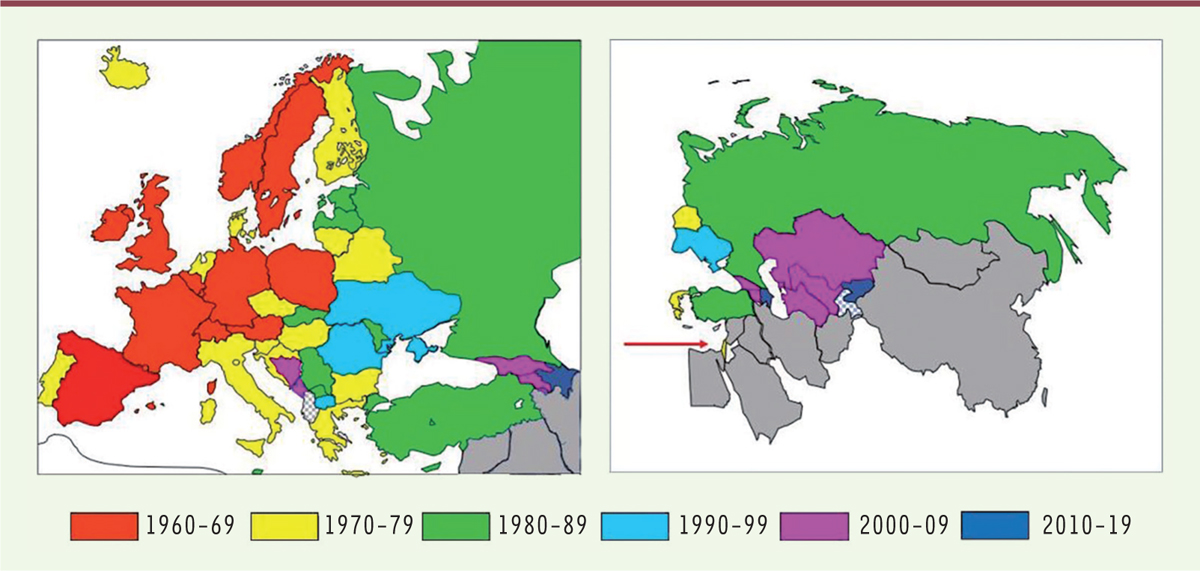
 | Figure 1.
L’Europe du DNN.
Cartes des pays de l’Europe géographique et de l’Europe étendue participant au DNN. La flèche rouge indique la position d’Israël. Les années d’entrée des différents pays dans le programme sont indiquées par les couleurs (adapté de la figure 1 de la publication originale
1
).
|
C’est dans les années 1960 que le DNN a commencé en Europe, d’abord à l’ouest du continent, s’étendant vers l’est durant les 40 années suivantes
(
Figure 1
)
. Dans presque tous ces pays, les programmes de dépistage ont été institutionnalisés, sous une forme ou une autre. Certains états, trop petits pour avoir leur propre programme, se sont appuyés sur des pays limitrophes plus grands (le Liechtenstein associé à la Suisse, Andorre et Monaco à la France, San Marin à l’Italie et le Kosovo en partie à la Serbie). En Albanie, dans la majeure partie du Kosovo, et au Tadjikistan, où il n’y a pas de programme officiel, le dépistage est néanmoins possible dans certains hôpitaux grâce à des initiatives locales.
Alors que l’importance du DNN a été largement reconnue, son implantation, son financement et son encadrement varient considérablement d’un pays à l’autre, dépendant de l’organisation des systèmes de santé, des ressources disponibles, des politiques nationales, et des contributions des acteurs de santé et du public. Afin de réunir plus d’informations sur ces différences entre pays, une enquête en ligne, diligentée par l’Union européenne, a été confiée à une équipe européenne en 2010 pour examiner les programmes de DNN sous tous leurs aspects [
11
]. Cette enquête a concerné les pays membres de l’Union européenne, les candidats potentiels à l’entrée dans l’Union et les pays membres de l’Association européenne de libre-échange (AELE), en tout 38 pays. Elle a révélé une grande hétérogénéité entre pays, dans le nombre des maladies dépistées (d’aucune à plus de 30), l’âge du nouveau-né au moment du prélèvement sanguin, les méthodes d’analyse des prélèvements, et la durée d’archivage des échantillons sanguins, allant de quelques mois à un stockage indéfini dans le temps. Des différences considérables sont également apparues dans les procédures de confirmation diagnostique, dans le traitement et dans le suivi des résultats du dépistage. En 2011, et sur la base de cet inventaire, le groupe de travail mandaté par l’Europe a produit une liste de 60 recommandations destinées à la Commission européenne [
12
], sans qu’aucune d’entre elles n’ait été jusqu’à présent endossée par cette commission. L’Union européenne a, par contre, encouragé la création de Réseaux européens de référence (ERN), particulièrement dans le domaine des maladies rares. Ces réseaux, qui reposent sur la collaboration d’institutions des divers états membres ayant des objectifs similaires en termes de recherche et de diagnostic, ont pour but d’offrir aux patients des chances égales d’accès aux centres d’excellence. Ils se sont particulièrement intéressés aux procédures de diagnostic et de traitement [
13
].
À la suite de l’initiative de 2010 visant à réaliser un inventaire de l’état du DNN en Europe, un réseau informel de collègues, presque tous membres de l’ISNS, s’est constitué. Une mise à jour des données a ainsi pu être réalisée tous les deux ans, la dernière datant de 2020.
Après avoir décrit le développement du dépistage entre 2010 et 2020 et les progrès accomplis pendant cette période, nous identifierons les zones géographiques où des progrès importants peuvent être accomplis, essentiellement en partageant les informations et en apprenant de l’expérience des pays limitrophes. Une partie de ces résultats a été publiée antérieurement [
14
-
17
].
|
Dans la majorité des pays, les données ont été recueillies auprès de membres de l’ISNS directement impliqués dans le programme national de dépistage. Lorsqu’aucun membre de la Société n’était présent dans l’un des pays couverts par l’enquête, des contacts personnels entre un membre de la Société et une personne d’un laboratoire de dépistage du pays ont été tentés. Ce fut notamment le cas pour les anciennes républiques de l’ex-URSS.
De 2012 à 2018, les données ont été recueillies grâce à des questionnaires standardisés. Des formulaires légèrement différents ont été utilisés pour les données additionnelles, colligées en 2020 en prévision du rapport annuel préparé par l’ISNS
2
. Bien que des programmes de dépistage des cardiopathies congénitales et des troubles de l’audition soient en place dans certains pays, nous avons limité l’analyse aux maladies dépistées sur taches de sang.
|
Les résultats de l’enquête
Les données recueillies ont concerné 51 pays. Le
Tableau I
fournit une vue d’ensemble des caractéristiques de la population participant au dépistage dans ces pays. Il inclut également des informations sur la logistique de ces programmes. Les maladies ciblées sont décrites dans les
Tableaux IIa
et
IIb
.
Tableau I.
| Pays |
Population en 2020 (en millions)
1
|
Nombre d’enfants approximatif |
Nombre de laboratoires |
Nombre moyen d’échantillons par laboratoire
2
|
Temps entre la naissance et le test (en h) |
Temps entre le test et son analyse (en jours) |
Enfants testés (en?%) |
Information aux parents |
Consentement pour le test |
Consentement pour la conservation de l’échantillon |
Temps de conservation (en années) |
Résultats négatifs rapportés aux parents |
| Albanie (pas de tests) |
3,0 |
36 000 |
n.a.
3
|
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
|
| Allemagne |
80 |
787 000 |
11 |
71 000 |
36-72 |
2-3 |
100 |
oui |
oui |
oui |
< 1 |
non |
|
| Autriche |
8,8 |
87 000 |
1 |
87 000 |
36-72 |
1-3 |
> 99,5 |
oui |
non |
non |
10 |
non |
|
| Arménie |
3,1 |
36 000 |
2
4
|
36 000 |
48-96 |
1-5 |
99,8 |
oui |
oui |
non |
indéfini |
non |
|
| Azerbaïdjan |
9,7 |
170 000 |
1 |
35 000 |
48-72 |
3-5 |
30 |
oui |
non |
non |
n.d. |
n.d. |
|
| Belgique |
10,5 |
117 000 |
4 |
30 000 |
48-120 |
2 |
99,8 |
oui |
non |
non |
5 |
non |
|
| Biélorussie |
9,8 |
108 000 |
1 |
108 000 |
72-120 |
1-5 |
n.d. |
oui |
non |
non |
5 |
n.d. |
|
| Bosnie-Herzégovine |
3,3 |
28 000 |
3
4
|
9 000 |
48-96 |
1-7 |
96 |
non |
non |
non |
10 |
non |
|
| Bulgarie |
7,4 |
61 000 |
2
4
|
61 000 |
72-120 |
5-10 |
n.d. |
non |
oui/non |
non |
20 |
n.d. |
|
| Chypre |
1,1 |
9 500 |
1 |
9 500 |
48-168 |
5-10 |
> 99, |
oui |
oui |
non |
2 |
non |
|
| Croatie |
4,2 |
36 200 |
1 |
36 200 |
48-72 |
3-5 |
100 |
oui |
non |
non |
5 |
non |
|
| Danemark |
5,6 |
63 000 |
1 |
63 000 |
48-72 |
1-2 |
99,1 |
oui |
oui |
oui |
indéfini |
en ligne |
|
| Espagne |
46,5 |
372 000 |
15 |
24 800 |
24-72 |
3-10 |
99,2 |
oui |
oui |
oui |
5, indéfini |
courriel |
|
| Estonie |
1,3 |
13 500 |
1 |
13 500 |
48-72 |
2-5 |
99,55 |
oui |
oui |
non |
> 25 |
non |
|
| Finlande |
5,5 |
45 000 |
1
4
|
45 000 |
48-120 |
1-5 |
99 |
oui |
oui |
non |
variable |
en ligne |
|
| France |
67 |
760 000 |
16 |
47 000 |
48-72 |
2-3 |
99,96 |
oui |
oui
5
|
non |
1 |
non |
|
| Georgie |
3,7 |
48 500 |
1 |
48 500 |
48-72 |
14-15 |
100 |
oui |
non |
non |
15 |
non |
|
| Grèce |
10,5 |
80 000 |
1 |
89 000 |
48-72 |
6-8 |
100 |
oui |
non |
non |
2 |
non |
|
| Hongrie |
10 |
90 000 |
2 |
50 000 |
48-72 |
3-4* |
99,99 |
oui |
non |
non |
indéfini |
non |
|
| Irlande |
4,9 |
59 700 |
1 |
59 700 |
72-120 |
1-2 |
> 99,5 |
oui |
oui |
oui |
10 |
non |
|
| Islande |
0,35 |
4 500 |
1 |
4 500 |
48-72 |
3-5 |
100 |
oui |
oui |
oui |
indéfini |
en ligne |
|
| Israël |
9,2 |
194 000 |
1 |
194 000 |
36-72 |
1-3 |
99,8 |
oui |
non |
non |
5 |
en ligne |
|
| Italie |
60,5 |
434 000 |
15 |
28 900 |
48-72 |
1-4 |
96,7 |
oui |
non |
non |
2-10 |
non |
|
| Kazakhstan |
18,7 |
402 000 |
21 |
20 000 |
24-72 |
1-2 |
96,5 |
oui |
oui |
non |
3 |
non |
|
| Kirghizistan |
7,0 |
160 000 |
1 |
32 000 |
48-72 |
3-5 |
30 |
oui |
non |
non |
n.d. |
n.d. |
|
| Kosovo |
1,8 |
25 000 |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
|
| Lettonie |
1,9 |
20 800 |
1 |
20 000 |
48-72 |
5-7 |
98,5 |
oui |
oui |
non |
7 |
en ligne |
|
| Lituanie |
2,8 |
24 600 |
1 |
24 600 |
48-96 |
2-9 |
99,6 |
oui |
oui |
non |
20 |
non |
|
| Luxembourg |
0,6 |
7 200 |
1 |
7 200 |
48-72 |
4 |
> 99 |
oui |
oui |
non |
indéfini |
non |
|
| Malte |
0,48 |
4 400 |
2
4
|
4 400 |
72-120 |
5 |
99,7 |
oui |
oui |
non |
indéfini |
non |
|
| Moldavie |
3,5 |
37 400 |
1 |
37 400 |
> 48 |
30 |
92,3 |
oui |
oui |
non |
0 |
n.d. |
|
| Monténégro |
0,62 |
7 200 |
1 |
7 200 |
24-72 |
1-3 |
100 |
non |
non |
non |
0,5 |
non |
|
| Macédoine du nord |
2,1 |
20 000 |
1 |
20 000 |
32-72 |
3 |
> 98 |
oui |
non |
oui |
3 |
non |
|
| Norvège |
5,3 |
55 500 |
1 |
55 500 |
48-72 |
1-3 |
> 99 |
oui |
oui |
oui |
indéfini |
non |
|
| Ouzbékistan |
31,3 |
760 600 |
14 |
54 000 |
72-96 |
10, |
95 |
oui |
oui |
n.d. |
1 |
n.d. |
|
| Pays-Bas |
17,8 |
168 500 |
5 |
34 000 |
72-96 |
1-3 |
99,3 |
oui |
oui |
oui |
5 |
courriel |
|
| Pologne |
38,4 |
373 000 |
6 |
62 000 |
48-96 |
3 |
99,8 |
oui |
oui |
oui |
5 |
en ligne |
|
| Portugal |
10,3 |
87 300 |
1 |
87 300 |
48-72 |
1-3 |
99,5 |
oui |
oui |
non |
5 |
en ligne |
|
| République Tchèque |
10,6 |
113 000 |
4
4
|
56 000 |
48-72 |
2,5 |
100 |
oui |
oui |
non |
5 |
non |
|
| Roumanie |
19,6 |
188 000 |
5 |
31 500 |
48-72 |
18 |
84 |
oui |
oui |
non |
5 |
non |
|
| Royaume-Uni |
66,6 |
760 000 |
16 |
47 500 |
120 |
3-4 |
96,5 |
oui |
oui |
non |
> 5 |
courriel |
|
| Russie |
142 |
1 670 000 |
78
4
|
20 000 |
48-72 |
3-5 |
90-92 |
oui |
oui |
non |
3 |
n.d. |
|
| Serbie |
7,0 |
65 000 |
2 |
32 500 |
48-72 |
3-5 |
99 |
oui |
non |
non |
5 |
non |
|
| Slovaquie |
5,4 |
57 000 |
1 |
57 000 |
72-96 |
2-3 |
100 |
oui |
oui |
non |
indéfini |
non |
|
| Slovénie |
2,07 |
20 000 |
1 |
20 000 |
48-72 |
1-2 |
> 99 |
oui |
non |
non |
indéfini |
non |
|
| Suède |
10 |
116 000 |
1 |
116 000 |
48-72 |
1-3 |
> 99,5 |
oui |
oui |
oui |
indéfini |
non |
|
| Suisse |
8,1 |
88 000 |
1 |
88 000 |
72-96 |
2 |
> 99,9 |
oui |
oui |
oui |
indéfini |
non |
|
| Tadjikistan (pas de tests) |
9,4 |
291 000 |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
n.a. |
|
| Turquie |
84,3 |
1 300 000 |
2 |
650 000 |
48-72 |
1-2 |
97 |
oui |
oui |
oui |
5 |
non |
|
| Turkménistan |
6,0 |
110 200 |
1 |
35 000 |
48-72 |
3-5 |
30 |
oui |
non |
non |
n.d. |
n.d. |
|
| Ukraine |
43,7 |
393 000 |
2 |
196 500 |
48-72 |
3 |
n.d. |
oui |
oui |
n.a. |
< 0,5 |
courriel |
Données générales des pays européens appliquant le DNN.
Membre de l’Union européenne (marron) ; candidats à l’entrée dans l’Europe (rouge) ; membres de l’EFTA (
European Free Trade Association
) (bleu) ; autres (violet). (1)
https://worldpopulationreview.com/
(2) Dans les pays plus grands, le nombre varie de façon importante. (3) n.d. : pas de données ; n.a. : pas applicable. (4) Tous les laboratoires ne réalisent pas la totalité des tests. (5) Uniquement la France, pour le consentement demandé pour l’analyse du gène
CFTR
.
|
Tableau IIA.
| |
CH (endo)
1
|
CAH (endo) |
CF (cys.f.) |
PKU (AAD) |
MSUD (AAD) |
HCY (AAD) |
Tyr-1 (AAD) |
Tyr-2 (AAD) |
ASA (AAD) |
Cit.1/2 (AAD) |
ARG (AAD) |
MAT I/III (AAD) |
GA1 (OA) |
IVA (OA) |
3MCC (OA) |
PA (OA) |
MMA
3
(OA)
|
BKT (OA) |
HCSD (OA) |
3HMG (OA) |
MCD (OA) |
| Albanie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Allemagne |
x |
x |
x |
x |
x |
|
x |
|
|
|
|
|
x |
x |
|
|
|
|
|
|
|
|
| Arménie |
x
1
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Autriche |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
x |
x |
|
x |
x |
|
|
|
|
|
| Azerbaïdjan |
x |
x |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Biélorussie |
x |
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Belgique |
x |
x |
x |
x |
x |
x |
x |
x |
|
|
|
|
x |
x |
|
x |
x |
|
|
|
|
|
| Bosnie-Herzégovine |
x |
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Bulgarie |
x |
x |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Chypre |
x |
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Croatie |
x |
|
|
x |
|
|
|
|
|
|
|
|
x |
x |
|
|
|
|
|
|
|
|
| Danemark |
x |
x |
x |
x |
x |
|
x |
|
x |
|
|
|
x |
x |
|
x |
x |
|
|
|
x |
|
| Espagne |
x |
p |
x |
x |
p |
p |
p |
p |
p |
p |
p |
|
x |
p |
p |
p |
p |
p |
p |
p |
p |
|
| Estonie |
x |
|
|
x |
x |
x |
x |
x |
|
x |
x |
|
x |
x |
|
x |
x |
|
|
|
|
|
| Finlande |
x |
x |
|
x |
x |
x |
x |
|
x |
x |
x |
|
x |
x |
|
x |
x |
|
|
|
|
|
| France |
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Georgie |
x |
|
x |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Grèce |
x |
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Hongrie |
x |
|
p
1
|
x |
x |
x |
x |
x |
x |
x |
|
|
x |
x |
x |
x |
x |
x |
|
x |
x |
|
| Islande |
x |
x |
|
x |
x |
x |
|
|
x |
x |
x |
|
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
| Irlande |
x |
|
x |
x |
x |
x |
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
| Israël |
x |
x |
|
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
x |
x |
x |
x |
x |
x |
|
| Italie |
x |
p |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
| Kazakhstan |
x |
|
p |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Kirghizistan |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Kosovo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Lettonie |
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Lituanie |
x |
x |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Luxembourg |
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Macédoine du nord |
x |
|
p |
x |
x |
x |
x |
|
x |
x |
x |
|
x |
x |
x |
x |
x |
x |
x |
|
x |
|
| Malte |
x |
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Moldavie |
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Monténégro |
x |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Norvège |
x |
x |
x |
x |
x |
x |
x |
|
|
|
|
|
x |
x |
|
x |
x |
x |
x |
x |
x |
|
| Ouzbekistan |
x |
|
p |
x |
p |
p |
p |
|
p |
p |
p |
|
p |
p |
p |
p |
p |
|
|
|
|
|
| Pays-Bas |
x |
x |
x |
x |
x |
|
x |
|
|
|
|
|
x |
x |
x |
x |
x |
|
|
x |
x |
|
| Pologne |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
x |
x |
x |
x |
x |
x |
|
x |
|
|
| Portugal |
x |
|
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
x |
x |
x |
x |
x |
|
|
x |
|
|
| Rép. Tchèque |
x |
x |
x |
x |
x |
x |
|
|
|
x |
x |
|
x |
x |
|
|
|
|
|
|
|
|
| Roumanie |
x |
|
|
x |
|
|
x |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Royaume-Uni |
x |
|
x |
x |
x |
x |
|
|
|
|
|
|
x |
x |
|
|
|
|
|
|
|
|
| Russie |
x |
x |
x |
x |
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
| Serbie |
x |
|
x |
x |
|
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
| Slovaquie |
x |
x |
x |
x |
x |
|
x |
x |
|
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
x |
|
|
| Slovénie |
x |
|
|
x |
x |
|
x |
|
|
|
|
|
x |
x |
x |
x |
x |
x |
x |
x |
|
|
| Suède |
x |
x |
|
x |
x |
x |
x |
|
x |
x |
x |
|
x |
x |
|
x |
x |
x |
|
|
|
|
| Suisse |
x |
x |
x |
x |
x |
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
| Tadjikistan |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Turquie |
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Turkménistan |
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Ukraine |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
x |
x |
x |
|
x |
x |
x |
|
|
|
|
Total
2
|
47 |
24+2 |
25+4 |
46 |
23+2 |
17+2 |
20+2 |
11+1 |
12+2 |
14+2 |
13+2 |
3 |
25+1 |
22+2 |
10+2 |
18+2 |
18+2 |
11+1 |
7+1 |
10+1 |
8+1 |
Les maladies dépistées selon les pays.
Membre de l’Union européenne (marron) ; candidats à l’entrée dans l’Europe (rouge) ; candidats potentiels à l’entrée dans l’Europe (vert) ; membres de l’EFTA (
European Free Trade Association
) (bleu) ; autres (violet). (1) x : inclus dans le panel de tests ; p : évaluation régionale ou pilote. (2) nombre total de conditions. (3) MMA (acidurie méthylmalonique) inclut les mutations MMA, les déficits en Cbl (cobalamine) et en vitamine B12. Spectre MS/MS complet à 30 % en Macédoine du nord et 20 % en Russie (les abréviation sont explicitées dans le glossaire).
|
Tableau IIB.
| |
GA2 (FAO) |
MCAD (FAO) |
LCHAD/TFP (FAO) |
VLCAD (FAO) |
SCAD (FAO) |
CPT1 (FAO) |
CPT2 (FAO) |
CACT (FAO |
CUD (FAO) |
RMD (M) |
GAL (M) |
BIOT (M) |
UDP (M) |
G6PD (M) |
X-ALD (M) |
SCID (M) |
SMA (M) |
SCD (hemo) |
Total
2
|
| Albanie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n.d.
3
|
|
| Allemagne |
|
x |
x |
x |
|
x |
x |
x |
|
|
x |
x |
|
|
|
x |
p |
p |
17+2 |
|
| Arménie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
| Autriche |
x |
x |
x |
x |
|
x |
x |
x |
x |
|
x |
x |
|
|
|
|
|
|
25 |
|
| Azerbaïdjan |
|
|
|
|
|
|
|
|
|
|
x |
|
|
x |
|
|
|
|
5 |
|
| Biélorussie |
x |
x |
|
x |
|
|
|
|
|
|
x |
x |
|
p |
|
|
p |
p |
17+3 |
|
| Belgique |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
| Bosnie-Herzégovine |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
| Bulgarie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
| Chypre |
|
x |
x |
x |
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
8 |
|
| Croatie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
| Danemark |
|
x |
x |
x |
|
|
|
|
x |
|
x |
x |
|
|
|
x |
p |
|
19+1 |
|
| Espagne |
p |
x |
x |
p |
p |
p |
p |
|
p |
p |
p |
p |
|
|
|
p |
|
x |
7+26 |
|
| Estonie |
|
x |
x |
x |
|
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
19 |
|
| Finlande |
|
x |
x |
x |
|
x |
x |
x |
x |
|
|
|
|
|
|
p |
|
|
20+1 |
|
| France |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
6 |
|
| Georgie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
| Grèce |
|
|
|
|
|
|
|
|
|
|
x |
|
|
x |
|
|
|
|
4 |
|
| Hongrie |
x |
x |
x |
x |
x |
x |
x |
x |
|
|
x |
x |
|
|
|
|
|
|
26+1 |
|
| Islande |
|
x |
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
8 |
|
| Irlande |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
|
|
|
|
p |
x |
|
|
27+1 |
|
| Israël |
x |
x |
x |
x |
|
x |
x |
|
x |
|
x |
|
x |
|
p |
x |
|
|
19+1 |
|
| Italie |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
p |
|
p |
p |
|
31+4 |
|
| Kazakhstan |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2+1 |
|
| Kirghizistan |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
| Kosovo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n.d. |
|
| Lettonie |
|
|
|
|
|
|
|
|
|
|
x |
x |
|
|
|
|
|
|
6 |
|
| Lituanie |
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
4 |
|
| Luxembourg |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
| Macédoine du nord |
x |
x |
x |
x |
x |
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
25+1 |
|
| Malte |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
3 |
|
| Moldavie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
| Monténégro |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
| Norvège |
|
x |
x |
|
|
x |
x |
x |
x |
|
|
x |
|
|
|
x |
|
|
23 |
|
| Ouzbekistan |
|
p |
p |
p |
|
p |
p |
|
p |
|
|
p |
|
|
|
|
|
|
2+19 |
|
| Pays-Bas |
|
x |
x |
x |
|
x |
|
|
|
|
x |
x |
|
|
x |
p |
|
p |
20+2 |
|
| Pologne |
x |
x |
x |
x |
|
x |
x |
x |
x |
|
p |
x |
|
|
|
p |
|
|
27+2 |
|
| Portugal |
x |
x |
x |
x |
|
x |
x |
x |
x |
|
|
|
|
|
|
|
|
|
24 |
|
| Rép. Tchèque |
|
x |
x |
x |
|
x |
x |
x |
|
x |
|
x |
|
|
|
|
|
|
18 |
|
| Roumanie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
| Royaume-Uni |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
9 |
|
| Russie |
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
6 |
|
| Serbie |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
| Slovaquie |
|
x |
x |
x |
|
x |
x |
x |
x |
|
|
|
|
|
|
p |
p |
|
24+2 |
|
| Slovénie |
|
x |
x |
x |
|
x |
x |
x |
x |
|
|
|
|
|
p |
|
|
|
19+1 |
|
| Suède |
x |
x |
x |
x |
|
x |
x |
x |
x |
|
x |
x |
|
|
|
x |
|
|
25-8 |
|
| Suisse |
|
x |
|
|
|
|
|
|
|
|
x |
x |
|
|
|
x |
|
|
10 |
|
| Tadjikistan |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n.d. |
|
| Turquie |
|
|
|
|
|
|
|
|
|
|
x |
|
|
x |
|
|
|
|
6 |
|
| Turkménistan |
|
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
5 |
|
| Ukraine |
x |
x |
x |
x |
|
x |
x |
x |
x |
|
x |
x |
|
|
|
|
|
|
28 |
|
|
Total
2
|
11+1 |
27+1 |
21+1 |
20+2 |
4+1 |
18+2 |
17+2 |
16 |
16+2 |
2+1 |
18+2 |
14+2 |
1 |
3+2 |
1+3 |
7+6 |
0+5 |
4+3 |
|
Les maladies dépistées selon les pays (suite).
Membre de l’Union européenne (marron) ; candidats à l’entrée dans l’Europe (rouge) ; candidats potentiels à l’entrée dans l’Europe (vert) ; membres de l’EFTA (bleu) ; autres (violet). (1) x : inclus dans le panel de tests ; p : évaluation régionale ou pilote. (2) nombre total de conditions. (3) MMA (acidurie méthylmalonique) inclut les mutations MMA, les déficits en Cbl (cobalamine) et en vitamine
B12. Nd : pas de donnée. Spectre MS/MS complet à 30 % en Macédoine du nord et 20 % en Russie (les abréviations sont explicitées dans le glossaire).
|
Infrastructure du DNN
Le premier élément de l’enquête était l’obtention des informations de base sur les infrastructures du système de dépistage. Elles incluaient l’âge des nouveau-nés au moment du prélèvement, les données pré-analytiques (méthodes de prélèvement, acheminement des échantillons, organisation du laboratoire, procédures d’analyse, compte-rendu des résultats et partenariats cliniques), ainsi que le diagnostic et le suivi des patients. Il est important de souligner que chaque pays a sa propre organisation du système de santé, et donc son propre système de DNN. Les résultats qui figurent dans le
Tableau I
sont présentés par pays, mais, dans certains États, le DNN est géré de manière autonome par les régions qui le constituent. C’est le cas en Belgique, en Bosnie-Herzégovine, en Allemagne et au Royaume-Uni. Pour certains États, les données n’étaient malheureusement pas disponibles ou étaient très insuffisantes pour en faire l’analyse.
Nombre de laboratoires de dépistage et charge annuelle de travail La plupart des pays disposent d’un ou deux laboratoires dédiés au dépistage. Les pays les plus peuplés en ont généralement davantage, ce nombre pouvant atteindre 78 unités, comme en Russie. Il n’y a pas de corrélation évidente entre le nombre de laboratoires et le nombre annuel de naissances. Il existe donc une grande variation dans la charge annuelle de travail par unité de dépistage. À la suite des modifications apportées à l’organisation du DNN en France et en Italie ces dernières années, le nombre de laboratoires dans ces pays a diminué de manière significative. La Finlande, qui pratiquait le dépistage sur le sang de cordon, a décidé depuis 2015 d’abandonner cette méthode au profit du prélèvement au talon du nouveau-né. La même stratégie a été menée à Malte.
Déterminer le nombre optimal d’examens par laboratoire n’est pas chose facile [
11
]. Il faut bien sûr utiliser de manière rationnelle les ressources humaines et l’équipement, ce qui milite en faveur d’une utilisation optimale de la charge de travail et d’un nombre limité de laboratoires. Ces conditions permettent de réaliser une estimation plus précise des valeurs moyennes ou médianes de chaque paramètre analysé, et leurs dérives éventuelles peuvent être connues plus rapidement. Finalement, cela permet une meilleure « assurance qualité » au quotidien. Cela rend aussi plus aisé le recueil des informations utiles sur les maladies rares dépistées par chaque laboratoire.
L’ensemble du processus de dépistage nécessite d’être réalisé de manière continue, avec un minimum d‘interruptions, uniquement pour les opérations de maintenance ou imposées par des pannes techniques. Ceci implique le doublement de tout l’équipement indispensable. Ces considérations plaident en faveur d’un nombre plus élevé de laboratoires par pays, chacun disposant de sa propre infrastructure mais étant capable de collaboration et, en cas d’urgence ou de sinistre, de prendre en charge le travail d’un laboratoire voisin. Néanmoins, la grande majorité des pays est autonome en ce qui concerne le DNN et ne souhaite pas dépendre des ressources des États limitrophes. Ainsi, il n’y a pas actuellement de collaborations transnationales permettant de remplacer un laboratoire qui serait défaillant par un autre dans un autre pays.
La plupart des pays ayant 100 000 à 120 000 nouveau-nés par an n’ont à leur disposition qu’un seul laboratoire
(
Tableau I
)
. Dans cette organisation qui apparaît efficace, il semble donc judicieux, tant sur le plan économique que scientifique, de disposer d’une seule unité fonctionnelle qui colligera et gèrera l’ensemble des données en utilisant un seul système de gestion. Les pays dans lesquels le nombre de naissances est supérieur, disposent souvent de plusieurs laboratoires de dépistage. Cela peut résulter de la charge de travail, mais aussi des structures géographiques ou politiques (par exemple en Italie, en Espagne, en France et en Allemagne) ou être dû au terrain et à la taille du pays (en Russie). Dans certains pays comme en Serbie ou en Bosnie-Herzégovine, les conditions politiques ou socio-économiques ont conduit à mettre en place un nombre plus élevé que nécessaire de laboratoires compte tenu du nombre de naissances.
L’organisation du réseau de DNN dépend d’une variété de facteurs, dont certains transcendent les considérations scientifiques ou d’efficacité et touchent à de nombreux autres aspects spécifiques à chaque pays. Couverture du DNN Dans la majorité des pays, la couverture du DNN (définie comme le pourcentage de nouveau-nés dépistés) est supérieure à 90 %, voire supérieure à 99 %, même si le dépistage n’est pas obligatoire, à l’exception de l’Italie. Des taux de couverture au-delà de 99 %, voire de 100 %, sont cependant à considérer avec précaution. En effet, même avec le meilleur registre de naissances, et avec un excellent registre de DNN, des nouveau-nés échapperont au dépistage. Rappelons que les enfants dont les parents ont refusé le dépistage, sont comptabilisés dans les cas « dépistés ». Les chiffres de 30 % que l’on observe au Kirghizistan et au Turkménistan doivent en revanche être regardés avec attention car le programme de dépistage n’a débuté que récemment ; ce chiffre devrait donc augmenter dans l’avenir. D’une façon générale, le pourcentage de nouveau-nés ayant participé au dépistage ne dépend pas du caractère obligatoire du test (favorisant la couverture) ou de la nécessité d’obtenir un consentement éclairé (qui pourrait la défavoriser). Information et consentement
La plupart des pays (94 %) informent les parents sur le dépistage en remettant des documents écrits ou
via
internet. Il s’agit d’une amélioration substantielle par rapport à 2010, cette proportion n’étant alors que de 66 %. Le consentement est demandé dans environ 64 % des pays, ce qui est identique à la situation de 2010. Un consentement spécifique pour la conservation à long terme des échantillons sanguins est demandé dans seulement 30 % des pays.
Logistique du prélèvement La technique de prélèvement de sang au talon du nouveau-né est utilisée par quasiment tous les pays. Le moment du prélèvement varie néanmoins d’un pays à l’autre : 13 % des pays recommandent un prélèvement 24 h après la naissance, 67 % 48 h après, 18 % après 72 h, et 2 % encore plus tardivement après la naissance. Ces variations proviennent à la fois des différences d’organisation du DNN, mais aussi des structures de soin en périnatalité. Dans certains pays, les prélèvements sont en effet effectués à la maternité alors qu’ailleurs, comme au Royaume-Uni, ils sont réalisés après le retour du nouveau-né à la maison, par la sage-femme ou les visiteurs de santé. La fenêtre de prélèvement médiane (de 48 à 72 h) est ainsi bien plus tardive qu’aux États-Unis.
Les différences que l’on observe doivent s’analyser également en fonction de la liste des maladies dépistées, la « fenêtre optimale » de prélèvement variant d’une maladie à l’autre. Ainsi, pour l’HC (hypothyroïdie congénitale), un prélèvement trop précoce peut générer des résultats faussement positifs à cause de l’augmentation physiologique de la TSH (
thyroid-stimulating hormone
) au cours des premières 24 heures de vie du nouveau-né. L’inverse est vrai pour le dépistage des déficits en MCAD (acyl-CoA déshydrogénase à chaîne moyenne), en VLCAD (acyl-CoA déshydrogénase à chaîne très longue) et pour la GA-I (acidurie glutarique de type I), si le sang est prélevé après 72 h. En effet, les concentrations en C8- et C14-acylcarnitine (pour les acyl-CoA déshydrogénases) et en glutarylcarnitine (pour la GA-I) diminuent après le stress de la naissance et la lipolyse qui l’accompagne [
18
,
19
] (Roscher A, données non publiées). À l’évidence, si le prélèvement est réalisé à 4 jours de vie, le dépistage devient problématique pour des maladies comme l’hyperplasie congénitale des surrénales, le déficit en galactose-1-phosphate uridyltransférase (GALT) et bien d’autres maladies héréditaires du métabolisme (MHM). Les nouveau-nés auront en effet souvent des symptômes cliniques bien avant que le résultat du test ne soit connu !
Le temps qui s’écoule entre le prélèvement et l’obtention du résultat est lié au temps d’acheminement du carton de prélèvements au laboratoire de dépistage (par la poste ou par courrier spécial). Dans la plupart des pays, cette transmission nécessite entre un et trois jours, mais dans certains, plus de dix jours sont requis, voire davantage ! Dans ces pays, peu d’améliorations ont été observées au cours des dix dernières années. Pourtant, un prélèvement précoce (avant 72 h de vie) et un résultat obtenu rapidement permettraient une confirmation rapide du diagnostic, et donc l’instauration d’un traitement en temps opportun. Techniques d’analyse
Bien que l’enquête n’ait pas été destinée à répertorier toutes les techniques d’analyse utilisées dans les laboratoires pour le dépistage, quelques remarques peuvent être faites quant à certaines de ces méthodes. La plupart des laboratoires utilisent des techniques de dosage de type ELISA (
enzyme-linked immunosorbent assay
) manuelles ou automatisées, mais, dans de nombreux pays, les techniques de dosage par spectrométrie de masse en tandem (MS/MS) sont devenues des méthodes de routine. Déjà, des techniques de séquençage de nouvelle génération (NGS) sont utilisées en Norvège comme tests de deuxième intention pour des maladies comme la mucoviscidose, ou pour déterminer quelles mutations sont présentes, une fois une maladie dépistée. La Croatie souhaite faire de même [
20
].
Stockage des cartons de prélèvement Lorsque les analyses ont été réalisées, les cartons sur lesquels les échantillons de sang avaient été déposés sont soit jetés, soit conservés. Les différents pays ont des politiques très variables pour la conservation de ces cartons. Celle-ci peut aller de quelques mois, comme en Allemagne, jusqu’à des périodes plus longues. La plupart des pays (43 %) conservent les taches de sang cinq ans au moins, et une minorité, entre un et deux ans.
L’utilité, le temps et les conditions de stockage de ces échantillons, font toujours l’objet de discussions [
21
]. La possibilité d’un diagnostic rétrospectif, chez un enfant qui développe une maladie qui n’avait pas été diagnostiquée au moment du dépistage (un faux négatif), mais aussi la possibilité d’étudier la prévalence et la faisabilité du dépistage pour de nouvelles maladies candidates à un DNN, plaident néanmoins en faveur de l’intérêt de ce stockage. Cependant, les enjeux liés à la confidentialité des données personnelles et les difficultés de stockage et de gestion militent plutôt contre la conservation des échantillons. En 2018, une loi protégeant les données personnelles (Règlement général sur la protection des données [RGPD]) est entrée en vigueur au sein de l’Union européenne. Cette loi stipule que les parents doivent donner leur consentement pour autoriser la conservation des prélèvements de leur enfant [
22
]. Néanmoins, seuls 8 des 27 pays membres de l’Union demandent un tel consentement.
Disponibilité des résultats
Dans plusieurs pays, les résultats des tests sont disponibles pour les parents, soit en ligne (
via
un portail dédié aux patients), soit par courriel. Dans d’autres pays, les parents ne sont informés que si une action médicale est requise, comme demander un second prélèvement, ou si l’enfant est orienté vers des services spécialisés.
|
La liste des maladies dépistées est présentée dans les
Tableaux IIa
et
IIb
. Historiquement, la PCU a été dépistée la première ; son dépistage a été suivi de celui de l’hyperplasie congénitale des surrénales (HCS). Dans les années 2005-2010, les dépistages de l’HCS (ou en anglais, CAH pour
congenital adrenal hyperplasia
) et de la mucoviscidose (en anglais, CF, pour
cystic fibrosis
) furent introduits dans plusieurs pays. C’est à la même époque que la spectrométrie de masse en tandem a été introduite et utilisée. Cette technique a permis le dépistage d’une dizaine de nouvelles maladies, essentiellement des maladies héréditaires du métabolisme. La description des maladies dépistées en Europe suivra à peu près la même cinétique.
Tous les pays européens (selon notre définition, voir plus haut), à l’exception du Monténégro, dépistent la PCU. En Finlande et à Malte, ce dépistage, d’abord réalisé sur sang du cordon, se fait désormais sur le sang prélevé au talon. Le sang du cordon continue néanmoins d’être utilisé pour dépister l’HC qui est dépistée dans tous les pays, sauf la Moldavie. Les Pays-Bas dépistent aussi l’hypothyroïdie d’origine centrale depuis 1990, grâce au dosage, en première intention, de la thyroxine totale (TT4), suivi du dosage de la TSH et de la
thyroxine-binding globulin
, chez les sujets qui se situent, respectivement, aux 20
e
et 5
e
percentiles des concentrations en TT4 [
23
]. À Malte, la TSH et la TT4 sont dosées simultanément sur tous les échantillons, ce qui permet le dépistage de l’hypothyroïdie d’origine centrale. La CF et l’HCS sont également dépistées dans environ 50 % des États (le double de ce qui était pratiqué en 2010).
L’introduction de la technique de MS/MS dans de nombreux laboratoires a permis une montée en puissance du dépistage des aminoacidopathies (leucinose, tyrosinémie de type 1, citrullinémie de type 1), ainsi que d’anomalies du métabolisme des acides organiques (GA-1, IVA [acidurie isovalérique], PA [acidurie propionique], MMA [acidurie méthylmalonique]) et de l’oxydation des acides gras (MCAD, LCHAD [L-3-hydroxyacyl-CoA déshydrogénase à chaîne longue], VLCAD). La situation est moins claire pour d’autres maladies pouvant être dépistées par MS/MS. Le choix est souvent orienté par l’état des connaissances médicales et techniques, par l’intérêt des médecins, des scientifiques ou des responsables de la santé publique qui sont impliqués dans les processus de décision, ainsi que par les possibilités de financement. La décision de DNN peut être aussi influencée par les parents. L’identification d’anomalies cliniques très modestes ou de phénotypes ambigus, et la valeur prédictive positive très basse de certains marqueurs, peuvent entraîner un stress pour les familles et ainsi constituer une contre-indication pour un dépistage dans certains pays. Le déficit en méthionine adénosyltransférase I/III (MATI/III) en Russie, ou le déficit en déshydrogénase des acyl-CoA à chaînes courtes (SCADD) en Hongrie, Islande, Italie et Macédoine du nord, offrent quelques exemples de ces conditions. Le dépistage du déficit en galactokinase (GALK) aux Pays-Bas a débuté en 2020. Ceux de la galactosémie classique (GAL) et du déficit en biotinidase commenceront en 2021, respectivement au Danemark et en Espagne. Au cours de ces dix dernières années, il a beaucoup été question du DNN des SCID (déficits immunitaires combinés sévères) et de l’X-ALD (adrénoleukodystrophie liée à l’X). Le dépistage en routine des SCID est pratiqué dans sept pays, et des programmes pilotes sont en cours dans sept autres. Ce dépistage sera effectif aux Pays-Bas en 2021. Un programme pilote pour l’X-ALD est en cours en Islande, aux Pays-Bas, et en Slovénie. Celui de la SMA (amyotrophie spinale) a été envisagé. Des programmes pilotes sont également en cours en Belgique et en Slovaquie. L’Allemagne et deux régions (ou communautés autonomes) de l’Espagne devraient commencer ce dépistage en 2021, les Pays-Bas en 2023.
En Europe, l’utilité de dépister les maladies lysosomiales reste controversée. Certaines régions, en Italie, ont cependant initié des programmes pilotes de dépistages de quatre maladies lysosomiales, et les Pays-Bas mettront en place le dépistage de la MPS-1 (mucopolysaccharidose de type 1) en 2021 [
24
]. Soulignons que la situation est très différente aux États-Unis, où le dépistage de différentes formes de maladies de surcharge lysosomale (
lysosomal storage disorders
, LSD) est réalisé en routine, dans de nombreux États.
|
Développements attendus à court terme
Dans l’enquête de 2020, il était demandé aux représentants des différents pays de décrire les modifications attendues dans leurs programmes de dépistage. En ce qui concerne les maladies qui pourraient être ajoutées au dépistage, mentionnons l’HCS en Hongrie et en Italie, la CF en Irlande et en Suède, la GAL en Estonie, les SCID en Italie et au Portugal. La Grèce et l’Italie espèrent introduire la technique de MS/MS et ainsi augmenter considérablement la liste des maladies qu’elles dépistent. Il faut noter que la Belgique utilise cette technique pour dépister les hémoglobinopathies, et que cette démarche est envisagée au Royaume-Uni. L’arrivée des techniques de NGS, la réduction des coûts, un accès plus large aux techniques de MS/MS, ainsi que l’analyse de données en masse (
Big Data
) (notamment, le recours au programme R4S/CLIR [
Region 4 stork
/
Collaborative laboratory integrated reports]
) pour évaluer les résultats du dépistage [
25
-
28
] devraient être porteurs de modifications importantes pour le DNN. La Finlande, l’Islande, la Norvège et la Suède utilisent déjà la base de données CLIR pour analyser les données individuelles du DNN [
20
,
29
], et la République Tchèque pour l’évaluation des seuils de dépistage. L’Estonie envisage des échanges automatisés de données en utilisant CLIR, et les Pays-Bas étudient la possibilité de l’utiliser pour améliorer la valeur prédictive positive de leur programme.
L’utilisation de la génétique moléculaire dans les laboratoires de DNN a commencé par l’identification des mutations du gène
CFTR
(
cystic fibrosis transmembrane conductance regulator
) pour la mucoviscidose. Les techniques utilisées en Europe pour dépister la SMA et les SCID ont été adaptées pour les rendre accessibles, moyennant la formation du personnel et de modestes ajustements dans les laboratoires de DNN. L’introduction des séquenceurs permettant le séquençage de nouvelle génération (NGS) est une étape supplémentaire dans l’évolution des laboratoires. Selon l’enquête, en 2020, très peu de laboratoires en étaient équipés. La Norvège est une exception, puisqu’elle a utilisé cette approche dès 2016 pour la mucoviscidose [
30
], et l’a adoptée plus récemment comme technique de deuxième intention pour dépister certaines erreurs innées du métabolisme ainsi que les SCID [
20
]. Au Royaume-Uni, l’analyse des résultats de l’étude pilote concernant l’utilisation des données de la NGS dans l’algorithme de dépistage de la mucoviscidose est en cours.
|
Au vu des résultats de l’étude, le DNN devrait évoluer selon quatre grandes directions. Évolutions techniques
On peut identifier trois domaines d’évolutions techniques. Le premier est l’utilisation de la spectrométrie de masse à haute résolution. Cette technique repose sur l’identification de profils de métabolites, ou d’autres composés, plutôt que sur l’analyse métabolite par métabolite réalisée avec les autres méthodes. Bien que des preuves de principe de cette technique aient été établies, aucun pays au sein de l’Europe n’utilise cette technique pour le dépistage. La seconde évolution repose sur la combinaison de données démographiques et de données analytiques afin d’estimer le risque de survenue d’une maladie, plutôt que d’apprécier ce risque en fonction du dosage d’un seul métabolite, ou d’un rapport de métabolites, et du seuil de détection correspondant [
28
]. Cela permettrait, en théorie, une meilleure performance du dépistage. Mais l’utilisation de la base de données CLIR n’est pas largement développée en Europe. Cette situation tient au fait que des éléments importants, comme le poids de naissance, l’âge gestationnel, le sexe et l’âge en heures au moment du prélèvement, ne sont pas toujours consignés sur les cartes de prélèvement et référencés dans la base. Les limites des systèmes informatiques des laboratoires contribueraient également à cette sous-utilisation. Le troisième point concerne l’évolution technique du séquençage de nouvelle génération, une approche en théorie très adaptable, qui pourrait, par exemple, permettre le dépistage sur un seul échantillon, de la SMA, de la mucoviscidose, des SCID, de même que d’autres déficits monogéniques [
20
]. Comment cette technique va se développer en Europe reste cependant une question ouverte, mais il est certain que les techniques de génétique moléculaire prendront leur place dans les laboratoires de DNN. Des techniques simplifiées, adaptées à l’environnement haut débit des laboratoires de dépistage, sont déjà opérationnelles dans certains laboratoires européens pour dépister la mucoviscidose, les SCID et la SMA. Leur utilisation nécessitera néanmoins d’être examinée avec prudence, pour ne pas ajouter de la confusion dans l’évaluation du dépistage.
Évolutions logistiques
Bien que l’utilisation des cartes de prélèvement qui portent quelques données démographiques et sont mises sous enveloppe et envoyées par courrier au laboratoire, ait été la norme pendant des dizaines d’années, cette pratique est en cours de modification. Les informations inscrites sur ces cartes pourront en effet être jumelées à des codes-barres ou des codes QR (
quick response code
) qui renverront aux données démographiques, grâce à un portail dédié au dépistage. De cette façon, la taille de la carte ne sera plus un facteur limitant pour la quantité d’informations nécessaires au laboratoire ; de plus, les cartes envoyées ne renfermeront plus de données personnelles, garantissant ainsi leur confidentialité en cas de piratage. Un autre avantage évident sera d’éviter les risques d’erreur lors de la transcription et du transfert manuels des données depuis les cartes vers le système informatique du laboratoire. Un tel système devrait par ailleurs permettre d’ouvrir un portail dédié aux parents, afin de les informer des résultats. Cela sera très utile dans les pays où toutes les informations sont transmises aux parents, y compris lorsque les résultats du dépistage sont négatifs.
Évaluations de la procédure et de son efficacité
La manière dont les laboratoires mesurent les indicateurs de performance de dépistage, comme la sensibilité, la spécificité et les valeurs prédictives des tests, n’a pas fait l’objet d’une enquête approfondie. Notons cependant que certains pays dépistent un large éventail de maladies mais, en revanche, ne réalisent qu’un nombre relativement faible de dosages. Dans ces conditions, de nombreuses années seront nécessaires pour réunir suffisamment de données afin d’estimer la performance de leurs laboratoires pour chaque maladie. C’est dans cette optique que l’utilisation d’une base de données d’envergure, comme le CLIR et son infrastructure, est recommandée [
25
].
Savoir si les programmes de DNN se sont donnés des objectifs de performance, comme l’augmentation du taux de couverture, l’amélioration de la valeur prédictive positive d’un marqueur, la diminution du temps de réponse du laboratoire, la diminution des erreurs administratives et l’amélioration de la qualité du suivi des patients dépistés, est également une question à laquelle il faudra répondre. En Europe, l’amélioration des programmes de dépistage reposera sur un travail collaboratif autour de bases de données internationales et d’outils d’analyse. De nombreuses données doivent être examinées et de nombreux tests sont réalisés différemment. Par exemple, selon les pays, le dépistage de la mucoviscidose peut être réalisé en une à quatre étapes. Pour l’hyperplasie surrénale congénitale, différents algorithmes ont été élaborés. En cas de résultats douteux, un second prélèvement est demandé dans certains pays ; dans d’autres, un test de seconde intention est effectué. Ce niveau d’analyse ne faisait pas l’objet de l’enquête actuelle. Un niveau plus détaillé devra donc faire partie des objectifs d’un prochain examen. En particulier, les indicateurs de performances des programmes devront être analysés afin d’identifier les pratiques qui se révèlent être les meilleures. Un repérage rigoureux des résultats faussement positifs fournirait déjà un indicateur-clé de qualité. À noter cependant que les maladies détectées sont des maladies rares. Sur une période de dix ans, la plupart des pays dépisteront, pour une maladie donnée, aucun ou quelques patients, rendant très importante la collaboration européenne fondée sur l’utilisation de bases de données communes. Une meilleure collaboration en Europe dans l’administration du DNN Il existe en Europe une disparité dans l’organisation du DNN et le traitement des enfants dépistés. En effet, étant indépendant pour la gestion de ses politiques de santé, chaque pays prend ses propres décisions pour effectuer le dépistage. De plus, contrairement à ce qui se passe aux États-Unis, où l’opinion publique dans chaque État influence de manière importante les politiques générales de dépistage, en Europe, la population d’un pays a peu d’informations sur l’organisation des services de santé d’un pays voisin. L’influence des groupes de pression sur des enjeux transnationaux en santé est par conséquent limitée. Les systèmes de santé des pays européens sont généralement financés par des organismes nationaux (comme l’Assurance maladie en France) ou des assurances reconnues par les États. Dans pratiquement tous les pays, des mécanismes ont donc été mis en place pour le financement du DNN et l’aide à son développement, après évaluation de divers critères (intérêt de nouvelles techniques, considérations économiques, sévérité des maladies, disponibilité du traitement). Cela conduit souvent à des décisions qui s’avèrent complexes lorsque de nouvelles applications sont envisagées.
Les
Tableaux IIA
et
IIB
montrent les importantes variations d’évolution du DNN en Europe. Si l’on compare à la situation qui prévalait en 2010, on constate que les modifications les plus importantes ont concerné le nombre de maladies dépistées, en raison surtout de l’introduction des techniques de MS/MS [
15
], qui rendent possible le dépistage de dix à quinze maladies sur une seule goutte de sang. En l’absence d’une véritable évaluation de ce que ces dépistages apportent en termes de santé publique, l’introduction de ces maladies dans les tests paraît dépendre, en grande partie, de l’état des connaissances scientifiques et de l’implication des décideurs.
Le suivi à long terme des patients repérés par le dépistage est indispensable. Lorsque les maladies dépistées sont rares, le nombre de patients reste faible dans chacun des pays. Les collaborations internationales apparaissent donc comme la meilleure approche pour optimiser le suivi de ces patients dans le temps. Ainsi, établir des registres internationaux, après qu’une définition commune des maladies a été déterminée, demeure une nécessité, même s’il est encourageant de constater les progrès accomplis grâce à des réseaux comme l’E-IMD (
european registry and network for intoxication type metabolic diseases
) et l’E-HOD (
european network and registry for homocystinurias and methylation defects)
.
Contrairement à la mise en œuvre des tests génétiques, pour lesquels des critères de priorisation ont été proposés en fonction des avantages et des besoins en termes de santé et des coûts [
31
], le DNN ne fait pas l’objet de recommandations ni de mécanismes d’encadrement à l’échelle européenne, que ce soit au niveau de l’Europe géographique ou de l’Union européenne [
13
]. Cette dernière a établi des traités entre les pays participants, mais ils concernent des sujets qui sont administrés ou surveillés par la Commission européenne (son organe exécutif), et les politiques de santé en sont exclues, les États membres estimant qu’il s’agissait de leur propre responsabilité (principe de subsidiarité). Le fait que dans certains pays (Belgique, Allemagne, Italie, Espagne et Royaume-Uni), les décisions politiques sont décentralisées au niveau de Régions ou de Provinces plus ou moins autonomes, ajoute encore à la complexité. La création par l’Union d’un réseau de référence pour le diagnostic et le traitement des maladies rares, dont les erreurs innées du métabolisme, les déficits immunitaires et les maladies endocriniennes rares, suscite ainsi de l’espoir. Les patients sont en effet en grande partie identifiés grâce au DNN. Les programmes de dépistage doivent donc être la cible de ces réseaux de référence, lorsqu’ils seront mis en place [
13
].
|
Nous rapportons les résultats d’une étude transversale des programmes européens de DNN. Ce travail a été réalisé afin que les équipes de chaque pays soient encouragées à fournir, pour chaque maladie, les résultats de leurs analyses globales des performance techniques du dépistage, des méthodes de confirmation du diagnostic, ainsi que les informations sur le suivi clinique des patients. Entre 2010 et 2020, les programmes de DNN se sont considérablement développés en Europe. Les techniques utilisées se sont modernisées et le nombre des maladies dépistées a augmenté. Notons que ces résultats sont susceptibles de modifications en fonction des nouvelles évolutions : l’ISNS construit une base de données qui sera mise à jour périodiquement et sera accessible au public [
32
].
C’est à l’occasion de congrès ou d’ateliers que l’ISNS a favorisé les contacts entre responsables des programmes de dépistage en Europe. La Société a également noué des liens étroits avec d’autres sociétés savantes : l’
International Patient Organization for Primary Immunodeficiencies
(IPOPI), l’
European Reference Network for Hereditary Metabolic Diseases and Rare Endocrine disorders
(metabERN/EndoERN), et l’
European Organization for Rare Disease
(EURORDIS). Dans le cadre des plateformes de la Communauté européenne (
Health Policy Platform
), l’ISNS, l’IPOPI et l’ESID (
European Society for Immunodeficiencies
) construisent une base de données commune de participation au DNN, appelée
Screen4Rare
. Ces différents développements révèlent l’amplification actuelle des collaborations entre les diverses organisations européennes. Reste à savoir si cette coopération conduira à l’établissement d’une liste de maladies qu’il est nécessaire de dépister [
15
], ce qui devrait aider les décideurs à déterminer les priorités en s’appuyant sur les recommandations internationales, comme celles établies par l’ISNS à partir des pratiques déployées, ou si l’Europe préfèrera choisir parmi d’autres collaborations afin de conclure quant aux recommandations qu’elle émettra.
Ce n’est qu’en établissant ce maillage collaboratif qu’il sera possible à la fois de dépister en temps opportun et de prendre en charge les nouveau-nés atteints de ces nombreuses maladies rares, mais aussi de mettre en place de nouvelles actions au profit des citoyens de l’Europe. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
3hmg
|
Acidurie 3-hydroxy-3-méthylglutarique |
|
3mcc
|
Acidurie 3-méthylcrotonique/acidurie 3-méthylglutaconique/acidurie 2-méthyl-3-OH-butyrique |
|
AAD
|
Anomalies du métabolisme des acides aminés |
|
X-ALD
|
Adrénoleucodystrophie liée à l’X |
|
arg
|
Hyperargininémie |
|
asa
|
Acidurie argininosuccinique |
|
bio
|
Déficit en biotinidase |
|
bkt
|
Déficit en bêta-cétothiolase |
|
CACT
|
Déficit en carnitine acylcarnitine translocase |
|
cah
|
Hyperplasie congénitale des surrénales |
|
cf
|
Mucoviscidose |
|
ch
|
Hypothyroïdie congénitale (primitive) |
|
cit1
|
Citrullinémie de type I |
|
cit2
|
Citrullinémie de type II |
|
cpt1
|
Déficit en carnitine palmitoyltransférase de type I |
|
cpt2
|
Déficit en carnitine palmitoyltransférase de type II |
|
cud
|
Déficit du transporteur de la carnitine |
|
FAOD
|
Déficits de l’oxydation des acides gras |
|
G6PD
|
Déficit en glucose-6-phophate déshydrogénase |
|
ga1
|
Acidurie glutarique de type I |
|
ga2
|
Acidurie glutarique de type II ou déficit multiple en acyl-coA déshydrogénase |
|
gal
|
Galactosémie congénitale |
|
GALK
|
Déficit en galactokinase |
|
hcY
|
Homocystinurie classique (déficit en cysthathionine bêta-synthase) |
|
hcsd
|
Déficit en holocarboxylase synthétase |
|
Hemo
|
Hémoglobinopathies |
|
iva
|
Acidurie isovalérique |
|
lchad
|
Déficit en L-3-hydroxyacyl-CoA déshydrogénase à chaîne longue |
|
M
|
Maladies diverses |
|
MAT I/III
|
Déficits en méthionine adénosyl transférase I/III |
|
mcad
|
Déficit en acyl-CoA déshydrogénase à chaîne moyenne |
|
MCD
|
Déficit en carboxylases multiples |
|
mma
|
Acidurie méthylmalonique |
|
MSUD
|
Leucinose |
|
OA
|
Aciduries organiques |
|
pa
|
Acidurie propionique |
|
PKU/hpa
|
Phénylcétonurie / Hyperphénylalaninémies |
|
RMD
|
Déficits de reméthylation de l’homosyctéine (méthylène tétrahydrofolate réductase, méthylcobalamines) |
|
scD
|
Dréanocytose / thalassémies |
|
SCID
|
Déficits immunitaires combinés sévères |
|
scad
|
Déficit en acyl-CoA déshydrogénase à chaîne courte |
|
SMA
|
Amyotrophie spinale |
|
TFP
|
Déficit en protéine trifonctionnelle |
|
tyr1
|
Tyrosinémie de type 1 |
|
tyr2
|
Tyrosinémie de type 2 |
|
udp
|
Déficit en UDP-galactose-4-épimérase |
|
vlcad
|
Déficit en acyl-CoA déshydrogénase des acides gras à chaîne très longue |
|
Ce travail est le fruit d’une très importante collaboration entre de nombreux acteurs du DNN. Les auteurs remercient les co-auteurs de la revue originale parue dans Int J Neonatal Screen [
1
] qui n’ont pu être cités ici. Nous remercions le Dr Ingeborg Blancquaert dans l’aide précieuse qu’elle a apporté à la traduction de ce manuscrit écrit initialement en langue anglaise.
|
Footnotes |
1.
Woolf
LI
,
Adams
J
.
The early history of PKU.
.
Int J Neonatal Screen.
2020;
;
6
:
:59.
–
62
.
2.
Guthrie
R
,
Susi
A
A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants.
.
Pediatrics.
1963;
;
32
:
:338.
–
343
.
3.
Dussault
JH
,
Laberge
C
Thyroxine (T4) determination by radioimmunological method in dried blood eluate: new diagnostic method of neonatal hypothyroidism?
.
Union Med Can.
1973;
;
102
:
:2062.
–
2064
.
4.
Millington
DS
,
Kodo
N
,
Norwood
DL
,
Roe
CR
Tandem mass spectrometry: a new method for acylcarnitine profiling with potential for neonatal screening for inborn errors of metabolism.
.
J Inherit Metab Dis.
1990;
;
13
:
:321.
–
324
.
5.
Rashed
MS
,
Ozand
PT
,
Harrison
ME
et al.
Electrospray tandem mass spectrometry in the diagnosis of organic acidemias.
.
Rapid Comm Mass Spectrometry.
1994;
;
8
:
:129.
–
133
.
6.
Schulze
A
,
Lindner
M
,
Kohlmuller
D
.
et al.
Expanded newborn screening for inborn errors of metabolism by electrospray ionization-tandem mass spectrometry: results, outcome, and implications.
.
Pediatrics.
2003;
;
111
:
:1399.
–
406
.
7.
Wilson
JM
,
Jungner
YG
Principles and practice of mass screening for disease.
.
Bull WHO.
1968;
;
65
:
:281.
–
393
.
13.
Loeber
JG
European Union should actively stimulate and harmonise neonatal screening initiatives.
.
Int J Neonatal Screen.
2018;
;
4
:
:32.
.
14.
Loeber
JG
Neonatal screening in Europe: situation in 2004.
.
Int J Neonatal Screen.
2007;
;
30
:
:430.
–
438
.
15.
Loeber
JG
,
Burgard
P
,
Cornel
MC
,
et al.
Newborn screening programmes in Europe; arguments and efforts regarding harmonization. Part 1. From blood spot to screening result.
.
J Inher Metab Dis.
2012;
;
35
:
:603.
–
11
.
16.
Burgard
P
,
Rupp
K
,
Lindner
M
,
et al.
Newborn screening programmes in Europe; arguments and efforts regarding harmonization. Part 2. From screening laboratory results to treatment, follow-up and quality assurance.
.
J Inher Metab Dis.
2012;
;
35
:
:613.
–
25
.
17.
Therrell
BL
,
Padilla
CD
,
Loeber
JG
et al.
Current status of newborn screening worldwide 2015.
.
Semin Perinatol.
2015;
;
39
:
:171.
–
187
.
18.
Groselj
U
,
Tansek
MZ
,
Smon
A
et al.
Newborn screening in southeastern Europe.
.
Mol Genet Metab.
2014;
;
113
:
:42.
–
45
.
19.
Estrella
J
,
Wilcken
B
,
Carpenter
K
et al.
Expanded newborn screening in New South Wales: missed cases.
.
J Inher Metab Dis.
2014;
;
37
:
:881.
–
887
.
20.
Boneh
A
,
Andresen
BS
,
Gregersen
N
et al.
VLCAD deficiency: pitfalls in newborn screening and confirmation of diagnosis by mutation analysis.
.
Mol Genet Metab.
2006;
;
88
:
:166.
–
170
.
21.
Schymik
I
,
Liebig
M
,
Mueller
M
et al.
Pitfalls of neonatal screening for very-long-chain acyl-CoA dehydrogenase deficiency using tandem mass spectrometry.
.
J Pediatr.
2006;
;
149
:
:128.
–
130
.
22.
Tangeraas
T
,
Sæves
I
,
Klingenberg
C
,
et al.
Performance of expanded newborn screening in norway supported by post-analytical bioinformatics tools and rapid second-tier DNA analyses.
.
Int J Neonatal Screen.
2020;
;
6
:
:51.
.
23.
Van Rijt
WJ
,
Schielen
PCJI
,
Özer
Y
,
et al.
Instability of acylcarnitines in stored dried blood spots: the impact on retrospective analysis of biomarkers for inborn errors of metabolism.
.
Int J Neonatal Screen.
2020;
;
6
:
:83.
–
95
.
26.
McHugh
D
,
Cameron
CA
,
Abdenur
JE
et al.
Clinical validation of cutoff target ranges in newborn screening of metabolic disorders by tandem mass spectrometry: a worldwide collaborative project.
.
Genet Med.
2011;
;
13
:
:230.
–
254
.
27.
Marquardt
G
,
Currier
R
,
McHugh
DM
et al.
Enhanced interpretation of newborn screening results without analyte cutoff values.
.
Genet Med.
2012;
;
14
:
:648.
–
655
.
28.
Minter Baerg
MM
,
Stoway
SD
,
Hart
J
et al.
Precision newborn screening for lysosomal disorders.
.
Genet Med.
2018;
;
20
:
:847.
–
854
.
29.
Lanting
CI
,
van Tijn
DA
,
Loeber
JG
et al.
Clinical effectiveness and cost-effectiveness of the use of the thyroxine/thyroxine-binding globulin ratio to detect congenital hypothyroidism of thyroidal and central origin in a neonatal screening program.
.
Pediatrics.
2005;
;
116
:
:168.
–
173
.
30.
Stroek
K
,
Heijboer
AC
,
Bouva
MJ
,
et al.
Critical evaluation of the newborn screening for congenital hypothyroidism in the Netherlands.
.
Eur J Endocrinol.
2020;
;
183
:
:265.
–
73
.
31.
Severin
F
,
Borry
P
,
Cornel
MC
et al.
Points to consider for prioritizing clinical genetic testing services: a European consensus process oriented at accountability for reasonableness.
.
Eur J Hum Genet.
2015;
;
23
:
:729.
–
735
.
|