| |
| Med Sci (Paris). 37(4): 400–402. doi: 10.1051/medsci/2021041.
Promotion des métastases d’adénocarcinomes pulmonaires
via
la stabilisation du facteur de transcription BACH1
Amel Ait Ali Said,1a Anthime Perrot²,2b and Corinne Dupuy3c 1M1 Biologie Santé, Université Paris-Saclay, Université de Versailles Saint-Quentin-en-Yvelines
,
78035Versailles
,
France
.
2M1 Biologie Santé, Université Paris-Saclay, École normale supérieure Paris-Saclay
,
91190Gif-sur-Yvette
,
France
.
3UMR 9019 CNRS - Université Paris-Saclay-Gustave Roussy
,
94800Villejuif
,
France
.
MeSH keywords: Adénocarcinome, Animaux, Facteurs de transcription à motif basique et à glissière à leucines, Protéines F-box, Heme oxygenase-1, Humains, Protéine-1 de type kelch associée à ECH, Tumeurs du poumon, Souris, Souris nude, Facteur-2 apparenté à NF-E2, Protéines tumorales, Récepteurs cytoplasmiques et nucléaires, métabolisme, secondaire, antagonistes et inhibiteurs, génétique, anatomopathologie |
Le cancer du poumon est l’un des cancers les plus fréquents : l’Institut national du cancer recensait, en France, 46 363 nouveaux cas diagnostiqués en 2018. Il est la première cause de mortalité par cancer chez l’homme, et la seconde chez la femme. Il existe deux types principaux de cancer du poumon, qui diffèrent par leur évolution, leur pronostic et leur traitement. Les cancers bronchiques à petites cellules, qui représentent environ 15 % des cas [
1
], et les cancers bronchiques non à petite cellules, qui représentent plus de 80 % des cas, et dont 60 % sont des adénocarcinomes avec un fort potentiel métastatique. Récemment, l’équipe de Michele Pagano a décrypté certains mécanismes conduisant à la formation des métastases pour ces adénocarcinomes [
2
].
Durant la tumorigenèse pulmonaire, les cellules cancéreuses tendent à augmenter leur production de formes réactives de l’oxygène, ce qui compromet leur homéostasie redox. Pour maintenir cette homéostasie, 30 % de ces cellules vont acquérir, par mutation, soit une stabilisation du facteur de transcription NRF2 (
nuclear factor erythroid-2-related factor 2)
, soit une inactivation de son régulateur négatif KEAP1 (
Kelch-like ECH-associated protein 1)
[
3
], avec, pour conséquence, une augmentation de la transcription de gènes codant des protéines anti-oxydantes. En condition normale, KEAP1 s’associe à NRF2, un régulateur important de la réponse anti-oxydante, pour induire sa dégradation
via
le complexe ubiquitine ligase CRL3 [
4
]. KEAP1 est un senseur intracellulaire du stress oxydant, et ne s’associe plus à NRF2 lorsque des formes réactives de l’oxygène sont présentes en grande quantité [
5
]. NRF2, alors stabilisé, peut être transloqué dans le noyau, où il active l’expression de gènes anti-oxydants, dont celui codant l’hème oxygénase-1 (HO-1), qui catabolise l’hème libre. Ce cofacteur s’associe avec des apoprotéines pour former des hémoprotéines fonctionnelles. En situation de stress oxydant, l’hème se dissocie des hémoprotéines, et l’hème libre va alors catalyser une production massive de radicaux libres. Pour éviter cette auto-amplification du stress oxydant [
6
], les cellules répondent par une induction rapide de HO-1.
Le régulateur transcriptionnel BACH1 (
BTB domain and CNC homolog 1)
est sensible aux fluctuations de la concentration d’hème libre [
7
]. De plus, BACH1, associé aux facteurs de transcription de la famille MAF, réprime l’expression de HO-1 [
8
]. En réponse à un stress oxydant, NRF2 s’accumule, et l’augmentation de l’hème libre conduit à une dégradation du répresseur BACH1 dépendante du protéasome. Par ailleurs, il a été montré que BACH1 promeut les métastases par l’activation de gènes pro-métastatiques [
9
]. Dans l’article issu des travaux de l’équipe de Michele Pagano [
2
], les chercheurs ont cherché à identifier les mécanismes moléculaires qui conduisent la protéine NRF2 à promouvoir la dissémination métastatique des adénocarcinomes pulmonaires. En particulier, ils ont cherché à établir les relations entre NRF2, KEAP1, BACH1 et le potentiel métastatique de cellules tumorales pulmonaires.
|
Le développement des métastases résulte de la perte de KEAP1 et de l’activation du programme transcriptionnel de BACH1
Afin d’étudier l’effet de la perte de KEAP1 sur l’incidence des métastases, les chercheurs ont utilisé des modèles de souris génétiquement modifiées, invalidées pour le gène suppresseur de tumeur
p53
et exprimant dans le poumon l’oncogène KRAS (souris KP), ce qui favorise le développement de tumeurs [
10
]. L’inactivation du gène codant KEAP1 dans le poumon de ces souris est réalisée à l’aide du système CRISPR/Cas9 [
11
], après infection intratrachéale par un lentivirus exprimant un ARN guide ciblant ce gène (souris KPK). Cette inactivation entraîne une incidence des métastases plus élevée que chez les souris KP. Afin d’identifier les voies de signalisation favorisant les métastases, une analyse comparative du transcriptome des cellules tumorales exprimant ou non KEAP1 (cellules de souris KP
versus
cellules de souris KPK) a été réalisée. Un enrichissement en transcrits liés aux processus de métastases a été observé dans les cellules issues des souris KPK. Les cellules KPK présentent une forte signature NRF2 ainsi qu’un score d’enrichissement de BACH1 plus élevé que dans les cellules KP, suggérant que BACH1 pourrait être responsable du phénotype métastatique de ces cellules. L’étude du transcriptome et du protéome de métastases issues des deux fonds génétiques (KPK
versus
KP) a confirmé un enrichissement en transcrits et protéines pro-métastatiques sous contrôle de BACH1. Afin de confirmer ces résultats, les chercheurs ont analysé différents échantillons dérivés d’adénocarcinomes de poumon humain, et ont constaté que les tumeurs humaines mutées pour
KEAP1
avaient également un taux élevé de BACH1.
|
L’accumulation de BACH1 à la suite de la perte de KEAP1 est consécutive à l’induction du gène HO-1 par NRF2
Le taux de BACH1 est plus élevé et sa demi-vie est allongée dans les cellules n’exprimant plus KEAP1 (souris KPK), indiquant que la perte de KEAP1 résulte en une stabilisation de BACH1. Dans les cellules compétentes pour KEAP1 (souris KP), le taux de BACH1 diminue en raison de sa dégradation par le protéasome
via
une ubiquitine E3 ligase. Puisque KEAP1 inhibe la capacité de NRF2 à être transloqué dans le noyau, les auteurs ont émis l’hypothèse que l’accumulation de BACH1 dans les cellules déficientes pour KEAP1 résulterait de l’accumulation de NRF2. Après délétion du gène codant NRF2 à l’aide du système CRISPR/Cas9, BACH1 n’est en effet plus exprimé, ce qui montre que l’activation de NRF2 précède la stabilisation de BACH1. L’hème libre est un puissant agent oxydant, qui se lie directement à BACH1 et favorise sa dégradation par le protéasome. Les auteurs montrent qu’en absence de KEAP1, la stabilisation de NRF2 permet une augmentation de l’expression de HO-1. En dégradant l’hème, HO-1 favorise alors la stabilisation de BACH1. Les résultats obtenus dans les modèles murins sont corroborés par l’existence d’une corrélation entre les taux de HO-1 et de BACH1 dans les cancers du poumon chez les patients porteurs d’une mutation de
KEAP1
.
|
L’activité transcriptionnelle de BACH1 est contrôlée par FBXO22 et la concentration d’hème libre
Afin d’identifier l’ubiquitine E3 ligase impliquée dans la dégradation de BACH1 induite par l’hème, une immunoprécipitation de BACH1 a été réalisée en présence et en absence d’hèmine, un analogue de l’hème, suivie d’une analyse, par spectrométrie de masse, des protéines associées à BACH1. L’expérience a révélé que BACH1 interagit avec 9 récepteurs du complexe CRL (
culling RING ubiquitin ligase
), FBXO22 étant celui interagissant le plus fortement avec BACH1. Elle a par ailleurs montré que BACH1 interagit davantage avec FBXO22 en présence d’hémine et dans les cellules KP que dans les cellules KPK, ces dernières ayant une moindre concentration d’hème en raison d’un taux plus élevé de HO-1. Ces résultats suggèrent donc que l’hème favorise la dégradation de BACH1 en augmentant son interaction avec FBXO22.
Pour confirmer le rôle inhibiteur de FBXO22 sur l’activité transcriptionnelle de BACH1, les auteurs ont réalisé une analyse du transcriptome des cellules tumorales des souris KP et KPK, déplétées en FBXO22. Lorsque KEAP1 est présent (cellules KP) et FBXO22 absent, ils ont constaté une augmentation significative du nombre des transcrits de 29 gènes cibles de BACH1, dont 14 sont connus pour être associés aux métastases. En revanche, l’absence de FBXO22 dans les cellules KPK n’entraînait pas d’enrichissement de la signature BACH1, ce dernier étant déjà présent à un taux élevé dans ces cellules. Afin d’identifier l’impact de cette dérégulation, les auteurs ont étudié la migration des cellules KP et KPK, exprimant de manière stable et inductible des shARN
1
ciblant soit
BACH1
soit
FBXO22
afin d’inhiber l’expression de ces gènes, par des expériences
in vitro
en chambre de Boyden. Ils ont constaté que la migration des cellules diminuait quand
BACH1
est inhibé, tandis qu’elle augmentait quand
FBXO22
est inhibé, ce qui provoque une accumulation de BACH1.
L’activité transcriptionnelle de BACH1 dépend donc de la présence de FBXO22, leur interaction étant d’autant plus favorisée en présence d’hème libre, dont la concentration est régulée par HO-1
(
Figure 1
)
.
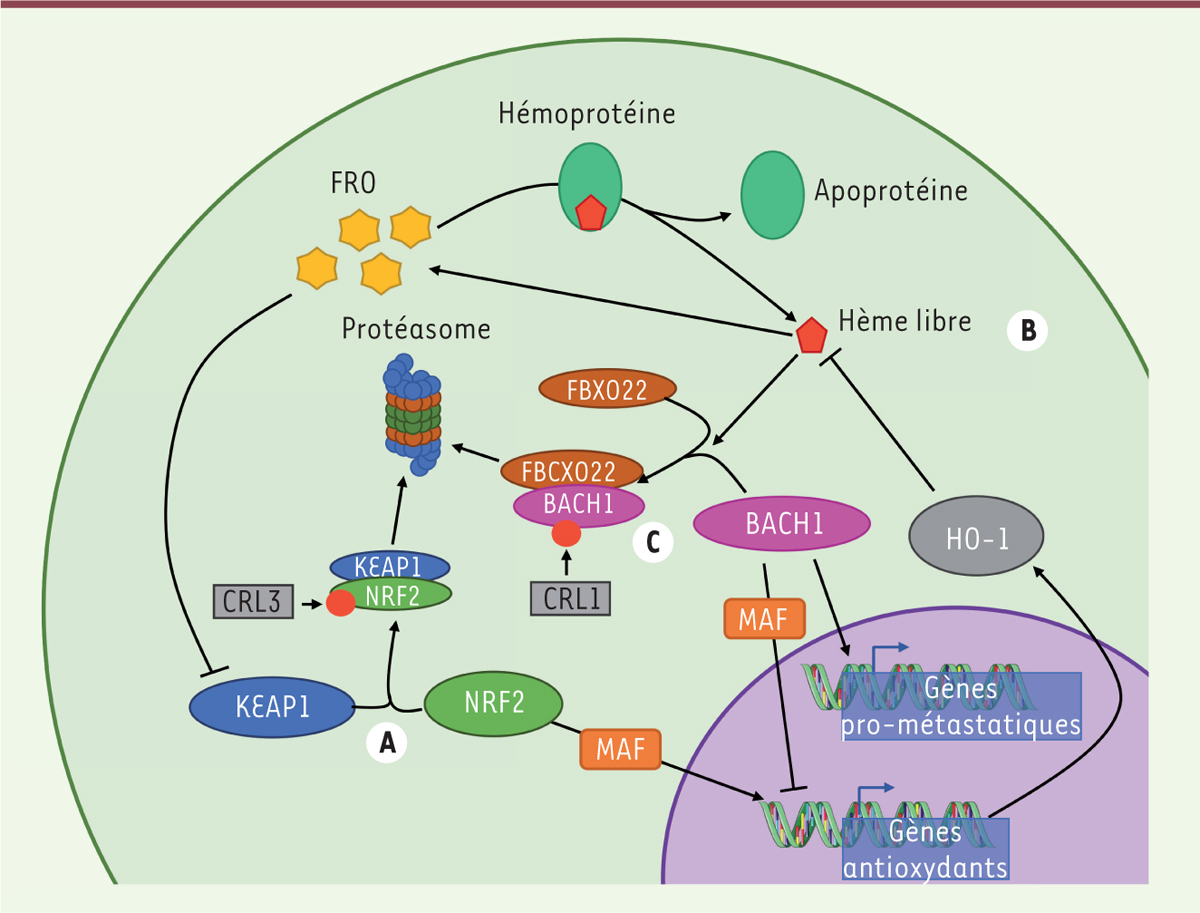
 | Figure 1.
Facteurs impliqués dans l’apparition des métastases d’adénocarcinomes bronchiques. A.
L’association de NRF2 avec KEAP1 permet son maintien à un niveau basal en conditions normales. L’ubiquitinylation de NRF2 par CRL3 entraîne sa dégradation par le protéasome. En condition de stress oxydant, KEAP1 est inhibé, NRF2 s’associe à MAF pour exprimer des protéines anti-oxydantes, dont l’enzyme HO-1, qui a la capacité de cataboliser l’hème libre.
B..
En condition normale, l’hème entre en interaction avec des apoprotéines pour former les hémoprotéines. Lors d’un stress oxydant, l’hémoprotéine se dissocie. L’hème libre catalyse alors une production massive de formes réactives de l’oxygène (FRO).
C.
Une fois libéré des apoprotéines, l’hème libre permet l’interaction entre FBXO22 et BACH1. BACH1 est par la suite ubiquitinylé par CRL1, puis dégradé par le protéasome. En conditions pathologiques, BACH1 entre en compétition avec NRF2 pour la liaison du facteur MAF, et joue un rôle inhibiteur de la transcription des gènes codant des protéines anti-oxydantes. BACH1 est également un facteur de transcription permettant la transcription de gènes pro-métastatiques. BACH1 :
BTB domain and CNC homolog 1
; CRL :
cullin-RING ubiquitin ligase
; FBXO22 :
F-box protein 22
; HO1 :
heme oxygenase-1
; KEAP1 :
Kelch-like ECH-associated protein 1
; MAF : facteur de transcription MAF ; NRF2 :
nuclear factor erythroid-2-related factor 2
.
|
|
La surexpression de FBXO22 ou l’inhibition de BACH1 altère la formation des métastases
Pour étudier
in vivo
l’impact de la dérégulation de l’interaction entre FBXO22 et BACH1 sur la formation des métastases, les auteurs ont utilisé des souris immunodéficientes «
nude
», chez lesquelles ils ont transplanté par voie sous-cutanée des cellules tumorales KP ou KPK exprimant de manière inductible des shRNA témoins ou des shRNA ciblant BACH1 ou FBXO22. En accord avec les résultats de l’étude précédente, les souris transplantées avec les cellules KPK (exprimant le shRNA témoin) développent plus de métastases que celles transplantées avec les cellules KP (exprimant le shRNA témoin). Surtout, l’invalidation de BACH1 dans les cellules tumorales KP ou KPK transplantées réduit l’incidence des métastases, alors que l’invalidation de FBXO22 l’augmente. Enfin, la déplétion concomitante de BACH1 réduit très fortement la formation de métastases induite par la perte de FBXO22, démontrant que l’augmentation de l’incidence des métastases induite par la déplétion de FBXO22 implique BACH1. Aucun impact sur la croissance de la tumeur primitive n’est observé dans ces conditions.
|
L’hème oxygenase-1, une nouvelle cible thérapeutique pour la dégradation de BACH1 et l’inhibition des métastases
Parmi les cancers bronchiques non à petites cellules, l’adénocarcinome présente un fort potentiel métastatique lui permettant d’envahir différents organes. Ces cellules cancéreuses vont maintenir leur homéostasie rédox par une stabilisation de NRF2, qui active l’expression de HO-1, à l’origine d’une stabilisation de BACH1, un facteur transcriptionnel promouvant les métastases par activation de gènes pro-métastatiques. Dans leur article, l’équipe de Michele Pagano montre que l’accumulation d’hème libre favorise l’interaction de FBXO22 avec BACH1, qui est un prérequis pour sa dégradation par le protéasome [
2
]
(
Figure 1
)
. Dans les conditions pathologiques, l’hème libre est catabolisé par HO-1, avec pour conséquence la stabilisation de BACH1. Il en résulte, pour les cellules cancéreuses, l’acquisition d’un phénotype migratoire et l’amélioration de leurs capacités de prolifération et de survie. L’analyse d’adénocarcinomes pulmonaires montre que les concentrations de BACH1 et de HO-1 sont augmentées dans les métastases par comparaison aux tumeurs primaires dont elles dérivent. L’analyse de la signature BACH1 montre que celle-ci est enrichie de manière significative dans les tumeurs de haut-grade et dans les stades tardifs de la maladie. Enfin, un taux élevé de BACH1 est associé à une survie plus courte.
à la lumière de leurs résultats, les auteurs proposent une nouvelle approche thérapeutique pour les patients atteints d’adénocarcinome pulmonaire et présentant une altération de la voie KEAP1-NRF2, fondée sur l’inhibition de HO-1, ce qui réduirait la formation des métastases en favorisant la dégradation de BACH1 impliquant FBXO22. Ils proposent même que cette stratégie thérapeutique soit également appliquée à d’autres types de cancers ayant une altération de la voie KEAP1-NRF2. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
2.
Lignitto
L
,
LeBoeuf
SE
,
Homer
H
,
et al.
Nrf2 activation promotes lung cancer metastasis by inhibiting the degradation of Bach1.
.
Cell.
2019;
;
178
:
:316.
–
329
.
3.
Cancer Genome Atlas Research Network.
Comprehensive genomic characterization of squamous cell lung cancers.
.
Nature.
2012;
;
489
:
:519.
–
525
.
4.
Rojo de la Vega
M
,
Chapman
E
,
Zhang
DD
.
NRF2 and the hallmarks of cancer.
.
Cancer Cell.
2018;
;
34
:
:21.
–
43
.
5.
Boutten
A
,
Goven
D
,
Artaud-Macari
E
,
Bonay
M
.
La voie Nrf2 en pathologie respiratoire.
.
Med Sci (Paris).
2011;
;
27
:
:966.
–
972
.
6.
Li
C
,
Sotcker
R
.
Heme oxygenase and iron: from bacteria to humans.
.
Redox Report.
2009;
;
14
:
:95.
–
101
.
7.
Ogawa
K
,
Sun
J
,
Taketani
S
,
et al.
Heme mediates derepression of Maf recognition element through direct binding to transcription repressor Bach1.
.
EMBO J.
2001;
;
20
:
:2835.
–
2845
.
8.
Oyake
T
,
Itoh
K
,
Motohashi
H
,
et al.
Bach proteins belong to a novel family of BTB-basic leucine zipper transcription factors that interact with MafK and regulate transcription through the NF-E2 site.
.
Mol Cell Biol.
1996;
;
16
:
:6083.
–
6095
.
9.
Anderson
NM
,
Simon
MC
.
BACH1 orchestrates lung cancer metastasis.
.
Cell.
2019;
;
178
:
:265.
–
267
.
10.
DuPage
M
,
Dooley
AL
,
Jacks
T
.
Conditional mouse lung cancer models using adenoviral or lentiviral delivery of Cre recombinase.
.
Nat Protoc.
2009;
;
4
:
:1064.
–
1072
.
11.
Romero
R
,
Sayin
VI
,
Davidson
SM
,
et al.
Keap1 loss promotes Kras-driven lung cancer and results in dependence on glutaminolysis.
.
Nat Med.
2017;
;
23
:
:1362.
–
1368
.
|