Le développement de métastases est la cause principale des décès liés aux cancers. Au cours de ce processus, des cellules tumorales acquièrent la capacité de dégrader la matrice extracellulaire (MEC) et d’envahir le tissu environnant. La MEC est un élément complexe et dynamique du microenvironnement tumoral. Le collagène de type I, un composant important de la MEC, est un inducteur de la formation des invadosomes, qui sont des structures d’adhérence des cellules, notamment tumorales, à la MEC, associées à sa dégradation [ 1 ]. Ce collagène interagit avec de nombreux autres composants de la MEC comme la fibronectine, le collagène de type III, l’élastine, la ténascine-C ou encore la vitronectine, pour former des réseaux de fibres entremêlées [ 2 , 3 ]. Un grand nombre de ces composants, impliqués eux aussi dans l’invasion tumorale [ 3 , 4 ], contiennent des ponts disulfures afin de stabiliser leur structure ( Figure 1 ) . Au cours de la progression tumorale, la MEC est constamment remodelée (accumulation, activation de sa dégradation, mais aussi réorganisation par alignement ou réticulation), afin de favoriser l’invasion tumorale. Les invadosomes formés par les cellules tumorales recrutent et sécrètent des métalloprotéinases matricielles (MMP), des enzymes contribuant à la dégradation des composants de la MEC. Bien que les étapes de dégradation de la MEC par les MMP aient été caractérisées [ 5 ], le remodelage des ponts disulfures au cours de ce processus n’avait pas encore été analysé.
| Figure 1.
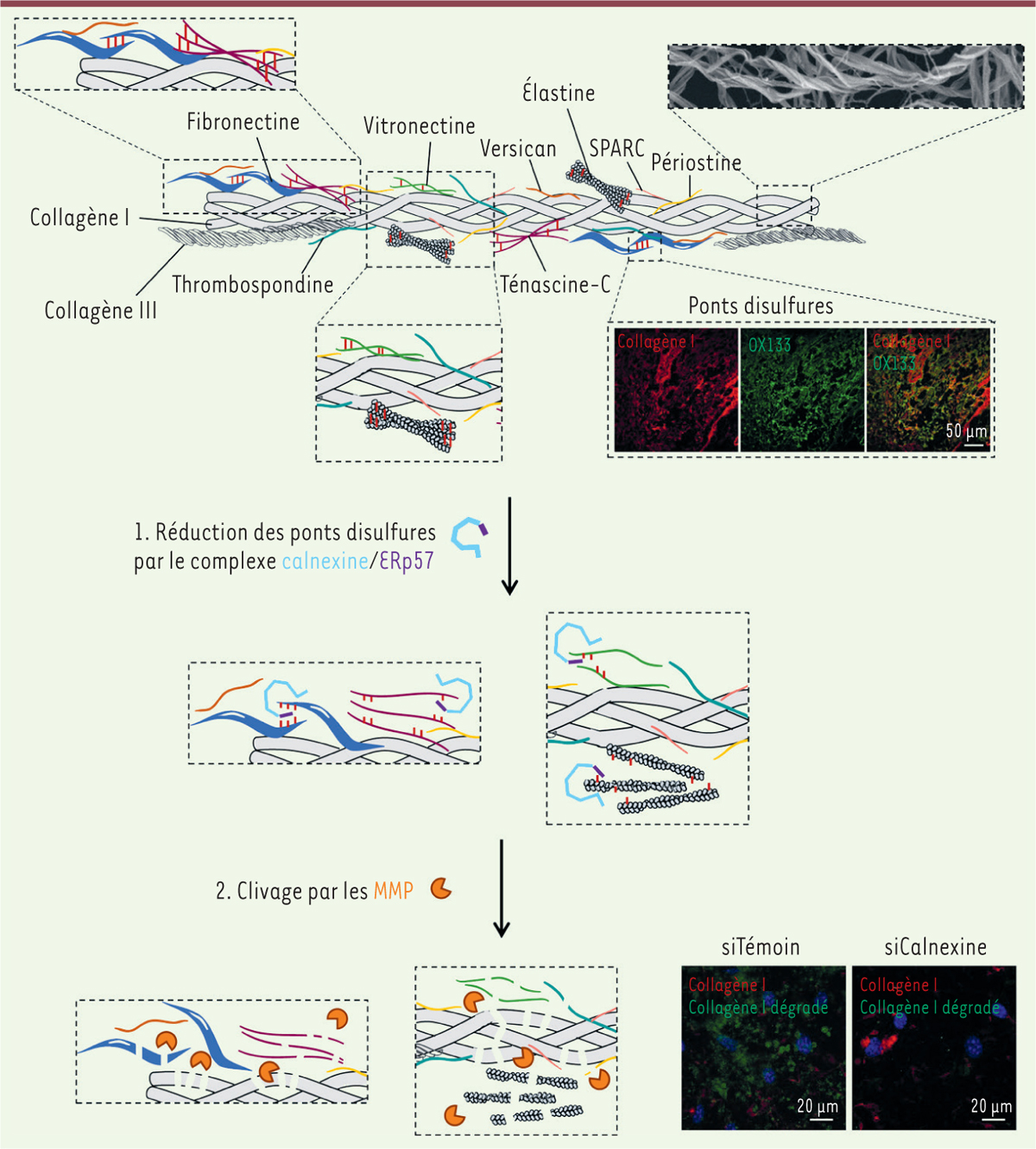
Représentation schématique de la matrice extracellulaire et des étapes de sa dégradation par les cellules tumorales.
Le collagène de type I forme une structure fibrillaire en triple hélice (observée ici en microscopie électronique), et peut interagir avec de nombreux autres composants de la matrice extracellulaire (MEC), dont certains contiennent des ponts disulfures (représentés en rouge). Ces ponts disulfures peuvent être visualisés par immunofluorescence en utilisant l’anticorps OX133. Le complexe calnexine/ERp57 présent au niveau des invadosomes permet la réduction des ponts disulfures des protéines de la MEC avant leur dégradation par les MMP. Les photos d’immunofluorescence en bas à droite montrent la dégradation du collagène par des cellules tumorales traitées avec un ARN interférent dirigé contre l’ARN messager codant la calnexine (siCalnexine) ou avec un ARN interférent témoin (siTémoin).
|
L’invasion des tissus par les cellules tumorales peut être favorisée par une dérégulation de la glycosylation des protéines dans ces cellules, notamment par activation de la voie de signalisation GALA (pour GALNT activation ) [ 6 , 7 ], qui induit la relocalisation partielle des enzymes de O-glycosylation GALNT ( polypeptide GalNAc transferases ) de l’appareil de Golgi vers le réticulum endoplasmique. Cette relocalisation augmente la glycosylation de nombreuses protéines, sans que l’on en comprenne encore totalement le mécanisme : il est possible que les conformations incomplètement « repliées » des protéines nouvellement synthétisées favorisent l’interaction avec les GALNT. Les protéines cibles de cette glycosylation anormale comprennent des protéines de surface et des protéines du réticulum endoplasmique. Ainsi, l’activation de la voie GALA favorise la glycosylation de MMP14 sur une portion charnière entre deux domaines globulaires [ 6 ]. Cette glycosylation active l’activité collagénase de MMP14, ce qui favorise la dégradation de la MEC, et par conséquent, la migration des cellules tumorales à partir de la tumeur primaire et l’invasion d’autres tissus par ces cellules [ 6 ]. Une analyse glycoprotéomique a aussi permis de mettre en évidence l’hyperglycosylation de la calnexine (CNX) lorsque la voie GALA est activée [ 8 ]. La CNX est une protéine chaperonne favorisant le repliement productif des protéines dans le réticulum endoplasmique grâce à son interaction avec l’oxydoréductase ERp57. En effet, lorsqu’au cours de sa synthèse, une protéine mal repliée est figée en raison de ponts disulfures inopportuns, cette protéine est d’abord reconnue par CNX, puis l’enzyme ERp57 réduit les ponts disulfures anormaux, permettant ainsi à la protéine de se replier correctement [ 9 ]. Par ailleurs, le réticulum endoplasmique se concentre au niveau des invadosomes [ 10 ], suggérant un lien possible entre la protéine CNX, les invadosomes, et l’invasion par les cellules tumorales.
Nous avons montré que la protéine CNX est hyperglycosylée par l’activation de la voie GALA dans des cellules tumorales in vitro , mais également au cours de la tumorigenèse in vivo , dans les cellules de tumeurs hépatiques murines et humaines. La glycosylation de CNX induit sa translocation, ainsi que celle de son partenaire ERp57, à la surface cellulaire, où les deux protéines se localisent au niveau des invadosomes [ 8 ]. Nous avons ensuite mis en évidence, en utilisant des ARN interférents et des anticorps bloquants, que CNX et ERp57 sont nécessaires à la dégradation de la MEC, notamment du collagène de type I. En revanche, ces deux protéines n’affectent ni la formation d’invadosomes ni l’expression, l’activité ou la localisation des MMP. Grâce à l’utilisation de cellules rendues génétiquement déficientes en CNX et à l’utilisation de mutants non glycosylables de cette protéine, nous avons également montré que la glycosylation de CNX par activation de la voie GALA est requise pour la dégradation de la MEC.
Pour tenter de comprendre le rôle de CNX et ERp57 dans la dégradation de la MEC, nous nous sommes fondés sur leur rôle dans le réticulum endoplasmique. Notre hypothèse était que le complexe CNX/ERp57 pourrait, à la surface cellulaire, remodeler les ponts disulfures présents dans les protéines de la MEC ( Figure 1 ) . Nous avons effectivement montré que le complexe CNX/ERp57 à la surface cellulaire est nécessaire pour le remodelage des ponts disulfures des protéines de la MEC, avant leur clivage par les MMP.
Enfin, nous avons confirmé in vivo l’implication de la CNX dans l’invasion des tissus par les cellules tumorales. Pour cela, nous avons induit des tumeurs hépatiques dans un modèle murin par injection d’un plasmide permettant d’activer la protéine proto-oncogène NRAS et d’inhiber la protéine anti-oncogène TP53 [ 6 ]. Les souris ont ensuite été traitées par injection d’un anticorps bloquant anti-CNX ou d’un anticorps témoin. L’inhibition du développement tumoral et de la formation de métastases constatée chez les souris injectées avec l’anticorps anti-CNX a montré que le complexe CNX/ERp57 anormalement présent à la surface cellulaire est nécessaire à ces processus. Ainsi, nous proposons, pour la dégradation de la MEC qui accompagne l’invasion des tissus par les cellules tumorales, une séquence d’événements au cours de laquelle la réduction des ponts disulfures des protéines de la MEC par l’action des protéines CNX et ERp57 à la surface des cellules tumorales précède le clivage par les MMP [ 8 ]. Le complexe CNX/ERp57 pourrait donc désormais être considéré comme une nouvelle cible thérapeutique dans le cancer.