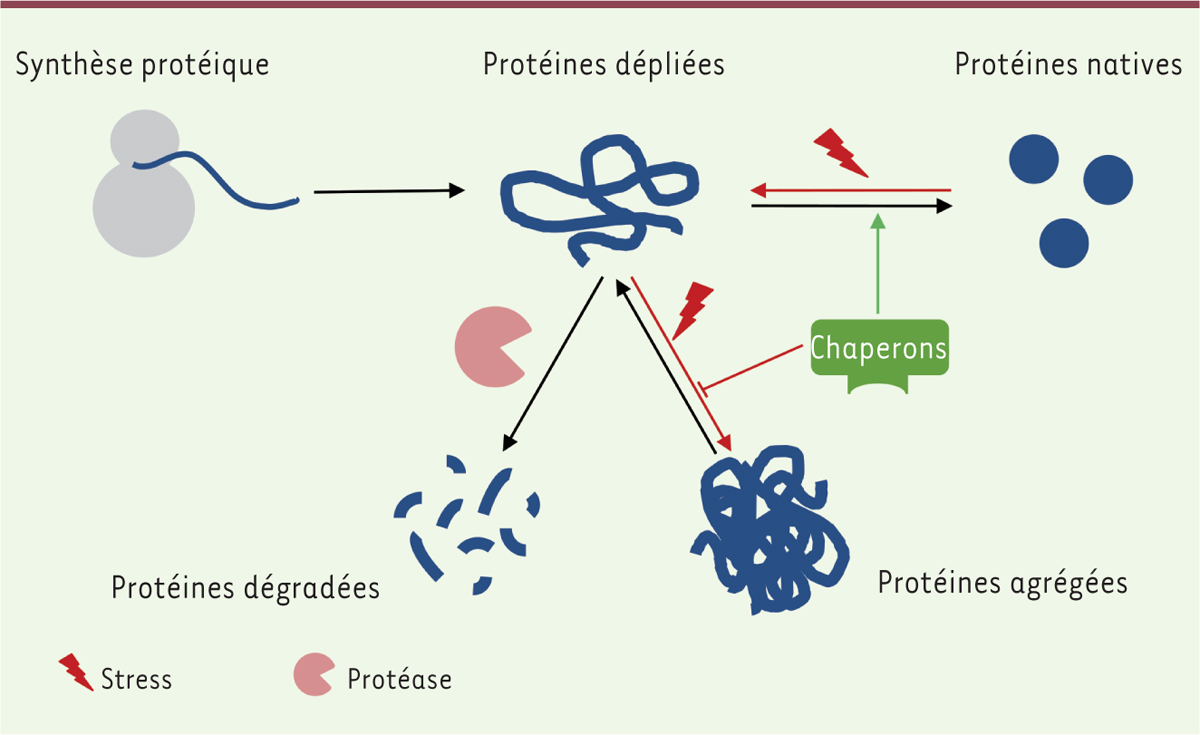
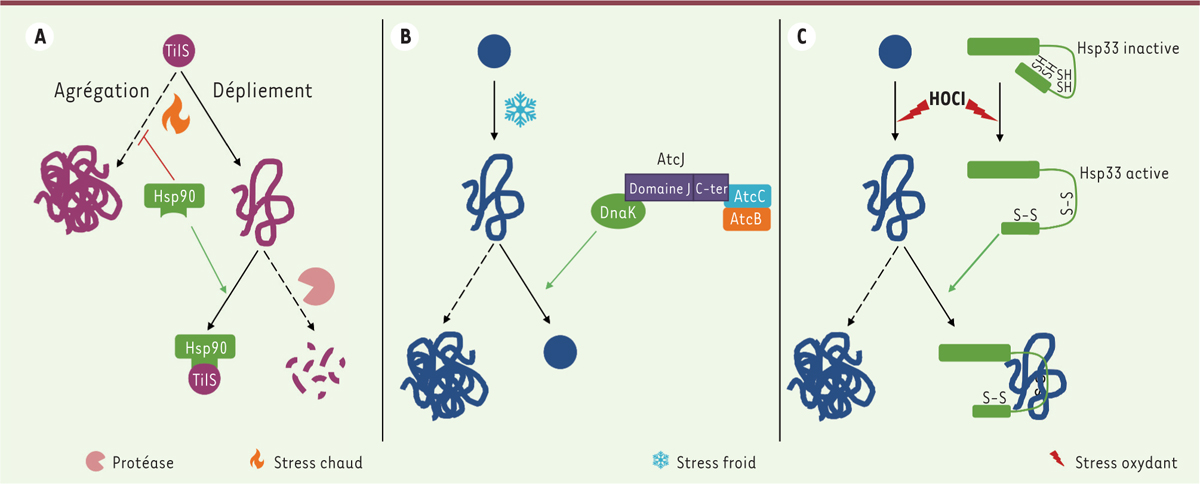
|
Entretien avec Marianne Ilbert et Olivier Genest
Marianne Ilbert et Olivier Genest sont chargés de recherche au laboratoire « Bioénergétique et ingénierie des protéines » (BIP) de Marseille. Ils se sont spécialisés dans l’étude de l’adaptation des bactéries aux stress environnementaux grâce aux protéines chaperons. Marianne Ilbert a reçu le prix Jacques Monod en 2007. Olivier Genest a obtenu la médaille de bronze du CNRS en 2019.
Qu’est-ce qui vous a conduits à travailler sur les protéines chaperons
?
Olivier Genest :
Je cherchais un stage de master et le sujet proposé sur un chaperon spécifique par Chantal Iobbi-Nivol, qui était la directrice de thèse de Marianne à ce moment-là, m’intéressait beaucoup. J’ai fait ma thèse dans cette équipe et j’ai pris la suite des travaux de Marianne. Par la suite, j’ai travaillé sur des chaperons généraux, car je trouvais ces protéines réellement fabuleuses au vu de leur importance dans les cellules. Elles sont généralement conservées des bactéries à l’Homme et souvent les mêmes mécanismes d’action sont retrouvés.
Marianne Ilbert :
Je ne me rappelle pas avoir eu d’enseignement sur la thématique des protéines chaperons. Je suis tombée un peu par hasard avec mon sujet de recherche de master sur une protéine chaperon. Je pensais à ce moment-là que les chaperons étaient des protéines accessoires. Je me suis rendue compte que ces protéines jouent en réalité un rôle central dans toutes les cellules vivantes et c’est ce qui rend leur étude fascinante.
Vous avez tous les deux effectué un post-doctorat aux États-Unis, avez-vous envisagé d’y rester
?
OG :
J’ai fait mon post-doctorat aux
National Institutes of Health
(NIH) aux États-Unis dans l’équipe de Sue Wickner. Cette expérience était vraiment exceptionnelle ! C’est un moment de notre carrière de chercheur en devenir où on a la possibilité de travailler exclusivement sur nos sujets de recherche. Dans mon cas, il n’y avait pas de tâches administratives à mener ou de cours à donner. C’était pour moi des conditions de travail optimales et le laboratoire avait énormément de moyens. J’ai passé cinq ans dans ce laboratoire et comme c’était très intéressant côté recherche, évidemment, ça donne très envie d’y rester. Mais j’avais quand même la volonté de rentrer en France et je suis très satisfait d’être de retour au CNRS.
MI :
Je voulais d’abord faire mon post-doctorat en Europe et je suis finalement partie aux États-Unis. Je n’étais initialement pas attirée par ce pays et finalement je ne voulais plus en repartir ! C’est une chance énorme de pouvoir partir pendant quelques années dans un laboratoire étranger. Ça m’a ouvert les yeux, j’ai une vision du monde complètement différente depuis que je suis partie. Au niveau scientifique, j’étais à l’université du Michigan et c’est vrai que d’être dans un laboratoire avec de gros financements permet de ne pas être limité dans nos recherches. C’est un des meilleurs moments d’une carrière de chercheur, même s’il existe quand même une pression liée à la publication de nos travaux. Mais je voulais rentrer d’une part pour des raisons personnelles, et, d’autre part, car notre système de recherche français est unique : nous pouvons mener librement nos recherches, nous avons la chance d’avoir des postes permanents relativement tôt dans nos carrières et nous avons une recherche de haut niveau.
Pouvez-vous nous donner les avantages et inconvénients d’être chercheur aux États-Unis et en France
?
OG :
Je trouve qu’un des gros avantages de la recherche au CNRS est la liberté du sujet. Il faut bien évidemment que nos recherches s’inscrivent dans le cadre des thématiques d’une section de recherche ou d’un laboratoire, mais on reste quand même très libre d’étudier les mécanismes que l’on souhaite. Je trouve que c’est un côté très positif. Un autre aspect très intéressant est qu’en France, en tout cas à Marseille, les chercheurs s’intéressant à des thématiques communes peuvent être regroupés. Par exemple, l’Institut de Microbiologie de la Méditerranée (IMM) dans lequel nous travaillons rassemble un très grand nombre de scientifiques travaillant sur divers aspects de la microbiologie, ce qui nous permet d’avoir de très nombreux échanges avec nos collègues pour pouvoir s’apporter des connaissances que nous ne possédons pas. Dans mon laboratoire de post-doc aux États-Unis, nous étions beaucoup moins regroupés par thématique.
MI :
En France, il y a aussi beaucoup de chercheurs permanents, c’est différent du système américain où il y a en général un chercheur permanent et les membres du laboratoire changent énormément. Cette stabilité nous permet de créer des collaborations pérennes. En France, nous sommes organisés sous forme d’équipes avec plusieurs chercheurs permanents, ce qui nous permet de nous soutenir. Dans les laboratoires américains, les chercheurs peuvent obtenir d’énormes financements mais si, pendant quelques années, ils ne décrochent pas de nouveaux financements, leur laboratoire peut fermer définitivement. Nous avons ce gros avantage, je pense, d’être plusieurs chercheurs permanents sur une thématique et du coup d’avoir une force de frappe différente et fonctionnelle, surtout sur le long terme.
Le métier de chercheur est-il compatible avec une vie familiale et sociale
?
OG :
C’est un métier qui demande beaucoup de travail, ça c’est sûr, mais il existe quand même une certaine flexibilité qui peut permettre d’allier très bien sa vie de chercheur et sa vie familiale. Il est vrai qu’après une journée de travail où on participe à l’encadrement des étudiants et aux manipulations, il est assez fréquent de travailler le soir chez soi pour rédiger des articles ou des demandes de financement. Si on comptait nos heures, on s’apercevrait qu’on travaille bien plus que si on faisait des horaires classiques de bureau, mais au final nous avons une certaine souplesse qui permet de concilier le travail et le reste. Mais il est clair que nos recherches nous trottent toujours dans la tête !
MI :
C’est vrai que c’est un métier qui requiert de la passion, on peut vite se retrouver dans un engrenage où certains se retrouvent à ne faire plus que ça. Mais il faut savoir faire la part des choses. Si vous travaillez tout le temps, vous ne prenez jamais de recul. Et quelque part, faire un
break
, prendre des vacances, c’est nécessaire et bénéfique pour votre bien-être et pour l’avancée de vos recherches. Il ne faut par contre pas espérer que ça soit un métier avec des journées de 8 h à 17 h et puis on passe à autre chose, ce n’est pas vrai. Mais on peut avoir une vie personnelle et sociale, tout en ayant une vie professionnelle épanouie.
Pour vous, le métier de chercheur est plus un travail individuel ou collectif
?
OG :
Je pense qu’il faut absolument l’individuel et le collectif. Il y a un gros investissement personnel car il faut à la fois lire les publications de la communauté scientifique, avoir des idées originales, mener des expériences… Mais tout seul on ne peut pas y arriver. Si je devais choisir entre les deux, je dirais donc que le métier de chercheur est un travail d’équipe. Nous travaillons directement avec des étudiants en thèse ou avec nos collègues de l’équipe, nous développons des collaborations avec d’autres chercheurs sur des thématiques qui apportent un plus à nos recherches comme par exemple sur des aspects interdisciplinaires.
MI :
Je suis d’accord avec Olivier, seul ce n’est juste pas possible de mener à bien un sujet de recherche. Les étudiants, ingénieurs et autres collègues sont indispensables pour avancer sur un projet. De plus, on ne maîtrise pas tout, il faut donc savoir aussi se dire « sur cette thématique, je ne suis pas compétent » et aller discuter avec des collègues. C’est mon cas actuellement, une partie de mon projet s’oriente sur la chimie du cuivre où je manque de compétences, donc je travaille en étroite collaboration avec des chimistes. Les collaborations sont indispensables : il faut savoir accepter que l’on ne puisse pas tout comprendre, tout savoir.
Comment envisagez-vous votre plan de carrière dans dix ou vingt ans
?
OG :
Ce que je souhaite dans dix ou vingt ans, c’est surtout continuer à me régaler dans la recherche et avoir toujours envie de découvrir des choses nouvelles. Continuer à travailler sur les chaperons, pourquoi pas, puisque c’est pour le moment ce que je fais et ça se passe plutôt bien. Par exemple, je voudrais trouver toutes les protéines clientes avec qui le chaperon Hsp90 interagit, et trouver leurs fonctions pour bien comprendre ce que fait Hsp90 chez les bactéries. Ce qu’on aimerait faire également c’est étudier les chaperons chez d’autres modèles bactériens. On pense en effet que chez certaines bactéries pathogènes, Hsp90 joue un rôle très important dans la virulence, donc pourquoi pas essayer de trouver des inhibiteurs d’Hsp90 qui permettent de bloquer ou de limiter la virulence chez ces bactéries. Et il y a pleins d’autres chaperons à explorer !
MI :
Je voudrais continuer à développer les projets qui me plaisent. Il y a deux/trois ans, j’ai fait un choix de carrière, j’ai dévié mon sujet de recherche dans le but de retravailler sur la thématique des chaperons et d’étudier leur rôle lors de l’adaptation des bactéries face aux stress induit par les métaux. Ce sont les recherches que je veux mener dans l’avenir, je pense que c’est un des meilleurs choix que j’ai fait dans ma carrière scientifique. Moralité, il faut toujours faire quelque chose qui vous plaît, aller vers les thématiques qui vous passionnent. Je vais donc continuer sur ce sujet, il y a des tonnes de choses que j’ai envie de faire, plein d’idées qui viennent, d’expériences qu’on veut mener, et clairement pour les dix ans à venir j’ai de quoi faire dans la recherche.
|