| |
| Med Sci (Paris). 37(3): 242–248. doi: 10.1051/medsci/2021010.Modélisation de la barrière de filtration glomérulaire Nouvelles avancées Mahamadou Dembele,1* Marion Delafosse,1* Nadhir Yousfi,1 Hanna Debiec,1 Kieu Ngo,2 Emmanuelle Plaisier,1 Pierre Ronco,1 and Guillaume Perry1,3*** 1Inserm, Sorbonne Université, Maladies rénales fréqunentes et rares (CoRaKiD), UMRS 1155, Hôpital Tenon, Bâtiment recherche
,
4 rue de la Chine
,
75020Paris
,
France 2Sorbonne Université, CNRS, Laboratoire interfaces et systèmes électrochimiques, LISE, Campus Pierre et Marie Curie
,
4 place Jussieu75252Paris
,
France 3CNRS, Sorbonne université, Laboratoire de génie électrique et électronique de Paris, GeePs, Campus Pierre et Marie Curie
,
4 Place Jussieu75252Paris
,
France |
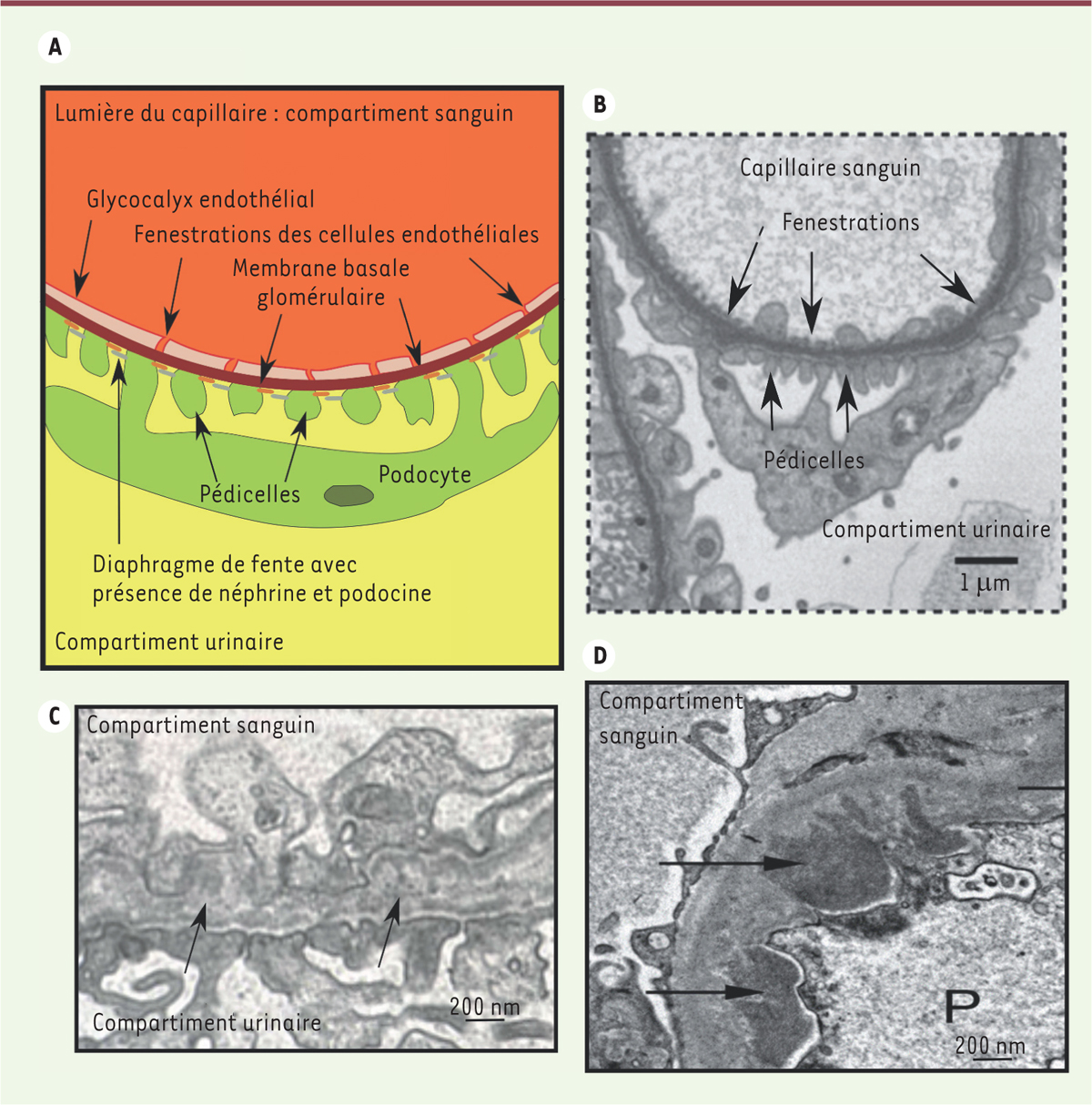
Vignette (Photo © Inserm-Blanc-Brunat, Nelly). Le rein est un organe essentiel au maintien de l’homéostasie de l’organisme par sa capacité à épurer le sang. Chez l’homme, chaque rein est composé d’environ un million d’unités fonctionnelles, appelées néphrons, eux-mêmes constitués de deux grandes parties : le glomérule et le système tubulaire. Le glomérule permet la production de l’urine primitive grâce à l’ultrafiltration du sang à travers une structure très spécifique, appelée barrière de filtration glomérulaire (BFG). Cette structure fonctionnelle constitue une barrière de taille et de charge, imperméable aux éléments figurés du sang, aux grosses molécules, telles que les lipides et les protéines plasmatiques dont la masse moléculaire est égale ou supérieure à celle de l’albumine (66 458 daltons).
La barrière de filtration glomérulaire est composée de trois couches avec, du compartiment sanguin au compartiment urinaire
(
Figure 1
)
:
 | Figure 1.
Barrière de filtration glomérulaire. A.
Représentation schématique. Photos de microscopie électronique
(B)
d’une barrière non altérée [
40
] (sous licence
Creative commons
CC BY4),
(C)
d’une barrière altérée par un syndrome d’Alport avec un épaississement typique de la membrane basale glomérulaire (flèches noires) et un effacement progressif des pédicelles, et
(D)
d’une glomérulonéphrite extra-membraneuse avec des dépôts immuns (flèches noires) au niveau de la membrane basale glomérulaire du côté des podocytes (P).
|
Les cellules endothéliales glomérulaires (CEnG)
. Le cytoplasme de ces cellules délimitant les capillaires glomérulaires a la particularité de former des pores, également appelés fenestrations, par réorganisation de l’actine. La présence de ces pores et celle du glycocalyx à la surface des CEnG jouent un rôle important dans la perméabilité à l’eau et aux solutés de faible masse moléculaire [
1
]. Ces cellules expriment des marqueurs spécifiques endothéliaux, tels que le
vascular endothelial growth factor receptor
(VEGFR) et CD31 [
2
].
La membrane basale glomérulaire (MBG)
. C’est une structure matricielle constituée de réseaux interconnectés de collagène de type IV et de laminines, auxquels s’associent des protéoglycanes. Des altérations génétiques de la MBG, comme le syndrome d’Alport, sont responsables de maladies glomérulaires avec un passage anormal des globules rouges dans les urines (hématurie) [
3
].
Les cellules épithéliales viscérales
. Elles sont également appelées podocytes du fait de leurs ramifications, ou pédicelles. Ceux-là forment un maillage étroit, qui ne laisse libre que de petits espaces, formés par des diaphragmes de fente (DF). L’intégrité des DF est assurée grâce à un réseau complexe de protéines transmembranaires, comme la podocine ou la néphrine. L’atteinte des podocytes, comme dans la glomérulonéphrite extra-membraneuse, va se traduire par une fuite massive de protéines d’une masse moléculaire égale ou supérieure à l’albumine dans les urines (protéinurie glomérulaire) [
4
].
De nombreuses maladies peuvent altérer l’architecture de la BFG, entraînant l’apparition d’une protéinurie et/ou d’une hématurie, voire d’une insuffisance rénale. La reproduction dans les modèles des propriétés structurales et fonctionnelles complexes de la BFG est essentielle pour comprendre les mécanismes physiopathologiques de ses altérations, pour proposer des thérapeutiques spécifiques, ou encore pour contribuer à la génération d’un rein bioartificiel. Les modèles
in vivo
et
ex vivo
(glomérule isolé et perfusé) présentent plusieurs limites : essentiellement fondés sur des modèles murins, les résultats obtenus posent le problème de leur pertinence pour l’étude des maladies rencontrées chez l’homme. Par ailleurs, la viabilité
ex vivo
des structures glomérulaires reste limitée, réservant ces expériences pour des équipes expérimentées réduisant leur champ d’exploitation [
5
]. Les organoïdes rénaux représentent une alternative intéressante [
6
]. Cependant, ces structures multicellulaires tridimensionnelles sont dépourvues de réseaux capillaires et de compartiments urinaires bien définis, ce qui les rend inaptes à reproduire l’activité de filtration glomérulaire [
7
]. Récemment, plusieurs modèles
in vitro
de BFG ont été développés, permettant notamment d’agir de manière spécifique sur chacun de ses composants. L’objectif de cette revue est de présenter les deux grands axes du développement des modèles
in vitro
de BFG, 1) l’utilisation de nouveaux types cellulaires et 2) la possibilité de reproduire le microenvironnement. Nous soulignerons également les limites respectives de ces modèles et présenterons les défis à relever.
|
Vers de nouveaux modèles de cellules glomérulaires Types cellulaires actuellement utilisés
La culture de cellules glomérulaires humaines
in vitro
est une approche essentielle pour étudier ces cellules et émettre des hypothèses sur les interactions entre les différents constituants de la BFG. Idéalement, les cellules doivent présenter des caractéristiques morphologiques (pédicelles des podocytes et fenestrations des CEnG) et moléculaires (expression des marqueurs spécifiques) identiques à celles des cellules glomérulaires
in vivo
. Actuellement, les principales sources de cellules glomérulaires étudiées présentent des limites impactant leur pertinence physiologique
(
Tableau I
)
. On peut regrouper ces cellules en trois grandes catégories : 1) les cultures primaires de cellules glomérulaires, 2) les lignées de cellules glomérulaires immortalisées, et 3) les cellules glomérulaires dérivées de cellules progénitrices ou de cellules souches. Les cultures primaires de cellules présentent l’avantage d’un phénotype proche de celui observé
in vivo,
plus particulièrement durant les passages
1
précoces de leur culture
in vitro
. Si leur utilisation a permis des avancées dans la compréhension des bases moléculaires de glomérulopathies humaines, leur très faible potentiel prolifératif et la difficulté à maintenir un phénotype différencié au-delà des premiers passages lors de la culture
in vitro
restent deux limites importantes à leur utilisation. Les lignées cellulaires de podocytes et de CEnG humaines immortalisées par transfection avec un transgène codant l’antigène T du virus simien 40 (SV40) ont constitué une avancée importante. Outre l’acquisition de propriétés prolifératives à 33 °C, l’utilisation d’un transgène thermosensible a permis l’acquisition, à 37 °C, de caractéristiques phénotypiques différenciées. Actuellement, ces lignées sont des modèles de cellules glomérulaires
in vitro
très largement utilisés. Toutefois, leurs caractéristiques et leur stabilité phénotypique en culture restent très imparfaites. Les cellules glomérulaires issues de cellules souches pluripotentes induites (
induced pluripotent stem cells
, iPSC) sont considérées comme une alternative intéressante aux lignées de cellules glomérulaires immortalisées, notamment podocytaires, mais un phénotype cellulaire stable correspondant à une différenciation terminale est rarement atteint.
Tableau I.
| Types cellulaires |
Marqueurs spécifiques |
Avantages |
Inconvénients |
Références |
| Culture primaire de podocytes |
Podocine, néphrine, P-CAD, WT-1 |
Pédicelles et DF proches de ceux de podocytes
in vivo
|
Accès difficile, coût élevé, potentiel prolifératif faible, perte des pédicelles et de SYN au cours des passages |
[
34
]
|
|
| Culture primaire de CEnG |
CD31, ICAM2, VEGFR2,vWF, VE-CAD, Tie2 |
Maintien des fenestrations au cours des passages précoces |
Accès difficile, coût élevé, potentiel prolifératif faible, perte progressive des fenestrations |
[
35
]
|
|
| Lignées de podocytes immortalisées |
Podocine, néphrine, P-CAD, SYN |
Potentiel prolifératif optimisé, source illimitée, accès facile Antigène SV40 thermosensible |
Différences phénotypiques entre différentes lignées et avec les podocytes
in vivo
, absence de pédicelles, Instabilité génomique
|
[
36
]
|
|
| Lignées de CEnG immortalisées |
CD31, ICAM2, VEGFR2,vWF |
Potentiel prolifératif optimisé, source illimitée, accès facile |
Absence de glycocalyx, Instabilité génomique |
[
37
]
|
|
| Podocytes dérivés de cellules progénitrices rénales issues du liquide amniotique (CPLA) |
Podocine, néphrine, WT-1, SYN |
Potentiel prolifératif intéressant, présence de structures semblables aux pédicelles, pas d’instabilité génomique |
Rôle physiologique des CPLA mal connu, coût du tri des CPLA élevé et rendement faible |
[
38
]
|
|
| Podocytes isolés des organoïdes rénaux dérivés des iPSC |
SYN, CD2AP, WT-1, PODXL |
Potentiel prolifératif intéressant, présence de structures semblables aux pédicelles, instabilité génomique faible ou inexistante, modèle personnalisable |
Protocole de différenciation long, complexe et coûteux, pédicelles et DF peu définis, immaturité potentielle |
[
39
]
|
Modèles cellulaires de la barrière de filtration glomérulaire
in vitro
. CD2AP :
cluster of differentiation 2-associated protein
; CPLA : cellules progénitrices rénales issues du liquide amniotique ; DF : diaphragme de fente ; ICAM 2 :
intercellular adhesion molecule 2
; P-CAD : P-cadhérine ; PODXL : podocalyxine ; SYN : synaptopodine, marqueur clé des podocytes différenciés
in vivo ;
Tie2 :
tyrosine kinase with immunoglobulin and EGF homology domains 2
; VE-CAD :
vascular endothelial cadherin
; VEGFR2 :
vascular endothelial growth factor receptor 2
; vWF :
von Willebrand factor
; WT1 :
Wilms tumor
1.
|
Des cellules souches aux cellules glomérulaires : une voie prometteuse
Au cours de ces dernières années, de nouvelles techniques d’ingénierie des iPSC ont permis des avancées majeures en biologie cellulaire et en bioingénierie. La capacité de ces cellules à se multiplier indéfiniment et à se différencier en cellules spécialisées suscite un vif intérêt en biologie. Ces propriétés représentent un avantage particulièrement intéressant pour modéliser les glomérulopathies humaines
in vitro
. En effet, la modélisation de ces maladies est restée longtemps compliquée car elles sont hétérogènes et leur physiopathologie moléculaire est largement influencée par le fond génétique des patients [
4
]. Les iPSC offrent l’opportunité de résoudre ce problème de variabilité génétique par la génération de cellules glomérulaires à partir de cellules issues de chaque patient, ouvrant la voie au développement de modèles de glomérulopathies patient-spécifiques.
Actuellement, deux approches permettent l’obtention des cellules glomérulaires à partir des iPSC, la première utilisant les organoïdes rénaux, la seconde s’appuyant sur une différenciation directe de ces cellules vers le type de cellules glomérulaire souhaité. Les organoïdes rénaux
Les organoïdes rénaux dérivés des iPSC représentent actuellement un outil intéressant pour la modélisation de maladies mais également pour étudier le développement des structures rénales
in vitro
. Les enjeux de ces structures multicellulaires rénales ont été détaillés dans une revue récente [
6
] (
→
).
(→) Voir la Synthèse de C. Steichen
et al
.,
m/s
n° 5, mai 2019, page 470
Néanmoins, si l’obtention d’organoïdes permet de générer les différents types cellulaires constituant le rein, donnant accès à des analyses transcriptomiques et protéomiques, et permettant le criblage de différentes populations cellulaires, la complexité de ces structure rend difficile la modélisation de fonctions physiologiques plus élémentaires telles que la filtration glomérulaire ou la réabsorption tubulaire. De plus, la faible vascularisation des organoïdes limite non seulement leur croissance, du fait du faible apport en nutriments, mais aussi la possibilité de les connecter à un système de microperfusion externe. Néanmoins, de récents travaux combinant la microfluidique à la culture d’organoïdes rénaux ont montré la formation d’un réseau vasculaire au sein des organoïdes par l’application d’un flux, ouvrant ainsi la voie à de nouvelles expériences [
8
]. De nos jours, il existe principalement deux stratégies pour obtenir des podocytes à partir des organoïdes rénaux. Ces stratégies passent d’abord par la constitution d’organoïdes rénaux, avant d’isoler des podocytes (stratégie 1) ou leurs précurseurs (stratégie 2) à partir de ces organoïdes. Cet isolement peut lui-même être réalisé soit par une étape de digestion enzymatique des organoïdes, suivie d’un tamisage de la suspension obtenue afin d’isoler des agrégats cellulaires qui se différencient en podocytes après 24 h de culture [
9
], soit en isolant spécifiquement les cellules progénitrices rénales (CPR) à partir des organoïdes et en les faisant se différencier en podocytes en 10 jours [
10
]. La génération des organoïdes et le criblage cellulaire restent des procédures expérimentales très coûteuses en matériels et d’une durée très importante, dont le rendement cellulaire est très faible.
Différenciation des iPSC en cellules glomérulaires matures
La stratégie alternative à l’utilisation d’organoïdes pour l’obtention de podocytes matures est celle fondée sur la différenciation des iPSC. En 2012, l’équipe de Song a décrit le premier protocole permettant d’obtenir des podocytes à partir d’iPSC [
11
]. Ce protocole reposait sur la culture de colonies d’iPSC dans un milieu spécifique supplémenté avec du sérum de veau fœtal. Bien que les cellules obtenues présentent des caractéristiques podocytaires, l’utilisation de sérum dans le milieu de culture rend ce protocole aléatoire. Il est bien connu que tout changement de lot de sérum, en raison de la variabilité de sa composition en facteurs de croissance, peut affecter les caractéristiques des cellules et donc la reproductibilité des résultats. D’autres protocoles sans supplémentation du milieu de culture avec du sérum ont été récemment développés, dont celui rapporté par Musah
et al
. qui permet d’obtenir une population de podocytes matures avec 99 % d’efficacité [
12
]. Il faut noter qu’il n’existe à l’heure actuelle aucun protocole de différenciation à partir d’iPSC permettant d’obtenir les autres types cellulaires du glomérule, en dehors de l’isolement de ces cellules à partir d’organoïdes. De plus, si de nombreux protocoles permettent de faire différencier des iPSC en cellules endothéliales, aucun protocole n’a été établi, à notre connaissance, pour la génération de cellules endothéliales glomérulaires fenestrées.
De plus, le microenvironnement de la paroi glomérulo-capillaire joue un rôle majeur dans la régulation physiologique des structures et dans les propriétés hémodynamiques de la barrière de filtration glomérulaire. Un système modèle suppose donc non seulement de maîtriser la composition cellulaire, mais aussi de fournir un microenvironnement le plus physiologique possible. |
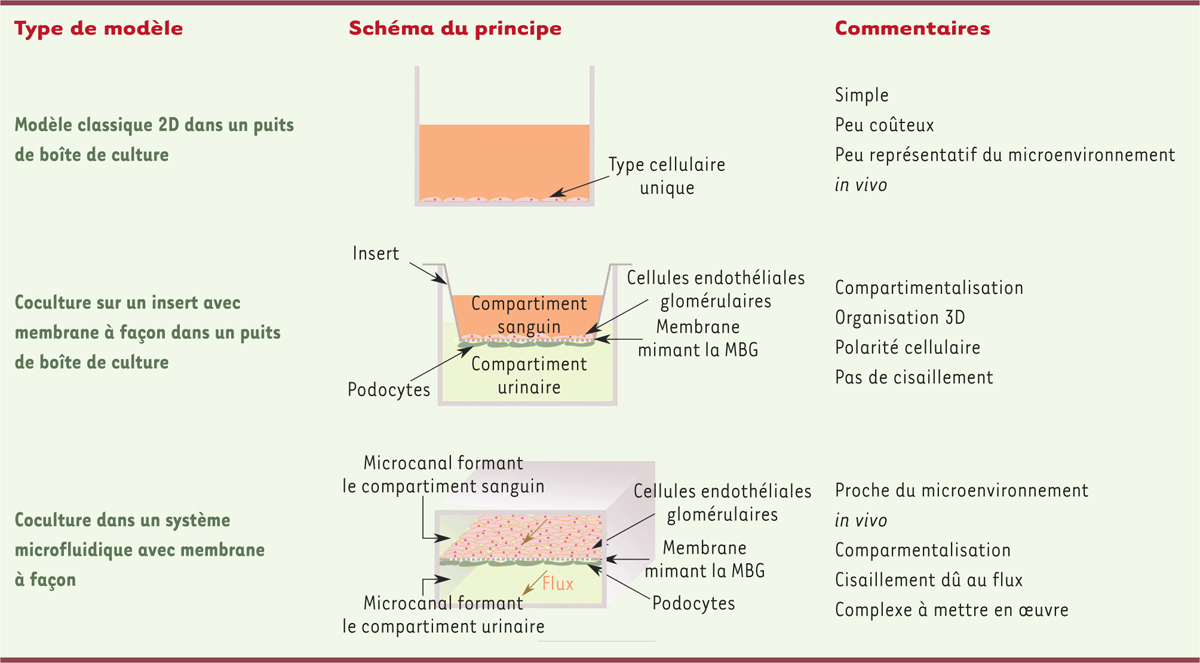
Vers un microenvironnement plus physiologique des cultures de cellules glomérulaires
Outre les propriétés intrinsèques des cellules utilisées, leur environnement local, ou microenvironnement, joue un rôle essentiel dans leur différenciation et leur capacité de prolifération. Pour étudier la BFG
in vitro
, il est donc indispensable de contrôler ce microenvironnement, en particulier les interactions intercellulaires, les propriétés de la matrice extracellulaire environnante, et les effets biomécaniques dus aux cisaillements générés par le flux sanguin et le flux urinaire. Les différents modèles existants sont illustrés dans la
Figure 2
.
 | Figure 2.
Les différents types de modèles de culture
in vitro
.
|
Les interactions cellule-cellule
De nombreuses molécules sont impliquées dans la différenciation de cellules souches pluripotentes en cellules glomérulaires, puis dans leur viabilité et dans le maintien de leur phénotype mature. Dans un système
in vitro
, ces molécules peuvent être apportées de manière exogène, en supplémentant le milieu de culture, ou de manière plus physiologique, grâce à la co-culture de plusieurs types cellulaires. La co-culture de cellules endothéliales glomérulaires (CEnG) avec des podocytes induit l’organisation des CEnG, en tubes ressemblant aux capillaires glomérulaires, grâce à un effet paracrine du VEGF (
vascular endothelial growth factor
) podocytaire sur les CEnG [
13
,
14
]. De même, l’endothéline 1 (ET-1), produite par les CEnG, stimule la prolifération des cellules mésangiales [
15
]. De nombreuses interactions entre cellules résidentes du glomérule ont été décrites [
21
], ainsi qu’avec d’autres types cellulaires extraglomérulaires, tels que les cellules tubulaires ou les cellules immunitaires [
17
]. En outre, les podocytes et les CEnG ont un rôle synergique dans la synthèse des constituants de la membrane basale glomérulaire mature. L’analyse par spectrométrie de masse de la composition de la matrice extracellulaire (MEC) obtenue avec des co-cultures de podocytes et de CEnG montre que celle-là se rapproche en effet plus de la composition de la membrane basale glomérulaire
in vivo
que celle de la MEC qui est obtenue avec des monocultures de cellules [
18
].
Matrice extracellulaire et propriétés locales
Contrairement aux organoïdes rénaux au sein desquels les différents types cellulaires s’organisent spontanément en trois dimensions pour reproduire l’architecture du glomérule observée
in vivo
, les autres systèmes de culture
in vitro
nécessitent un support artificiel pour reproduire l’interface que constitue la membrane basale glomérulaire au sein de la BFG qui est composée des deux compartiments distincts que sont le compartiment sanguin et le compartiment urinaire. Cela est particulièrement important pour l’étude des capacités de filtration de la BFG. De nombreux procédés ont été mis au point pour reproduire les propriétés biochimiques et biophysiques des membranes basales [
19
]. Li
et al
. ont montré que des podocytes cultivés sur un support recouvert de collagène de type IV (le collagène majoritaire de la MBG) exprimaient plus fortement les marqueurs de différenciation néphrine/synaptopodine que des podocytes cultivés sur un support recouvert de collagène de type I (en quantité faible dans la MBG) [
20
]. Flegeau
et al.
ont récemment généré une microfibre mimant la BFG par extrusion d’une solution à base de collagène de type I contenant des CEnG en suspension [
21
] sur lesquels les podocytes sont ensuite déposés. Dans ce modèle, une néosynthèse de MEC ainsi que la présence de podocytes fonctionnels en périphérie de la microfibre et de CEnG au centre, ont été observées. Néanmoins, ce modèle ne présente pas de lumière au niveau des CEnG.
Outre la composition moléculaire, le contrôle des propriétés biophysiques des supports de culture est essentiel. En effet, la rigidité d’un hydrogel (exprimée par le module de Young
2
) servant de support de culture permet d’optimiser la morphologie et l’expression de marqueurs de différenciation de podocytes humains immortalisés, les meilleurs résultats étant observés avec une rigidité comprise entre 2 et 5 kPa [
22
]. La forme du support de culture influence également le phénotype cellulaire. La méthode d’électrofilage, qui génère un réseau de microfibres grâce à un champ électrique, permet ainsi de créer des supports propices au maintien de la viabilité et du phénotype des cellules glomérulaires [
23
]. Pour prendre en compte l’influence de la courbure du support sur la morphologie spécifique des podocytes, Korolj
et al
. ont produit un support de culture en 3 dimensions constitué de micro-hémisphères s’approchant du diamètre des glomérules [
24
]. La culture de podocytes dans ces conditions induit un réarrangement des fibres d’actine et une meilleure capacité de filtration que la culture développée sur un support en deux dimensions classique.
Effets biomécaniques des contraintes de cisaillement
In vivo
, les cellules sont soumises à différentes forces sous forme de contraintes mécaniques qui vont moduler leur phénotype. L’étirement des podocytes entraîne ainsi une élongation de leurs pédicelles et une réorganisation du cytosquelette d’actine [
25
]. Deux principales forces s’exercent au niveau de la paroi capillaire glomérulaire : (1) la contrainte de cisaillement induite par le flux sanguin rénal sur le versant endothélial, et (2) celle induite par le phénomène d’ultrafiltration sur le versant podocytaire. Au niveau des CEnG, les forces de cisaillement induisent un alignement des filaments d’actine et modulent la perméabilité du capillaire glomérulaire [
26
]. Au niveau podocytaire, le cisaillement diminue la quantité de fibres d’actine et peut entraîner le détachement des cellules [
27
]. L’intensité et la durée des contraintes imposées peuvent considérablement moduler ces effets cellulaires. Arora
et al.
ont cultivé des cellules endothéliales dérivées d’iPSC, à l’aide d’un montage en canaux parallèles permettant de faire varier les niveaux de cisaillement de 0,4 à 15 dyn/cm
2
. Dans ces conditions, les cellules n’exprimaient les marqueurs endothéliaux Notch 1 et Ephrin-B2 que dans le cas des cisaillements supérieurs à 4 dyn/cm
2
, leur expression n’étant stable que pour des durées d’exposition dépassant 24 heures [
28
].
|
Depuis ces dernières années, des progrès importants ont été effectués dans la modélisation
in vitro
de la barrière de filtration glomérulaire (BFG), notamment grâce au développement de deux techniques d’importance : la maîtrise de l’utilisation de cellules souches pluripotentes induites (iPSC) et la miniaturisation. Même si iPSC représentent une approche très prometteuse, de nombreux obstacles existent encore avant l’obtention d’un phénotype physiologique stable de cellules glomérulaires. Le développement des techniques à haut-débit et les progrès en biologie du développement devraient permettre des avancées significatives, notamment grâce à l’identification des voies de signalisation importantes pour la différenciation des différentes cellules. En parallèle, les innovations de la bioingénierie ont permis la mise au point de plateformes microfluidiques, aussi appelées organes sur puce, intégrant des paramètres essentiels du microenvironnement cellulaire, tels que la compartimentalisation et l’application de contraintes de cisaillement. Différents points techniques restent néanmoins encore à approfondir, comme l’intégration de biomatériaux mimant la MBG. Les plateformes microfluidiques ont déjà été utilisées, notamment pour étudier la BFG. Les modèles actuels ont surtout servi à reproduire certaines situations pathologiques, comme les néphropathies hypertensive [
29
] et diabétique [
30
], ou certaines pathologies autoimmunes [
31
]. D’autres organes sur puce intégrant également la barrière intestinale ont été utilisés pour des études de néphrotoxicité [
32
]. Au-delà, la production de ce type de puces à grande échelle pourrait être une alternative intéressante, dans un avenir beaucoup plus lointain, aux techniques actuelles de suppléance rénale [
33
].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions l’UFR d’ingénierie de Sorbonne Université et la société francophone de Néphrologie, Dialyse et Transplantation pour le financement des stages de Mahamadou Dembele et de Marion Delafosse.
|
Footnotes |
1.
Satchell
SC
,
Braet
F
.
Glomerular endothelial cell fenestrations : an integral component of the glomerular filtration barrier.
.
Am J Physiol Ren Physiol.
2009;
;
296
:
:F947.
–
F956
.
2.
Halt
KJ
,
Pärssinen
HE
,
Junttila
SM
,
et al.
CD146
+
cells are essential for kidney vasculature development
.
.
Kidney Int.
2016;
;
90
:
:311.
–
324
.
3.
Hudson
BG
,
Tryggvason
K
,
Sundaramoorthy
M
,
et al.
Alport’s syndrome, Goodpasture’s syndrome, and type IV collagen.
.
N Engl J Med.
2003;
;
348
:
:2543.
–
2556
.
4.
Ronco
P
,
Debiec
H
.
Molecular pathogenesis of membranous nephropathy.
.
Annu Rev Pathol Mech Dis.
2020;
;
15
:
:287.
–
313
.
5.
Desideri
S
,
Onions
KL
,
Qiu
Y
,
et al.
A novel assay provides sensitive measurement of physiologically relevant changes in albumin permeability in isolated human and rodent glomeruli.
.
Kidney Int.
2018;
;
93
:
:1086.
–
1097
.
6.
Steichen
C
,
Giraud
S
,
Hauet
T
.
Les organoïdes rénaux.
.
Med/Sci (Paris).
2019;
;
35
:
:470.
–
477
.
7.
Takasato
M
,
Er
PX
,
Chiu
HS
,
et al.
Generation of kidney organoids from human pluripotent stem cells.
.
Nat Protoc.
2016;
;
11
:
:1681.
–
1692
.
8.
Homan
KA
,
Gupta
N
,
Kroll
KT
,
et al.
Flow-enhanced vascularization and maturation of kidney organoids in vitro.
.
Nat Methods.
2019;
;
16
:
:255.
–
262
.
9.
Hale
LJ
,
Howden
SE
,
Phipson
B
,
et al.
3D organoid-derived human glomeruli for personalised podocyte disease modelling and drug screening.
.
Nat Commun.
2018;
;
9
:
:5167.
.
10.
Yoshimura
Y
,
Taguchi
A
,
Tanigawa
S
,
et al.
Manipulation of Nephron-patterning signals enables selective induction of podocytes from human pluripotent stem cells.
.
J Am Soc Nephrol.
2019;
;
30
:
:304.
–
321
.
11.
Song
B
,
Smink
AM
,
Jones
C V
,
et al.
The directed differentiation of human ips cells into kidney podocytes.
.
PLoS One.
2012;
;
7
:
:e46453.
.
12.
Musah
S
,
Dimitrakakis
N
,
Camacho
DM
,
et al.
Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a glomerulus chip.
.
Nat Protoc.
2018;
;
13
:
:1662.
–
1685
.
13.
Hirschberg
R
,
Wang
S
,
Mitu
GM
.
Functional symbiosis between endothelium and epithelial cells in glomeruli.
.
Cell Tissue Res.
2008;
;
331
:
:485.
–
493
.
14.
Kitahara
T
,
Hiromura
K
,
Ikeuchi
H
,
et al.
Mesangial cells stimulate differentiation of endothelial cells to form capillary-like networks in a three-dimensional culture system.
.
Nephrol Dial Transplant.
2005;
;
20
:
:42.
–
49
.
15.
Essig
M
,
Dussaule
JC
,
Vandermeersch
S
,
et al.
Modulation by angiotensin ii of endothelial cell control of dna synthesis in human mesangial cells.
.
Nephron.
1997;
;
75
:
:303.
–
309
.
16.
Lennon
R
,
Hosawi
S
.
Glomerular cell crosstalk.
.
Curr Opin Nephrol Hypertens.
2016;
;
25
:
:187.
–
193
.
17.
Ebefors
K
,
Nyström
J
.
New insights into crosstalk in the kidney.
.
Curr Opin Nephrol Hypertens.
2017;
;
26
:
:143.
–
147
.
18.
Byron
A
,
Randles
MJ
,
Humphries
JD
,
et al.
Glomerular cell cross-talk influences composition and assembly of extracellular matrix.
.
J Am Soc Nephrol.
2014;
;
25
:
:953.
–
966
.
19.
Perry
G
,
Xiao
W
,
Welsh
GI
,
et al.
Engineered basement membranes : from in vivo considerations to cell-based assays.
.
Integr Biol.
2018;
;
10
:
:680.
–
695
.
20.
Li
M
,
Corbelli
A
,
Watanabe
S
,
et al.
Three-dimensional podocyte-endothelial cell co-cultures : assembly, validation, and application to drug testing and intercellular signaling studies.
.
Eur J Pharm Sci.
2016;
;
86
:
:1.
–
12
.
21.
Flegeau
K
,
Rubin
S
,
Mucha
S
, et al.
Towards an in vitro model of glomerular barrier unit with an innovative bioassembly method.
.
Nephrol Dial Transplant.
.
2019;
;
34
:
:ii1.
-
42
.
22.
Hu
M
,
Azeloglu
EU
,
Ron
A
,
et al.
A biomimetic gelatin-based platform elicits a pro-differentiation effect on podocytes through mechanotransduction.
.
Sci Rep.
2017;
;
7
:
:43934.
.
23.
Slater
SC
,
Beachley
V
,
Hayes
T
,
et al.
An in vitro model of the glomerular capillary wall using electrospun collagen nanofibres in a bioartificial composite basement membrane.
.
PLoS One.
2011;
;
6
:
:e20802.
.
24.
Korolj
A
,
Laschinger
C
,
James
C
,
et al.
Curvature facilitates podocyte culture in a biomimetic platform.
.
Lab Chip.
2018;
;
18
:
:3112.
–
3128
.
25.
Endlich
N
,
Kress
KR
,
Reiser
J
, et al.
Podocytes respond to mechanical stress in vitro.
.
J Am Soc Nephrol.
2001;
;
12
:
:413.
LP-22.
.
26.
Bevan
HS
,
Slater
SC
,
Clarke
H
,
et al.
Acute laminar shear stress reversibly increases human glomerular endothelial cell permeability via activation of endothelial nitric oxide synthase.
.
Am J Physiol Physiol.
2011;
;
301
:
:F733.
–
F742
.
27.
Friedrich
C
,
Endlich
N
,
Kriz
W
,
et al.
Podocytes are sensitive to fluid shear stress in vitro.
.
Am J Physiol Physiol.
2006;
;
291
:
:F856.
–
F865
.
28.
Arora
S
,
Lam
AJY
,
Cheung
C
,
et al.
Determination of critical shear stress for maturation of human pluripotent stem cell-derived endothelial cells towards an arterial subtype.
.
Biotechnol Bioeng.
2019;
;
116
:
:1164.
–
1175
.
29.
Zhou
M
,
Zhang
X
,
Wen
X
,
et al.
Development of a functional glomerulus at the organ level on a chip to mimic hypertensive nephropathy.
.
Sci Rep.
2016;
;
6
:
:31771.
.
30.
Wang
L
,
Tao
T
,
Su
W
,
et al.
A disease model of diabetic nephropathy in a glomerulus-on-a-chip microdevice.
.
Lab Chip.
2017;
;
17
:
:1749.
–
1760
.
31.
Petrosyan
A
,
Cravedi
P
,
Villani
V
,
et al.
A glomerulus-on-a-chip to recapitulate the human glomerular filtration barrier.
.
Nat Commun.
2019;
;
10
:
:3656.
.
32.
Li
Z
,
Su
W
,
Zhu
Y
,
et al.
Drug absorption related nephrotoxicity assessment on an intestine-kidney chip.
.
Biomicrofluidics.
2017;
;
11
:
:034114.
.
33.
Ashammakhi
N
,
Wesseling-Perry
K
,
Hasan
A
,
et al.
Kidney-on-a-chip : untapped opportunities.
.
Kidney Int.
2018;
;
94
:
:1073.
–
1086
.
34.
Fish
AJ
,
Michael
AF
,
Vernier
RL
,
et al.
Human glomerular cells in tissue culture.
.
Lab Invest.
1975;
;
33
:
:330.
–
341
.
35.
Striker
GE
,
Soderland
C
,
Bowen-Pope
DF
,
et al.
Isolation, characterization, and propagation in vitro of human glomerular endothelial cells.
.
J Exp Med.
1984;
;
160
:
:323.
–
328
.
36.
Saleem
MA
,
O’Hare
MJ
,
Reiser
J
,
et al.
A conditionally immortalized human podocyte cell line demonstrating nephrin and podocin expression.
.
J Am Soc Nephrol.
2002;
;
13
:
:630.
–
638
.
37.
Satchell
SC
,
Tasman
CH
,
Singh
A
,
et al.
Conditionally immortalized human glomerular endothelial cells expressing fenestrations in response to VEGF.
.
Kidney Int.
2006;
;
69
:
:1633.
–
1640
.
38.
Da
Sacco S
,
Lemley
K V.
,
Sedrakyan
S
,
et al.
A novel source of cultured podocytes.
.
PLoS One.
2013;
;
8
:
:1.
–
15
.
39.
Taguchi
A
,
Nishinakamura
R
.
Higher-order kidney organogenesis from pluripotent stem cells.
.
Cell Stem Cell.
2017;
;
21
:
:730.
–
746e6
.
40.
Randles
MJ
,
Collinson
S
,
Starborg
T
,
et al.
Three-dimensional electron microscopy reveals the evolution of glomerular barrier injury.
.
Sci Rep.
2016;
;
6
:
:35068.
.
|