| |
| Med Sci (Paris). 37(2): 192–193. doi: 10.1051/medsci/2020284.
Une signalisation lysosomale permet un dialogue inter-organites améliorant l’activité métabolique, l’homéostasie redox et augmentant la longévité chez
Caenorhabditis elegans
Assaf Alassaf1* and Bernard Mignotte2,3** 1M1 Biologie Santé, Université Paris-Saclay
,
91405Orsay
,
France 2Université Paris-Saclay, UVSQ, LGBC
,
78000
,
Versailles
,
France 3École pratique des hautes études, PSL University
,
75014
,
Paris
,
France MeSH keywords: Animaux, Caenorhabditis elegans, Protéines de Caenorhabditis elegans, Homéostasie, Triacylglycerol lipase, Longévité, Lysosomes, Mitochondries, Chaperons moléculaires, Oxydoréduction, Stress oxydatif, Espèces réactives de l'oxygène, Facteurs de transcription, métabolisme, physiologie |
L’activité métabolique joue un rôle clé dans l’homéostasie cellulaire et sa dérégulation est à l’origine d’une grande variété de maladies. Les lysosomes et les mitochondries sont des organites cellulaires très actifs, impliqués dans le maintien de l’homéostasie métabolique. Les lysosomes contiennent diverses enzymes hydrolytiques capables de digérer des protéines et des lipides, ce qui permet de recycler les constituants cellulaires, contribuant ainsi au maintien de cette homéostasie cellulaire. Dans les mitochondries, se produit la b-oxydation qui correspond à la principale voie catabolique des acides gras pour produire, d’une part, de l’acétyl-CoA, dont le groupe acétyle est oxydé par le cycle de l’acide citrique et, d’autre part, du NADH (forme réduite du nicotinamide adénine dinucléotide) et du FADH2 (forme réduite du flavine adénine dinucléotide), dont les électrons alimentent la chaîne respiratoire qui contribue à la production de formes réactives de l’oxygène (FRO). Les FRO sont responsables notamment de l’oxydation des acides nucléiques, des protéines et des lipides, ce qui a pour conséquence une grande variété de lésions dans l’ADN. Les mutations ainsi induites peuvent avoir un impact sur la longévité. Le nématode
Caenorhabditis elegans
constitue un des organismes modèles de choix pour l’étude du vieillissement et de la longévité, notamment en raison de sa facilité d’élevage et sa longévité réduite [
1
] (
→
).
(→) Voir la Synthèse (série
Modèles alternatifs
) de R. Litke
et al
.,
m/s
n° 6-7, juin-juillet 2018, page 571
Une récente étude de Ramachandran
et al
. parue dans
Developmental Cell
[
2
], réalisée chez cet organisme, a démontré qu’une voie de signalisation impliquant la LIPL-4 (lipase lysosomale 4) et la LBP-8 (
lipid-binding protein 8
), une protéine qui fixe des lipides digérés par les lipases, est impliquée dans le contrôle de la longévité. Cette étude met en évidence une relation entre la dégradation des lipides au niveau du lysosome et la production mitochondriale de FRO. Cette signalisation lysosomale augmente la longévité ainsi que l’adaptation au stress oxydant chez
C. elegans
.
|
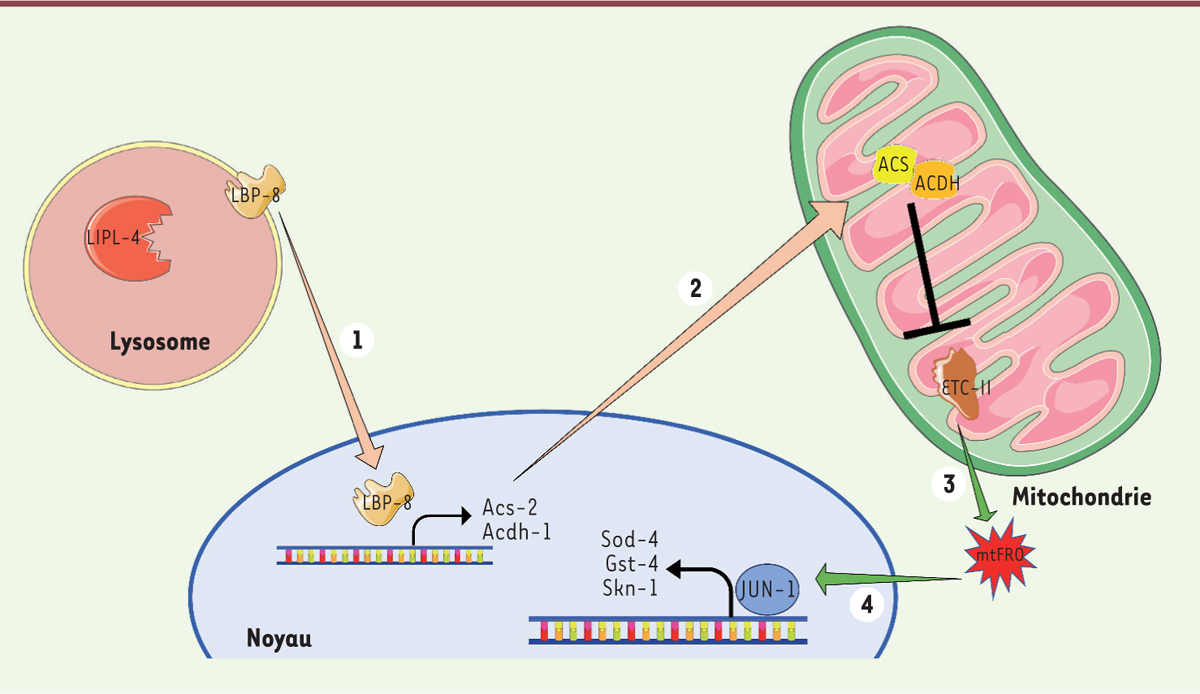
L’activation de la voie de signalisation lysosomale LIPL-4-LBP-8 mobilise les acides gras via une stimulation de la b-oxydation mitochondriale et augmente la longévité
L’induction de la lipolyse lysosomale par la surexpression constitutive de la lipase LIPL-4 dans un modèle transgénique de
C. elegans
déclenche la translocation nucléaire de la chaperonne lipidique LBP-8. Celle-ci active la transcription des gènes
acs-2
(codant l’acétyl-CoA synthétase) et
acdh-1
(codant l’acétyl-CoA déshydrogénase), facteurs clés de la b-oxydation mitochondriale [
3
]. Ainsi, l’activation de la voie de signalisation lysosomale LIPL-4-LBP-8 stimule la b-oxydation mitochondriale, une étape essentielle du catabolisme lipidique qui décompose les molécules d’acides gras pour générer de l’acétyl-CoA entrant dans le cycle de l’acide citrique. En réalisant, dans ce modèle de
C. elegans
surexprimant LIPL-4, une mesure de la teneur en acide gras par spectrométrie Raman (une méthode non destructive d’observation et de caractérisation de la composition moléculaire d’un échantillon), Ramachandran
et al
. ont démontré que l’augmentation de la b-oxydation mitochondriale a pour conséquence de diminuer la teneur en acides gras dans l’intestin, qui est le principal tissu adipeux de
C. elegans
, et est associée à une augmentation de la longévité de l’organisme.
|
La voie de signalisation lysosomale LIPL-4-LBP-8 inhibe le complexe II de la chaîne respiratoire, induit la production de FRO mitochondriaux et améliore la tolérance au stress oxydant via JUN-1
Ramachandran
et al.
ont également montré par spectrophotométrie que l’augmentation de l’activité de la b-oxydation inhibe spécifiquement le complexe II (succinate déshydrogénase) de la chaîne d’oxydoréduction mitochondriale, ce qui aboutit à la production de FRO mitochondriaux [
4
]. Suite à cette production de FRO, des gènes impliqués dans la réponse au stress sont activés, tels que
JUN-1
. La protéine JUN s’hétèrodimérise avec c-Fos pour former AP1 (
activator protein 1
), un facteur de transcription de la voie JNK (
c-Jun N-terminal kinase
). AP1 permet la régulation de l’expression de gènes impliqués dans la réponse au stress oxydant tels que les gènes
Sod-4
(codant la superoxyde dismutase),
Gst-4
(codant la glutathione S-transférase) et
Skn
(codant la protéine
skinhead-1
). Ainsi, en modulant l’activité de la succinate déshydrogénase et, par conséquent, le couplage métabolique entre la b-oxydation mitochondriale et les activités de la chaîne respiratoire, la voie de signalisation lysosomale LIPL-4-LBP-8 interagit avec la chaîne d’oxydoréduction mitochondriale pour moduler l’expression de gènes impliqué dans la résistance au stress oxydant
(
Figure 1
)
.
 | Figure 1.
La modulation de l’expression génique par la signalisation lysosomale LIPL-4-LBP-8 induit une adaptation au stress oxydant et une augmentation de la longévité chez
C. elegans
. La signalisation LIPL-4-LBP-8 induit une activation des gènes
Acs-2
et
Acdh-1
(1)
qui conduit à une inhibition du complexe II de la chaine de transfert d’électrons (ETC-II)
(2)
. L’inhibition du complexe II induit la production de mtFRO (formes réactives de l’oxygène mitochondriales)
(3)
. Les mtFRO conduisent à leur tour à l’activation de la voie de signalisation JNK
(4)
qui contribue à l’adaptation au stress oxydant, et ainsi à l’augmentation de la longévité.
Acs-2
: gène codant l’acétyl-Coa synthétase (ACS) ;
Acdh-1
: gène codant l’acétyl-Coa déshydrogénase (ACDH) ;
Sod-4
: gène codant la superoxide dismutase ;
Gst-4
: gène codant la glutathion S-transférase ;
Skn
: gène codant la protéine skinhead-1.
|
|
La régulation de la b-oxydation par la voie de signalisation lysosomale LIPL-4-LBP-8 augmente la production des FRO, ce qui induit des voies de signalisation impliquées dans l’adaptation au stress oxydant telles que les voies dans lesquelles les facteurs de transcription HIF ou JNK ont un rôle important [
5
]. Or, l’activation de la voie de signalisation JNK est un mécanisme clé en réponse aux FRO, mécanisme qui protège les cellules contre les dommages oxydatifs et favorise la longévité chez
C. elegans
[
6
]. L’ensemble de ces résultats conduisent à proposer un mécanisme moléculaire par lequel les lipides lysosomaux régulent l’activité mitochondriale et activent ainsi une signalisation qui améliore l’homéostasie métabolique et redox, ce qui conduit à une augmentation de la longévité. Ainsi, le bon fonctionnement du dialogue entre les voies de signalisation lysosomale et mitochondriale est crucial pour l’homéostasie redox et métabolique et constitue un facteur de longévité.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Litke
R
,
Boulanger
E
,
Fradin
C
.
Caenorhabditis elegans, un modèle d’étude du vieillissement.
.
Med Sci (Paris).
2018;
;
34
:
:571.
–
579
.
2.
Ramachandran
PV
,
Savini
M
,
Folick
AK
,
et al.
Lysosomal signaling promotes longevity by adjusting mitochondrial activity.
.
Dev Cell.
2019;
;
48
:
:685.
–
96.e5
.
3.
Folick
A
,
Oakley
HD
,
Yu
Y
,
et al.
Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans.
.
Science.
2015;
;
347
:
:83.
–
86
.
4.
Bezawork-Geleta
A
,
Rohlena
J
,
Dong
L
,
et al.
Mitochondrial complex II: at the crossroads.
.
Trends Biochem Sci.
2017;
;
42
:
:312.
–
325
.
5.
Hwang
AB
,
Lee
SJ
.
Regulation of life span by mitochondrial respiration: the HIF-1 and ROS connection.
.
Aging.
2011;
;
3
:
:304.
–
310
.
6.
Wang
MC
,
Bohmann
D
,
Jasper
H
.
JNK Signaling confers tolerance to oxidative stress and extends lifespan in Drosophila.
.
Dev Cell.
2003;
;
5
:
:811.
–
816
.
|