| |
| Med Sci (Paris). 37(2): 152–158. doi: 10.1051/medsci/2020278.Dernières nouvelles du chromosome X Des principes généraux nuancés Madeleine Moscatelli1 and Claire Rougeulle1* 1Université de Paris, Épigénétique et Destin Cellulaire, CNRS
,
F-75006Paris
,
France |
Vignette (Photo © Inserm/Heard, Edith/Institut Curie).
Chez les mammifères, l’unique différence entre les mâles et les femelles d’un point de vue génétique se situe au niveau de la 23
e
paire de chromosomes, les chromosomes sexuels X et Y. Chez les femelles, la présence de deux copies du chromosome X (XX) par rapport au mâle (XY) est compensée, très tôt au cours du développement de l’embryon, par l’inactivation d’un des deux X – c’est-à-dire que la quasi-totalité des gènes du chromosome ainsi inactivé ne s’exprime plus. Cet état silencieux est ensuite maintenu, de manière stable et pourtant réversible, dans toutes les cellules de l’organisme (à l’exception des cellules sexuelles qui ne seront pas discutées ici). Ce processus d’inactivation du chromosome X (ICX) constitue un paradigme de régulation épigénétique qui implique un traitement différent de deux chromosomes homologues au sein d’un même noyau cellulaire. L’hypothèse de l’inactivation du X a été proposée au début des années 1960 par Mary Lyon, une éminente généticienne britannique [
1
] (
→
).
(→) Voir le Forum de J. L. Guenet
et al
.,
m/s
n° 6-7, juin-juillet 2015, page 687
L’étude de ce processus, principalement chez la souris, a, depuis, permis d’en comprendre les principes généraux mais aussi les mécanismes moléculaires. Plus récemment, les progrès techniques et l’analyse d’autres espèces, l’homme en particulier, ont contribué à compléter et préciser nos connaissances sur l’ICX. Ces nouvelles données nous conduisent aujourd’hui à revisiter et nuancer certains des principes généraux initialement établis. |
Principe n° 1 : en présence de XIST, l’inactivation se déclenchera XIST, l’ARN aux multiples facettes, chef d’orchestre de l’inactivation du X
L’inactivation du chromosome X est sous le contrôle d’une région du chromosome X, le centre d’inactivation (
X inactivation center
,
XIC)
, dont l’une des particularités est d’inclure de nombreux gènes ne codant pas des protéines
(
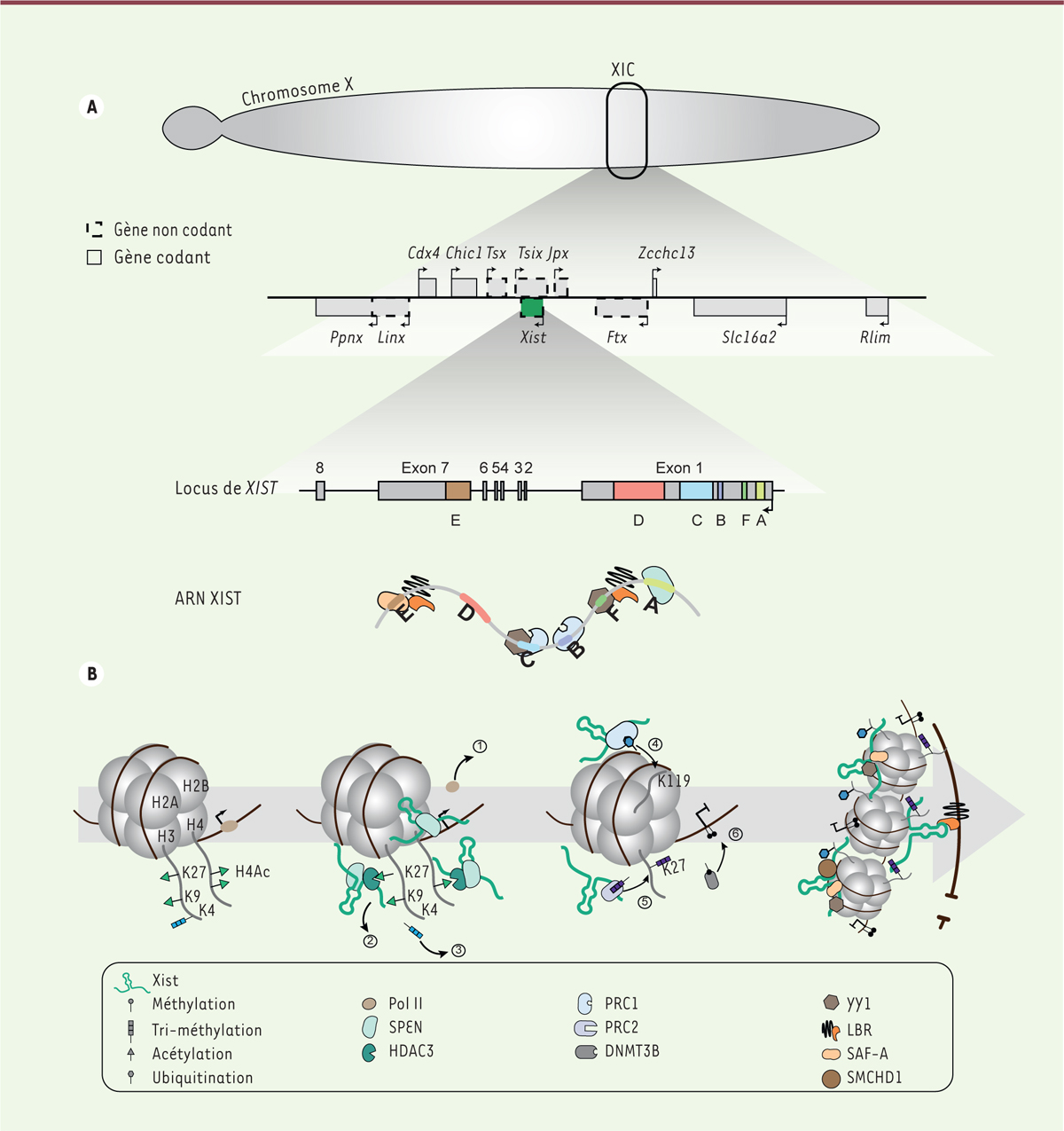
Figure 1A
)
. Parmi ceux-ci,
XIST (X-inactive specific transcript)
est l’acteur principal de ce processus ; sa transcription conduit à la synthèse d’un long ARN non-codant (lARNnc) qui s’accumule dans le noyau autour du chromosome X dont il est issu.
XIST
est présent uniquement chez les euthériens (ou mammifères placentaires) et sa séquence est peu conservée d’une espèce à l’autre, à l’exception des régions A à F, riches en répétitions en tandem
(
Figure 1A
)
, et qui jouent chacune un rôle dans la localisation de l’ARN XIST ou dans l’extinction des gènes.
Via
de multiples interactions ribonucléoprotéiques, notamment au niveau de ces régions [
2
-
4
]
(
Figure 1A
)
, XIST est à l’origine de la série de bouleversements, dont la cinétique et les mécanismes sont progressivement élucidés, qui mènent à la formation d’un compartiment chromosomique réprimé.
 | Figure 1.
XIST et la mise en place de l’inactivation d’un des deux chromosomes X chez la souris. A.
Panneau du haut : zoom sur le centre d’inactivation du chromosome X de la souris, où sont représentés les gènes codants (traits pleins) et les gènes non codants (pointillés) dont
XIST
(en vert). Panel du milieu : zoom sur la structure du gène de
XIST
chez la souris, avec les exons (de 1 à 8) représentés par les rectangles gris et les introns par une ligne noire. Les éléments répétés annotés de A à F sont représentés en couleurs. Panneau du bas : représentation schématique de l’ARN XIST avec ses partenaires protéiques.
B.
Représentation schématique, au niveau d’un nucléosome, de la cinétique d’inactivation du chromosome X. Avant l’inactivation, les marques activatrices H3K27ac, H3K9ac, H3K4me3, H4ac ainsi que l’ARN polymérase II (Pol II) sont présentes sur le chromosome X. L’expression de XIST et son interaction avec SPEN conduit à (1) l’expulsion de la Pol II, (2) au recrutement de HDAC3 et à la déacétylation des histones 3 et 4, (3) la perte de la marque H3K4me3. (4) L’interaction de XIST avec PRC1 permet l’apposition de la marque répressive H2AK119ub, (5) puis de la marque H3K27me3 par PRC2 ; (6) enfin, DNMT3B catalyse la méthylation de l’ADN. La localisation de XIST au niveau du X inactif se fait par le biais des protéines SAF-A et YY1. Enfin, les protéines SMCHD1 et LBR entraînent, respectivement, une réorganisation topologique du X inactif et sa localisation en périphérie du noyau cellulaire.
|
Parmi les premiers changements, l’interaction entre la région A de XIST et le co-répresseur SPEN (
split-ends
), un effecteur majeur de l’inactivation, conduit, successivement, au recrutement de SPEN sur les promoteurs actifs et les séquences
enhancers
du chromosome X ciblé, puis à l’exclusion de la machinerie de transcription (ARN polymérase II et facteurs généraux) et donc à l’extinction de la transcription des gènes du chromosome [
3
,
5
,
6
]. Par ailleurs, SPEN, formant un complexe avec HDAC3 (histone déacétylase 3), entraîne la déacétylation des histones 3 (H3) et 4 (H4), puis la perte d’autres marques de chromatine active, telles que la di- ou triméthylation de la lysine 4 de l’histone H3 (H3K4me2/3) [
6
,
7
]. Le recrutement successif de deux autres complexes chromatiniens répresseurs de type Polycomb, PRC1 (
polycomb repressive complex
) par les régions B et C de XIST [
8
,
9
] puis PRC2, conduit respectivement à l’apposition des marques répressives H2AK119ub (monoubiquitination de l’histone H2A sur la lysine 119) et H3K27me3 (triméthylation de la lysine 27 de l’histone H3) [
7
,
10
]. Plus tardivement, les îlots CpG des promoteurs des gènes du X inactif (Xi) sont méthylés par l’ADN méthyltransférase DNMT3B (
DNA méthyltransferase 3 B
) [
11
]
(
Figure 1B
)
.
L’inactivation du X s’accompagne également d’une réorganisation globale de l’architecture du chromosome dans l’espace nucléaire qui fait intervenir la protéine structurale SMCHD1 (
structural maintenance of chromosomes flexible hinge domain containing 1
) [
12
], aussi impliquée dans la méthylation de certaines régions du Xi [
11
]. De plus, l’interaction de la protéine LBR (
lamina B receptor
) avec l’ARN XIST pourrait permettre d’ancrer le chromosome Xi à la périphérie du noyau et ainsi contribuer à sa répression [
3
,
13
], mais cela est encore débattu [
14
]. Par ailleurs, la localisation de l’ARN XIST sur le chromosome impliquerait à la fois des interactions entre les régions C et F de XIST, d’une part, et E, d’autre part, avec, respectivement, le facteur de transcription YY1 [
15
] et la protéine de matrice nucléaire SAF-A (
scaffold attachment factor A
) [
16
]
(
Figure 1B
)
.
Par les remaniements qu’il engendre, XIST est l’initiateur principal de l’ICX lors de l’embryogénèse précoce. Des éléments régulateurs, en particulier au sein du
XIC
, assurent une expression correcte de
XIST,
c’est-à-dire chez les femelles exclusivement, à partir d’un seul des deux chromosomes X et à une période précise du développement embryonnaire. Cette régulation fine de l’expression et de la localisation de XIST est fondamentale puisque l’absence d’expression de XIST au cours du développement entraîne la létalité des embryons femelles [
17
], et dans la mesure où XIST est potentiellement capable d’inactiver, avec plus ou moins d’efficacité, n’importe quel chromosome dans lequel il a été introduit artificiellement. Cette « propriété » a été élégamment exploitée pour rendre non-fonctionnel un des trois chromosomes 21 dans des cellules issues de patients atteints de trisomie, atténuant ainsi,
in vitro
, certains phénotypes moléculaires associés au syndrome de Down [
18
]. Cependant, le contexte est important, l’inactivation ne pouvant se mettre en place que dans certaines situations développementales ou de différenciation cellulaire [
19
].
Découplage entre accumulation de XIST et inactivation chromosomique : le cas du développement précoce humain
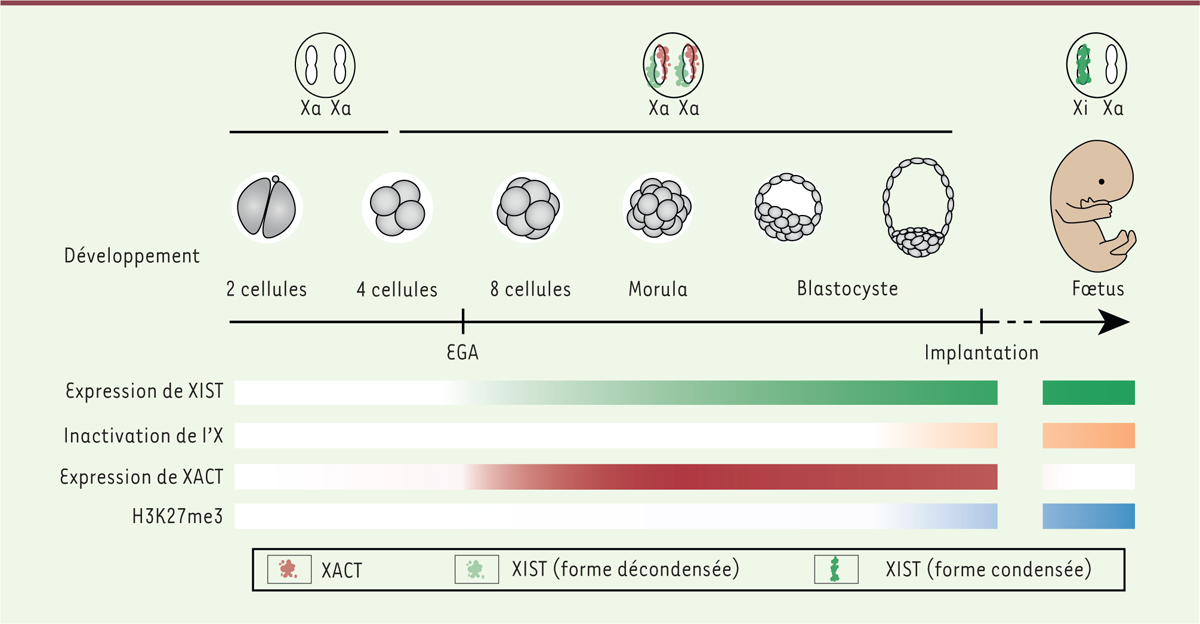
L’analyse de la cinétique d’inactivation du X et du rôle de XIST chez la souris montrent que l’accumulation de XIST lors du développement embryonnaire précoce entraîne l’inactivation du chromosome concerné. Ce couplage ne semble cependant pas systématiquement transposable aux autres espèces de mammifères chez lesquels différentes stratégies semblent à l’œuvre, dans l’espèce humaine notamment
(
Figure 2
)
. Si, comme chez la souris, l’expression de
XIST
chez l’homme est initiée très rapidement après la fécondation, dès l’activation du génome zygotique, cette expression est détectable chez les embryons mâles [
20
] et l’ARN XIST s’accumule au niveau des deux chromosomes X chez les femelles [
21
]. Plus surprenant encore, ces chromosomes couverts par XIST restent actifs [
21
-
23
]. Ainsi, durant le développement pré-implantatoire humain, l’accumulation de XIST n’entraîne ni l’apposition de marques répressives (H3K27me3), ni l’inactivation massive des chromosomes
(
Figure 2
)
. L’hypothèse d’un mécanisme alternatif et transitoire de compensation de dose, faisant intervenir une atténuation globale du niveau d’expression des gènes des deux chromosomes X, a été proposée [
22
]. Ce modèle controversé s’oppose à celui d’une initiation partielle de l’inactivation de certains gènes entre le jour 5 et le jour 6 du développement embryonnaire [
23
,
24
]. La limitation de l’accès aux stades péri- et post-implantatoires empêche, pour l’instant, de répondre à l’ensemble des questions concernant la mise en place de l’inactivation du X chez l’homme. Le développement de procédures pour cultiver des embryons jusqu’au jour 14 du développement devrait permettre de lever ces interrogations, au moins partiellement. Les premières analyses suggèrent une mise en place tardive et graduelle [
25
], confirmant ainsi l’important décalage entre la présence de XIST et la répression du chromosome X lors de l’embryogenèse humaine.
 | Figure 2.
Inactivation du chromosome X au cours du développement humain.
Aux stades 4-8 cellules, XIST (en vert) et XACT (en rouge) sont exprimés simultanément et recouvrent les deux chromosomes X sur des territoires bien distincts ; cependant, les deux chromosomes X sont toujours actifs (Xa). L’inactivation du chromosome X se met en place plus tardivement lors du développement embryonnaire (en orange), concomitamment à l’enrichissement de la marque épigénétique répressive H3K27me3 (en bleu). Notons que les cinétiques exactes qui aboutissent, dans le fœtus, à l’accumulation de XIST et à l’inactivation aléatoire d’un des deux chromosome X restent à préciser.
|
Qui pour contrecarrer l’action de XIST ?
Plusieurs hypothèses peuvent être proposées pour expliquer l’absence d’inactivation des chromosomes X en présence de XIST durant le développement précoce humain. L’une implique les effecteurs de XIST, dont on connait peu de choses chez l’homme, mais qui pourraient être absents, non fonctionnels ou incapables d’interagir avec XIST. Selon une hypothèse alternative, un mécanisme antagoniste empêcherait XIST d’inactiver les chromosomes X. En accord avec ce modèle, le nuage que forme XIST à ces stades paraît plus dispersé que dans les cellules somatiques présentant un chromosome Xi [
23
]
(
Figure 2
)
. Ceci suggère que l’ARN XIST ne peut, à ce stade, interagir avec le chromosome X et/ou que celui-ci est réfractaire à l’action de XIST. XACT (
X active coating transcript)
, un lARNnc également codé par le chromosome X, pourrait entrer en compétition avec XIST lors des premiers stades du développement. D’évolution récente puisque présent uniquement chez les hominoïdes
1,
,
XACT
est exprimé principalement dans les embryons préimplantatoires et dans les cellules souches embryonnaires humaines (CSEh) qui en dérivent [
23
,
26
,
27
] (
→
).
(
→
) Voir la Dernière heure de C. Vallot et C. Rougeulle, m/s n° 2, février 2013, page 253
L’expression de
XACT
, qui débute de manière concomitante à celle de
XIST
après la fécondation, est régulée par les facteurs de pluripotence (SOX2 [
sex-determining region Y-box2
], NANOG [
Nanog homebox
], OCT4 [
octamer-binding protein
]) [
28
]. Propriété la plus marquante, l’ARN XACT s’accumule simultanément à XIST au niveau des deux chromosomes X actifs (Xa) durant les premiers stades du développement [
26
,
27
]. Les molécules XIST et XACT occupent cependant des territoires bien distincts qui ne se chevauchent pas [
23
]
(
Figure 2
)
. Dans une première étude fonctionnelle de
XACT
utilisant des cellules souches embryonnaires de souris qui modélisent la mise en place de l’inactivation lors de la différenciation, le locus
XACT
a été artificiellement intégré sur l’un des deux chromosomes X murins. Alors que l’inactivation du X est normalement aléatoire (touchant l’un ou l’autre des chromosomes X avec une égale probabilité), dans ces cellules transgéniques, la présence de
XACT
tend à empêcher l’accumulation de
XIST
sur le chromosome modifié et donc son inactivation [
23
]. Cette expérience renforce l’hypothèse selon laquelle XACT pourrait avoir un rôle antagoniste à XIST en affectant son accumulation et/ou sa fonction. Cette hypothèse nécessite désormais d’être testée dans un contexte plus physiologique.
|
Principe n° 2 : l’inactivation du chromosome X, chez l’adulte, stable, elle sera Stabilité et maintien de l’état inactif
L’état inactif du chromosome X, qui s’installe avant que l’embryon ne soit totalement formé, persiste tout au long de la vie intra-utérine et post-natale. C’est donc un état extrêmement stable qui, en théorie, est maintenu indépendamment du signal de départ, donc de la présence de l’ARN XIST [
19
,
29
]. Cependant, des données récentes conduisent à remettre en question ce principe et à s’interroger sur le rôle de XIST dans le maintien de l’inactivation, notamment dans le système hématopoïétique et dans certains cancers.
Par ailleurs, environ 20 % des gènes du X (5 % chez la souris) échappent à l’inactivation, soit de façon constitutive, dans l’ensemble des tissus, soit, de façon spécifique, dans certains types cellulaires [
30
]. L’impact de ce processus d’échappement n’est pas encore établi, mais il pourrait contribuer au dimorphisme sexuel [
30
].
Le système immunitaire : l’exception qui confirme la règle ?
Le lignage hématopoïétique est un système bien caractérisé dans lequel des cellules souches adultes assurent, par différentes voies de différenciation, la genèse de l’ensemble des cellules sanguines. Il joue un rôle essentiel, aussi bien dans le transport de l’oxygène que dans l’immunité et dans la distinction entre le soi et le non-soi. Mais une observation est intrigante : les femmes ont une réponse immunitaire accrue à certaines infections
2
par rapport aux hommes. Elles sont aussi plus susceptibles de développer des maladies auto-immunes, suggérant un système immunitaire globalement plus réactif [
31
]. Le chromosome X est porteur de nombreux gènes aux fonctions cruciales dans la régulation des mécanismes immunitaires [
31
]. Le processus d’inactivation du X pourrait donc participer à ce dimorphisme sexuel immunitaire.
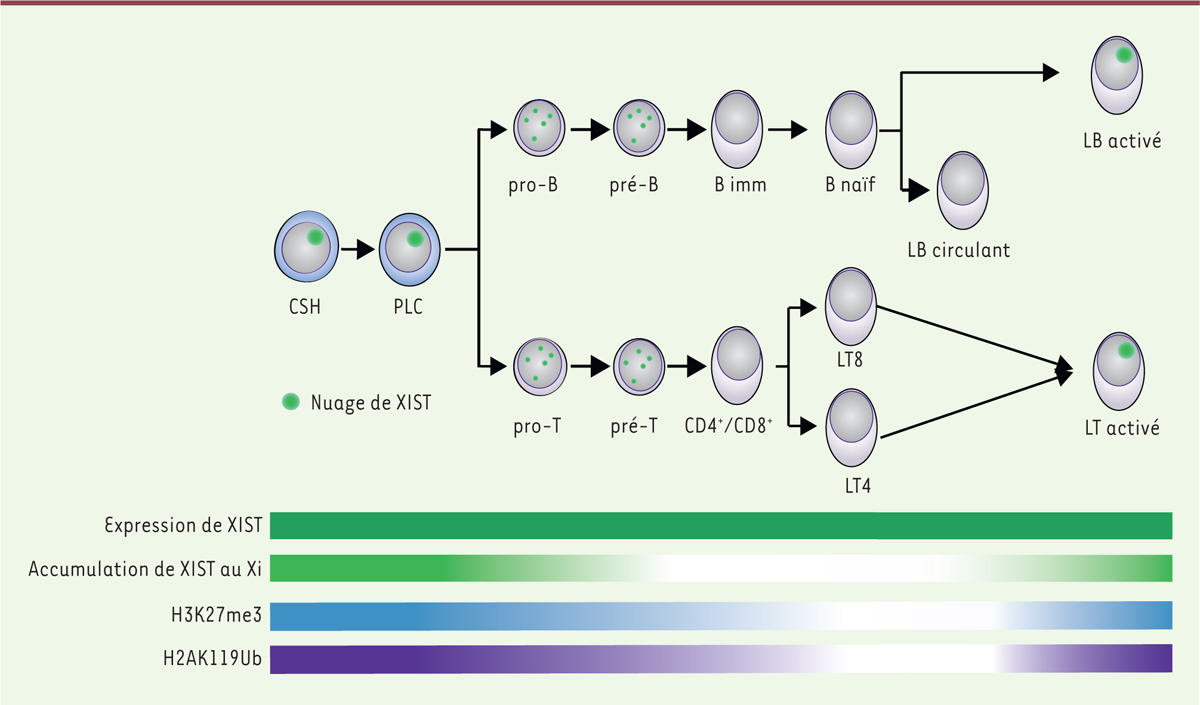
Le chromosome Xi présente en effet des caractéristiques particulières dans certaines cellules du lignage hématopoïétique qui suggèrent une dynamique de régulation de l’état inactif spécifique de ce lignage adulte
(
Figure 3
)
[
32
]. Lors de la différenciation des lymphocytes B et T, l’ARN XIST se délocalise progressivement et transitoirement du Xi, tout en restant présent dans le noyau. Le paysage chromatinien du Xi est également modifié : la perte de XIST est associée à la disparition des marques chromatiniennes répressives H3K27me3 et H2AK119ub. Cependant, lorsque les lymphocytes sont activés, XIST recouvre à nouveau le Xi
(
Figure 3
)
[
32
]. Ces changements n’entraînent pas de réactivation globale du Xi, mais certains gènes, notamment des gènes jouant un rôle dans l’immunité, sont ré-exprimés [
32
]. Le gène codant le récepteur
Toll-like
TLR7 (
Toll-like receptor 7
), par exemple, échappe à l’ICX durant la différenciation des lymphocytes B. Il en est de même dans les macrophages et les cellules dendritiques qui l’expriment [
32
-
34
]. TLR7 est impliqué dans la détection d’ARN viral, et constitue l’un des facteurs clés du lupus érythémateux, une maladie auto-immune qui touche préférentiellement les femmes (80 % des cas). Ainsi, cette plasticité atypique de l’état inactif pourrait avoir des conséquences physiologiques à l’origine de dimorphismes sexuels.
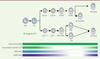 | Figure 3.
Dynamique de l’inactivation du chromosome X dans le lignage lymphoïde.
Au cours de la différenciation des progéniteurs lymphoïdes communs (PLC) en lymphocytes B et T, le nuage que forme XIST au Xi (en vert clair), ainsi que les marques répressives H3K27me3 (en bleu) et H2AK119ub (en violet) associées sont progressivement perdus, cependant l’expression de
XIST
reste inchangée (vert foncé). Lorsque les lymphocytes B et T sont activés, le nuage de XIST et les marques épigénétiques répressives sont à nouveau localisés au niveau du Xi. CSH : Cellule souche hématopoïétique ; pro-B/T : lymphocyte pro-B/T ; pré-B/T : lymphocyte pré-B/T ; B imm : lymphocyte B immature ; B naïf : lymphocyte B naïf ; LB circulant : lymphocyte B circulant ; CD4
+
/CD8
+
: précurseur lymphocytaire double positif ; LT4/8 : lymphocytes T CD4
+
/CD8
+
.
|
Inactivation du X et cancers
Des anomalies du Xi ont été mises en évidence dans certains contextes cancéreux. Par exemple, la perte de l’expression de
XIST
et de marques d’hétérochromatine associées au Xi est observée dans le cancer du sein [
35
]. Une perte totale du Xi, souvent accompagnée d’une duplication du Xa, est également décrite dans de nombreux types de cancers (cancer du sein, des ovaires) [
36
,
37
]. De ces processus résulte une expression accrue de gènes liés à l’X [
35
], en particulier des facteurs de croissance ou des oncogènes, dont la surexpression pourrait mener à une croissance cellulaire anormale. Cependant, il n’existe actuellement aucune preuve d’un lien causal entre anomalie d’inactivation du X et tumorigenèse, notamment dans l’espèce humaine. Chez la souris, la délétion de XIST dans les cellules souches hématopoïétiques entraîne, chez les femelles uniquement, le développement d’hémopathies malignes très agressives et associées à une surexpression de certains gènes du chromosome X [
38
]. Dans ce contexte,
XIST
a donc un rôle de suppresseur de tumeur. Cependant, le statut d’inactivation du X n’ayant pas été étudié en détail dans ces souris mutantes, la question de l’action de
XIST
sur le maintien de l’état inactif du chromosome X reste ouverte.
|
Des avancées majeures ont récemment révélé l’extraordinaire plasticité du processus d’inactivation du X et les particularités d’espèce et de contexte qui y sont associées. Les divers mécanismes d’action de
XIST
sont encore à explorer en détail, tant dans la mise en place du processus d’inactivation du X que dans son maintien, et plus généralement dans l’homéostasie cellulaire.
La découverte que, loin d’être figé, l’état du X inactif reste modulable, ouvre des perspectives d’étude du dimorphisme sexuel et des maladies qui y sont associées. Si la stabilité de l’inactivation a jusqu’alors été principalement étudiée dans le système immunitaire, il est intéressant de noter que le chromosome X porte un nombre important de gènes jouant un rôle dans des fonctions cérébrales et que des gènes échappant à l’inactivation sont impliqués dans des maladies, telles que l’autisme et l’épilepsie [
39
]. L’approfondissement de notre connaissance de la régulation et de la stabilité de l’inactivation du X chez l’adulte pourrait donc révéler de nouveaux mécanismes à l’origine de ces diverses maladies (cancer, autisme, épilepsie et maladies du système immunitaire) et, idéalement, nous permettre d’identifier des biomarqueurs et de nouvelles cibles thérapeutiques spécifiques.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions Pauline Andreu, Project Manager du Labex Who Am I?, ainsi que Céline Morey pour leurs relectures avisées du manuscrit. Nous remercions également la Ligue contre le Cancer qui soutient ce travail.
|
Footnotes |
1.
Guénet
JL
,
Panthier
JJ
,
Avner
P
,
et al.
L’héritage de Mary F. Lyon (1925–2014).
.
Med Sci (Paris).
2015;
;
31
:
:687.
–
689
.
2.
Chu
C
,
Zhang
QC
,
da Rocha
ST
,
et al.
Systematic discovery of Xist RNA binding proteins.
.
Cell.
2015;
;
161
:
:404.
–
416
.
3.
McHugh
CA
,
Chen
CK
,
Chow
A
,
et al.
The Xist lncRNA interacts directly with SHARP to silence transcription through HDAC3.
.
Nature.
2015;
;
521
:
:232.
–
236
.
4.
Minajigi
A
,
Froberg
J
,
Wei
C
,
et al.
Chromosomes. A comprehensive Xist interactome reveals cohesin repulsion and an RNA-directed chromosome conformation.
.
Science.
2015;
;
349
:
10.1126/science.aab2276 aab2276.
.
5.
Monfort
A
,
Di Minin
G
,
Postlmayr
A
,
et al.
Identification of spen as a crucial factor for Xist function through forward genetic screening in haploid embryonic stem cells.
.
Cell Rep.
2015;
;
12
:
:554.
–
561
.
6.
Dossin
F
,
Pinheiro
I
,
Żylicz
JJ
,
et al.
SPEN integrates transcriptional and epigenetic control of X-inactivation.
.
Nature.
2020;
;
578
:
:455.
–
60
.
7.
Żylicz
JJ
,
Bousard
A
,
Žumer
K
,
et al.
The implication of early chromatin changes in X chromosome inactivation.
.
Cell.
2019;
;
176
:
:182.
–
97.e23
.
8.
Bousard
A
,
Raposo
AC
,
Żylicz
JJ
,
et al.
The role of Xist-mediated Polycomb recruitment in the initiation of X-chromosome inactivation.
.
EMBO Rep.
2019;
;
20
:
:e48019.
.
9.
Pintacuda
G
,
Wei
G
,
Roustan
C
,
et al.
hnRNPK recruits PCGF3/5-PRC1 to the Xist RNA B-repeat to establish polycomb-mediated chromosomal silencing.
.
Mol Cell.
2017;
;
68
:
(955–969)
:e10.
.
10.
Almeida
M
,
Pintacuda
G
,
Masui
O
,
et al.
PCGF3/5-PRC1 initiates Polycomb recruitment in X chromosome inactivation.
.
Science.
2017;
;
356
:
:1081.
–
1084
.
11.
Gendrel
AV
,
Apedaile
A
,
Coker
H
,
et al.
Smchd1-dependent and independent pathways determine developmental dynamics of Cpg island methylation on the inactive X chromosome.
.
Dev Cell.
2012;
;
23
:
:265.
–
279
.
12.
Gdula
MR
,
Nesterova
TB
,
Pintacuda
G
,
et al.
The non-canonical SMC protein SmcHD1 antagonises TAD formation and compartmentalisation on the inactive X chromosome.
.
Nat Commun.
2019;
;
10
:
:30.
.
13.
Chen
CK
,
Blanco
M
,
Jackson
C
,
et al.
Xist recruits the X chromosome to the nuclear lamina to enable chromosome-wide silencing.
.
Science.
2016;
;
354
:
:468.
–
472
.
14.
Nesterova
TB
,
Wei
G
,
Coker
H
,
et al.
Systematic allelic analysis defines the interplay of key pathways in X chromosome inactivation.
.
Nat Commun.
2019;
;
10
:
:1.
–
15
.
15.
Jeon
Y
,
Lee
JT
.
YY1 Tethers Xist RNA to the inactive X nucleation center.
.
Cell.
2011;
;
146
:
:119.
–
133
.
16.
Yamada
N
,
Hasegawa
Y
,
Yue
M
,
et al.
Xist exon 7 contributes to the stable localization of Xist RNA on the inactive X-chromosome.
.
PLoS Genet.
2015;
;
11
:
:e1005430.
.
17.
Marahrens
Y
,
Panning
B
,
Dausman
J
,
et al.
Xist-deficient mice are defective in dosage compensation but not spermatogenesis.
.
Genes Dev.
1997;
;
11
:
:156.
–
166
.
18.
Czermin΄ski
JT
,
Lawrence
JB
.
Silencing trisomy 21 with XIST in neural stem cells promotes neuronal differentiation.
.
Dev Cell.
2020;
;
52
:
:294.
–
308.e3
.
19.
Wutz
A
,
Jaenisch
R
.
A shift from reversible to irreversible X inactivation is triggered during ES cell differentiation.
.
Mol Cell.
2000;
;
5
:
:695.
–
705
.
20.
Briggs
SF
,
Dominguez
AA
,
Chavez
SL
,
et al.
Single-cell XIST expression in human preimplantation embryos and newly reprogrammed female induced pluripotent stem cells: XIST in human preimplantation embryos and iPSCs.
.
Stem Cells.
2015;
;
33
:
:1771.
–
1781
.
21.
Okamoto
I
,
Patrat
C
,
Thépot
D
,
et al.
Eutherian mammals use diverse strategies to initiate X-chromosome inactivation during development.
.
Nature.
2011;
;
472
:
:370.
–
374
.
22.
Petropoulos
S
,
Edsgärd
D
,
Reinius
B
,
et al.
Single-cell RNA-Seq reveals lineage and X chromosome dynamics in human preimplantation embryos.
.
Cell.
2016;
;
165
:
:1012.
–
1026
.
23.
Vallot
C
,
Patrat
C
,
Collier
AJ
,
et al.
XACT noncoding RNA competes with XIST in the control of X chromosome activity during human early development.
.
Cell Stem Cell.
2017;
;
20
:
:102.
–
111
.
24.
Moreira de Mello
JC
,
Fernandes
GR
,
Vibranovski
MD
,
et al.
Early X chromosome inactivation during human preimplantation development revealed by single-cell RNA-sequencing.
.
Sci Rep.
2017;
;
7
:
:1.
–
12
.
25.
Zhou
F
,
Wang
R
,
Yuan
P
,
et al.
Reconstituting the transcriptome and DNA methylome landscapes of human implantation.
.
Nature.
2019;
;
572
:
:660.
–
664
.
26.
Vallot
C
,
Rougeulle
C
.
Inactivation du chromosome X chez l’humain: XACT et XIST, à chacun son chromosome.
.
Med Sci (Paris).
2013;
;
29
:
:223.
–
225
.
27.
Vallot
C
,
Huret
C
,
Lesecque
Y
,
et al.
XACT, a long noncoding transcript coating the active X chromosome in human pluripotent cells.
.
Nat Genet.
2013;
;
45
:
:239.
–
241
.
28.
Casanova
M
,
Moscatelli
M
,
Chauvière
LÉ
,
et al.
A primate-specific retroviral enhancer wires the XACT lncRNA into the core pluripotency network in humans.
.
Nat Commun.
2019;
;
10
:
:5652.
.
29.
Csankovszki
G
,
Panning
B
,
Bates
B
,
et al.
Conditional deletion of Xist disrupts histone macroH2A localization but not maintenance of X inactivation.
.
Nat Genet.
1999;
;
22
:
:323.
–
324
.
30.
Carrel
L
,
Brown
CJ
.
When the Lyon(ized chromosome) roars: ongoing expression from an inactive X chromosome.
.
Philos Trans R Soc Lond B Biol Sci.
2017;
;
372
:
31.
Libert
C
,
Dejager
L
,
Pinheiro
I
.
The X chromosome in immune functions: when a chromosome makes the difference.
.
Nat Rev Immunol.
2010;
;
10
:
:594.
–
604
.
32.
Syrett
CM
,
Anguera
MC
.
When the balance is broken: X-linked gene dosage from two X chromosomes and female-biased autoimmunity.
.
J Leukoc Biol.
2019;
;
106
:
:919.
–
932
.
33.
Souyris
M
,
Cenac
C
,
Azar
P
,
et al.
TLR7 escapes X chromosome inactivation in immune cells.
.
Sci Immunol.
2018;
;
3
:
:eaap8855.
.
34.
Souyris
M
,
Mejía
JE
,
Chaumeil
J
,
et al.
Female predisposition to TLR7-driven autoimmunity: gene dosage and the escape from X chromosome inactivation.
.
Semin Immunopathol.
2019;
;
41
:
:153.
–
164
.
35.
Chaligné
R
,
Popova
T
,
Mendoza-Parra
M-A
,
et al.
The inactive X chromosome is epigenetically unstable and transcriptionally labile in breast cancer.
.
Genome Res.
2015;
;
25
:
:488.
–
503
.
36.
Sirchia
SM
,
Tabano
S
,
Monti
L
,
et al.
Misbehaviour of XIST RNA in breast cancer cells.
.
PLoS One.
2009;
;
4
:
:e5559.
.
37.
Kawakami
T
,
Zhang
C
,
Taniguchi
T
,
et al.
Characterization of loss-of-inactive X in Klinefelter syndrome and female-derived cancer cells.
.
Oncogene.
2004;
;
23
:
:6163.
–
6169
.
38.
Yildirim
E
,
Kirby
JE
,
Brown
DE
,
et al.
Xist RNA is a potent suppressor of hematologic cancer in mice.
.
Cell.
2013;
;
152
:
:727.
–
742
.
39.
Fang
H
,
Disteche
CM
,
Berletch
JB
.
X Inactivation and escape: epigenetic and structural features.
.
Front Cell Dev Biol.
2019;
;
7
:
:219.
.
|