| |
| Med Sci (Paris). 37(2): 130–133. doi: 10.1051/medsci/2020276.Repenser la place des lymphocytes B et des structures lymphoïdes tertiaires dans l’immunothérapie des cancers Claire Germain,1 Hélène Kaplon,2 and Marie-Caroline Dieu-Nosjean3* 1Invectys-Cancer Immunotherapeutics
,
75013Paris
,
France
.
2Translational medicine department
, Institut de recherches internationales Servier
,
92150Suresnes
,
France
.
3Laboratoire Microenvironnement immunitaire et immunothérapie, UMRS 1135 Sorbonne Université, Inserm U1135, Centre d’immunologie et des maladies infectieuses (CIMI-Paris), Faculté de médecine Sorbonne Université
,
91 boulevard de l’Hôpital
,
75013Paris
,
France
.
MeSH keywords: Complexe antigène-anticorps, Lymphocytes B, Humains, Immunité cellulaire, Immunothérapie, Lymphocytes TIL, Oses, Tumeurs, Lymphocytes T, Structures lymphoïdes tertiaires, immunologie, physiologie, thérapie |
Des lymphocytes B aux structures lymphoïdes tertiaires
Les lymphocytes B ont suscité beaucoup de travaux portant sur leur capacité unique à produire, une fois différenciés en plasmocytes, des anticorps spécifiques d’une immense variété d’antigènes. Une fois fixées sur leur cible antigénique et outre leur capacité neutralisante, ces molécules vont activer des mécanismes effecteurs majeurs de la réponse immunitaire, incluant la phagocytose, l’endocytose, la cytotoxicité à médiation cellulaire dépendante des anticorps et celle dépendante du complément. Mais le rôle des lymphocytes B ne se limite pas à la production des anticorps. Au début des années 1980, il a été montré qu’ils servaient également de cellules présentatrices d’antigènes, conduisant à la formation de synapses immunologiques avec des lymphocytes T spécifiques,
via
la présentation de peptides antigéniques associés à des molécules du complexe majeur d’histocompatibilité de classe II, cette synapse étant renforcée par des interactions entre des molécules de co-stimulation et de signalisation. Ainsi, les lymphocytes B sont des acteurs pléiotropes du système immunitaire, avec cette capacité à activer à la fois des effecteurs de l’immunité innée et des effecteurs de l’immunité adaptative.
Malgré le rôle important des lymphocytes B dans l’élaboration de la réponse immunitaire, notamment contre des microorganismes pathogènes, leur rôle reste controversé dans le contexte du cancer. Un rôle pro-tumoral a été mis en avant, car les lymphocytes B peuvent sécréter des cytokines immunosuppressives (par exemple, IL[interleukine]-10 ou le TGF-β [
transforming growth factor beta
]) conduisant les lymphocytes T à un état d’anergie et peuvent aussi inhiber certains mécanismes de cytotoxicité
via
la production d’Ig(immunoglobuline)G4, ou encore bloquer la fonction des lymphocytes T en présence de certains médicaments utilisés en chimiothérapie comme l’oxaliplatine [
1
] (
→
).
(→) Voir la Synthèse de H. Kaplon et C. Dieu-Nosjean,
m/s
n° 1, janvier 2018, page 72
A contrario
, des fonctions anti-tumorales sont de plus en plus souvent rapportées dans la littérature scientifique. Les lymphocytes B, par leur production d’anticorps, sont à l’origine de la formation des complexes immuns (constitués par des complexes antigènes-anticorps de tailles plus ou moins importantes). Ils présentent des antigènes aux lymphocytes T, sécrètent des cytokines pro-inflammatoires (par exemple, le TNF-α [
tumor necrosis factor alpha
], l’IL-12, ou l’IFN-γ [interféron-gamma]). Ils activent également des mécanismes cytotoxiques
via
la sécrétion d’anticorps d’isotype IgG1 ou IgG3 spécifiques d’antigènes associés aux tumeurs, ou contribuent à l’élaboration de réponses immunitaires anti-tumorales
in situ
du fait de leur présence au sein d’organisations lymphoïdes ectopiques, appelées structures lymphoïdes tertiaires (
tertiary lymphoid structures
, TLS)
(
Figure 1
)
, que nous avons découvertes dans les tumeurs solides en montrant que leur présence était associée à un meilleur pronostic chez les patients opérés d’un cancer du poumon non-à petites cellules (
non-small cell-lung cancer
, NSCLC) [
2
].
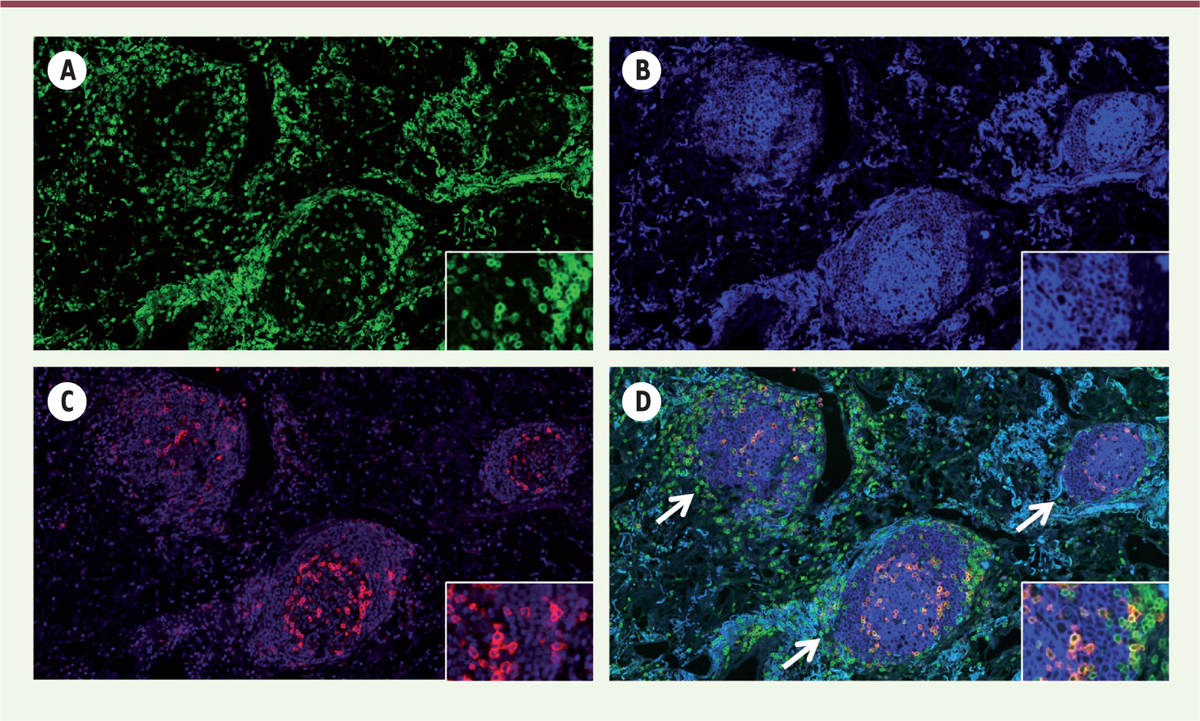
 | Figure 1.
Présence de structures lymphoïdes tertiaires dans les tumeurs pulmonaires humaines.
Triple marquage, par immunofluorescence, d’une coupe de tumeur pulmonaire humaine fixée et incluse en paraffine : CD3 (lymphocytes T) en vert
(A, D)
; CD20 (lymphocytes B) en bleu
(B, D)
; PD-1 en rouge
(C, D)
. Visualisation des marquages uniques
(A-C)
et du triple marquage
(D)
. Les flèches indiquent la présence de trois structures lymphoïdes tertiaires (tertiary lymphoid structures, TLS) dans le stroma tumoral. Grossissement : x 40. L’encart correspond à un agrandissement d’une zone d’une des TLS.
|
Deux aspects importants peuvent expliquer ce rôle ambivalent – pro-tumoral
versus
anti-tumoral – des lymphocytes B dans les cancers, au-delà des biais que les modèles animaux utilisés dans ces études pourraient avoir sur l’interprétation des résultats. En effet, la localisation et le statut d’activation (état au repos, non activé ou activé) des lymphocytes B dans leur microenvironnement tissulaire ont des conséquences majeures sur leur fonction, ces deux éléments étant intrinsèquement liés. En 2014, nous avons fait cette observation princeps qu’une forte densité de lymphocytes B intra-tumoraux organisés en TLS était associée à une survie plus longue des patients opérés d’un cancer du poumon de type NSCLC [
3
], une observation qui a par la suite été étendue à de nombreuses autres tumeurs solides : cancers du pancréas et de l’estomac, mélanome, sarcome, ou encore dans le cas des métastases ovariennes et hépatiques [
4
]. Tous les stades de différenciation du lymphocyte B sont détectés au sein des TLS, du lymphocyte B naïf au lymphocyte B mémoire et au plasmablaste. Au sein de ces structures, l’expression par les lymphocytes B de l’enzyme AID (
activation-induced cytidine deaminase
), associée à la présence d’hypermutations somatiques et à la commutation de classe des immunoglobulines, a également permis de révéler l’expansion clonale de ces lymphocytes B dans le mélanome et le cancer gastrique [
4
]. Par ailleurs, une augmentation de la clonalité des lymphocytes T CD4
+
a été montrée dans les tumeurs pulmonaires fortement infiltrées par des lymphocytes B, suggérant un dialogue fonctionnel entre les lymphocytes B et T CD4
+
organisés en TLS [
4
]. Ainsi, comme les lymphocytes T, les lymphocytes B infiltrant les tumeurs pourraient également jouer un rôle important dans l’élaboration des réponses anti-tumorales à médiation humorale et cellulaire lorsqu’ils sont organisés en TLS.
|
Des lymphocytes B aux biomarqueurs en cancérologie
À partir de ce postulat se pose alors la question de la valeur prédictive de la présence de cette population de cellules immunitaires pour la réponse à des traitements anti-cancéreux. Les différents effecteurs de la réponse immunitaire sont précisément au cœur des thérapies ciblant des points de contrôles immunitaires (
immune checkpoint
, ICP), auxquelles 20 à 30 % des patients cancéreux répondent favorablement de manière stable et durable, avec parfois cependant des effets secondaires qui peuvent être sévères. Deux questions se posent dans ce contexte : les patients dits « répondeurs » à ces traitements à base d’anticorps anti-ICP présentent-ils de fortes densités de TLS à l’issue de ces traitements ? L’analyse quantitative de la présence de TLS dans les tumeurs et de la composition cellulaire de ces TLS permet-elle de prédire quels patients seront répondeurs aux traitements ? Dans l’affirmative, une nouvelle question se pose : quels sont précisément les traitements concernés parmi l’arsenal d’anticorps et les diverses combinaisons thérapeutiques proposées ? Deux études antérieures avaient mis en évidence le fait que des patients répondeurs à une vaccination anti-tumorale présentaient de fortes densités de TLS : vaccination contre les papillomavirus humains HPV16/18 par immunisation contre les oncoprotéines précoces E6 et E7 de ces virus dans le cancer du col de l’utérus ; administration du vaccin GVAX, constitué de cellules tumorales transfectées par un ADN complémentaire (ADNc) codant le GM-CSF (
granulocyte-macrophage colony-stimulating factor
), dans le cancer pancréatique ductal [
4
]. En ce qui concerne les anticorps anti-ICP, une première étude portant sur 20 patients présentant un cancer du poumon de type NSCLC, sept des neuf patients répondeurs présentaient des densités très fortes de TLS après traitement par un anticorps anti-PD1 (
programmed cell death protein 1
), le nivolumab, dans un essai de phase II [
5
]. Des résultats similaires ont été rapportés dans un essai clinique de phase II mené sur 23 patients atteints d’un mélanome de stade très avancé (stade III ou IV), traités par le nivolumab ou par l’association nivolumab et ipilimumab, un anticorps anti-CTLA-4 (
cytotoxic-T-lymphocyte-associated protein 4
), dans le cadre d’un traitement néo-adjuvant, suivi d’un traitement adjuvant
1
par le nivolumab. Dans cette dernière étude, les auteurs ont en particulier noté une expression intra-tumorale plus élevée de marqueurs de lymphocytes B avant et en cours de traitement chez les patients répondeurs par rapport aux patients non répondeurs [
6
]. Le degré d’infiltration des lymphocytes B est également prédictif de la réponse à la chimiothérapie dans les cancers du sein, et notamment dans la forme agressive de cancer du sein « triple négatif »
2
[
7
,
8
]. Ainsi, la présence et la persistance d’une signature de lymphocytes B infiltrant les tumeurs sont corrélées avec une évolution favorable chez les patients traités.
Trois articles publiés récemment dans le même numéro de la revue
Nature
démontrent formellement cette association entre présence de lymphocytes B dans les TLS et réponse favorable au traitement avec des anticorps anti-ICP [
9
-
11
]
(
Figure 2A
)
. Que ce soit par une approche transcriptomique globale ou par une approche plus ciblée d’identification de populations de cellules immunitaires par la méthode MCP-
counter
(
microenvironment cell population-counter
), une présence (caractérisée par une « signature » dite génique ou moléculaire) de lymphocytes B est très fréquemment retrouvée avant et pendant le traitement par le nivolumab ou la combinaison nivolumab + ipilimumab chez des patients répondeurs atteints d’un mélanome, d’un cancer du rein métastatique ou d’un sarcome des tissus mous. L’association entre la signature de lymphocytes B, l’organisation de ces cellules en TLS et la réponse au traitement par anticorps anti-ICP n’est toutefois pas retrouvée chez des patients ayant un mélanome dont les cellules tumorales présentent une mutation du gène
BRAF
(un proto-oncogène codant la protéine kinase B-raf), suggérant la mise en place d’un environnement immunitaire distinct en fonction du statut génétique de la tumeur, comme cela a déjà été rapporté dans les tumeurs présentant ou non des instabilités de microsatellites
3
[
12
].
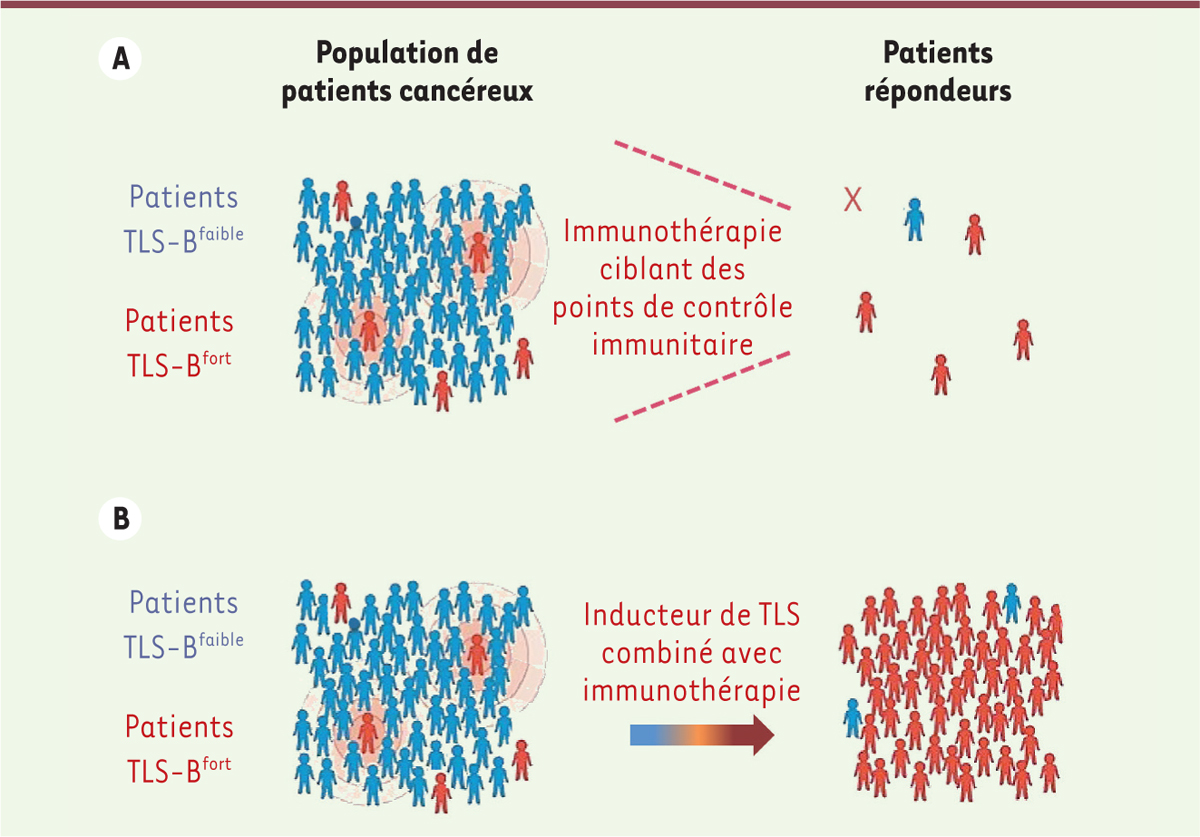
 | Figure 2.
A. Analyse de la réponse aux traitements par les inhibiteurs de points de contrôle immunitaire en fonction de la densité des structures lymphoïdes tertiaires chez les patients cancéreux.
Les structures lymphoïdes tertiaires sont quantifiées sur la base de la densité des lymphocytes B présents dans ces structures (nommés TLS-B), par une signature génique de marqueurs associés aux lymphocytes B ou par immunohistochimie à partir d’une biopsie tumorale obtenue après résection de la tumeur du patient, permettant ainsi de stratifier les patients en TLS-B
faible
(en bleu) ou TLS-B
fort
(en rouge). Parmi les patients répondeurs au traitement avec des anticorps dirigés contre des points de contrôle immunitaire (anti-immune checkpoint antibodies, anti-ICP), ceux présentant une tumeur avec une forte densité de TLS-B (patients TLS-B
fort
) sont les plus nombreux. La croix représente un patient TLSBfort n’ayant cependant pas répondu au traitement par anticorps anti-ICP.
B. Induction de structures lymphoïdes tertiaires par des stratégies innovantes pour améliorer la réponse aux immunothérapies.
Une stratégie visant à induire des TLS associées à la tumeur chez les patients TLS-B
faible
(en bleu), ou à augmenter leur nombre chez des patients TLS-B
fort
(en rouge), pourrait permettre d’optimiser l’efficacité des immunothérapies, notamment celles fondées sur l’utilisation d’anticorps anti-ICP.
|
Remarquablement, la signature de lymphocytes B n’est prédictive de la réponse au traitement par anticorps anti-ICP (nivolumab ou nivolumab + ipilimumab) que dans les analyses univariées, pas dans les analyses multivariées
4
, laissant penser que les lymphocytes B pourraient interagir avec d’autres composantes du système immunitaire pour conduire à une coopération fonctionnelle et protectrice. Tous les stades de différenciation des lymphocytes B sont surreprésentés chez les patients répondeurs par rapport aux patients non répondeurs. Cette coopération cellulaire pourrait alors opérer soit au sein des TLS lorsque les lymphocytes B peuvent jouer un rôle de cellules présentatrices d’antigènes, soit en dehors des TLS lorsqu’ils sont différenciés en cellules effectrices (lymphocytes B mémoires et plasmocytes), et dans ce cas, au contact par exemple de cellules cytotoxiques (lymphocytes T et cellules
natural killer
, NK) et de cellules myéloïdes.
Dans l’étude de Petitprez
et al
., les auteurs ont identifié un sous-groupe de sarcomes des tissus mous, nommé SIC-E (
sarcoma immune class-E
), présentant la plus forte signature de lymphocytes B (CD19, CD79A, CD79B, MS4A1) et le meilleur taux de réponse aux traitements par anticorps anti-PD1 (50 % de réponse objective au traitement par le pembrolizumab) [
11
]. Ce sous-groupe se caractérise également par une forte présence de lymphocytes T CD8
+
cytotoxiques, de cellules NK, mais également, paradoxalement, par la présence de lymphocytes T régulateurs (Treg) et par le niveau d’expression des ICP, notamment de PD-L1 et PD-L2 (
PD1 ligands 1 and 2
), CTLA-4, TIM-3 (
T-cell immunoglobulin and mucin domain-3
) et LAG-3 (
lymphocyte activation gene 3
), qui est le plus élevé lorsqu’on le compare à celui des autres sous-groupes de patients. L’étude de la localisation et de la fonction de ces cellules immunosuppressives Treg ou exprimant des ICP, et de leur relation avec les lymphocytes B reste à effectuer pour tenter de comprendre leur rôle dans la formation et le fonctionnement des TLS dans un tel environnement immunosuppresseur, alors même que les patients du sous-groupe SIC-E répondent favorablement au traitement par anticorps anti-PD1. Plusieurs autres questions fondamentales concernant le rôle des lymphocytes B présents dans les TLS des tumeurs solides restent sans réponse. Ces lymphocytes sont-ils essentiels pour effectuer une présentation antigénique efficace à des lymphocytes T également présents dans ces structures ? Produisent-ils des cytokines aboutissant à un recrutement et à une activation de certaines sous-populations de lymphocytes T (lymphocytes T effecteurs, lymphocytes T effecteurs mémoires,
etc.
) ? Jouent-ils un rôle majeur dans la protection anti-tumorale grâce à leur production
in situ
d’anticorps dirigés contre des antigènes associés aux tumeurs, une fois sélectionnés et différenciés dans les TLS ? Existe-t-il un répertoire différent de ces anticorps entre les patients répondeurs et les patients non répondeurs, et comment ce répertoire évolue-t-il au cours du traitement ? Enfin, il devient essentiel de déterminer pour quelles autres thérapies anti-tumorales que celles ciblant les ICP les TLS peuvent prédire une réponse favorable chez des patients cancéreux.
|
L’effet bénéfique de la présence de structures lymphoïdes tertiaires (TLS), observé dans la majorité des tumeurs solides en fait des cibles thérapeutiques de choix pour développer un nouveau modèle d’immunothérapie dans lequel la question de la spécificité antigénique du ciblage ne se pose pas. De plus, il est probable que des stratégies visant à induire la formation des TLS, combinées avec une immunothérapie fondée sur l’utilisation d’anticorps anti-ICP, permettraient d’augmenter significativement le taux des réponses favorables chez les patients traités
(
Figure 2B
)
. Les récentes observations associant l’abondance de lymphocytes B organisés en TLS à une réponse favorable au traitement par des anticorps anti-ICP chez des patients présentant des tumeurs solides remettent au premier plan ces cellules longtemps laissées pour compte dans les stratégies d’immunothérapie anti-tumorale.
Des analyses approfondies seront nécessaires pour comprendre et caractériser les interactions privilégiées entre les lymphocytes B et les autres cellules immunitaires, dans et hors des TLS présentes dans les tumeurs. Ces analyses pourraient notamment conduire à l’identification de couples ligand-récepteur jouant un rôle essentiel dans ce dialogue impliquant les lymphocytes B présents dans les tumeurs, permettant ainsi de définir de nouvelles cibles thérapeutiques. Enfin, repenser l’effet des thérapies actuelles sur ces interactions où le lymphocyte B est susceptible de jouer un rôle central dans la réponse anti-tumorale
in situ
devient une priorité.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Kaplon
H
,
Dieu-Nosjean
MC
.
Quel avenir pour les lymphocytes B infiltrant les tumeurs solides : marqueur pronostique et/ou cible thérapeutique ?
.
Med Sci (Paris).
2018;
;
34
:
:72.
–
78
.
2.
Dieu-Nosjean
MC
,
Antoine
M
,
Danel
C
,
et al.
Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures.
.
J Clin Oncol.
2008;
;
26
:
:4410.
–
4417
.
3.
Germain
C
,
Gnjatic
S
,
Tamzalit
F
,
et al.
Presence of B cells in tertiary lymphoid structures is associated with a protective immunity in patients with lung cancer.
.
Am J Respir Crit Care Med.
2014;
;
189
:
:832.
–
844
.
4.
Teillaud
JL
,
Dieu-Nosjean
MC
.
Tertiary lymphoid structures: An anti-tumor school for adaptive immune cells and an antibody factory to fight cancer?
.
Front Immunol.
2017;
;
8
:
:830.
.
5.
Cottrell
TR
,
Thompson
ED
,
Forde
PM
,
et al.
Pathologic features of response to neoadjuvant anti-PD-1 in resected non-small-cell lung carcinoma: a proposal for quantitative immune-related pathologic response criteria (irPRC).
.
Ann Oncol.
2018;
;
29
:
:1853.
–
1860
.
6.
Amaria
RN
,
Reddy
SM
,
Tawbi
HA
,
et al.
Neoadjuvant immune checkpoint blockade in high-risk resectable melanoma.
.
Nat Med.
2018;
;
24
:
:1649.
–
1654
.
7.
Reddy
SM
,
Reuben
A
,
Barua
S
,
et al.
Poor response to neoadjuvant chemotherapy correlates with mast cell infiltration in inflammatory breast cancer.
.
Cancer Immunol Res.
2019;
;
7
:
:1025.
–
1035
.
8.
Song
IH
,
Heo
SH
,
Bang
WS
,
et al.
Predictive value of tertiary lymphoid structures assessed by high endothelial venule counts in the neoadjuvant setting of triple-negative breast cancer.
.
Cancer Res Treat.
2017;
;
49
:
:399.
–
407
.
9.
Cabrita
R
,
Lauss
M
,
Sanna
A
,
et al.
Tertiary lymphoid structures improve immunotherapy and survival in melanoma.
.
Nature.
2020;
;
577
:
:561.
–
5
.
10.
Helmink
BA
,
Reddy
SM
,
Gao
J
,
et al.
B cells and tertiary lymphoid structures promote immunotherapy response.
.
Nature.
2020;
;
577
:
:549.
–
55
.
11.
Petitprez
F
,
de Reyniès
A
,
Keung
EZ
,
et al.
B cells are associated with survival and immunotherapy response in sarcoma.
.
Nature.
2020;
;
577
:
:556.
–
60
.
12.
Picard
E
,
Verschoor
CP
,
Ma
GW
,
Pawelec
G
.
Relationships between immune landscapes, genetic subtypes and responses to immunotherapy in colorectal cancer.
.
Front Immunol.
2020;
;
11
:
:369.
.
|