Les neuroscientifiques ont longtemps considéré que les neurones étaient les acteurs principaux, sinon exclusifs des fonctions « supérieures » du cerveau des mammifères, telles que la motricité volontaire, la perception sensorielle, l’apprentissage, ou la mémorisation. Les cellules gliales, qui représentent pourtant environ la moitié de nos cellules cérébrales, n’étaient créditées au mieux que d’un rôle ancillaire dans nos capacités mentales. Cependant, l’utilisation de récentes et puissantes techniques de bio-imagerie a révélé que les cellules gliales contribuent activement au fonctionnement du cerveau, et qu’elles effectuent bien plus que de simples tâches « ménagères » au service des neurones. Les cellules gliales sont désormais reconnues comme de véritables partenaires des neurones, qu’il est notamment nécessaire d’intégrer dans la modélisation pour progresser dans notre compréhension du fonctionnement cérébral normal ou pathologique.
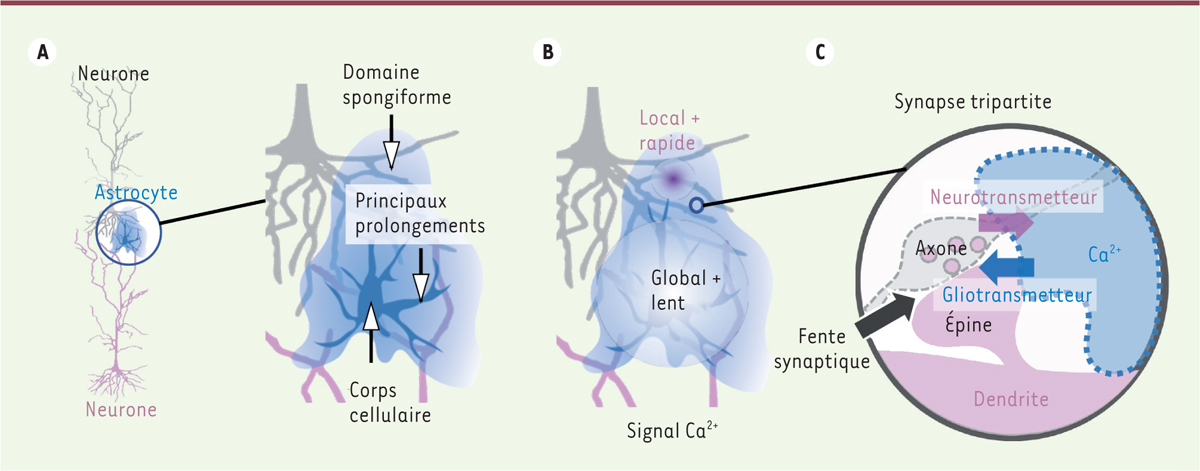
Parmi les cellules gliales du cerveau, les astrocytes sont les plus nombreux. Alors qu’on a longtemps cru qu’ils ne servaient qu’à apporter un soutien structurel et métabolique aux neurones, les astrocytes sont maintenant reconnus comme des facteurs influents du fonctionnement des synapses neuronales et même du comportement [ 1 ]. Une accumulation de preuves a aussi permis de lier étroitement les altérations de la structure et du fonctionnement des astrocytes à des maladies du cerveau [ 2 ], telles que la schizophrénie et la maladie d’Alzheimer, ce qui en fait une nouvelle cible thérapeutique potentielle dans ces maladies. Si les astrocytes, contrairement aux neurones, sont électriquement silencieux, ils sont loin d’être inertes. Le concept de « synapse tripartite » [ 3 ] établit les processus astrocytaires fins comme un troisième partenaire important dans la transmission synaptiques, en plus des structures pré-synaptiques (boutons axonal) et post-synaptique (épine dendritique) ( Figure 1C ) . Les astrocytes ont des récepteurs de neurotransmetteurs à leur surface, ce qui leur permet de détecter l’activité neuronale dans leur voisinage et de la traduire en une augmentation de la concentration intracellulaire de l’ion Ca 2+ (ce qui influe sur de nombreux processus cellulaires). À leur tour, ces signaux Ca 2+ peuvent entraîner la libération de molécules neuroactives (gliotransmetteurs) par les astrocytes, comme le glutamate, la D-sérine et l’ATP, qui stimulent l’activité synaptique. En plus de la « gliotransmission », les astrocytes peuvent également éliminer le glutamate de la fente synaptique ( Figure 1C ) pour mettre fin aux événements synaptiques, ou empêcher sa diffusion vers les synapses voisines [ 1 ] pour inhiber leur « crosstalk ».
| Figure 1.
Organisation de la synapse tripartite, impliquant des ramifications astrocytaires fines en contact étroit avec les structures synaptiques. A.
Organisation structurelle d’un astrocyte.
B.
Signaux Ca
2+
globaux lents observés classiquement dans les corps cellulaires des astrocytes et dans les branches proximales de leurs prolongements arborescents, et signaux Ca
2+
locaux rapides récemment observés dans le domaine spongiforme.
C.
Communication bidirectionnelle au niveau de la synapse tripartite.
|
On pensait que les signaux Ca 2+ dans les astrocytes étaient plutôt lents et spatialement dispersés. Cela reflétait les limites de la technique d’imagerie, qui permettait d’enregistrer les signaux Ca 2+ , principalement dans le corps cellulaire et les branches proximales de leurs prolongements arborescents ( Figure 1A , B ) . L’avènement des indicateurs de Ca 2+ génétiquement codés, c’est-à-dire des biocapteurs fluorescents à base de protéines, qu’il est possible d’exprimer spécifiquement dans les astrocytes, a permis d’observer enfin les fluctuations de la concentration du Ca 2+ dans le domaine « spongiforme » où se trouvent les synapses tripartites ( Figure 1B , C ) . Cela a révélé que les astrocytes présentent également des signaux Ca 2+ rapides et locaux, ce qui suggère une capacité de traitement de l’information à grande vitesse ( Figure 1B ) , à l’instar des neurones.
Puisqu’un astrocyte entre en contact avec plus de 100 000 synapses appartenant à de nombreux neurones différents [ 4 ], il pourrait agir sur l’activité du circuit synaptique local de manière complexe et profonde. Alors qu’un signal Ca 2+ « global » de l’astrocyte pourrait être comparé à une émission de radio nationale, un signal Ca 2+ local s’apparenterait plutôt à une annonce par haut-parleur dans un stade de football ou même, dans le cas extrême d’un signal Ca 2+ limité à une seule synapse, à un appel téléphonique privé. Il est donc très important de capter le spectre complet des signaux Ca 2+ pour décoder leur langage et comprendre leur impact sur le traitement de l’information par les circuits synaptiques. Toutefois, cela représente un défi technique important, en raison de la complexité anatomique du domaine spongiforme, où la finesse des ramifications astrocytaires peut atteindre des diamètres d’à peine 100 nm. La microscopie optique conventionnelle, dont la résolution spatiale est limitée à environ 200 nm, ne peut saisir que des images floues de ces petites ramifications, ce qui ne permet pas de visualiser la relation entre les signaux Ca 2+ et les synapses individuelles.
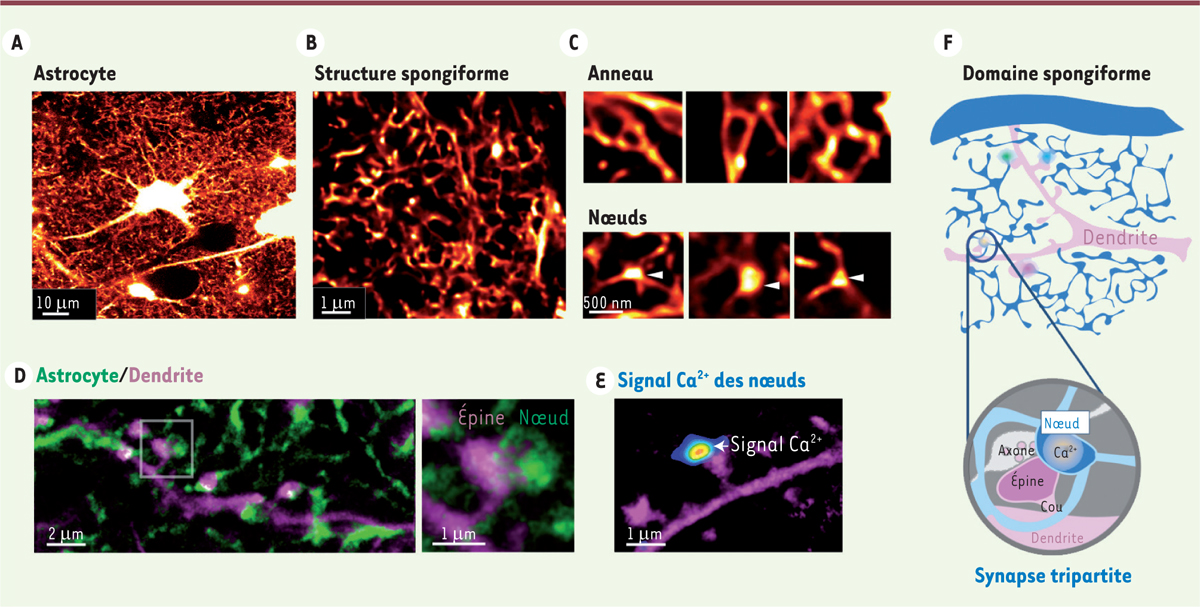
Pour surmonter cette difficulté, nous avons utilisé la microscopie 3D-STED ( stimulation emission depletion ), une technique récente de fluorescence, qui peut résoudre optiquement des structures aussi petites que 50 nm dans des tissus vivants [ 5 ]. En combinant cette technique de microscopie avec l’imagerie du Ca 2+ , nous avons pu visualiser son activité au niveau des synapses tripartites [ 6 ]. Nous avons utilisé des coupes cérébrales « organotypiques » d’hippocampe de souris, dont l’organisation cellulaire et les caractéristiques fonctionnelles se rapprochent de celles de cette structure in vivo , tout en offrant un accès optique et une stabilité de l’échantillon optimaux. L’utilisation de la microscopie 3D-STED a permis d’obtenir des images nettes du domaine spongiforme, qui ont révélé l’étonnante organisation réticulaire des ramifications astrocytaires fines ( Figure 2A , B ) . Nous avons observé des structures annulaires ( Figure 2C ) suggérant que les ramifications astrocytaires peuvent se connecter les unes aux autres et former des réseaux anastomotiques comme les capillaires sanguins. Nous avons également observé, aux points de ramification de ce maillage, des structures bulbeuses ( Figure 2C ) que nous avons appelées des « nœuds », et qui ressemblent, par leur forme, leur taille et leur densité, aux boutons axonaux et aux épines dendritiques des neurones, dont ils pourraient représenter la structure homologue astrocytaire aux synapses tripartites.
| Figure 2.
Organisation structurelle du domaine spongiforme, où les noeuds sont la composante fonctionnelle astrocytaires des synapses tripartites. A.
Image confocale d’un astrocyte marqué par fluorescence.
B.
Image STED du domaine spongiforme révélant son organisation réticulaire.
C.
Exemples d’images d’anneaux (en haut) et de noeuds (en bas) astrocytaires.
D.
Image STED du domaine spongiforme d’un astrocyte (vert) et d’une dendrite neuronale (magenta). L’image agrandie montre un noeud en contact avec une épine dendritique.
E.
Image du signal Ca
2+
astrocytaire (pseudo-couleur) superposée à l’image STED d’une dendrite (magenta).
F.
Schéma du modèle proposé, où un astrocyte peut communiquer avec des synapses individuelles par des noeuds.
|
Sur des images simultanées des astrocytes et des neurones utilisant deux couleurs différentes, nous avons constaté que plus de la moitié des épines dendritiques des neurones étaient en contact avec au moins un nœud astrocytaire ( Figure 2D ) , et que les épines plus grandes, qui dénotent des synapses plus fortes (correspondant à des évènements synaptiques plus importants), avaient tendance à être en contact avec des nœuds astrocytaires plus grands eux aussi, ce qui suggère l’existence d’un lien fonctionnel entre ces deux structures ( Figure 2D ) . Nous avons constaté que les contacts entre les nœuds astrocytaires et les épines dendritiques des neurones étaient maintenus au moins pendant quelques heures, ce qui implique l’existence de forces locales d’adhérence, similaires à celles qui maintiennent en contact les structures neuronales pré- et post-synaptiques dans un contexte tissulaire dynamique.
La finesse des ramifications reliant les nœuds astrocytaires pourrait permettre de compartimenter les signaux Ca 2+ en empêchant leur propagation aux nœuds voisins. En réalisant des expériences de FRAP ( fluorescence recovery after photobleaching ), une technique permettant de quantifier la diffusion des molécules, nous avons constaté que les tiges minces avaient effectivement tendance à ralentir la diffusion d’une sonde fluorescente cytosolique, de la même manière que le cou des épines dendritiques peut empêcher la propagation des signaux Ca 2+ vers la dendrite mère ou les synapses voisines ( Figure 2F ) [ 7 ]. Enfin, en cartographiant les signaux Ca 2+ enregistrés sur les structures sous-jacentes, visualisées par STED, nous avons pu montrer que les nœuds astrocytaires sont les sites préférentiels des signaux Ca 2+ locaux aux synapses tripartites. En fait, la majorité de l’activité Ca 2+ spontanée, c’est-à-dire des signaux qui se produisent sans stimulation externe, est limitée à des nœuds individuels, ce qui suggère que les astrocytes peuvent avoir des « conversations privées » avec de nombreuses synapses différentes simultanément ( Figure 2E , F ) .
Cette étude montrant que les nœuds sont la composante astrocytaire fonctionnellement pertinente des synapses tripartites ( Figure 2F ) a révélé le support structurel d’un mécanisme glial de régulation de l’activité synaptique, qui ajoute un niveau de coordination et de contrôle du flux des signaux électriques à travers les circuits cérébraux. Les astrocytes humains sont environ dix fois plus grands que les astrocytes des rongeurs, et un astrocyte humain peut à lui seul être en contact avec jusqu’à deux millions de synapses [ 8 ]. Cette complexité architecturale constitue vraisemblablement un ingrédient important de l’extraordinaire capacité de calcul du cerveau humain.