L’ion calcium (Ca 2+ ) est impliqué dans différents processus cellulaires tels que la prolifération, la différenciation et la migration, ou encore la mort cellulaire par apoptose [ 1 ]. Il n’est donc pas surprenant qu’une dérégulation de l’homéostasie calcique favorise le développement du cancer [ 2 ]. La signalisation calcique implique presque toujours un influx de Ca 2+ à travers des canaux ou échangeurs calciques membranaires. Ces derniers sont souvent exprimés de façon aberrante dans les cellules tumorales, dans lesquelles leur fonction semble détournée pour promouvoir la survie cellulaire ou la formation de métastases.
Les mitochondries produisent l’adénosine triphosphate (ATP), principale source d’énergie pour la cellule, et participent activement à la signalisation calcique. Les mitochondries stockent les ions Ca 2+ principalement sous la forme de précipités de Ca 3 (PO 4 ) 2 dans la matrice mitochondriale. La formation de ces précipités est dépendante du pH, et réversible lors de l’effondrement du potentiel de membrane mitochondrial par les translocateurs de protons (protonophores), qui libèrent les ions Ca 2+ du complexe Ca 3 (PO 4 ) 2 [ 3 ], ce qui entraînera in fine l’efflux d’ions Ca 2+ des mitochondries vers le cytosol par les acteurs moléculaires décrits ci-dessous.
Malgré la force électromotrice des ions Ca 2+ favorisant leur entrée à travers la membrane mitochondriale interne, les mitochondries ont une très faible affinité pour le transport des ions Ca 2+ . Il est proposé que le transfert des ions Ca 2+ dans les mitochondries se situe dans des régions spécialisées de contacts étroits entre les mitochondries et le réticulum endoplasmique : les « membranes associées aux mitochondries » (MAM). Au sein des MAM, la libération de Ca 2+ entre les deux organites, consécutive à la fixation d’inositol-1,4,5-trisphosphate (IP3) sur les canaux récepteurs de l’IP3 du réticulum endoplasmique, entraîne une libération d’ions Ca 2+ , dont la concentration est alors proche de 1 µM au voisinage des mitochondries. Pour atteindre la matrice mitochondriale, les ions Ca 2+ doivent traverser les membranes mitochondriales externe puis interne. La membrane mitochondriale externe est perméable aux molécules de moins de 5 kDa, et les ions Ca 2+ diffusent facilement à travers cette membrane. Cette perméabilité aux ions Ca 2+ implique le canal anionique peu sélectif VDAC ( voltage-dependent anion channel ). La perméabilité aux ions de la membrane mitochondriale interne est en revanche beaucoup plus sélective. L’entrée des ions Ca 2+ dans la matrice mitochondriale à travers la membrane interne implique le canal calcique MCU ( mitochondrial calcium uniporter ) [ 4 ]. On sait maintenant que MCU fonctionne au sein d’un grand complexe moléculaire composé de MCU, de protéines d’absorption du Ca 2+ mitochondriales (MICU1, MICU2 et MICU3) et d’une protéine régulatrice de 10 kDa appelée régulateur essentiel de MCU l (EMRE), ainsi que de plusieurs autres protéines comme MCUR1, SLC25A23 et MCUb [ 5 ]. L’extrusion mitochondriale des ions Ca 2+ , quant à elle, implique l’échangeur ionique Na + /Ca 2+ /Li + ou NCLX (codé par le gène SLC8B1 ) de la membrane mitochondriale interne [ 6 ].
Des études réalisées dans les années 1960-1970 ont montré que l’absorption mitochondriale des ions Ca 2+ dépendait d’un potentiel membranaire mitochondrial élevé (Δψ @ -180 mV) et était inhibée par le rouge de ruthénium [ 7 ]. La chaîne de transport mitochondrial des électrons transfère les protons à travers la membrane mitochondriale interne dans l’espace inter-membranaire, produisant ainsi un gradient électrochimique de protons qui orchestre la synthèse de l’ATP. Ce potentiel de membrane mitochondrial contribue également à la force motrice favorisant l’absorption des ions Ca 2+ cytosoliques par les mitochondries [ 8 ]. Les variations de la concentration intra-mitochondriale des ions Ca 2+ (de 0,1 µM au mM) sont essentielles pour la bioénergétique cellulaire. Trois enzymes déshydrogénases du cycle des acides tricarboxyliques (cycle de Krebs) sont régulées par les ions Ca 2+ dans la matrice mitochondriale [ 9 ]. Ainsi, le signal Ca 2+ cytosolique consécutif à l’activation des récepteurs (à activité tyrosine-kinase ou couplés à des protéines G) de la membrane plasmique se propage jusqu’aux mitochondries, améliorant ainsi la fonction respiratoire, l’extrusion des ions H + et la synthèse d’ATP. À l’échelle cellulaire, cette signalisation calcique permet donc un couplage efficace entre la stimulation de récepteurs dans la membrane plasmique et la production d’ATP.
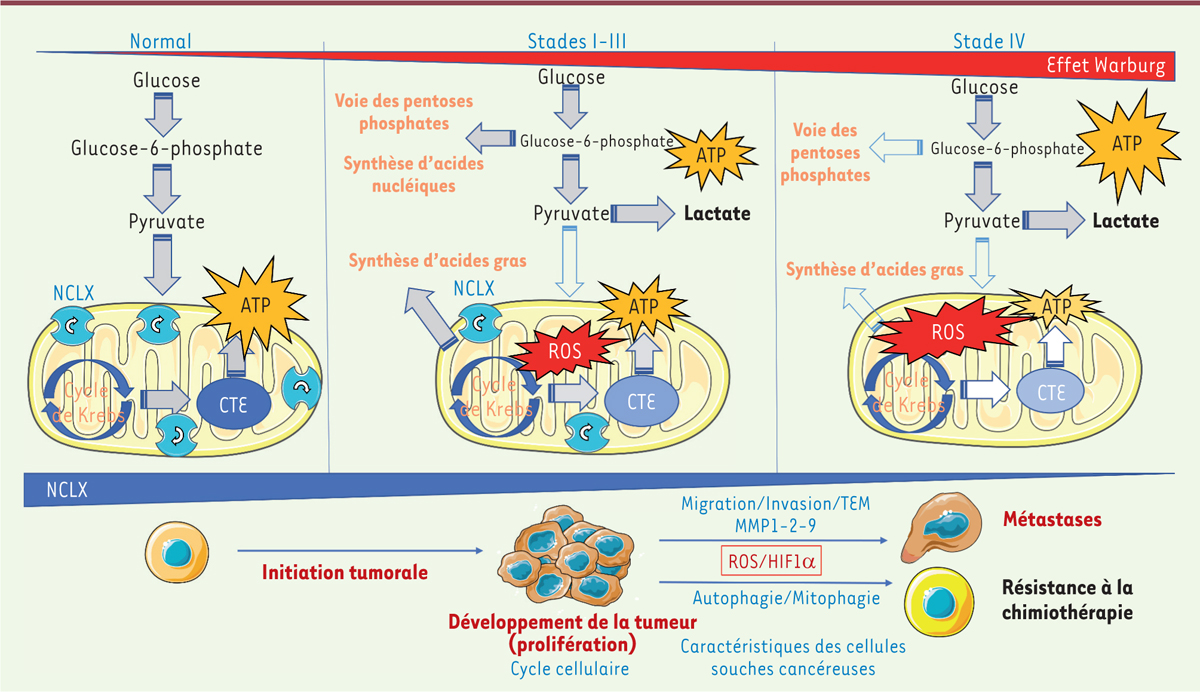
Le rôle des mitochondries dans le développement du cancer est désormais établi [ 10 ], mais les mécanismes par lesquels le calcium mitochondrial est impliqué dans la tumorigenèse ne sont pas encore complètement élucidés. De nouveaux éléments d’explication proviennent des résultats de notre récente étude, qui a permis de mettre en évidence le rôle de l’échangeur NCLX dans le cancer colorectal grâce à des modèles in vitro et in vivo chez la souris, ainsi que chez les patients [ 11 ]. Dans un modèle de cancer colorectal induit par azoxyméthane et dextran sulfate de sodium, les souris invalidées ( knockout , KO) pour NCLX présentent un nombre réduit de tumeurs et des volumes tumoraux plus faibles que les souris témoins de génotype « sauvage ». Cette réduction du volume tumoral est également observée dans un modèle murin de xénogreffe tumorale orthotopique, lorsque les cellules coliques cancéreuses humaines injectées à la souris sont dépourvues de NCLX. In vitro , la suppression de l’expression de NCLX par la stratégie CRISPR/Cas9, ou sa diminution en utilisant des petits ARN artificiels « en épingle à cheveux » (shARN), dans des cellules de lignées coliques cancéreuses entraîne 1) une surcharge mitochondriale en ions Ca 2+ , 2) une dépolarisation mitochondriale, 3) une diminution de l’expression des gènes du cycle cellulaire réprimant la prolifération cellulaire, et 4) une augmentation de l’expression des gènes régulant l’apoptose. Nous avons également montré le rôle essentiel de NCLX dans le contrôle de certaines voies métaboliques associées à la prolifération tumorale, comme la voie des pentoses phosphates et les voies de synthèses des acides nucléiques et des acides gras [ 11 ].
Cependant, en dehors de ces résultats indiquant un intérêt potentiel d’inhiber NCLX pour traiter le cancer colorectal, la suppression ou la diminution de l’expression de NCLX dans les lignées de cellules cancéreuses coliques et dans les modèles in vivo a également révélé un rôle anti-tumoral de NCLX. En effet, la suppression ou la diminution de l’expression de NCLX favorise 1) l’apparition de métastases, observée dans un modèle murin de xénogreffe tumorale orthotopique, 2) la résistance au 5-fluorouracile (5-FU), une molécule utilisée en chimiothérapie anti-cancéreuse, 3) l’expression des transcrits impliqués dans les voies de signalisation liées à la transition épithélio-mésenchymateuse et à l’hypoxie (analyse d’enrichissement fonctionnel ou gene set enrichment analysis, GSEA ), 4) l’expression des transcrits impliqués dans les voies caractéristiques des cellules souches tumorales (analyse GSEA), et 5) une activation de l’autophagie. La perte de NCLX entraîne une surcharge mitochondriale en ions Ca 2+ liée à la production accrue de dérivés réactifs de l’oxygène dans les mitochondries, ce qui active le facteur HIF1α ( hypoxia inducible factor 1 a) et la glycolyse. L’ensemble de ces phénomènes promeut à son tour le caractère métastatique des cellules tumorales déficientes pour NCLX. Chez les patients, la diminution de l’expression de NCLX mise en évidence dans les tumeurs colorectales est associée aux stades avancés de la maladie.
Ainsi, NCLX a un effet ambivalent dans le cancer colorectal selon une chronologie précise ( Figure 1 ) . La diminution d’expression et de fonction de NCLX entraîne, d’une part, une réduction significative de la croissance tumorale, mais, d’autre part, participe ensuite à l’établissement d’un phénotype mésenchymateux qui conduit à l’apparition de métastases et favorise la résistance à la chimiothérapie. Cependant, l’ensemble des résultats in vitro que nous avons obtenus jusqu’à présent l’ont été sur des cellules qui se sont adaptées afin de survivre en l’absence de NCLX. Il est désormais nécessaire d’utiliser également des approches pharmacologiques ciblant NCLX pour tenter de savoir s’il est un ennemi ou au contraire un allié dans le traitement du cancer colorectal.
| Figure 1.
Processus pathogéniques et voies métaboliques liés à l’échangeur ionique NCLX au cours de l’initiation et du développement du cancer colorectal
. ATP : adénosine tri-phosphate ; NCLX : échangeur ionique Na
+
/Ca
2+
/Li
+
; CTE : chaîne de transfert d’électrons ; TEM : transition épithélio- mésenchymateuse ; ROS (reactive oxygen species) : espèces réactives de l’oxygène ; HIF1α : facteur de transcription induit par l’hypoxie 1α ; MMP : métalloprotéinases matricielles.
|