| |
| Med Sci (Paris). 37(2): 117–119. doi: 10.1051/medsci/2020272.Rôle du récepteur β des œstrogènes dans les comportements sociaux et émotionnels chez la souris mâle Lydie Naulé,1 Hélène Hardin-Pouzet,1 and Sakina Mhaouty-Kodja1* 1Sorbonne Université, CNRS UMR 8246, Inserm U1130, Neuroscience Paris Seine - Institut de biologie Paris Seine
,
7 quai Saint-Bernard
,
75005Paris
,
France MeSH keywords: Facteurs âges, Animaux, Arginine vasopressine, Comportement animal, Dépression, Régulation émotionnelle, Récepteur bêta des oestrogènes, Femelle, Hypothalamus, Mâle, Souris, Mutation, Neurones, Ocytocine, Facteurs sexuels, Comportement social, Testostérone, Tryptophane 5-monooxygenase, génétique, métabolisme, traitement médicamenteux, physiologie |
Œstrogènes et comportements sociaux et émotionnels
Les œstrogènes influencent un large éventail de comportements sociaux, liés à la reproduction (comportements sexuel et parental) ou impliqués dans la communication et la reconnaissance sociale, ou encore l’agressivité et la domination [
1
]. Ce rôle des œstrogènes semble impliquer l’ocytocine et l’arginine-vasopressine, deux neuropeptides qui contrôlent les comportements sociaux et l’attachement. Les neurones synthétisant l’ocytocine ou l’arginine-vasopressine impliqués dans ces comportements sont localisés dans le noyau paraventriculaire de l’hypothalamus
1
, et leurs axones se projettent sur plusieurs régions cérébrales, dont l’amygdale et le noyau du lit de la strie terminale (NLST), qui contiennent également des populations neuronales exprimant ces deux neuropeptides.
L’œstradiol exerce également des effets anxiolytique et antidépresseur. Les comportements émotionnels varient en effet en fonction des niveaux circulants d’œstradiol au cours du cycle œstral, avec une diminution de l’état d’anxiété et de dépression chez les rats et souris femelles en proœstrus [
2
,
3
]. Chez la femme, la susceptibilité à développer des troubles de l’humeur apparaît à la puberté avec le déclenchement de la cyclicité ovarienne. Les régions cérébrales impliquées sont principalement le raphé, l’amygdale, l’hippocampe et le cortex préfrontal, avec un rôle émergent du NLST [
4
]. Dans ces régions, le système sérotoninergique est un puissant modulateur des comportements émotionnels. L’œstradiol peut modifier le système sérotoninergique, notamment en agissant dans le raphé dorsal sur l’expression de la tryptophane hydroxylase 2 (TPH2) [
5
], enzyme clé de la synthèse de la sérotonine. L’ocytocine et l’arginine-vasopressine semblent également jouer un rôle dans les comportements anxieux et dépressif [
6
].
|
Rôle du récepteur β des œstrogènes chez le mâle Dans le système nerveux central mâle, la testostérone peut agir directement en activant les récepteurs des androgènes (AR), mais elle peut aussi être métabolisée en œstradiol grâce à l’activité de l’aromatase cytochrome P450. L’œstradiol agit principalement en activant les deux types de récepteurs nucléaires des œstrogènes (ER), α et β, et, possiblement, également des récepteurs membranaires qui ne conduisent pas à des modifications d’expression génique.
Afin d’identifier le rôle du récepteur εRβ dans la modulation des comportements sociaux et émotionnels par les œstrogènes, plusieurs modèles ont été utilisés. Les analyses de souris mutantes dépourvues de εRβ dans toutes les cellules qui normalement l’expriment, ou seulement dans les cellules de la région préoptique hypothalamique ou celles de l’amygdale médiane, montrent des effets opposés sur l’agressivité et la mémoire de reconnaissance sociale chez le mâle. Concernant les comportements liés à l’humeur, les résultats des quelques études pharmacologiques et génétiques menées chez des souris ou des rats mâles sont également divergents [
7
,
8
], alors que ceux des nombreuses études disponibles chez les femelles de ces deux espèces convergent vers un rôle important de εRβ dans la modulation de ces comportements
via
la régulation de l’expression de
Tph2
dans le raphé dorsal ([
5
], et voir [
3
]).
Afin de préciser le rôle du récepteur εRβ dans la modulation des comportements sociaux et émotionnels chez le mâle, nous avons utilisé des souris mutantes dépourvues de ce récepteur dans le système nerveux central [
2
]. Chez ces animaux, l’excision de l’exon 3 du gène
ER
b par la recombinase Cre sous le contrôle du promoteur et de l’
enhancer
neural du gène codant la nestine a lieu dans les progéniteurs neuronaux et gliaux dès le 10
e
jour embryonnaire. Une première caractérisation de cette lignée a montré que le récepteur εRβ exprimé par les cellules neurales n’était impliqué ni dans l’expression du comportement sexuel, mâle ou femelle, ni dans l’organisation anatomique des zones cérébrales sous-tendant ce comportement [
2
,
9
]. Nous avons montré que les souris mâles mutantes présentent une interaction sociale diminuée avec des congénères mâles de même âge [
3
]
(
Figure 1A
)
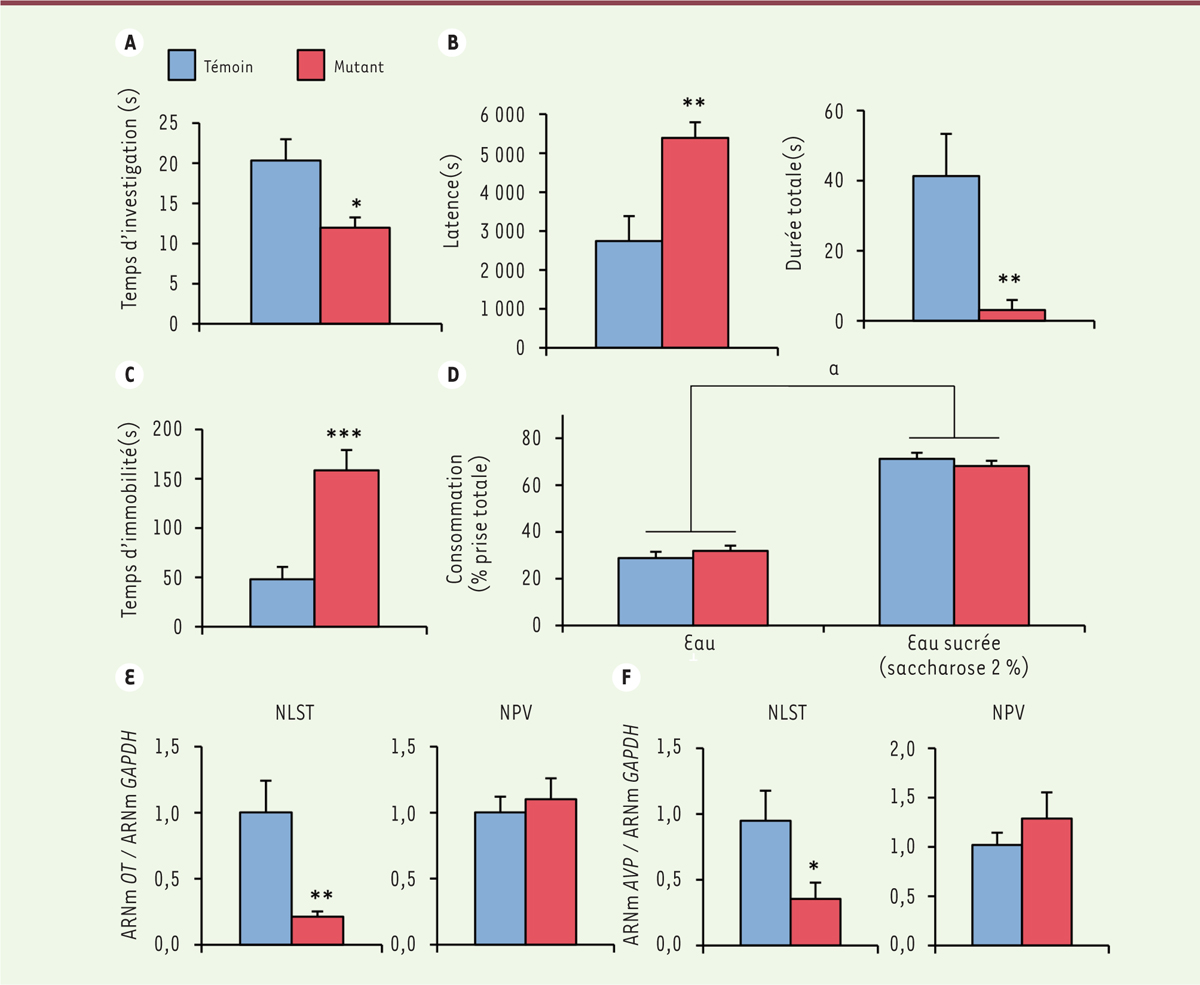
. Dans le test « résident-intrus » analysant le niveau d’agressivité, 78 % des mâles mutants ne présentent aucun comportement agressif vis-à-vis du mâle intrus, et les quelques mâles présentant un comportement agressif affichent une latence à la première attaque augmentée et une durée des attaques très réduite
(
Figure 1B
)
. Aucun effet de la mutation n’a été observé sur l’état d’anxiété des mâles dans trois tests différents : labyrinthe en croix surélevé, labyrinthe en O surélevé, champ ouvert. En revanche, ces mâles présentent un état de résignation élevé
(
Figure 1C
)
, mis en évidence par deux tests couramment utilisés pour tester l’efficacité des médicaments antidépresseurs : suspension par la queue et nage forcée. Enfin, l’analyse des mâles mutants dans le test de préférence de l’eau sucrée n’a pas montré de différence avec les animaux témoins
(
Figure 1D
)
.
 | Figure 1.
A. Effets de la suppression du récepteur β des oestrogènes dans le système nerveux sur le temps passé par les souris mâles à interagir avec un congénère mâle de même âge
. Les mâles issus des mêmes portées mais chez lesquels l’expression du gène codant ce récepteur est préservée (du fait de l’absence du transgène Nestine-Cre) ont été utilisés comme témoins.
B. Test « résident-intrus » mesurant l’agressivité des souris mâles vis-à-vis de mâles intrus non agressifs
: 78 % des mâles mutants ne présentent aucun comportement agressif vis-à-vis du mâle intrus, et pour les 22 % des mâles mutants dont le comportement est agressif, la latence à l’attaque est augmentée (à gauche) et la durée des attaques très réduite (à droite).
C. Temps d’immobilité, signe de résignation, dans le test de nage forcée. D. Consommation d’eau versus consommation d’eau sucrée
(saccharose 2 %) : les animaux préfèrent l’eau sucrée quel que soit leur génotype (a : p < 0,001).
E, F. Quantification des transcrits codant l’ocytocine
(OT)
(E)
et l’argininevasopressine (AVP)
(F)
, normalisée par rapport au transcrit du gène de « ménage » GAPDH, dans le noyau du lit de la strie terminale (NLST) et le noyau paraventriculaire (NPV). Les différences significatives entre les deux génotypes sont indiquées : *p < 0,05 ; **p < 0,01 ; ***p < 0,001.
|
La dépression se caractérise par différents symptômes, dont l’aversion sociale, l’anxiété, la résignation et l’anhédonie. Nos résultats indiquent donc que les mâles dépourvus d’εRβ dans le système nerveux présentent une partie, mais non la totalité, du profil dépressif. Cette étude a été effectuée chez de jeunes adultes, et il serait intéressant de savoir si ces troubles modérés de l’humeur peuvent s’aggraver avec l’âge. Par ailleurs, il est à noter que dans les mêmes conditions expérimentales, et en accord avec la littérature, les femelles mutantes présentent des niveaux d’anxiété et de résignation très élevés, en particulier pendant la phase d’œstrus.
En relation avec les modifications de l’humeur induites par la suppression de εRβ dans le système nerveux, la quantification de la protéine TPH2 dans le raphé n’a montré aucune différence entre les mâles mutants et les mâles témoins [
3
], alors qu’elle a confirmé la diminution précédemment rapportée chez les femelles mutantes [
5
]. L’intégrité de l’axe hypothalamo-hypophysaire surrénalien chez les souris mutantes a été évaluée par des mesures des taux circadiens de la corticostérone et après induction d’un stress par contention. L’absence de différence avec les souris témoins a permis d’exclure une activation de cet axe du stress qui aurait pu être à l’origine du phénotype observé chez les mâles mutants. En revanche, l’analyse quantitative des ARN messagers (ARNm) codant l’ocytocine et l’arginine-vasopressine chez les mâles mutants a révélé une diminution significative dans le NLST, mais pas dans l’amygdale ou le noyau paraventriculaire
(
Figure 1E
,
Figure 1F
)
. Ce résultat est d’autant plus intéressant que le NLST, situé dans le cerveau antérieur basal, est à l’intersection de plusieurs circuits impliqués dans le contrôle de la réponse au stress, de la peur, du comportement social, de l’humeur et de l’anxiété [
4
]. De plus, le NLST présente une organisation sexuellement dimorphique qui dépend des hormones stéroïdes sexuelles, et nous avions montré précédemment que la suppression de εRβ dans le système nerveux altère de manière sélective l’expression de
AR
et de
εRα
dans cette structure [
9
].
|
Conclusion et perspectives
Des différences selon le sexe sont observées dans les effets induits par la suppression d’
ER
b dans le système nerveux : comportements émotionnels modérément altérés chez les mâles et fortement perturbés chez les femelles, et expression de
Tph2
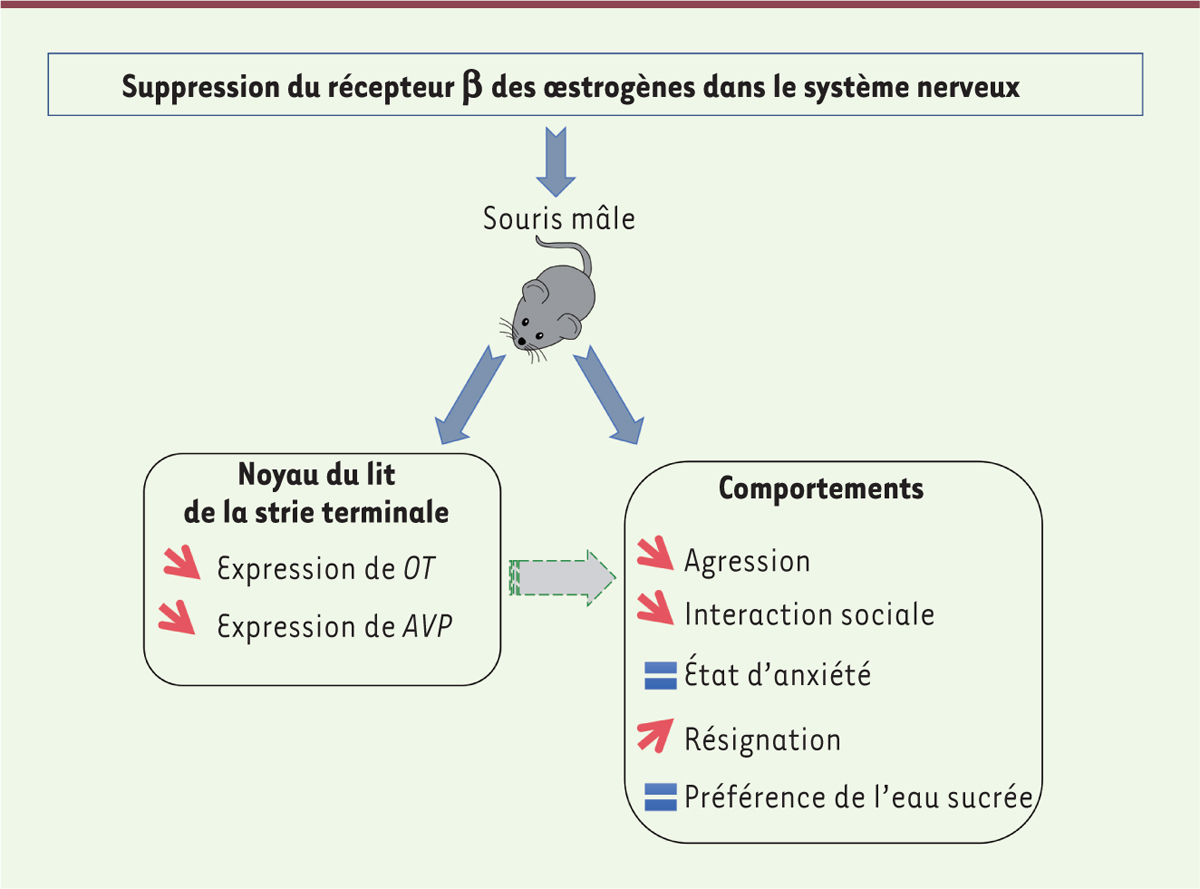
dans le raphé normale chez les mâles et réduite chez les femelles. Nos résultats suggèrent que les altérations comportementales observées chez la souris mâle pourraient être liées, au moins en partie, aux modifications des neurones du NLST produisant l’ocytocine et l’arginine-vasopressine
(
Figure 2
)
, bien que l’implication d’autres zones cérébrales ne puisse être exclue. L’obtention de nouvelles souris mutantes chez lesquelles la suppression de εRβ serait restreinte à cette structure permettrait, en comparant les phénotypes des deux sexes, de confirmer cette hypothèse.
 | Figure 2.
Chez la souris mâle, la suppression du récepteur β des oestrogènes dans le système nerveux produit des altérations de comportements sociaux et de l’humeur qui pourraient être causées par la diminution de l’expression des gènes codant l’ocytocine (OT) et l’arginine vasopressine (AVP) dans le noyau du lit de la strie terminale
. Les flèches rouges indiquent les diminutions ou augmentations des paramètres ou comportements mesurés ; le signe = indique les comportements inchangés.
|
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Ervin
KSJ
,
Lymer
JM
,
Matta
R
,
et al.
Estrogen involvement in social behavior in rodents: Rapid and long-term actions.
.
Horm Behav.
2015;
;
74
:
:53.
–
76
.
2.
Naulé
L
,
Robert
V
,
Parmentier
C
,
et al.
Delayed pubertal onset and pre-pubertal Kiss1 expression in female mice lacking central estrogen receptor β.
.
Hum Mol Genet.
2015;
;
24
:
:7326.
–
7338
.
3.
Dombret
C
,
Naulé
L
,
Trouillet
A-C
,
et al.
Effects of neural estrogen receptor β deletion on social and mood-related behaviors and underlying mechanisms in male mice.
.
Sci Rep.
2020;
;
10
:
:6242.
.
4.
Lebow
MA
,
Chen
A
.
Overshadowed by the amygdala: the bed nucleus of the stria terminalis emerges as key to psychiatric disorders.
.
Mol Psychiatry.
2016;
;
21
:
:450.
–
463
.
5.
Suzuki
H
,
Barros
RPA
,
Sugiyama
N
,
et al.
Involvement of estrogen receptor β in maintenance of serotonergic neurons of the dorsal raphe.
.
Mol Psychiatry.
2013;
;
18
:
:674.
–
680
.
6.
Acevedo-Rodriguez
A
,
Mani
SK
,
Handa
RJ
.
Oxytocin and estrogen receptor β in the brain: an overview.
.
Front Endocrinol.
2015;
;
6
:
:160.
.
7.
Krezel
W
,
Dupont
S
,
Krust
A
,
et al.
Increased anxiety and synaptic plasticity in estrogen receptor β-deficient mice.
.
Proc Natl Acad Sci USA.
2001;
;
98
:
:12278.
–
12282
.
8.
Frye
CA
,
Koonce
CJ
,
Edinger
KL
,
et al.
Androgens with activity at estrogen receptor β have anxiolytic and cognitive-enhancing effects in male rats and mice.
.
Horm Behav.
2008;
;
54
:
:726.
–
734
.
9.
Naulé
L
,
Marie-Luce
C
,
Parmentier
C
,
et al.
Revisiting the neural role of estrogen receptor β in male sexual behavior by conditional mutagenesis.
.
Horm Behav.
2016;
;
80
:
:1.
–
9
.
|