| |
| Med Sci (Paris). 37(1): 100–102. doi: 10.1051/medsci/2020264.La synthèse des céramides C18:0 par les muscles squelettiques, à l’origine de l’insulino-résistance induite par l’obésité ? Ana-Magdalena Pineau,1 Romain Vessely,1 and Hervé Le Stunff2* 1M1 Biologie santé, Université Paris-Saclay
,
91405Orsay
,
France 2Institut des neurosciences Paris-Saclay (Neuro-PSI) - CNRS UMR 9197, Équipe neuroendocrinologie moléculaire de la prise alimentaire, Université Paris-Saclay
,
Orsay
,
France MeSH keywords: Animaux, Glycémie, Céramides, Métabolisme énergétique, Hyperglycémie provoquée, Insulinorésistance, Mâle, Muscles squelettiques, Obésité, Sphingosine N-acyltransferase, métabolisme, biosynthèse |
L’obésité est caractérisée par un excès de masse grasse, qui s’accompagne souvent d’une hyperlipidémie chronique délétère pour la santé. L’obésité entraîne une résistance des tissus à l’action de l’insuline, et peut être à l’origine de différents désordres métaboliques, notamment d’un diabète de type 2 [
1
-
3
]. Le développement de nouvelles thérapies efficaces contre les maladies métaboliques induites par l’obésité constitue un enjeu majeur de santé publique car leur incidence ne cesse d’augmenter dans nos sociétés d’abondance alimentaire. Il est donc important de s’intéresser à leurs mécanismes, et en particulier à la contribution des muscles squelettiques, qui sont d’importants régulateurs du métabolisme du glucose du fait de leur sensibilité à l’insuline et de leur grande capacité à absorber le glucose sanguin. L’obésité induit un stockage anormal de lipides bioactifs dans ces muscles. Les lipides, dont les céramides, jouent un rôle important pour le fonctionnement cellulaire, mais leur accumulation excessive a été associée au développement de la résistance des cellules musculaires à l’insuline induite par l’obésité [
4
]. Les céramides sont produits par l’action d’une famille d’enzymes, les céramide synthases (CerS), qui catalysent l’acylation de la sphingosine [
5
] sur son groupement amine. La longueur de la chaîne carbonée des acides gras ajoutés est variable, et définit l’espèce de céramide formée. Ainsi, chez les mammifères, les six céramides synthases existantes sont à l’origine de la diversité des espèces de céramides synthétisées [
5
].
La nature des espèces de céramides impliquées dans la résistance musculaire à l’insuline due à l’obésité n’a pas été complètement élucidée. Il a été montré
in vitro
que la résistance à l’insuline induite par un acide gras saturé comme le palmitate est associée à l’augmentation des taux de céramides C16:0 (présence d’un acide stéarique lié à la sphingosine), alors qu’
in vivo
, la résistance musculaire à l’insuline a été associée aux céramides C18:0 [
6
,
7
]. Le groupe de J. Brüning, en utilisant différents modèles murins comportant un défaut génétique d’expression de céramide synthases, a cherché à identifier
in vivo
la ou les céramides synthases, donc les espèces de céramides, à l’origine de la résistance à l’insuline induite par l’obésité [
7
].
|
Quelle est l’espèce de céramide des cellules musculaires associée à la dérégulation de l’homéostasie énergétique et glucidique induite par l’obésité ?
Dans un premier temps, les auteurs ont montré que l’espèce de céramide la plus présente dans le muscle squelettique de souris rendues obèses par un régime alimentaire riche en lipides est le céramide C18:0. Or les céramides C18:0 sont principalement produits grâce à l’enzyme CerS1 [
5
]. La suppression génétique ubiquitaire de CerS1 conduit à une diminution de l’accumulation de céramide C18:0 dans les muscles squelettiques des souris obèses. Il a été observé que la suppression de CerS1 chez des souris obèses augmente leur dépense énergétique et donc limite la prise de poids en réduisant la masse adipeuse. Des tests physiologiques mesurant la tolérance au glucose (capacité à normaliser la glycémie suite à l’ingestion de glucose) ainsi que la sensibilité à l’insuline (capacité de l’insuline à diminuer la glycémie) montrent que la délétion du gène codant CerS1 empêche la résistance à l’insuline induite par l’obésité. L’ensemble de ces résultats expérimentaux suggère donc que l’expression de CerS1 dans différents tissus,
via
la production de céramide C18:0, contribue à la dérégulation de l’homéostasie énergétique et glucidique par l’obésité.
|
Quelle est le rôle de l’enzyme CerS1 produite par les cellules musculaires dans la dérégulation de l’homéostasie énergétique et glucidique induite par l’obésité ?
Afin de préciser l’impact, chez des souris obèses, de la suppression de CerS1 sur l’homéostasie énergétique et glucidique, l’équipe de J. Brüning a développé un modèle de souris rendues génétiquement déficientes en CerS1 dans les cellules musculaires en utilisant le système Cre-LoxP [
8
,
9
] (
→
)
avec l’expression de la recombinase Cre sous le contrôle du promoteur du gène de la créatine kinase, une enzyme produite uniquement par les cellules des muscles squelettiques. Ces chercheurs ont constaté que la suppression tissu-spécifique de CerS1 dans les muscles squelettiques conduit, tout comme sa suppression ubiquitaire, à une diminution de l’accumulation de céramides C18:0 dans les muscles des souris obèses. Les tests de tolérance au glucose et de sensibilité à l’insuline chez ces souris montrent également une amélioration de l’homéostasie glucidique. Ces résultats indiquent que la CerS1 synthétisée par les cellules musculaires contribue, par la production de céramide C18:0, à la dérégulation de l’homéostasie glucidique induite par l’obésité
(
Figure 1
)
. En revanche, l’inhibition spécifique de CerS1 dans les cellules musculaires n’améliore pas la dépense énergétique de ces souris, et n’empêche donc pas leur prise de poids lorsqu’elles sont soumises à un régime riche en lipides. La CerS1 produite dans l’hypothalamus, une région cérébrale qui joue un rôle clé dans le contrôle de la dépense énergétique [
10
,
11
], pourrait être impliquée dans ce contrôle.
(→) Voir la Mini-synthèse de C. Babinet,
m/s
n° 8, août 1995, page 1154
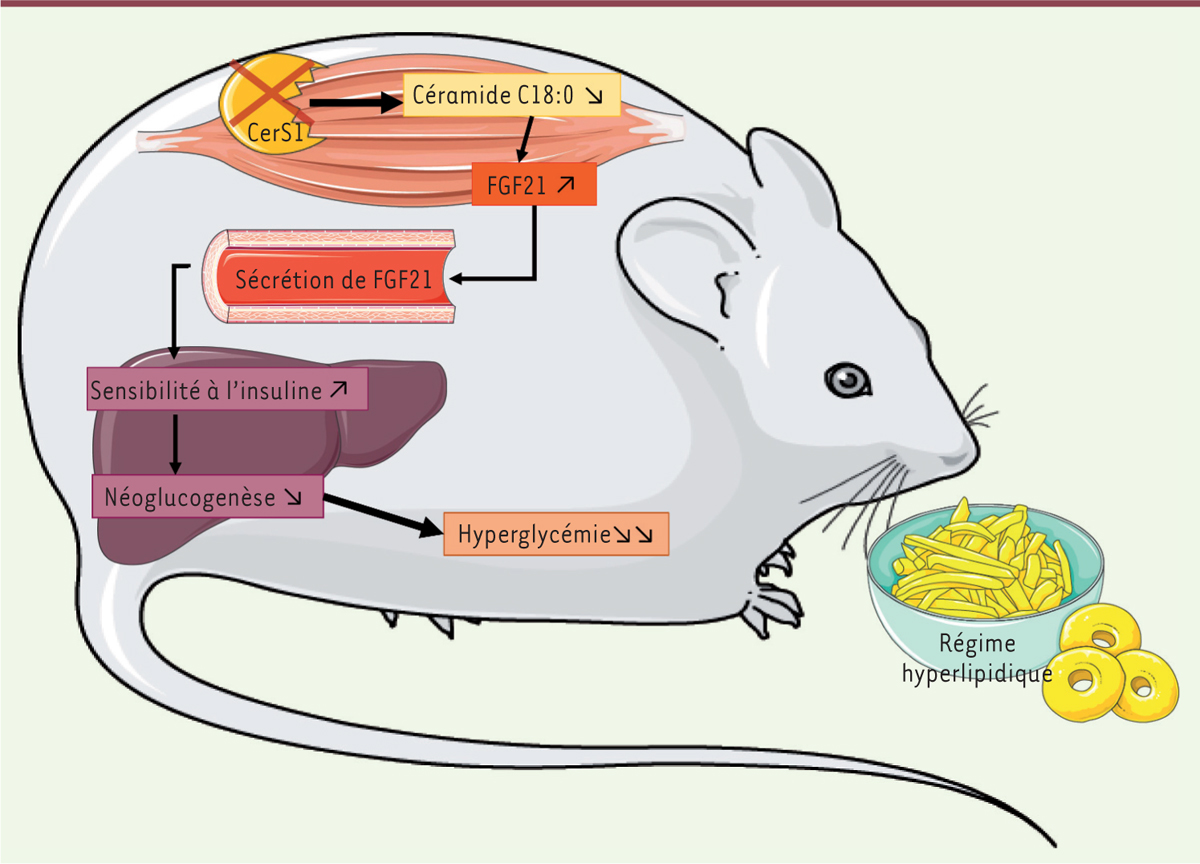
 | Figure 1.
La suppression sélective de la céramide synthase 1 dans les cellules musculaires empêche la perturbation de l’homéostasie glucidique induite par l’obésité.
Une suppression de la céramide synthase 1 (CerS1) dans les cellules musculaires entraîne une diminution de l’insulino-résistance liée à l’obésité. Dans ce cas, l’obésité induite par un régime alimentaire riche en lipides ne conduit pas à l’accumulation des céramides C18:0 dans les cellules musculaires, ce qui permet l’augmentation de la production de la protéine FGF21 (
fibroblast growth factor 21
) dans le muscle, puis sa sécrétion dans le sang. Cette protéine, connue pour ses propriétés insulino-sensibilisatrices, agit sur les cellules du foie en favorisant l’inhibition de la néoglucogenèse induite par l’insuline, et limite ainsi l’installation d’une hyperglycémie.
|
|
Comment les céramides C18:0 musculaires contribuent-ils à l’insulino-résistance induite par l’obésité ?
Une analyse plus approfondie de l’homéostasie glucidique chez les souris génétiquement déficientes en CerS1 dans les cellules musculaires, en utilisant la technique du clamp euglycémique hyperinsulinémique
1,
[
7
,
12
], a permis de confirmer que ces souris sont protégées contre la résistance à l’insuline induite par l’obésité. Néanmoins, la restauration de la sensibilité à l’insuline chez ses souris n’est pas associée à une amélioration de sa cascade de signalisation ou de l’augmentation de l’absorption du glucose par les cellules musculaires. En revanche, il apparaît que l’inhibition de la néoglucogenèse hépatique par l’insuline est nettement plus efficace, ce qui suggère l’existence d’un signal de communication entre le muscle et le foie à l’origine de l’amélioration de l’homéostasie glucidique constatée chez ces souris. Afin d’étayer cette hypothèse, les auteurs ont cherché à identifier le facteur musculaire impliqué dans cette communication. Ils ont pu montrer que l’expression de la protéine FGF21, un facteur de croissance connu pour ses propriétés insulino-sensibilisatrices [
13
], par les cellules musculaires ainsi que sa sécrétion dans le sang sont augmentées chez les souris obèses invalidées pour
Cers1 (
Figure 1
)
. Chez ces souris, la neutralisation pharmacologique de FGF21 à l’aide d’anticorps spécifiques anti-FGF21 conduit à l’installation d’une résistance à l’insuline, donc perturbe l’homéostasie glucidique. L’ensemble de ces résultats met en évidence l’importance du facteur FGF21 produit par les cellules musculaires dans le contrôle de la sensibilité à l’insuline des cellules du foie. FGF21 agit notamment en favorisant l’inhibition de la néoglucogenèse hépatique induite par l’insuline, et limite ainsi l’installation d’une hyperglycémie
(
Figure 1
)
. Il reste à identifier les mécanismes moléculaires impliqués dans cette régulation.
|
Conclusion et perspectives
L’équipe de J. Brüning a montré que l’espèce de céramide majoritaire dans le muscle squelettique de souris obèses est l’espèce C18:0, synthétisée par l’enzyme CerS1. En cas d’obésité, les céramides C18:0 des cellules musculaires,
via
l’inhibition de la production et de la sécrétion de FGF21 par ces cellules, sont à l’origine d’une résistance des hépatocytes à l’insuline. L’utilisation de médicaments qui agiraient en inactivant spécifiquement la CerS1 pourrait donc théoriquement être envisagée pour traiter le diabète de type 2 induit par l’obésité. Néanmoins, une autre étude récente a montré que l’inhibition pharmacologique de CerS1 n’améliore pas la sensibilité des tissus à l’insuline chez des souris obèses [
14
], suggérant l’existence de mécanismes compensatoires. Quoi qu’il en soit, le rôle de FGF21, sécrété par les cellules musculaires, pour la communication entre le muscle et le foie dans l’homéostasie glucidique devra désormais être pris en compte dans la conception de futurs traitements contre la résistance à l’insuline.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Goossens
G.
.
The metabolic phenotype in obesity: fat mass, body fat distribution, and adipose tissue function.
.
Obes Facts.
2017;
;
10
:
:207.
–
215
.
2.
Turinsky
J
,
O’Sullivan
DM
,
Bayly
BP
.
1,2-diacylglycerol and ceramide levels in insulin-resistant tissues of the rat in vivo.
.
J Biol Chem.
1990;
;
265
:
:16880.
–
16885
.
3.
Roden
M
,
Price
TB
,
Perseghin
G
,
et al.
Mechanism of free fatty acid-induced insulin resistance in humans.
.
J Clin Invest.
1996;
;
97
:
:2859.
–
2865
.
4.
Turpin
SM
,
Lancaster
GI
,
Darby
I
,
et al.
Apoptosis in skeletal muscle myotubes is induced by ceramides and is positively related to insulin resistance.
.
Am J Physiol Endocrinol Metab.
2006;
;
291
:
:1341.
–
1350
.
5.
Mullen
TD
,
Hannun
YA
,
Obeid
LM
.
Ceramide synthases at the centre of sphingolipid metabolism and biology.
.
Biochem J.
2012;
;
441
:
:789.
–
802
.
6.
Park
M
,
Kaddai
V
,
Ching
J
,
et al.
A role for ceramides, but not sphingomyelins, as antagonists of insulin signaling and mitochondrial metabolism in C2C12 myotubes.
.
J Biol Chem.
2016;
;
291
:
:23978.
–
23988
.
7.
Turpin-Nolan
SM
,
Hammerschmidt
P
,
Chen
W
,
et al.
CerS1-derived C18:0 ceramide in skeletal muscle promotes obesity-induced insulin resistance.
.
Cell Rep.
2019;
;
26
:
:1.
–
10
.
8.
Schwenk
F
,
Baron
U
,
Rajewsky
K
.
A Cre-transgenic mouse strain for the ubiquitous deletion of loxP-flanked gene segments including deletion in germ cells.
.
Nucleic Acids Res.
1995;
;
23
:
:5080.
–
5081
.
9.
Babinet
C.
.
Un nouveau pas dans l’utilisation du système Cre-LoxP chez les cellules souches embryonnaires de souris : la création de remaniements chromosomiques.
.
Med Sci (Paris).
1995;
;
11
:
:1154.
–
1157
.
10.
Abdalla
MM
.
Central and peripheral control of food intake.
.
Endocr Regul.
2017;
;
51
:
:52.
–
70
.
11.
Laperrousaz
E
,
Moullé
VS
,
Denis
RG
,
et al.
Lipoprotein lipase in hypothalamus is a key regulator of body weight gain and glucose homeostasis in mice.
.
Diabetologia.
2017;
;
60
:
:1314.
–
1324
.
12.
Könner
AC
,
Janoschek
R
,
Plum
L
,
et al.
Insulin action in AgRP-expressing neurons is required for suppression of hepatic glucose production.
.
Cell Metab.
2007;
;
5
:
:438.
–
449
.
13.
BonDurant
LD
,
Ameka
M
,
Naber
MC
,
et al.
FGF21 regulates metabolism through adipose-dependent and -independent mechanisms.
.
Cell Metab.
2017;
;
25
:
:935.
–
944
.
14.
Turner
N
,
Lim
XY
,
Toop
HD
,
et al.
A selective inhibitor of ceramide synthase 1 reveals a novel role in fat metabolism.
.
Nat Commun.
2018;
;
9
:
:3165.
.
|