| |
| Med Sci (Paris). 37(1): 97–100. doi: 10.1051/medsci/2020263.PolDIP2, une protéine clé de la régulation du fonctionnement mitochondrial et du métabolisme cellulaire Étienne Andjongo,1 Sonia Benhamouche,1 Aicha Bouraoui,2 and Laura Baciou2* 1M1 Biologie santé, Université Paris-Saclay
,
91405Orsay
,
France 2Université Paris-Saclay, CNRS, Institut de chimie physique, UMR8000
,
91405Orsay
,
France |
L’actualité scientifique vue par les étudiants du Master Biologie Santé, module physiopathologie de la signalisation, Université Paris-Saclay
Équipe pédagogique
Karim Benihoud (professeur, université Paris-Sud)
Sophie Dupré (maître de conférences, université Paris-Sud)
Boris Julien (maître de conférences, université Paris-Sud)
Philippe Robin (maître de conférences, université de Paris-Sud)
Hervé Le Stunff (professeur, université Paris-Sud)
karim.benihoud@u-psud.fr
Série coordonnée par Sophie Sibéril.
La protéine PolDIP2 (
polymerase delta-interacting protein 2
) également dénommée PDIP38 (
polymerase delta-interacting protein of 38 kDa
), exprimée de manière constitutive, a été identifiée comme partenaire de liaison de l’ADN polymérase-δ. Elle serait impliquée dans la réplication et la réparation de l’ADN nucléaire [
1
], mais elle interagit également avec des protéines mitochondriales et serait impliquée dans plusieurs fonctions encore non identifiées [
2
]. PolDIP2 a une masse moléculaire de 37 kDa après le clivage d’une séquence signal d’adressage à la mitochondrie, localisée à son extrémité N-terminale. Deux domaines fonctionnels, YccV-like et DUF525, ont été identifiés dans sa séquence primaire. Le domaine DUF525 serait impliqué dans les interactions protéine-protéine [
3
].
|
Implication de PolDIP2 dans le métabolisme mitochondrial
Sur la base de sa localisation intracellulaire et de son interaction avec des composants mitochondriaux, Paredes
et al
. ont impliqué PolDIP2 dans le fonctionnement mitochondrial et le métabolisme cellulaire [
4
]. Ces auteurs ont d’abord étudié la distribution de PolDIP2 dans différents tissus, et ont montré, dans divers types cellulaires, tels que les cellules musculaires lisses aortiques humaines, les cellules épithéliales mammaires humaines et les fibroblastes embryonnaires murins, que la protéine est localisée presque exclusivement dans les mitochondries. Ils ont ensuite comparé le métabolisme bioénergétique mitochondrial de cellules déficientes ou non en PolDIP2, et ont montré que dans les cellules exprimant faiblement PolDIP2, le niveau d’oxygène basal est plus faible et l’acidification du milieu extracellulaire plus importante. Ils ont également découvert que ces cellules produisent moins d’ATP par phosphorylation oxydative, tout en ayant un même niveau global d’ATP [
4
]. Ces résultats suggèrent l’existence d’une reprogrammation cellulaire associée à une augmentation de la glycolyse anaérobie.
|
Implication de PolDIP2 dans la régulation d’enzymes du cycle de Krebs
La lipoylation d’enzymes cataboliques mitochondriales, telles que les pyruvate (PDH) et α-cétoglutarate (α-KGDH) déshydrogénases, est une modification post-traductionnelle de ces protéines, nécessaire à leur activité enzymatique, et consistant en une fixation covalente, par une liaison amide, d’un lipoate sur des résidus lysine spécifiques en présence d’ATP
(
Figure 1
)
. Les mécanismes impliqués dans la lipoylation des protéines ont fait l’objet d’études approfondies chez la bactérie
Escherichia coli
[
5
] et, plus récemment, chez la levure
Saccharomyces cerevisae
[
6
]. Toutefois, une étude portant sur des cellules de mammifères, a montré que la lipoylation des protéines est inhibée par l’hypoxie et dans les cellules cancéreuses [
7
].
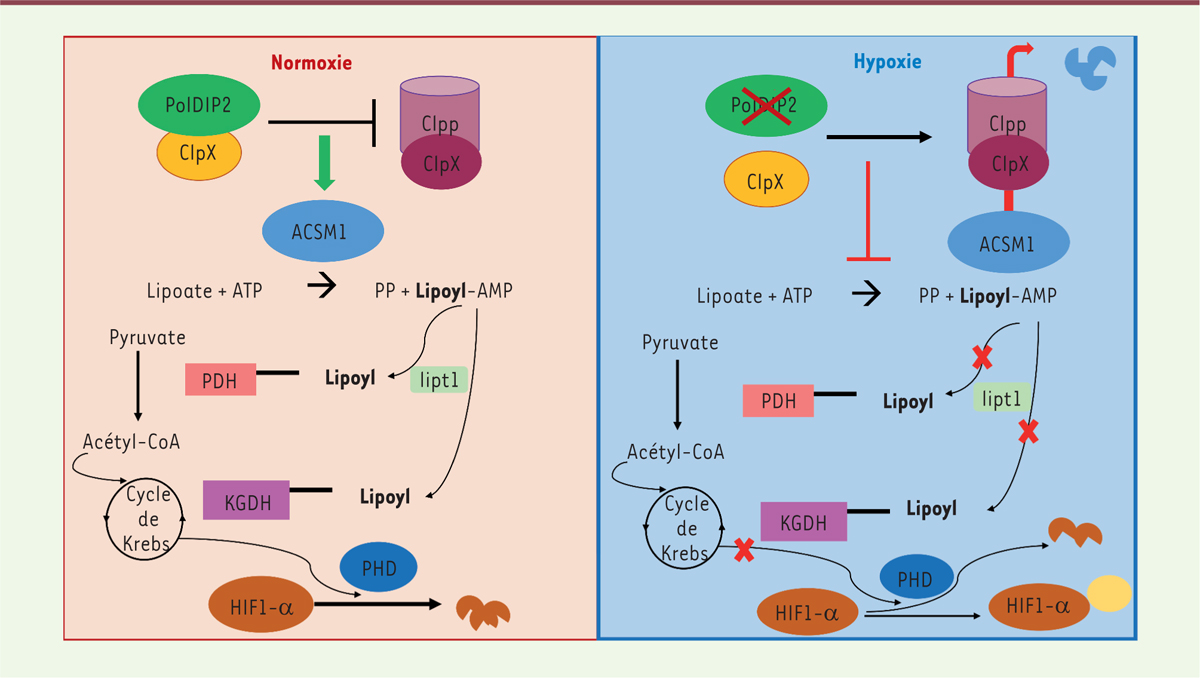
 | Figure 1.
Rôle de PolDIP2 dans le métabolisme mitochondrial.
En situation de normoxie (à gauche), PolDIP2 séquestre Clpx, ce qui inhibe la formation du complexe Clpp-Clpx, responsable de la dégradation de la protéine mitochondriale ACSM1 (
Acetyl-CoA synthetase medium-chain family member 1
). ACSM1 catalyse la réaction conduisant à la formation du lipoyl-AMP à partir du lipoate, en présence d’ATP. L’enzyme mitochondriale LIPT1 (
lipoyltransferase 1
) greffe le groupement lipoyl sur les enzymes PDH (pyruvate déshydrogénase) et α-KGDH (α-cétoglutarate déshydrogénase) intervenant dans le cycle de Krebs. La respiration mitochondriale stabilise les protéines PHD (
prolyl-4-hydroxylase domain-containing proteins)
, conduisant à la dégradation du facteur HIF1-α.
|
Paredes
et al.
ont entrepris de vérifier la stabilité de la protéine HIF-1α (
hypoxia-inducible factor 1
a) dans les cellules déficientes ou non en PolDIP2, car HIF-1α est fortement exprimée en situation d’hypoxie [
8
]. Ils ont montré, grâce à une analyse des protéines cellulaires par
western blot
, qu’en l’absence de PolDIP2, la protéine HIF-1α est stabilisée, ce qui induit l’expression de la pyruvate déshydrogénase kinase (PDK), un inhibiteur de la sous-unité PDHE1α du complexe enzymatique PDH [
4
].
La protéine HIF-1α a une demi-vie de quelques minutes. Elle est rapidement hydroxylée par un membre de la famille des prolyl-4-hydroxylases (
prolyl-4-hydroxylase domain-containing proteins
, PHD), puis reconnue par un complexe d’ubiquitine ligase E3, poly-ubiquitinylée et dégradée par le protéasome. La réaction d’hydroxylation dépend de la disponibilité en oxygène et de l’α-cétoglutarate. Une perturbation des enzymes du cycle de Krebs inhibe les PHD et stabilise HIF-1α. L’hypothèse des auteurs selon laquelle la stabilisation de HIF-1α en l’absence de PolDIP2 serait due à l’inhibition de l’enzyme PHD2 a pu être confirmée par un dosage de l’α-cétoglutarate, montrant que sa concentration était faible dans les cellules déficientes en PolDIP2. De plus, l’ajout d’un dérivé de l’α-cétoglutarate dans le milieu de culture a restauré la stabilité de HIF-1α [
4
].
Une étude génétique réalisée chez le nématode
Caenorhabditis elegans
avait prédit une association fonctionnelle entre les produits des gènes
tag-307
et
gip-2,
orthologues présumés des gènes humains codant respectivement PolDIP2 et la lipoyltransférase 1 (LIPT1) [
9
], une protéine mitochondriale codée par l’ADN nucléaire. Chez les mammifères, LIPT1 permet le transfert du groupement lipoyl-AMP sur deux des trois composants enzymatiques des complexes PDH et α-KGDH : la dihydrolipoamide S-acétyltransférase (DLAT) et la dihydrolipoamide S-succinyltransférase (DLST). Paredes
et al.
ont analysé la lipoylation de ces deux enzymes dans les cellules déficientes en PolDIP2, et ont trouvé une réduction significative des concentrations de lipoyl-DLAT et de lipoyl-DLST, conduisant à une inhibition des complexes enzymatiques PDH et α-KGDH. Ils ont également constaté une augmentation, probablement par un mécanisme compensateur, mais inefficace, de la concentration de LIPT1 [
4
].
|
Régulation de l’enzyme ACSM1, impliquée dans la lipoylation des protéines mitochondriales, par PolDIP2
Il a été montré, dans des cellules de mammifère, que la lipoylation des protéines nécessite la présence de l’enzyme ACSM1 (
acetyl-CoA synthetase medium-chain family member 1
) [
10
]. Paredes
et al.
ont observé une absence de la protéine ACSM1 dans les cellules déficientes en PolDIP2, associée à une diminution de la lipoylation des protéines DLAT et DLST. La lipoylation de ces deux protéines est rétablie lorsque l’expression d’ACSM1 est restaurée [
4
]. Ces résultats indiquent que la perte d’ACSM1 est la principale cause de l’absence de lipoylation dans des cellules déficientes en PolDIP2.
Des expériences de co-immunoprécipitation ont révélé l’existence d’une interaction forte entre la protéine CLPX (
caseinolytic protease subunit X
) et PolDIP2. CLPX est une ATPase chaperonne se liant à la peptidase caséinolytique CLPP pour former le complexe Clp-protéase. CLPX permet l’entrée de protéines dans le protéasome en assurant un changement de leur conformation, un processus consommant de l’ATP. Les auteurs ont montré que dans les cellules déficientes en CLPP, la diminution de l’expression de PolDIP2 n’induit pas la dégradation de ACSM1, permettant ainsi de préserver la lipoylation des sous-unités DLAT et DLST [
4
]. L’interaction spécifique entre PolDIP2 et CLPX suggère également que PolDIP2 peut inhiber l’activité du complexe Clp-protéase en séquestrant CLPX, et empêcher par conséquent la dégradation d’ACSM1, permettant ainsi la lipoylation des complexes enzymatiques PDH et α-KGDH.
|
Conséquence de l’hypoxie sur le métabolisme cellulaire
Paredes
et al.
ont montré que l’hypoxie réduit significativement la quantité de protéines ACSM1 et la lipoylation de DLAT et DLST, en même temps qu’elle induit la stabilisation de la protéine HIF-1α. Une expression exogène de PolDIP2 en condition d’hypoxie était suffisante pour rétablir les taux d’ACSM1, de lipoyl-DLST et de lipoyl-DLAT [
4
].
Dans certains types de cancers agressifs, tels que le cancer du sein « triple-négatif »
1,
, les cellules cancéreuses présentent un phénotype hautement glycolytique. Les auteurs ont émis l’hypothèse que le déficit en PolDIP2 pourrait contribuer à ce phénotype. Ils ont démontré que, dans les cellules de cancer du sein « triple-négatif », l’expression de PolDIP2 est faible, et la lipoylation de DLAT et DLST est complètement inhibée. Ils ont ensuite évalué l’impact de PolDIP2 sur la fonction mitochondriale : la surexpression de PolDIP2 dans des lignées cancéreuses a permis de stabiliser la protéine ACSM1, d’augmenter la lipoylation de la PDH et α-KGDH, et de réduire la stabilisation d’HIF-1α sous condition de normoxie. Ces changements biochimiques étaient accompagnés par la lipoylation des enzymes mitochondriales, une augmentation de la respiration mitochondriale, ainsi que par une importante inhibition de la croissance cellulaire [
4
].
En conclusion, l’étude de Paredes
et al
. a permis de montrer que PolDIP2 est un régulateur de la lipoylation de protéines mitochondriales. PolDIP2, en séquestrant la protéine Clpx, inhibe la formation du complexe Clpp-Clp, ce qui conduit à la stabilisation d’ACSM1, qui n’est alors plus dégradé. ACSM1 catalyse la réaction conduisant à la formation du lipoyl-AMP, ce qui permet l’activation par lipoylation des enzymes PDH et α-KGDH intervenant dans le cycle de Krebs
(
Figure 1
)
. Ce mécanisme est inhibé en condition d’hypoxie car la concentration cellulaire de PolDIP2 diminue alors fortement. Cela permet une adaptation du métabolisme énergétique de la cellule, normale ou cancéreuse, en situation d’hypoxie.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Liu
L
,
Rodriguez-Belmonte
EM
,
Mazloum
N
,
et al.
Identification of a novel protein, PDIP38, that interacts with the p50 subunit of DNA polymerase d and proliferating cell nuclear antigen.
.
J Biol Chem.
2003;
;
278
:
:10041.
–
10047
.
2.
Cheng
X
,
Kanki
T
,
Fukuoh
A
,
et al.
PDIP38 associates with proteins constituting the mitochondrial DNA nucleoid.
.
J Biochem.
2005;
;
138
:
:673.
–
678
.
3.
Kim
Y
,
Park
H
,
Nah
J
,
et al.
Essential role of POLDIP2 in Tau aggregation and neurotoxicity via autophagy/proteasome inhibition.
.
Biochem Biophys Res Commun.
2015;
;
462
:
:112.
–
118
.
4.
Paredes
F
,
Sheldon
K
,
Lassegue
B
,
et al.
Poldip2 is an oxygen-sensitive protein that controls PDH and aKGDH lipoylation and activation to support metabolic adaptation in hypoxia and cancer.
.
Proc Natl Acad Sci USA.
2018;
;
115
:
:1789.
–
1794
.
5.
Morris
TW
,
Reed
KE
,
Cronan
JE
,
Jr.
.
Lipoic acid metabolism in Escherichia coli: the lplA and lipB genes define redundant pathways for ligation of lipoyl groups to apoprotein.
.
J Bacteriol.
1995;
;
177
:
:1.
–
10
.
6.
Hermes
FA
.
Cronan
JE. The role of the Saccharomyces cerevisiae lipoate protein ligase homologue, Lip3, in lipoic acid synthesis
.
.
Yeast.
2013;
;
30
:
:415.
–
427
.
7.
Chen
YC
,
Kuo
CC
,
Chian
CF
,
et al.
Knockdown of POLDIP2 suppresses tumor growth and invasion capacity and is linked to unfavorable transformation ability and metastatic feature in non-small cell lung cancer.
.
Exp Cell Res.
2018;
;
368
:
:42.
–
49
.
8.
Semenza
GL
.
Hypoxia-inducible factor 1: control of oxygen homeostasis in health and disease.
.
Pediatr Res.
2001;
;
49
:
:614.
–
617
.
9.
Szklarczyk
D
,
Franceschini
A
,
Kuhn
M
,
et al.
The STRING database in 2011: functional interaction networks of proteins, globally integrated and scored.
.
Nucleic Acids Res.
2011;
;
39
:
:D561.
–
D568
.
10.
Fujiwara
K
,
Takeuchi
S
,
Okamura-Ikeda
K
,
Motokawa
Y
.
Purification, characterization, and cDNA cloning of lipoate-activating enzyme from bovine liver.
.
J Biol Chem.
2001;
;
276
:
:28819.
–
28823
.
|