| |
| Med Sci (Paris). 37(1): 53–58. doi: 10.1051/medsci/2020261.
Un analogue du
glucagon-like peptide 1
(GLP1) administré par voie orale
Une nouveauté dans le traitement du diabète de type 2 Étienne Larger1* 1Université de Paris et Service de diabétologie et immunologie clinique, Hôpital Cochin, APHP centre-université de Paris
,
27 rue du Faubourg Saint-Jacques
,
75014Paris
,
France |
Vignette (© Inserm/Latron, Patrice).
Le sémaglutide pour prise orale (Rybelsus®) a obtenu une autorisation de mise sur le marché (AMM) par l’Agence européenne des médicaments, un évènement majeur puisqu’il s’agit du premier médicament peptidique à effet général administré par voie orale. Cette percée dans le domaine de l’utilisation de peptides à usage thérapeutique en annonce probablement d’autres dans un avenir proche [
1
].
|
Il a été montré, il y a plus de 40 ans, que deux délivrances orales de glucose, l’une double de l’autre, déclenchaient une sécrétion d’insuline différente, alors même que les évolutions de la glycémie au cours du test restaient similaires [
2
] : cette observation démontrait que la glycémie n’est pas le seul facteur contrôlant la sécrétion d’insuline
1
. D’autres travaux montrèrent ultérieurement que, pour une même charge de glucose, la quantité d’insuline sécrétée différait selon que le glucose était administré par voie orale ou par voie intraveineuse, et cela avec des valeurs de glycémie égales au cours du test [
3
,
4
] : c’est « l’effet incrétine », dont l’existence avait été pressentie dès 1906 [
5
,
22
] (
→
).
→ Voir la Mini-synthèse de B. Thorens,
m/s
n° 8-9,aoûtseptembre 2003, page 860
La sécrétion d’insuline en réponse au glucose intestinal ne dépend pas seulement de l’augmentation de la glycémie, mais aussi de signaux provenant de l’intestin, relayés par voies nerveuse et hormonale. Cet effet hormonal « incrétine » est dû essentiellement à deux hormones peptidiques : le GIP
(glucose-dependent insulinotropic polypeptide
) et le GLP1 (
glucagon-like peptide
), un produit de clivage du proglucagon
2
[
6
]. Si l’on s’accorde à dire que l’effet incrétine rend compte d’environ 60 % de la sécrétion post-prandiale d’insuline, l’implication relative du GIP et du GLP1 dans cet effet reste discutée [
7
]. Chez les patients diabétiques de type 2, la sécrétion de GLP1 est réduite, et ces patients avaient d’abord été décrits comme résistants à l’action du GIP. Cette hypothèse n’a cependant pas été confirmée ultérieurement, ce qui a conduit à concevoir des peptides synthétiques hybrides bi-agonistes, produits à la fois à partir de la séquence du GIP et de celle du GLP1. Ces peptides bispécifiques, en cours de développement industriel, activent les récepteurs de ces deux hormones [
8
]. Des agonistes spécifiques des récepteurs du GLP1 (aGLP1) ont également été développés, ainsi que des inhibiteurs de la dipeptidyl peptidase 4 (DPP4), la principale enzyme responsable du catabolisme du GLP1 et du GIP. Une intense recherche en cours sur ces molécules et leurs récepteurs témoigne de l’importance qui leur est accordée
3
.
Le GLP1 amplifie la sécrétion d’insuline induite par le glucose. Il inhibe la sécrétion de glucagon (cet effet semble indirect,
via
la somatostatine, et est différent de celui du GIP qui, lui, stimule la sécrétion de glucagon), ralentit la vidange gastrique et le transit intestinal et, à fortes doses, induit un effet central de satiété précoce et de faim retardée, ce qui rend compte de la perte de poids observée lors d’un traitement de long cours par les aGLP1 [
6
]. Cette perte de poids n’est pas observée avec les inhibiteurs de la DPP4, qui augmentent seulement modérément les concentrations post-prandiales de GLP1 et de GIP.
L’avènement des aGLP1 constitue un succès industriel et thérapeutique majeur dans la pharmacopée du diabète de type 2. En France, les aGPL1 commercialisés sont l’exénatide, le liraglutide, le dulaglutide et le sémaglutide. Au-delà de leur effet bénéfique sur le contrôle de la glycémie, les essais de sécurité cardio-vasculaire ont montré que ces médicaments avaient également des effets bénéfiques sur le risque cardio-vasculaire et rénal chez les patients diabétiques. Les aGLP1 induisent en outre une perte de poids significative
4
, améliorant ainsi les hépatopathies métaboliques. Ils sont donc en passe de devenir la classe de médicaments majeure pour le traitement du diabète de type 2, à tel point que la Société européenne de cardiologie recommande qu’ils soient désormais prescrits en première intention chez les patients diabétiques à haut risque cardio-vasculaire. La metformine, un antidiabétique oral commercialisé en France depuis 1979, est ainsi détrônée (mais pas abandonnée…), à la suite de preuves concordantes qui ont été obtenues à partir d’essais thérapeutiques de grande ampleur avec cette nouvelle classe de médicaments [
9
]. Rappelons cependant qu’un mois de traitement avec la metformine ne coûte qu’environ 5 euros, tandis que la même durée de traitement par le sémaglutide, en injection hebdomadaire, revient à plus de 80 euros.
|
Le sémaglutide administré par voie orale
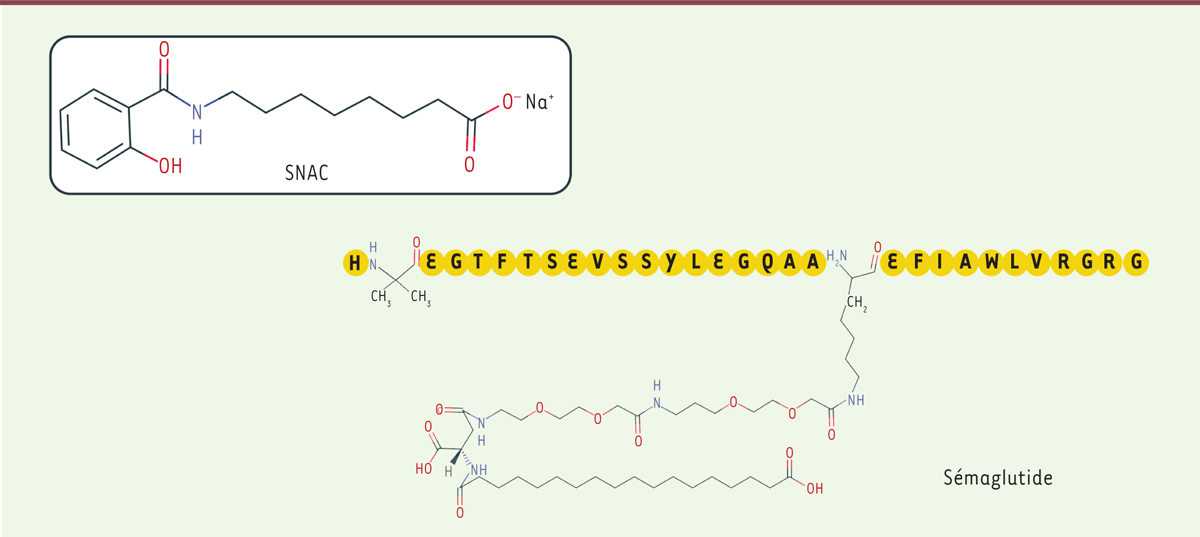
Le sémaglutide en solution injectable (Ozempic®) est commercialisé en France (AMM de l’agence européenne des médicaments en 2018) sous forme de trois doses injectables possibles (0,25 mg, 0,5 mg, 1 mg), et avec une recommandation d’administration hebdomadaire par voie sous-cutanée. Cette fréquence d’administration est similaire à celle indiquée pour le dulaglutide, tandis que le liraglutide et l’exénatide dans sa forme princeps doivent respectivement être administrés quotidiennement et biquotidiennement. La séquence peptidique du sémaglutide présente 94 % d’identité avec celle du GLP1
(
Figure 1
)
, et comporte notamment deux modifications d’acides aminés : la première abolit le site de liaison à la DPP4, la seconde permet le branchement d’un acide stéarique en position C26. Ces deux modifications contribuent à prolonger la durée d’action du peptide, qui est de 8 jours pour le sémaglutide injectable, alors qu’elle n’est que de quelques minutes pour le GLP1 natif.
 | Figure 1.
Formules du N- [8 (2-hydroxylbenzoyl) amino] caprylate de sodium (SNAC) et des sémaglutide.
|
La formulation du sémaglutide pour prise orale associe le peptide le N-[8 (2-hydroxylbenzoyl) amino] caprylate de sodium (SNAC)
(
Figure 1
)
. Ce nouvel excipient semble favoriser l’absorption de peptides en augmentant le pH gastrique, limitant ainsi leur dégradation, en particulier par la pepsine [
1
,
10
, 11]. Le SNAC semble également favoriser la forme monomérique du sémaglutide, au détriment de la forme oligomérique qui a tendance à se former spontanément, ce qui améliore aussi son absorption. Par ailleurs, le SNAC diminue transitoirement la résistance électrique transépithéliale de la muqueuse gastrique, permettant ainsi une amélioration du passage transépithélial des petites molécules. En présence du SNAC, une partie du sémaglutide ingéré est absorbée par voie transcellulaire dans l’estomac, le reste étant ensuite dégradé dans l’intestin. On notera néanmoins que le rapport de l’Agence européenne des médicaments souligne que la preuve que cet excipient augmente effectivement l’absorption du sémaglutide n’a pas encore été apportée
in vivo
5
. Le SNAC semble dépourvu d’effets cardiaques, vasculaires ou neurologiques indésirables. Une toxicité rénale est cependant observée chez l’animal, mais à des doses plus de 100 fois supérieures à celles utilisées pour la formulation du sémaglutide.
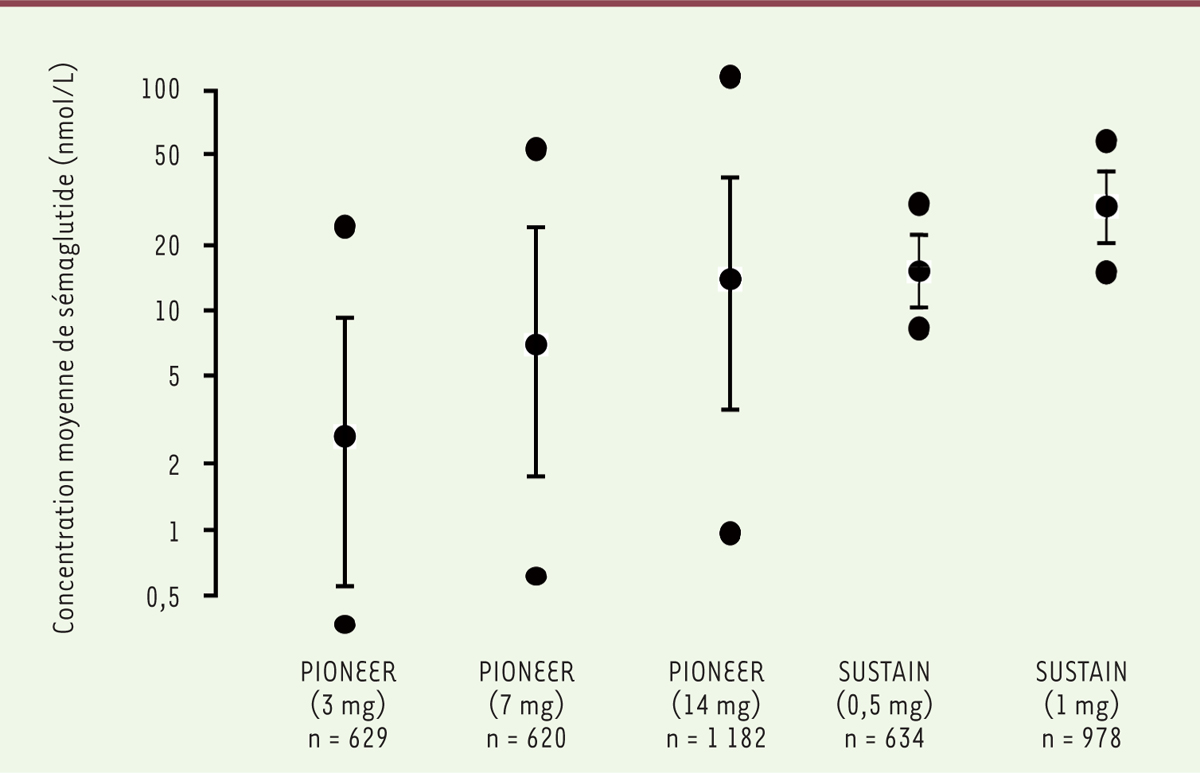
Après l’administration orale de sémaglutide, le pic de concentration sérique de la molécule est observé en 2 à 4 heures
6,
, avec une biodisponibilité de l’ordre de 1 % (0,2 % chez le singe) et une importante variabilité inter-individuelle et intra-individuelle
7
(
Figure 2
)
. La pharmacocinétique est proportionnelle à la dose de sémaglutide administrée, et son absorption est modifiée par l’ingestion concomitante d’un repas.
 | Figure 2.
Variabilité des concentrations plasmatiques moyennes de sémaglutide dans les différentes études PIONEER, pour différentes doses quotidiennes du médicament administré par voie orale (3 mg, 7 mg, ou 14 mg), comparées aux valeurs obtenues avec une administration hebdomadaire par voie sous-cutanée (0,5 mg ou 1 mg) dans les études SUSTAIN.
Pour chaque condition sont indiquées la moyenne et l’écart-type, ainsi que les valeurs extrêmes (n indique le nombre de patients diabétiques dans chaque groupe). Figure adaptée d’après l’
Assessment report
EMA/95374/2020.
|
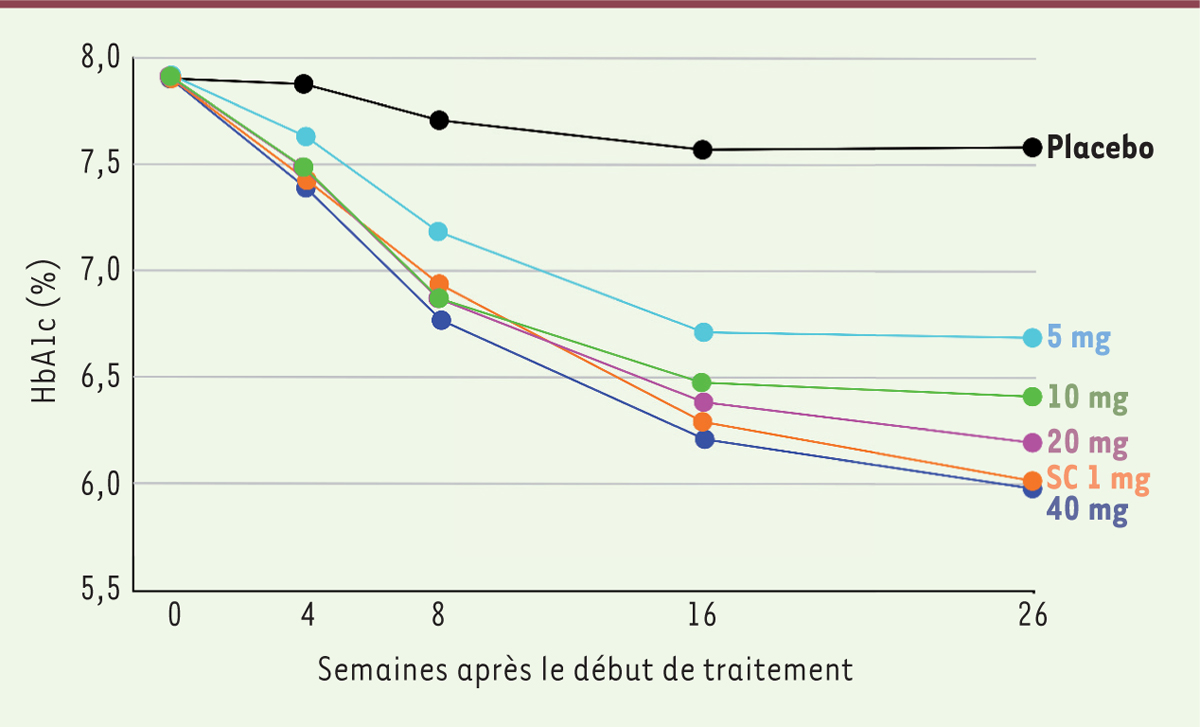
La recherche des doses actives a comparé plusieurs doses de sémaglutide (entre 2,5 mg/j et 40 mg/j) administré quotidiennement par voie orale (dose thérapeutique atteinte en 6 à 12 semaines
8
) à une dose de 1 mg de sémaglutide injectable administrée par injection sous-cutanée hebdomadaire (dose augmentée de 0,25 à 1 mg sur une durée de 8 semaines) [
12
], chez des individus en surpoids, dont l’indice de masse corporelle (IMC) était de 32 kg/m² en moyenne, et pour lesquels la valeur du taux d’hémoglobine glyquée (HbA
1c
)
9
était de 8 % en moyenne. Dans cette étude, un effet équivalent à celui de la dose sous-cutanée utilisée a été obtenu pour la dose orale de 40 mg/j, soit une dose hebdomadaire près de 300 fois supérieure à la dose sous-cutanée
(
Figure 3
)
. La nature et la fréquence des effets indésirables avec cette dose orale étaient cependant similaires à celles qui ont été observées lors d’une administration par voie sous-cutanée. En fait, dans la plupart des essais cliniques de phase III réalisés, c’est une dose quotidienne orale de 14 mg qui a été utilisée, car cette dose induit une diminution du taux d’HbA
1c
similaire à celle obtenue avec la dose hebdomadaire recommandée pour la voie sous-cutanée, qui est de 0,5 mg.
 | Figure 3.
Effet de doses quotidiennes de sémaglutide administré par voie orale (de 5 à 40 mg) ou d’une dose hebdomadaire injectée par voie sous-cutanée (sc, 1 mg) sur l’évolution du taux d’HbA1c durant 26 semaines, chez des patients atteints d’un diabète de type 2
(figure adaptée d’après [
12
]).
|
|
Principaux essais cliniques de phase III : toxicité et études d’efficacité comparatives La sécurité cardio-vasculaire (étude PIONEER 6) : une non-infériorité sans supériorité…
L’étude PIONEER 6 est une étude multicentrique internationale, commanditée par les autorités de régulation américaine (
Food and drug administration
, FDA) et européenne (Agence européenne des médicaments, AEM). Elle a porté sur plus de 3 000 patients diabétiques, avec une durée de suivi médiane de 16 mois, et a comparé le sémaglutide oral (14 mg/j) à un placebo, chacun étant administré en plus de la poursuite du traitement antérieur [
13
]. Sur demande de la FDA, la stratégie d’analyse a été celle d’un essai de « non-infériorité » afin de vérifier que l’administration du peptide par voie orale n’était pas responsable d’un excès de plus de 80 % d’évènements cardio-vasculaires indésirables (un critère composite rassemblant des évènements divers) par rapport au placebo, l’étude devant être poursuivie jusqu’à ce que plus de 122 évènements aient été enregistrés. On peut juger cette stratégie d’analyse beaucoup moins ambitieuse que celles appliquées récemment à d’autres molécules, pour lesquelles on a pu démontrer, sur le même critère composite, non seulement leur non-infériorité, mais aussi leur supériorité par rapport au placebo. Cette étude a été arrêtée après avoir observé 137 évènements du critère composite : une non-infériorité du sémaglutide oral par rapport au placebo a été démontrée, mais pas sa supériorité.
Sémaglutide administré par voie orale : une comparaison à d’autres stratégies thérapeutiques dans le diabète de type 2 Comparaison du sémaglutide administré par voie orale avec le liraglutide (étude PIONEER 4)
L’étude internationale PIONEER 4, de phase III, réalisée en double aveugle et avec un double placebo (oral et injectable), a comparé le sémaglutide administré par voie orale (dose augmentée progressivement jusqu’à 14 mg/j, plus placebo injectable), le liraglutide (dose injectée augmentée progressivement jusqu’à 1,8 mg/j, plus placebo oral), et le double placebo, chez des patients diabétiques déjà traités par la metformine, avec ou sans inhibiteur du cotransporteur sodium/glucose rénal de type 2 (
sodium/glucose cotransporter 2
, SGLT2) assurant la plus grande part de la réabsorption du glucose dans le tubule proximal [
14
]. Le critère principal de jugement était la baisse du taux d’HbA
1c
après 6 mois de traitement. Plus de 700 patients (âge moyen 56 ± 10 ans, HbA
1c
8,0 ± 0,7 %, IMC 33,0 ± 6,3 kg/m²) ont été inclus dans cette étude, dont la moitié de femmes. La baisse du taux d’HbA
1c
observée avec le sémaglutide administré par voie orale s’est révélée supérieure à celle observée avec le placebo double (– 1,0 % vs. – 0,2 %) et non inférieure à celle observée avec le liraglutide. De plus, après un an, la perte de poids avec le sémaglutide oral (5 kg en moyenne) était supérieure à celle observée avec le liraglutide, ce qui n’est pas surprenant puisqu’on savait déjà que chez les sujets obèses non diabétiques, l’effet du sémaglutide injectable sur le poids, à la dose de 0,5 mg par semaine, est supérieur à celui du liraglutide à la dose de 3 mg/j [
15
].
Sémaglutide administré par voie orale et dulaglutide (étude PIONEER 10)
L’étude PIONEER 10 a concerné des patients diabétiques japonais [
16
], chez lesquels a été comparé le sémaglutide administré par voie orale (à la dose quotidienne de 3 à 14 mg) au dulaglutide administré par voie sous-cutanée (à la dose hebdomadaire de 0,75 mg)
10
dans une étude ouverte (où le patient et l’expérimentateur connaissent tous deux l’appartenance du patient au groupe traité par sémaglutide ou au groupe traité par dulaglutide). Dans cette étude, une dose de 7 mg/j de sémaglutide administré par voie orale s’est révélée supérieure au dulaglutide injecté de façon hebdomadaire, tant en ce qui concerne la baisse du taux d’HbA
1c
que la perte de poids. Cependant, une étude en double aveugle aurait été préférable, en utilisant la dose hebdomadaire de dulaglutide recommandée (1,5 mg/semaine) plutôt que la dose de 0,75 mg préconisée seulement en début de traitement.
Comparaison du sémaglutide administré par voie orale à la sitagliptine, un inhibiteur de l’enzyme DPP4 (étude PIONEER 3)
Cette étude internationale de phase III [
17
], réalisée en double aveugle (avec deux placebo par voie orale), a concerné des patients diabétiques traités par metformine plus ou moins sulfonylurée, ayant globalement les mêmes caractéristiques cliniques que les patients ayant participé à l’étude PIONEER 4 (voir ci-dessus). Le sémaglutide administré par voie orale à la dose de 7 mg/j ou de 14 mg/j s’est révélé plus efficace que la sitagliptine (administrée par voie orale à la dose de 100 mg/j) pour induire la baisse du taux d’HbA
1c
et la perte de poids. Mais, à l’instar de tous les inhibiteurs de la DPP4, la sitagliptine n’a pas d’effet connu sur le poids. Une autre étude (PIONEER 7), de conception un peu plus complexe, a abouti aux mêmes conclusions [
18
].
Comparaison du sémaglutide administré par voie orale à l’empagliflozine, un inhibiteur du SGLT2 (étude PIONEER 2)
L’étude PIONEER 2 est une étude randomisée ouverte. Elle a concerné 800 patients traités par la metformine, à laquelle a été ajouté le sémaglutide administré par voie orale (à la dose de 14 mg/j), ou l’empagliflozine (25 mg/j, par voie orale), qui appartient à une classe de médicaments (inhibiteurs du SGLT2) n’ayant pas montré d’effet significatif sur le taux d’HbA
1c
, mais ayant des effets bénéfiques spécifiques chez les patients souffrant d’une complication cardiaque ou rénale de leur diabète. Dans cette étude, le sémaglutide administré par voie orale s’est révélé plus efficace que l’empagliflozine pour induire une baisse de l’HbA
1c
, mais pas pour la perte de poids [
19
].
Ajout du sémaglutide en administration orale à l’insuline chez des patients diabétiques de type 2 (étude PIONEER 8)
Cette étude internationale de phase III a concerné plus de 700 patients diabétiques de type 2, déjà traités par insuline (une ou plusieurs injections quotidiennes) en association ou non à la metformine, mais sans autre médicament antidiabétique administré par voie orale ou injectable. Elle a comparé quatre doses de sémaglutide (3 à 14 mg/j) et un placebo. Le critère principal de jugement était la baisse du taux d’HbA
1c
. Une diminution du taux d’HbA
1c
, une réduction des doses d’insuline nécessaires, ainsi qu’une perte de poids ont été observées pour toutes les doses de sémaglutide oral qui ont été testées [
20
].
|
Le sémaglutide est le premier peptide à pouvoir être utilisé comme médicament administrable par voie orale : sa formulation avec un excipient original qui permet une absorption gastrique sans dégradation par la pepsine constitue une réelle innovation pour le traitement des patients diabétiques [
1
]. Cependant, si l’on peut se réjouir de disposer désormais d’une formulation permettant l’administration orale d’un médicament important dans le traitement du diabète de type 2, plusieurs questions persistent. Les aGLP1 sont des médicaments puissants, qui occupent une place importante dans la pharmacopée du diabète de type 2, par leur efficacité sur le contrôle de la glycémie, mais aussi sur le pronostic cardio-vasculaire et rénal, ainsi que sur la réduction pondérale. Pourtant, ces médicaments sont probablement sous-utilisés pour trois raisons : leur prix élevé, le fait qu’il s’agit de traitements nécessitant des injections, avec, comme conséquence, un nombre très faible de prescriptions, et enfin, le fait qu’ils n’aient qu’une place très réduite dans les recommandations de la Haute autorité de santé (HAS), des recommandations anciennes qui ne prennent pas en compte les données de sécurité cardio-vasculaire issues de récents essais cliniques, ni la classe des médicaments inhibiteurs du transporteur SGLT2, qui n’existait pas lors de la publication de ces recommandations. Celles-ci doivent donc être révisées et la forme orale du sémaglutide, désormais disponible, devrait permettre une prescription plus large de cet aGLP1.
Cependant, malgré la présence d’un activateur de l’absorption gastrique dans la formulation du médicament, sa biodisponibilité reste très faible, avec une importante variabilité inter- et intra-individuelle. De plus, pour optimiser la biodisponibilité et réduire la variabilité de l’absorption, le médicament doit être pris à distance des repas, ce qui n’est pas favorable à une bonne observance thérapeutique. La prescription du sémaglutide par voie orale reste donc concurrencée par celle des formes injectables des aGLP1, dont l’utilisation est plus simple que celle d’autres médicaments injectables, en particulier l’insuline, et est généralement bien acceptée par les patients : l’effet des aGLP1 sur la perte de poids aide à leur popularité, et l’autonomie des patients pour les injections est rapidement obtenue dans la plupart des cas. On peut aussi estimer, comme souligné précédemment, que les critères d’évaluation utilisés et le choix des médicaments auxquels le sémaglutide par voie orale a été comparé dans les études cliniques ont biaisé les conclusions, et qu’il manque des essais comparatifs plus contraignants.
Enfin, reste la question du coût de la production industrielle de la molécule thérapeutique : la dose de 14 mg par jour recommandée pour le sémaglutide pour prise orale est en effet presque 200 fois supérieure à la dose habituelle utilisée pour la même molécule administrée par voie sous-cutanée (0,5 mg par semaine). Cependant, le coût d’un traitement utilisant le sémaglutide pour prise orale a été également comparé à celui des autres traitements utilisant l’empagliflozine, la sitagliptine ou le liraglutide. Cette comparaison s’est fondée sur un coût de 770 dollars par mois, aux États-Unis, pour un traitement par le sémaglutide par voie orale, à la dose de 14 mg/j. En utilisant quatre critères de jugement, incluant la proportion de patients dont le taux d’HbA
1c
était inférieur à 7 % sous traitement (le seul critère pertinent selon l’auteur de l’article), cette analyse a montré que le traitement par le sémaglutide administré par voie orale était moins onéreux que les traitements par les autres médicaments, des médicaments soigneusement choisis cependant afin d’éviter une comparaison à des médicaments plus anciens environ 100 fois moins coûteux [
21
].
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Drucker
DJ
.
Advances in oral peptide therapeutics.
.
Nat Rev Drug Disco.
2020;
;
19
:
:277.
–
89
.
2.
De Nobel
E
,
Van’t Laar
A
.
The size of the loading dose as an important determinant of the results of the oral glucose tolerance test. A study in subjects with slightly impaired glucose tolerance.
.
Diabetes.
1978;
;
27
:
:42.
–
48
.
3.
Elrick
H
,
Stimmler
L
,
Hlad
CJ
,
et al.
Plasma insulin response to oral and intravenous glucose administration.
.
J Clin Endocrinol Metab.
1964;
;
24
:
:1076.
–
1082
.
4.
Mcintyre
N
,
Holdsworth
C
,
Turner
D
.
New interpretation of oral glucose tolerance.
.
Lancet.
1964;
;
284
:
:20.
–
21
.
5.
Müller
TD
,
Finan
B
,
Bloom
SR
,
et al.
Glucagon-like peptide 1 (GLP-1).
.
Mol Metab.
2019;
;
30
:
:72.
–
130
.
6.
Andersen
A
,
Lund
A
,
Knop
FK
,
et al.
Glucagon-like peptide 1 in health and disease.
.
Nat Rev Endocrinol.
2018;
;
14
:
:390.
–
403
.
7.
Gasbjerg
LS
,
Bergmann
NC
,
Stensen
S
,
et al.
Evaluation of the incretin effect in humans using GIP and GLP-1 receptor antagonists.
.
Peptides.
2020;
;
125
:
:170183.
.
8.
Stemmer
K
,
Müller
TD
,
DiMarchi
RD
,
et al.
CNS-targeting pharmacological interventions for the metabolic syndrome.
.
J Clin Invest.
2019;
;
129
:
:4058.
–
4071
.
9.
Cosentino
F
,
Grant
PJ
,
Aboyans
V
,
et al.
2019;
ESC guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD.
.
Eur Heart J.
2020 ;
41
:
:255.
–
323
.
10.
Granhall
C
,
Donsmark
M
,
Blicher
TM
,
et al.
Safety and pharmacokinetics of single and multiple ascending doses of the novel oral human GLP-1 analogue, oral semaglutide, in healthy subjects and subjects with type 2 diabetes.
.
Clin Pharmacokinet.
2019;
;
58
:
:781.
–
791
.
11.
Alani
AWG
,
Robinson
JR
.
Mechanistic understanding of oral drug absorption enhancement of cromolyn sodium by an amino acid derivative.
.
Pharm Res.
2008;
;
25
:
:48.
–
54
.
12.
Davies
M
,
Pieber
TR
,
Hartoft-Nielsen
ML
,
et al.
Effect of oral semaglutide compared with placebo and subcutaneous semaglutide on glycemic control in patients with type 2 diabetes a randomized clinical trial.
.
JAMA.
2017;
;
318
:
:1460.
–
1470
.
13.
Husain
M
,
Birkenfeld
AL
,
Donsmark
M
,
et al.
Oral semaglutide and cardiovascular outcomes in patients with type 2 diabetes.
.
N Engl J Med.
2019;
;
381
:
:841.
–
851
.
14.
Pratley
R
,
Amod
A
,
Hoff
ST
,
et al.
Oral semaglutide versus subcutaneous liraglutide and placebo in type 2 diabetes (PIONEER 4): a randomised, double-blind, phase 3a trial.
.
Lancet.
2019;
;
394
:
:39.
–
50
.
15.
O’Neil
PM
,
Birkenfeld
AL
,
McGowan
B
,
et al.
Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial.
.
Lancet.
2018;
;
392
:
:637.
–
649
.
16.
Yabe
D
,
Nakamura
J
,
Kaneto
H
,
et al.
Safety and efficacy of oral semaglutide versus dulaglutide in Japanese patients with type 2 diabetes (PIONEER 10): an open-label, randomised, active-controlled, phase 3a trial.
.
Lancet Diabetes Endocrinol.
2020;
;
8
:
:392.
–
406
.
17.
Rosenstock
J
,
Allison
D
,
Birkenfeld
AL
,
et al.
Effect of additional oral semaglutide vs sitagliptin on glycated hemoglobin in adults with type 2 diabetes uncontrolled with metformin alone or with sulfonylurea: The PIONEER 3 randomized clinical trial.
.
JAMA.
2019;
;
321
:
:1466.
–
1480
.
18.
Pieber
TR
,
Bode
B
,
Mertens
A
,
et al.
Efficacy and safety of oral semaglutide with flexible dose adjustment versus sitagliptin in type 2 diabetes (PIONEER 7): a multicentre, open-label, randomised, phase 3a trial.
.
Lancet Diabetes Endocrinol.
2019;
;
7
:
:528.
–
539
.
19.
Rodbard
HW
,
Rosenstock
J
,
Canani
LH
,
et al.
Oral semaglutide versus empagliflozin in patients with type 2 diabetes uncontrolled on metformin: the PIONEER 2 trial.
.
Diabetes Care.
2019;
;
42
:
:2272.
–
2281
.
20.
Zinman
B
,
Aroda
VR
,
Buse
JB
,
et al.
Efficacy, safety, and tolerability of oral semaglutide versus placebo added to insulin with or without metformin in patients with type 2 diabetes: The PIONEER 8 trial.
.
Diabetes Care.
2019;
;
42
:
:2262.
–
2271
.
21.
Hunt
B
,
Hansen
BB
,
Ericsson
Å
,
et al.
Evaluation of the cost per patient achieving treatment targets with oral semaglutide: a short-term cost-effectiveness analysis in the United States.
.
Adv Ther.
2019;
;
36
:
:3483.
–
3493
.
22.
Thorens
B
.
Incrétines, sécrétion d’insuline et diabète.
.
Med Sci (Paris).
2003;
;
19
:
:860.
–
863
.
|