Le moustique Anopheles gambiae est le vecteur majeur du parasite Plasmodium falciparum responsable du paludisme en Afrique sub-saharienne. An. gambiae est en fait un ensemble de sept espèces, parmi lesquelles An. gambiae sensu stricto ( s.s. ), An. coluzzii et An. arabiensis sont les vecteurs principaux de P. falciparum (voir Encadré ). Ces espèces ont des répartitions géographiques et saisonnières souvent différentes, mais peuvent également vivre en sympatrie 1 . Une de leurs particularités est leur grande adaptabilité aux conditions arides, notamment dans la région sahélienne caractérisée par une alternance de saisons des pluies et de saisons sèches de plusieurs mois. Ces espèces semblent disparaître complètement pendant la saison sèche et réapparaissent en grand nombre dès les premières pluies. Dès lors, la question de savoir si les moustiques survivent en saison sèche par estivation ou s’ils réapparaissent en début de saison des pluies par migration a hanté les entomologistes médicaux depuis des décennies.
En 1968, Omer et Cloudsley-Thompson ont démontré que des femelles d’ An. gambiae sensu lato ( s.l. ) pouvaient estiver durant la saison sèche au Soudan [ 1 ]. Les femelles capturées pouvaient pondre des œufs dans les rétentions d’eau nouvellement formées par l’arrivée des premières pluies. En simulant différentes conditions de saison sèche, ces auteurs ont montré que les femelles pouvaient survivre entre 51 et 206 jours. Ces observations ont été confirmées récemment par d’autres auteurs [ 2 - 4 ]. Cependant, elles ne permettaient pas d’exclure des phénomènes de migration d’anophèles à partir de régions présentant des gîtes larvaires pérennes. Mais une telle hypothèse remettait en cause le dogme d’une capacité de migration des anophèles limitée à quelques kilomètres [ 5 ].
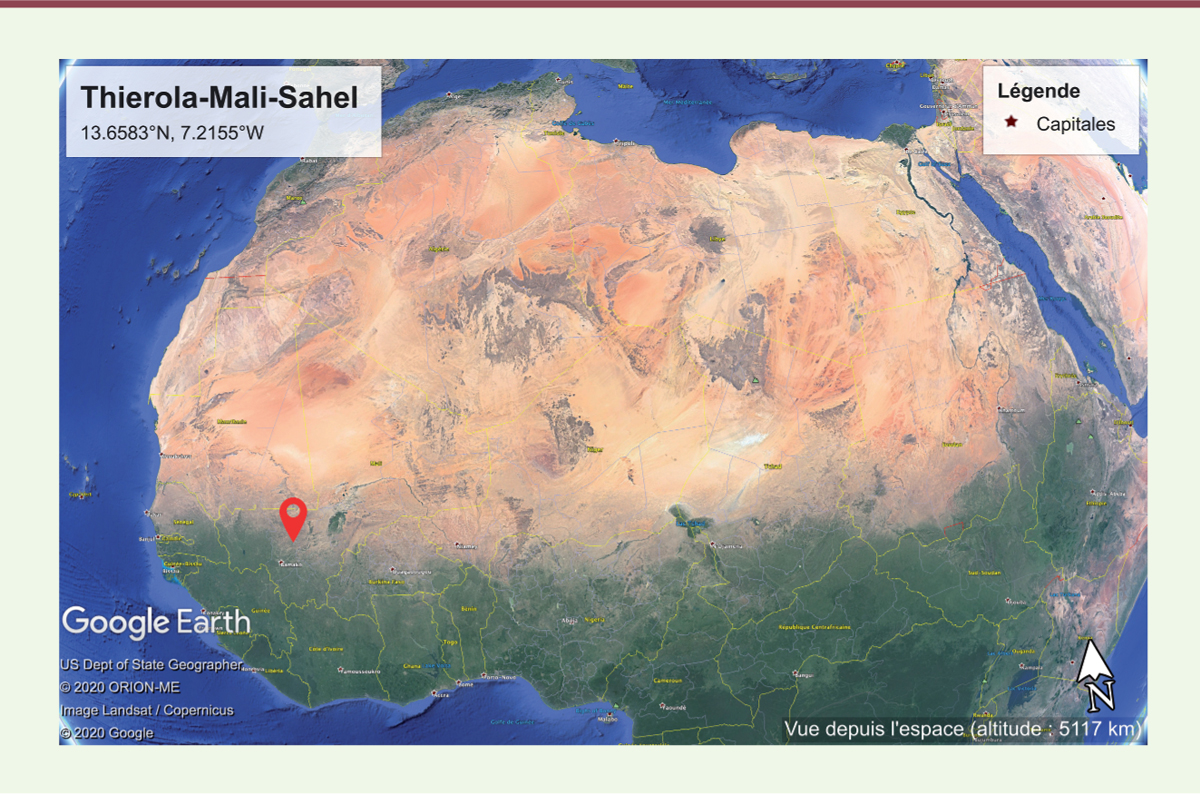
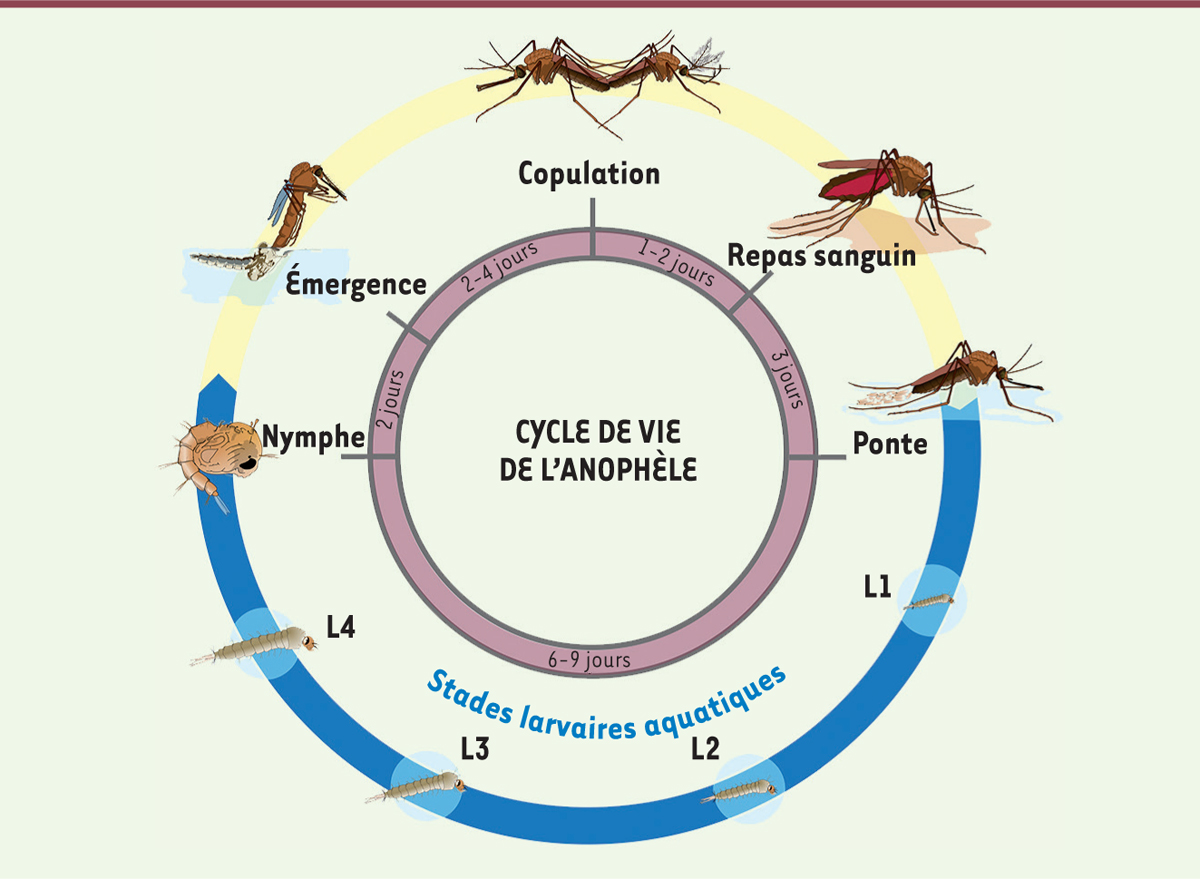
Pour tenter d’élucider l’origine, estivation ou migration, des anophèles recolonisant les régions arides du Sahel dès les premières pluies, l’équipe dirigée par Tovi Lehmann a conduit de nombreuses études dans la région sahélienne du Mali, à proximité du village de Thierola ( Figure 1 ) . En suivant l’apparition et la disparition de An. coluzzii , An. gambiae s.s. et An. arabiensis , ainsi que la dynamique de leurs populations au cours de plusieurs alternances de saisons des pluies et saisons sèches entre 2008 et 2013, ils ont pu montrer que An. coluzzii pouvait se maintenir en saison sèche en estivant alors que An. gambiae s.s. et An. arabiensis recolonisaient la région vraisemblablement par migration sur une longue distance [ 6 ]. Cette conclusion reposait sur l’augmentation des populations de An. coluzzii dès les premières pluies, alors que l’augmentation des populations de An. gambiae s.s. et An. arabiensis ne se produisait que dans les deux mois suivant les premières pluies. Compte tenu du cycle de développement d’ An. gambiae s.l. ( Figure 2 ) , seule l’estivation pouvait expliquer cette abondance soudaine d’ An. coluzzii après les toutes premières pluies. Mais l’implication de la migration longue distance pour An. gambiae s.s. et An. arabiensis restait à démontrer.
| Figure 2.
Cycle de développement d’An. gambiae s.l.
Les femelles d’anophèles pondent des œufs à la surface de l’eau. Ces œufs ne supportent pas la dessiccation, contrairement aux œufs des moustiques du genre
Aedes
tels que
Aedes albopictus
, le moustique tigre. La durée du stade larvaire aquatique dépend de la température et des sources nutritives. Elle varie entre 6 et 9 jours en conditions tropicales.
|
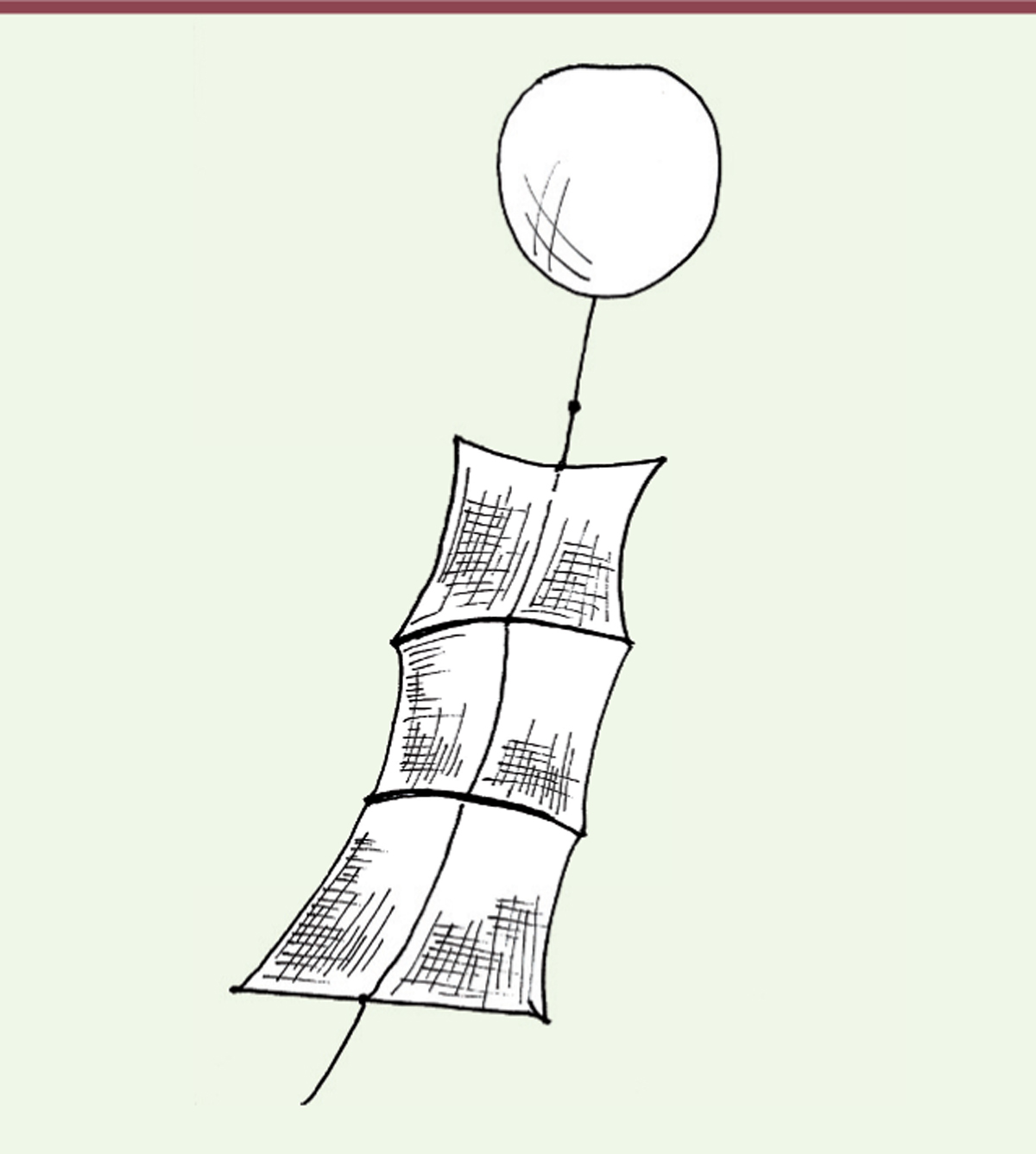
Plusieurs observations anciennes (entre 1960 et 1990) avaient établi que certaines espèces de moustiques pouvaient utiliser des flux d’air ascendants et être ainsi transportés de manière aérienne à de grandes distances de leur site originel. Reynolds et al . ont d’ailleurs capturé plusieurs espèces de moustiques d’importance médicale, dont deux espèces d’anophèles, à 150 mètres au-dessus du sol en utilisant un filet attaché à un ballon aérodynamique [ 7 ]. Bénéficiant des avancées techniques pour étudier la migration par voie aéroportée en haute altitude [ 8 ], l’équipe de Lehmann a démontré, en 2019, la migration sur de longues distances de plusieurs espèces d’anophèles vectrices du paludisme en zone sahélienne [ 9 ]. En s’inspirant d’un système éprouvé pour la capture de fourmis volantes [ 10 ], ces chercheurs ont fixé trois panneaux de tulle moustiquaire le long d’une corde hissée dans l’air par un ballon gonflé à l’hélium pouvant atteindre une hauteur de 290 mètres ( Figure 3 ) . Afin de pouvoir capturer des moustiques et autres insectes, chaque panneau est imprégné d’un fin film de glue à insectes avant d’être fixé sur la corde par un système Velcro . La position de chaque panneau le long de la corde permet de définir des altitudes de capture, en fonction de l’altitude de stabilisation du ballon. Les anophèles sont des moustiques nocturnes, et les opérations de capture sont donc réalisées la nuit (ascension du ballon une heure avant le coucher du soleil et descente une heure après le lever du soleil). Au cours de ces 14 heures de collecte, les filets de capture sont soumis à différents courants d’air et vents, variant en fonction des périodes de capture et de l’altitude de chaque filet. Pour s’assurer que les moustiques capturés proviennent bien de moustiques évoluant en altitude au cours de la nuit et non pas au niveau de sol au moment de la manipulation du système de capture, une montée-descente rapide d’un filet témoin est effectuée au moment de l’ascension et à la fin de la nuit. Au petit matin, les moustiques englués sont délicatement collectés, déglués, et classés par groupe d’espèces sur des critères morphologiques et moléculaires. Les moustiques sont également testés pour la présence de Plasmodium , et l’espèce, animale ou humaine, ayant fourni le repas de sang des femelles « gorgées » est identifiée par PCR ( polymerase chain reaction ).
| Figure 3.
Représentation schématique des filets de capture de moustiques en altitude
Chacun des trois panneaux correspond à une pièce de tulle moustiquaire de 3 m
2
(hauteur 3 m, largeur 1 m), « rigidifiée » par l’inclusion à ses extrémités horizontales de fins tubes en carbone (d’après [
9
]).
|
Entre 2013 et 2015, 617 nuits de captures ont été menées à des altitudes de 90 mètres, 120 mètres et 190 mètres, réparties principalement au cours de la saison humide mais incluant les transitions entre saison sèche et saison humide, et entre saison humide et saison sèche. Parmi 461 100 insectes capturés, 2 748 étaient des moustiques, dont 235 appartenaient au genre Anopheles . Au maximum, 5 anophèles étaient capturés par nuit. Quelle que soit l’espèce, plus de trois quarts des moustiques capturés étaient des femelles, dont 90 % avaient pris un repas de sang, mais aucune femelle anophèle n’était porteuse de Plasmodium . Contre toute attente, environ 10 % des moustiques capturés appartenaient à l’espèce An. coluzzii , tandis qu’un seul moustique An. gambiae s.s. avait été collecté. La majorité des anophèles capturés appartenaient à des espèces vectrices mineures de P. falciparum : An. squamosus , An. pharoensis et An. coustani . En utilisant les valeurs des densités nocturnes moyennes de moustiques capturés à différentes hauteurs et les vitesses de vent réelles estimées, les auteurs ont évalué l’intensité de la migration nocturne. En se fondant sur une distance de 100 km, correspondant à la distance entre deux des sites d’étude, les migrations annuelles ont été estimées à plus de 80 000 individus pour An. gambiae s.s. , 6 millions pour An. coluzzii et 44 millions pour An. squamosus . Si une telle ampleur de migration peut sembler gigantesque, les migrations massives d’insectes sont néanmoins bien documentées, comme en témoigne l’estimation de 3 500 milliards d’insectes migrant chaque année dans le sud de l’Angleterre à des altitudes comprises entre 150 et plus de 1 000 mètres [ 11 ]. Dans cette étude, l’analyse des schémas de déplacement des insectes a conduit à formuler l’hypothèse selon laquelle les gros insectes (de masse supérieure à 10 mg) exploiteraient les vents arrière-saisonniers bénéfiques, en s’orientant vers des composants spécifiques du vent, du sud ou du nord selon la saison, ce qui impliquerait donc un comportement actif de ces insectes. En utilisant les données de très haute résolution sur les vents et les modèles de transport atmosphérique développés aux États-Unis par la National oceanic and atmospheric administration , largement utilisées pour modéliser la dispersion des particules en altitude, Huestis et al . ont pu estimer la provenance des moustiques qu’ils avaient capturés, et ils ont constaté que leurs points de départ étaient multiples dans la région étudiée [ 9 ]. De plus, les modèles suggèrent que les mouvements saisonniers sont véhiculés par les vents dominants. Ainsi, les moustiques, dont la masse est faible (2,5 à 5 mg), ne sélectionneraient pas activement des composants spécifiques des vents dominants, mais suivraient simplement le courant. Néanmoins, le déplacement d’une telle densité de moustiques du sol vers des hauteurs élevées reflète très probablement leur comportement actif afin de bénéficier des vents pour se disperser. En utilisant les modèles atmosphériques, les auteurs ont aussi estimé les distances moyennes parcourues au cours d’un vol de nuit de 2 ou 9 heures à respectivement 30 km et 120 km.
En complément de ces travaux, l’équipe de Lehmann a quantifié l’aptitude des femelles d’ An. gambiae s.l. capturées pendant la saison des pluies à effectuer des vols de longue durée [ 12 ]. Pour cela, cette équipe a développé un système d’enregistrement sonore des battements d’ailes de moustiques fixés sur un support. Grâce à ce système original, elle a pu mettre en évidence l’existence de moustiques présentant des capacités de vol différentes, avec une proportion faible de moustiques volant durant une longue période (4,5 heures). Plus spécifiquement, les femelles ayant pris un repas de sang présentent une meilleure aptitude au vol, et cette aptitude est également meilleure pour An. coluzzii que pour An. arabiensis . La présence d’ailes mieux adaptées au vol chez les individus « super-volants » de l’espèce An. coluzzii pourrait expliquer leur plus grande aptitude au vol de longue durée. Selon ces auteurs, l’espèce An. coluzzii , dont la capacité de survie à la saison sèche par estivation était déjà connue, aurait ainsi développé, par cette capacité de migration sur de longues distances, une autre stratégie adaptative de survie pour faire face aux périodes de sécheresse au cours de la saison des pluies, phénomène qui se produit à une échelle de temps décennale. De cette façon, An. coluzzii parvient à survivre même dans les conditions climatiques difficiles de ces régions arides du Sahel.
Bien que Huestis et al. n’aient trouvé de parasite responsable du paludisme chez aucun des moustiques anophèles capturés, probablement en raison du nombre relativement faible de captures, une telle migration estimée de moustiques en nombre et en distance entraîne inévitablement l’arrivée de moustiques infectés. Ainsi, non seulement ces migrations reconstituent, à temps pour la saison des pluies, les populations locales de moustiques dans les zones arides, mais elles pourraient également être une source importante d’infection par Plasmodium . Cette hypothèse est d’ailleurs étayée par une étude très récente montrant que les femelles gravides (ayant pris un repas de sang) de An. gambiae s.l. soumises expérimentalement à des vents en haute altitude étaient toujours aptes à produire des œufs viables et à ingérer de nouveau du sang, pouvant alors transmettre des parasites infectants [ 13 ] ( Figure 2 ) . Alors qu’il est admis que le réservoir de Plasmodium pendant la saison sèche est l’homme, un afflux de moustiques infectés au tout début de la saison des pluies pourrait accélérer le redémarrage de la transmission du paludisme. La conséquence la plus importante de cette découverte concerne l’éradication du paludisme. En effet, une importation faible mais continue de parasites et de moustiques en provenance de régions éloignées signifiera que les stratégies d’élimination des moustiques devront être maintenues en permanence et à grande échelle, plutôt régionale (multi-pays) que nationale. Bien qu’il s’agisse d’un défi de taille, les progrès de notre compréhension de l’endroit et du moment où les moustiques peuvent utiliser le vent pour se déplacer sur de longues distances devraient permettre de concentrer les efforts d’élimination dans les zones situées sur leurs trajets de migration.
|
Nomenclature des moustiques Anopheles gambiae Avant le développement de la cytotaxonomie (étude des inversions chromosomiques sur chromosomes polytènes) et des outils moléculaires, An. gambiae était décrit, sur la base d’une analyse morphologique, comme un complexe d’espèces, An. gambiae sensu lato (s.l.) . Ce complexe groupait tout d’abord quatre espèces : An. gambiae A, B, C et D. L’association des données de bioécologie et de biogéographie a permis d’inclure dans l’espèce An. gambiae s.l. cinq espèces : An. gambiae s.s (ancienne espèce A), An. arabiensis (ancienne espèce B), An. merus , An. melas et An. quadriannulatus (ancienne espèce C), auxquelles a été associée plus tardivement An. bwambae . Parmi ces six espèces « jumelles », An. gambiae et An. arabiensis , constituaient les vecteurs majeurs de P. falciparum . Les travaux de cytogénétique de l’équipe de Mario Coluzzi ont été essentiels pour cartographier les inversions chromosomiques associées à chacune des six espèces du complexe. Par des études approfondies de ces inversions chromosomiques dans des populations de moustiques couvrant principalement l’Afrique de l’Ouest (Mali, Burkina Faso, Bénin, Guinée, Nigeria), des « écotypes » ont ensuite été décrits au sein d’ An. gambiae s.s (nomenclature d’avant 2001) et associés principalement à une adaptation aux conditions arides. Ainsi, la forme « Forest », sans inversion chromosomique, se rencontre dans les zones humides, où la transmission du paludisme est fréquente tout au long de l’année, tandis que les formes Bamako, Mopti et Savanna se rencontrent principalement en zone sahélienne, où la transmission du paludisme est saisonnière. Dans cette zone, les formes se succèdent selon une séquence très similaire à chaque saison : la forme Mopti prédomine au début de la saison des pluies, tandis que les formes Savanna et Bamako prédominent à la fin de la saison des pluies et au début de la saison sèche. Cette alternance des formes a renforcé la question de l’estivation ou migration des anophèles pour expliquer leur présence en grand nombre dès les premières pluies. Dans les années 2000, un test moléculaire a permis de distinguer la forme Mopti des formes Bamako et Savanna, et introduit la nomenclature An. gambiae de forme moléculaire M (Mopti) ou S (Savanna). En 2013, la forme moléculaire M a été élevée au rang d’espèce et nommée An. coluzzii , en hommage à Mario Coluzzi, et la forme moléculaire S est maintenant dénommée An. gambiae s.s. [ 14 ]. |