| |
| Med Sci (Paris). 36: 38–50. doi: 10.1051/medsci/2020266.L’Homme Gelé (渐冻人) et le déficit en cristalline αB J. Andoni Urtizberea1 and Jean-Claude Kaplan2 1Enseignant, Institut de Myologie
,
Paris
,
France
.
2Ancien professeur émérite, Faculté de Médecine de Cochin
,
Paris
,
France
.
|
Une observation très singulière Un appel au secours C’est en quelque sorte une bouteille à la mer qu’une maman chinoise désespérée a lancée depuis les rives du Huang-Pou à Shanghaï en décembre 2018. Son message électronique envoyé aux quatre coins de la terre concernait son enfant gravement malade. Elle demandait au vu des résultats des études génétiques, et documents à l’appui, s’il existait la moindre chance de guérir son enfant atteint d’une maladie neuromusculaire grave, quel qu’en fût le prix. Manifestement instruite et bien renseignée, elle osait même parler de thérapie génique au motif que l’anomalie génétique aurait été formellement identifiée chez son fils. EURORDIS, l’alliance européenne des associations de patients atteints de maladies rares, destinataire du courrier, prêta attention à ce dernier et le partagea avec une administratrice de l’AFM-Téléthon, comme c’est l’habitude pour les requêtes complexes en provenance de pays situés en dehors de l’Union Européenne. Cette administratrice, Françoise Salama, connaissant nos liens anciens avec la Chine et ayant elle-même accueilli chez elle une jeune étudiante chinoise atteinte de maladie de Charcot-Marie-Tooth, nous a transmis le message pour avis et conseils, avec le secret espoir que nous puissions rendre service à cette famille ou, à tout le moins, la guider dans sa quête.
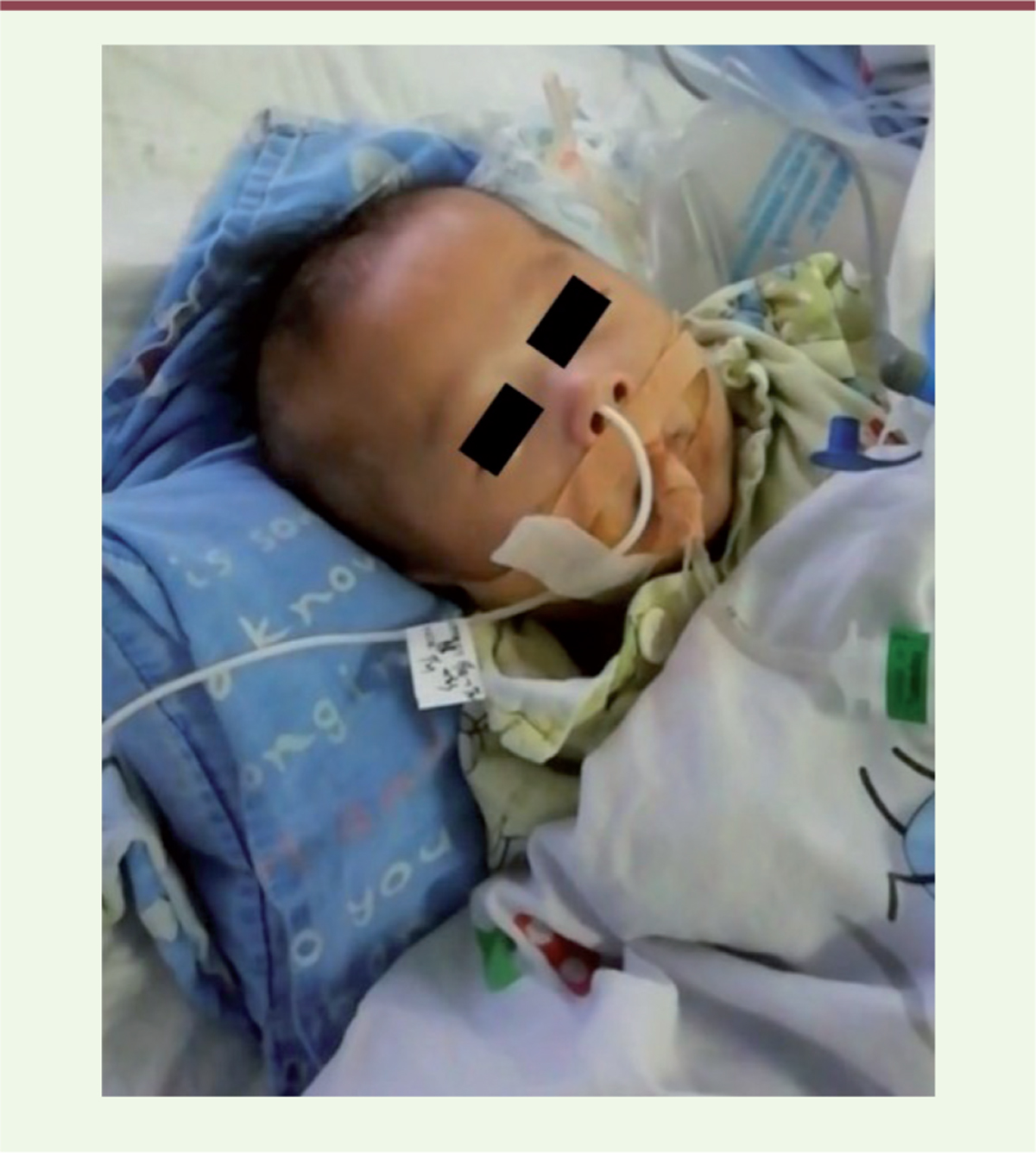
à la lecture de l’histoire clinique, telle que retracée par la maman dans son premier courriel, et des documents médicaux – fort heureusement traduits en anglais – transmis subséquemment, nous étions quelque peu perplexes. Enfant unique d’un couple non consanguin sans antécédents particuliers, le petit Lu M. était né à terme après une grossesse et un accouchement sans histoire. Mais à l’âge de deux mois, le nourrisson, dont le développement initial n’avait apparemment pas inspiré d’inquiétude, s’est retrouvé en soins intensifs, intubé-ventilé, dans les suites d’une pneumonie sévère. Au décours, le nourrisson était resté très hypotonique, puis hypertonique, et surtout totalement dépendant de son assistance ventilatoire
(
Figure 1
)
. La maman décrivait par ailleurs son enfant comme éveillé et réactif. Le diagnostic présomptif avancé par les médecins était celui de myopathie congénitale. Les examens paracliniques standards n’avaient pas apporté beaucoup d’éléments d’orientation (IRM cérébrale, EEG et échographie cardiaque étaient sans particularités). Les taux sériques de CPK oscillaient entre 500 et 1 000 UI/l. Le diagnostic d’amyotrophie spinale avait été écarté en biologie moléculaire, tout comme celui d’une dystrophie myotonique congénitale. Une biopsie musculaire avait été envisagée mais s’avérait très compliquée à organiser au vu du contexte local. Un EMG avait été dit myogène. Plus étonnants étaient les résultats du séquençage à haut débit d’un panel large de gènes de pathologies neuromusculaires : une mutation homozygote du gène
CRYAB
, y avait été identifiée et classée comme possiblement pathogène (classe 2), les deux parents s’avérant tous les deux porteurs à l’état hétérozygote de ladite mutation. Les médecins de l’hôpital périphérique de Shanghaï où était soigné l’enfant étaient très réservés quant au pronostic vital du fait, notamment, de la dépendance ventilatoire totale.
 | Figure 1.
Le propositus, à l’âge de 6 mois, ventilé sur sonde oro-trachéale et alimenté artificiellement
© J. Andoni Urtizberea.
|
Des réticences à valider le diagnostic
Nous avions quelques réticences à valider ce diagnostic et ceci tenait surtout à ce que nous pensions savoir du gène
CRYAB
. Ce gène est bien connu pour faire partie des gènes impliqués dans les myopathies dites myofibrillaires [
1
-
4
]. Composé de trois exons, il code la cristalline αB, une protéine chaperone de type
heat-shock-protein
interagissant avec la desmine et intervenant dans le maintien de l’architecture des myofibrilles. Il s’agit d’une maladie neuromusculaire particulièrement rare ne concernant, à travers le monde, que quelques dizaines de patients à peine (OMIM 608810).
Des formes bien connues chez l’adulte bien qu’ultra-rares
En 1978, Michel Fardeau a rapporté une famille étendue de la région de Domfront dans l’Orne dans laquelle le phénotype clinique associait une myopathie avec surcharge en desmine débutant à l’âge adulte, des troubles de la déglutition, une cardiomyopathie hypertrophique et des opacités cristalliniennes, l’ensemble étant transmis de façon autosomique dominante. Les lésions histologiques étaient décrites comme une «
accumulation intra-sarcoplasmique d’un matériel granulo-filamentaire dense en microscopie électronique
» pour reprendre les termes exacts du titre de l’article publié dans la Revue Neurologique [
5
]. Le concept de myopathie myofibrillaire forgé par Andrew Engel à la Mayo Clinic ne faisait pas encore consensus pour décrire ces nouvelles entités ; il ne le deviendra que quelques années plus tard [
6
]. C’est précisément cette famille française qui, une fois écartée l’hypothèse d’une mutation du gène
DES
codant la desmine, a servi d’abord à la cartographie puis au clonage du gène
CRYAB
par Patrick Vicart en 1998 dans le cadre d’une collaboration entre l’équipe de Denise Paulin à Jussieu et celle de Michel Fardeau à l’Institut de Myologie [
1
]. Andrew Engel, quant à lui, confirma l’implication du gène
CRYAB
dans deux cas adultes sporadiques de myopathie sans cardiomyopathie ni cataracte [
2
]. Les cristallinopathies αB à expression musculaire ont semblé relever de l’anecdote pendant des années tant elles étaient exceptionnelles, surtout comparées aux autres formes de myopathie myofibrillaire impliquant d’autres gènes (les gènes
DES, ZASP, MYOT, FLNC, BAG3
pour ne citer que les plus fréquents).
Nous-mêmes connaissions le gène
CRYAB
pour avoir participé à la description, en 2012, de la deuxième famille française atteinte de ce type de myopathie myofibrillaire autosomique dominante liée au gène
CRYAB
, en collaboration avec des collègues de Nice et de Saint-Étienne [
7
]. Dans cette famille originaire d’Afrique du Nord, le tableau clinique était en tous points comparable à celui de la première famille étudiée dans l’Orne : atteinte de la musculature distale débutant à l’âge adulte, cataracte précoce, troubles de la déglutition, syndrome respiratoire restrictif, et cardiomyopathie. Là aussi, la mutation identifiée du gène
CRYAB
ségrégeait bien selon une hérédité autosomique dominante.
Des doutes sur la validité des résultats
Dans ce contexte, et en première analyse, nous n’étions donc pas très enclins à admettre l’implication du gène
CRYAB
chez ce nourrisson shanghaïen dont les signes musculaires étaient si précoces. Notre sentiment était qu’il devait sans doute y avoir une erreur quelque part… Restait à l’identifier. Outre l’incongruité clinique liée à l’âge des premiers symptômes musculaires, nous avions deux autres bonnes raisons d’exercer notre sens critique. Certains médecins chinois avaient, par le passé, déjà pris quelques libertés avec l’orthodoxie scientifique. En deuxième lieu, nous avions quelques interrogations sur les résultats de l’étude génétique (NGS pour
next-generation sequencing
). Dans notre expérience, en effet, le gène
CRYAB
fait partie des gènes, tout comme les gènes
FLNC
et
PLEC1 (
eux aussi codant des protéines impliquées dans les myopathies myofibrillaires), au sein desquels des variants de signification inconnue (VSI, ou VUS pour
variants of unkown significance
) sont annotés en très grand nombre dans les bases de données. Tertio, si les laboratoires chinois de génétique étaient connus depuis longtemps pour leurs capacités hors du commun en matière de séquenceurs d’ADN, leurs interprétations des données ne jouissaient pas, sauf exception et jusqu’à une date récente, d’une réputation irréprochable.
Des compléments d’information
Pour en avoir le cœur net, nous avons demandé et obtenu des compléments d’informations concernant cet enfant. Des vidéos, des photographies cliniques de bonne qualité, et le détail des examens complémentaires (dont le résultat du NGS) nous ont été transmis. En complément, nous avons pu nous arranger pour que Zhao Changbo, neurologue à l’hôpital Huashan de Shanghaï et ancien élève de la
Summer School of Myology
de Paris (promotion 2005) puisse aller examiner l’enfant sur place, ce qui fut fait.
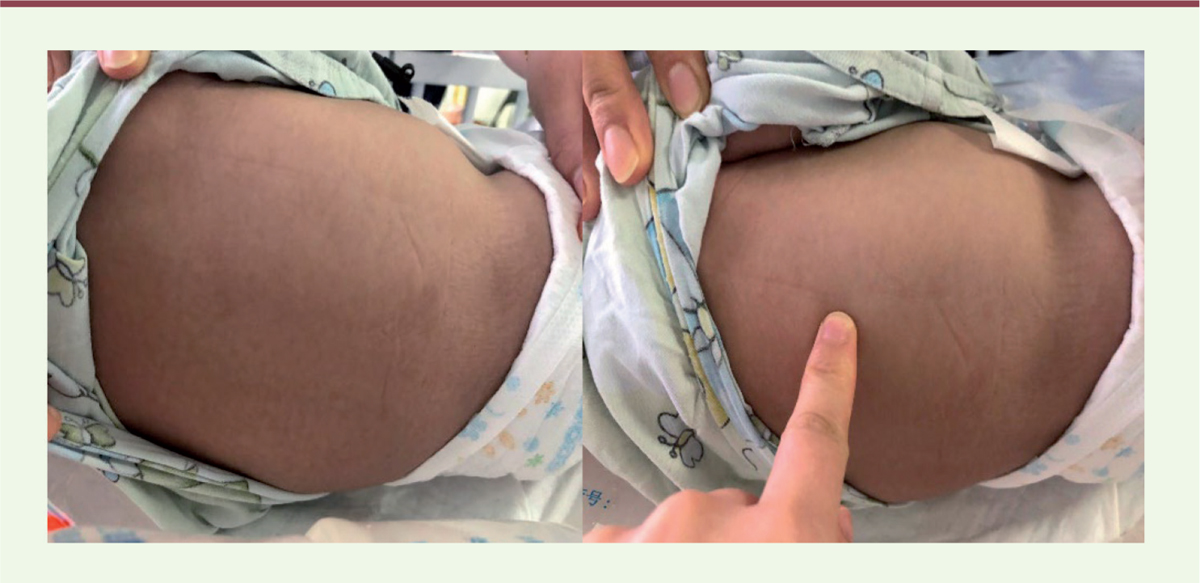
L’état clinique de l’enfant, alors âgé de six mois, tel qu’analysé par notre collègue, se résumait ainsi : hypomobilité globale respectant le visage, ventilation mécanique sur sonde d’intubation oro-trachéale, absence complète d’autonomie respiratoire, mimique faciale et oculomotricité conservées, absence de syndrome dysmorphique, bon niveau d’éveil, abolition des réflexes ostéo-tendineux mais sans fasciculations linguales associées, et absence de signes cutanés (pas de chéloïde ou de kératose folliculaire). Outre quelques rétractions musculo-tendineuses des membres inférieurs d’allure banale, l’attention de Zhao Chango avait été attirée par la rigidité musculaire prédominant au niveau du tronc et de la cage thoracique et pour laquelle il n’avait pas d’explication quant à son origine
(
Figure 2
)
. Il n’y avait pas de myotonie ni cliniquement ni à l’EMG dont on rappelle qu’il ne montrait que quelques éléments myogènes dans le bilan initial.
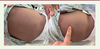 | Figure 2.
Les muscles du tronc sont le siège d’une rigidité résistant à la pression digitale
(face postérieure) © J. Andoni Urtizberea.
|
De nombreux diagnostics différentiels
Nous avons alors passé en revue tous les diagnostics différentiels possibles. Au vu des taux modérément élevés de CPK dans les premiers mois, une dystrophie musculaire congénitale (DMC) restait encore plausible. Un déficit en collagène VI (de type Ullrich) semblait plus difficilement concevable au vu de la modestie du syndrome rétractile et de l’absence de signes cutanés. Une amyotrophie spinale atypique avec, par exemple, une délétion hétérozygote du gène
SMN1
associée à une mutation ponctuelle sur l’autre allèle
SMN1
aurait pu convenir mais était peu compatible avec les données cliniques (absence d’indices pour une atteinte de la corne antérieure). Un syndrome de Schwartz-Jampel, connu pour donner une contraction musculaire permanente pouvait être écarté au vu de la sévérité de l’atteinte respiratoire et de l’absence de syndrome dysmorphique au niveau du visage, et d’anomalies de type chondrodysplasique. Une canalopathie musculaire sodique précoce était proche sur le plan clinique du fait de la rigidité mais manquaient le stridor laryngé et la myotonie électriquement prouvée. Sans compter que pour cette dernière hypothèse, le NGS n’aurait pas manqué d’identifier une mutation dans le gène
SCN4A,
ce qui n’avait pas été le cas.
La littérature revisitée
Nous en étions là quand une analyse plus exhaustive des bases de données génétiques en ligne et de la littérature sur les cristallinopathies αB et nous a donné la clé de l’énigme. Une énigme qui n’en était d’ailleurs pas une : nos homologues chinois avaient parfaitement conclu au bon diagnostic étiologique même si manquaient les données de l’histologie musculaire ! Des formes précoces de cette forme de myopathie myofibrillaire avaient en effet déjà été rapportées. Qui plus est, la mutation homozygote du gène
CRYAB
trouvée chez cet enfant avait déjà été publiée chez des nourrissons de Shenzhen et de Dongguan
(
Figure 3
)
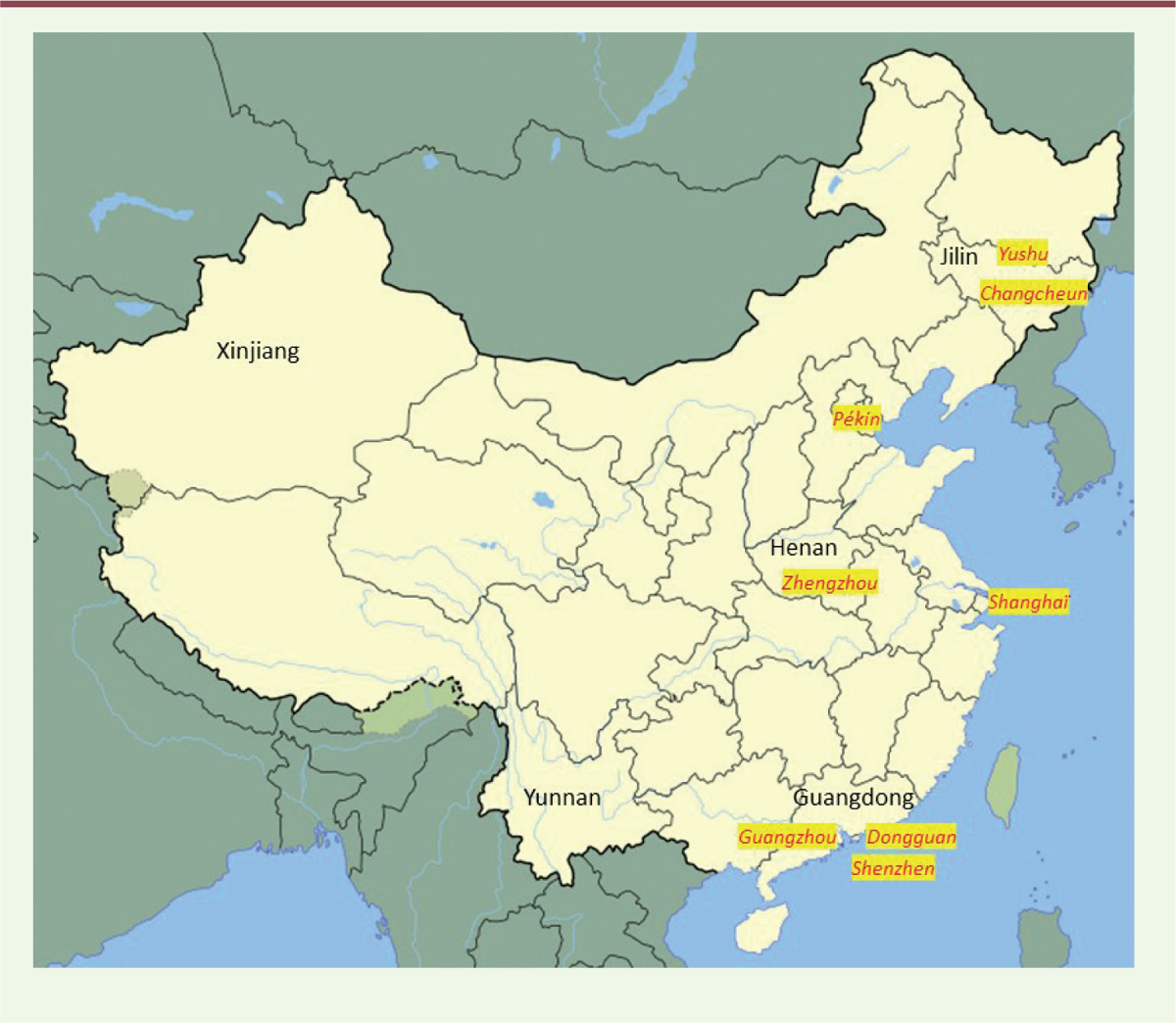
, tous d’origine… chinoise, et étant phénotypiquement identiques. Tout était désormais très clair. Il avait suffi de se mettre à jour… et de refaire un peu de bibliographie.
 | Figure 3.
Carte de la Chine
(adaptée de Wikipédia) avec les principaux lieux cités dans l’article © J. Andoni Urtizberea.
|
Un éventail phénotypique plus large
Depuis la description princeps de l’implication du gène
CRYAB
dans une myopathie autosomique dominante de l’adulte, rares ont été les observations rapportées dans la littérature avec ce phénotype clinique et histologique au complet [
2
,
7
-
8
]. En dehors de ces formes à expression musculaire, des formes familiales autosomiques dominantes de cataracte congénitale pure ont toutefois été rapportées [
9
,
10
] tout comme des cas de cardiopathie familiale pure [
11
-
13
] ou des cas de myopathie isolée [
14
]. Des chercheurs néerlandais ont également établi le lien entre le gène
CRYAB
et une famille où cataracte postérieure congénitale et cardiomyopathie dilatée apparue à l’âge adulte cosegrégeaient [
15
].
Des formes autosomiques récessives excessivement rares
Les premières formes autosomiques récessives de cristallinopathie αB ont été rapportées par des généticiens saoudiens. Ceux-ci avaient identifié une mutation du gène
CRYAB
au sein d’une famille consanguine dans laquelle deux enfants étaient atteints de cataracte congénitale isolée, sans atteinte musculaire associée [
16
].
En 2011, à quelques mois d’intervalle, deux équipes rapportaient d’autres observations de cristallinopathie αB cette fois-ci dans un contexte de myopathie débutant dans les premiers mois de vie. La découverte la plus originale fut sans conteste celle de chercheurs canadiens qui s’étaient intéressés à la grande cohorte d’enfants canadiens aborigènes appartenant à la communauté amérindienne
Cree
dans l’ouest de l’Ontario et le Manitoba [
17
-
18
], et qui développaient un syndrome myopathique inédit se transmettant de manière autosomique récessive. Tous les patients présentaient un tableau précoce associant une hypotonie initiale sévère suivie d’une hypertonie, d’une insuffisance respiratoire rapidement progressive, d’une élévation franche des CPK (jusqu’à vingt fois la limite supérieure de la normale) et un décès prématuré dans les premières semaines ou mois de vie. En 1994, les auteurs avaient utilisé le terme de
fatal infantile hypertonic muscular dystrophy
pour décrire ce qui ne ressemblait pas à grand-chose de connu [
17
]. Le matériel biopsique rassemblé chez quelques-uns de ces nourrissons avait mis en évidence des lésions musculaires comparables à celles observées dans les myopathies myofibrillaires, sans pouvoir écarter l’hypothèse d’un phénomène possiblement secondaire. L’hypothèse d’une myopathie myofibrillaire primitive avait été reprise par les spécialistes de la Mayo Clinic à Rochester qui avaient eu accès à ces éléments du dossier. Une importante désorganisation de l’architecture des myofibrilles ainsi que des dépôts de matériel granulaire étaient en effet présents. En criblant, par la méthode Sanger, les gènes déjà tenus pour responsables de myopathies myofibrillaires, les généticiens ont, en 2011, mis en évidence, et à leur grande surprise, une mutation homozygote du gène
CRYAB
, mutation dont le caractère récessif et fondateur au sein de la communauté
Cree
faisait peu de doute. Cette découverte fut confortée par l’absence complète d’immunomarquage de la cristalline αB sur coupe musculaire. La question de la physiopathologie de l’hypertonie avait été soulevée mais restait sans réponse. En revanche, les auteurs considéraient que les parents, cliniquement sains mais porteurs de l’anomalie du gène
CRYAB
à l’état hétérozygote, n’avaient pas développé de symptômes musculaires en raison du type très particulier de cette mutation récessive.
Pratiquement au même moment, le groupe de Londres dirigé par Francesco Muntoni décrivait le cas d’un nourrisson d’origine européenne où l’atteinte musculaire était elle aussi le point d’appel, avec des lésions très évocatrices de myopathie myofibrillaire sur la biopsie musculaire, et une mutation distincte homozygote du gène
CRYAB
[
19
]. De nouveau, la rigidité musculaire apparaissait au premier plan au point qu’une anomalie du canal sodium avait été envisagée avant d’être écartée en biologie moléculaire. Les auteurs signalaient en outre l’existence d’une myotonie à la percussion mais sans traduction électrique très claire, et l’absence de réponse à différents traitements myorelaxants comme le dantrolène, le baclofène ou les benzodiazépines.
Des cas similaires en Chine
Il faudra attendre huit années avant de voir apparaitre dans la littérature deux articles rapportant des cas similaires, mais cette fois-ci en Chine, dans plusieurs familles non apparentées et non consanguines [
20
-
21
]. Dans un premier article, des médecins et biologistes de l’hôpital de Dongguan, dans la province du Guangdong (près de Canton)
(
Figure 3
)
, faisaient état d’un nourrisson décédé à 17 mois de vie ayant présenté un tableau d’hypertonie musculaire progressive depuis l’âge de deux mois, une insuffisance respiratoire à cinq mois, avec des CPK élevées (jusqu’à 15-20 fois la normale) mais sans cataracte à l’examen ophtalmologique ni neuropathie associée. La biopsie d’un des muscles jumeaux et d’un muscle droit abdominal réalisée à l’âge de six mois avait révélé la présence de lésions myopathiques sévères mais sans grande spécificité. Une étude de l’exome entier en NGS avait ensuite permis d’identifier une mutation homozygote dans le codon initiateur du gène
CRYAB
(c.3G>A ; p.(Met1Ile)), les parents et la sœur ainée du propositus étant hétérozygotes pour la mutation et cliniquement sains. Dans un deuxième article publié la même année mais à diffusion plus confidentielle (car rédigé en chinois), des spécialistes de l’hôpital de Shenzhen, toujours dans la province du Guangdong, ont rapporté l’observation de deux nourrissons non apparentés et distincts du premier article, présentant une myopathie dès les premiers mois de vie avec rigidité musculaire, insuffisance respiratoire, élévation modérée des CPK et décès précoce. L’EMG montrait une activité musculaire de type tétanique. Chez ces deux enfants, la même mutation c.3G>A ; (p.Met1Ile) était également présente à l’état homozygote.
Les médecins chinois avaient tout bon ! Le cas du nourrisson shanghaïen cité plus haut correspondait donc en tout point à ces observations passées. Rien ne manquait si ce n’est les données de l’examen histologique du muscle. La rigidité des muscles du tronc, interprétée par certains comme une hypertonie simple et par d’autres comme une activité musculaire permanente, faisait bien partie du tableau et avait, à juste raison, attiré l’attention des cliniciens en charge de l’enfant. La signification de cette manifestation clinique pour le moins inhabituelle reste, à ce stade, toujours aussi mystérieuse : contraction musculaire permanente mais alors de quelle origine ? rétraction tendineuse sélective de certains groupes musculaires ? infiltration tissulaire par un matériel de surcharge ? Les données actuelles de la littérature ne permettent pas de trancher. On ne peut s’empêcher de faire le rapprochement entre la cataracte fréquemment retrouvée dans les cristallinopathies αB et donc avec un possible mécanisme de surcharge. Un possible effet fondateur
Le fait d’avoir retrouvé la même mutation c.3G > A dans le gène
CRYAB
dans quatre familles non apparentées mais toutes d’origine chinoise interroge également sur la possibilité d’un effet fondateur dans cette partie du monde ou, à tout le moins, d’une mutation récurrente. D’après les bases de données, ce variant de séquence est excessivement rare dans la population générale. Il touche un codon très conservé du gène
CRYAB,
ce qui constitue un argument supplémentaire en faveur de sa pathogénicité. On notera toutefois que trois des quatre nourrissons concernés provenaient de deux villes proches situées dans la province méridionale du Guangdong, Shenzhen et Dongguan, Shanghaï étant très à distance (1 500 km,
Figure 3
).
Un pronostic sombre Nous n’avons pu que confirmer à la maman, en accord avec les médecins shanghaiens, qu’un tel déficit en cristalline αB était, dans l’état actuel des connaissances, au-delà de toute ressource thérapeutique à visée curative et que le pronostic vital était effectivement engagé à court-moyen terme, ce d’autant qu’une assistance ventilatoire à domicile, invasive ou non, n’était pas envisageable dans le contexte chinois. Seule et maigre consolation, le couple pourrait désormais bénéficier d’un conseil génétique fiable afin qu’un tel drame ne se reproduise plus lors de grossesses ultérieures. Un mea culpa
On apprend toujours de ses erreurs et dans le cas présent, d’un raisonnement biaisé par des idées préconçues d’une part et par une analyse trop superficielle de la littérature de l’autre
(
Figure 4
)
. Non, la médecine chinoise n’est pas si en retard qu’il y paraît. Par ailleurs, le médecin, quel que soit son lieu d’exercice, n’a tendance à croire/accepter que ce qu’il voit ou que ce qu’il a déjà vu de ses propres yeux. Dans le domaine des maladies ultra-rares comme l’est celui des cristallinopathies αB, et compte tenu du très faible nombre de cas recensés, il faut pourtant conserver une certaine ouverture d’esprit et accepter de remettre en cause certains dogmes, comme celui du mode de transmission. Ces pathologies sont loin d’avoir livré tous leurs secrets. On en veut pour preuve la description toute récente de formes congénitales de cristallinopathie αB à transmission dominante [
22
]. Cet adage vaut aussi pour des maladies beaucoup plus fréquentes comme l’illustre parfaitement, et dans un autre domaine, des mutations somatiques du gène
UBA1
dans des pathologies inflammatoires de l’adulte [
23
].
A contrario
, il faut se garder de sur-interpréter des résultats de NGS en validant trop facilement la pathogénicité de certains variants de séquence, ces derniers pouvant être des simples polymorphismes.
 | Figure 4.
Le jardin Yu de Shanghaï ou le chemin, souvent tortueux, pour aboutir à la vérité
© J. Andoni Urtizberea.
|
Les formes autosomiques récessives de cristallinopathie αB du nourrisson à expression musculaire, pour exceptionnelles qu’elles soient, ne sont pas anecdotiques. Elles existent bel et bien et sont sans doute sous-diagnostiquées. Elles sont répertoriées dans OMIM (OMIM 613869) mais n’ont pas fait l’objet d’une mise à jour depuis 2016. Au rythme où vont les choses, il est d’ailleurs possible qu’elles supplantent, par leur nombre, les formes de l’adulte. L’accès désormais plus aisé au NGS devrait grandement aider à leur recensement. Elles représentent enfin un défi quant à la compréhension des mécanismes physiopathologiques qui les sous-tendent, particulièrement la rigidité musculaire. |
L’histoire peu commune contée ci-dessus a été l’occasion de nous pencher à nouveau sur l’état de développement de la myologie dans ce pays en pleine mutation. Le hasard du calendrier a également voulu que l’un d’entre nous (JAU) reprenne le chemin de Shanghaï quelques mois plus tard, en novembre 2019, à l’occasion du meeting national de myologie auquel il était invité. à rebours des slogans de la vulgate maoïste, c’est plutôt à un bond en arrière d’un quart de siècle auquel nous convions ici le lecteur. Une collaboration datant des années 1990 Nos collaborations avec la Chine en matière de myologie sont nées au début des années 1990, par le truchement initial de Marc Delpech, professeur de biochimie à Cochin, et celui de bien d’autres sinophiles (et pour certains, sinisants) de l’APHP. Le pays fascinait et commençait à sortir de son isolement scientifique. Les événements de Tian-An-Men étaient encore dans toutes les mémoires. Beaucoup de jeunes chercheurs chinois partaient se former à l’étranger et constituaient, pour de nombreux laboratoires de recherche, particulièrement aux États-Unis, un réservoir de main-d’œuvre abondante, bon marché et souvent docile. Peu d’entre eux rentraient au pays, et ceux qui faisaient ce choix se heurtaient à une bureaucratie digne de Kafka, à des salaires de misère et à un manque criant d’équipements. Quelques-uns avaient atterri en France, dans le laboratoire de biochimie génétique de l’hôpital Cochin mais aussi chez Denise Paulin, à Jussieu. Fan Qishi, une jeune biochimiste de l’hôpital Rui Jin de Shanghaï, faisait partie d’entre eux, et a ainsi passé de nombreuses années dans l’équipe du pavillon Cassini à Cochin où elle décrochera une thèse de sciences. C’est par son intermédiaire, et aussi du fait de la thématique neuromusculaire affichée par le laboratoire qui l’accueillait à Paris, que nous avons été amenés à nous s’intéresser à ce que les Chinois réalisaient dans ce domaine et dans quelle mesure ils pourraient contribuer eux aussi aux efforts en cours au niveau international pour développer cette discipline en plein essor. Un colloque fondateur
Un premier colloque franco-chinois de biochimie génétique a été organisé en décembre 1996 à Shanghaï et a constitué le point d’orgue de cette collaboration naissante
(
Figure 5
)
. Ce fut l’occasion pour beaucoup d’entre nous de fouler, pour la première fois de leur vie, le sol de l’ex-Empire du Milieu. Même pour ceux qui avaient déjà bien bourlingué à travers le monde, le dépaysement fut total, il faut bien l’avouer : une mégapole en pleine mutation architecturale, une population prise d’une frénésie de consommation, le tout contrastant avec les vestiges du passé comme le quartier, très proche, des anciennes concessions et celui du Bund, toujours aussi magique et empreint de nostalgie. En marge du colloque, des consultations médicales et des visites de laboratoires avaient été organisées au sein même de l’hôpital Rui Jin, un des fleurons de la médecine shanghaïenne. Cet hôpital comportait encore des bâtiments historiques non dénués de charme datant de l’époque des concessions, et plus particulièrement de l’Université l’Aurore, un établissement d’enseignement fondé par des jésuites français au début des années 1900 et opérationnel jusqu’en 1952, date de sa « reprise en main » par les autorités communistes. La tradition a néanmoins perduré au-delà de l’expulsion des jésuites et c’est ainsi qu’une section entière d’étudiants en médecine bénéficie encore de nos jours d’un enseignement en français.
 | Figure 5.
(A, B, C). Le premier colloque franco-chinois de génétique moléculaire organisé à Shanghaï en 1996 avec les équipes de l’hôpital de Rui Jin
© J. Andoni Urtizberea.
|
Des moyens limités en pathologie neuromusculaire Dire que les spécialistes hospitaliers de Rui Jin étaient peu au fait des maladies neuromusculaires relève d’un doux euphémisme, même si beaucoup d’entre eux manifestaient devant nous une certaine et authentique curiosité pour la chose. Malgré cela, les jeunes praticiens de l’équipe de Chen Shengdi, le chef de service de neurologie, avaient réussi à sélectionner et réunir plusieurs cas cliniques de dystrophie musculaire de Duchenne (DMD), d’amyotrophie spinale, de myopathie facio-scapulo-humérale et de myotonie de Steinert, tous sans confirmation moléculaire de leur diagnostic, faute de moyens. Quel ne fut pas notre étonnement d’entendre les internes de neurologie nous présenter l’histoire clinique de chaque malade dans un parfait français, eux qui n’avaient jamais mis les pieds dans l’hexagone ! Concernant les investigations à visée étiologique, il fallait se contenter de peu. L’histologie musculaire était inexistante, faute de moyens et d’expertise, sans parler de l’imagerie dont on ne parlait quasiment pas à l’époque. Seule la biochimie relevait le niveau même si on était encore loin de disposer, sur place, de tests génétiques de base comme le diagnostic moléculaire de la dystrophie musculaire de Duchenne par exemple. Le développement des collaborations
Nous avons capitalisé sur cet événement fondateur pour développer, dans les années qui ont suivi, les échanges et les collaborations médicales et scientifiques entre Rui Jin et la Chine en général, l’hôpital Cochin, l’université Paris-Descartes, et l’Institut de Myologie. C’est tout naturellement que deux jeunes neurologues de l’hôpital Rui Jin ont fait partie de la première promotion d’élèves de la
Summer School of Myology
organisée par l’Institut de Myologie en 1997 à la Salpêtrière
(
Figure 6
)
. Beaucoup d’autres, toujours de Shanghaï, suivront dans le cadre d’un accord informel de coopération bilatérale. Dans l’autre sens, plusieurs missions médicales seront organisées, faites de conférences, de consultations communes et d’enseignements au lit du malade, que ce soit à Shanghaï, à Zhengzhou (à l’invitation de Zheng Hong, une jeune généticienne de la province du Henan),
(
Figure 7
)
, ou à l’université Li Ka Sheng de Shantou (près de Canton) à l’occasion de l’année France-Chine en 2004
(
Figure 8
)
.
 | Figure 6.
Les deux élèves shanghaïens de la première promotion de la
Summer School of Myology
avec Michel Fardeau
(Paris, 1997) © J. Andoni Urtizberea.
|
 | Figure 7.
En mission à Zhengzhou, capitale de la province centrale du Henan, à l’invitation de Zheng Hong
© J. Andoni Urtizberea.
|
 | Figure 8.
Jamel Chelly ovationné lors du colloque célébrant l’année France-Chine à l’Université de Shantou (2004)
© J. Andoni Urtizberea.
|
Looking under every rock L’une de ces missions mérite d’être narrée par le détail. à la fin des années 1990, des rumeurs insistantes faisaient état de traitements miracles, ou à tout le moins spectaculaires, prodigués en Chine pour les patients atteints de dystrophie musculaire de Duchenne. De plus en plus de familles concernées, d’abord nord-américaines, puis européennes, se rendaient même sur place, essentiellement à Pékin, pour faire bénéficier leurs enfants de ces soins. En dehors de toute démarche scientifique, car il ne s’agissait aucunement d’un essai clinique, les patients bénéficiaient pendant plusieurs semaines de séances d’acupuncture, de massages divers et variés, et enfin de cocktails associant des décoctions de plantes et d’insectes aux vertus médicinales supposées, et de pilules issues de la pharmacopée traditionnelle chinoise. Un hôpital ayant pignon sur rue s’était même forgé une spécialité dans l’accueil des familles étrangères venues en quête du Graal.
À l’été 1998, nous avons été envoyés sur place à la demande du
Duchenne Parent Project
néerlandais et de sa présidente, Elizabeth Vroom, soucieuse d’en savoir plus sur l’efficacité supposée de telles thérapies. Elizabeth Vroom et son fils Justus, lui-même atteint de DMD, avaient également fait le déplacement et nous ont facilité la tâche pour essayer de comprendre, de l’intérieur, ce qui se passait. Notre enquête s’est déroulée principalement à Pékin, à l’hôpital Wangjin, le tout dans une ambiance très bon enfant. L’aide de notre collègue Fan Qishi fut précieuse car rares étaient, à l’époque, les médecins chinois qui maitrisaient la langue de Shakespeare. Elle fut aussi très utile pour rassurer les enfants qui, pour certains, étaient confrontés pour la première fois à des 外国人 (
wài guó rén
= étrangers) et qui en concevaient une certaine appréhension… En dépit de cela, nous avons pu les examiner dans de bonnes conditions, vérifier leur diagnostic clinique et faire des prélèvements d’ADN à visée confirmatoire.
Nos premières constatations furent assez décevantes. Si les diagnostics de myopathie de Duchenne semblaient cliniquement étayés pour la majorité d’entre eux, l’amélioration fonctionnelle tant vantée était assez modeste et se traduisait par une prolongation toute relative de la marche de quelques mois seulement. En revanche, beaucoup de témoignages concordaient pour penser que le passage par ce service était revigorant et très apprécié, y compris des patients étrangers et de leurs familles. Une vraie cure de remise en forme. Dans le contexte chinois, où l’accès aux soins de ce type se fait de manière très discontinue, cela n’avait rien d’étonnant. Les familles étaient ravies qu’on s’occupe de leur enfant quelques semaines dans l’année et cela sans bourse délier.
Il en fallait toutefois plus pour nous convaincre. La cheffe de service, Xia Yuqin, décida alors de nous emmener voir le patient qu’elle estimait avoir le mieux répondu au traitement. C’est ainsi que nous nous sommes retrouvés à Yushu, une petite bourgade proche de Changcheung, dans la province septentrionale du Jilin, à une heure d’avion de Pékin et après un long périple en voiture au milieu de la campagne chinoise. Il s’agissait d’examiner à son domicile le jeune Liu X, un adolescent de 15 ans, confiné dans son HLM faute d’ascenseur, mais encore capable de faire quelques pas avec appui, ce qu’il fit devant nous
(
Figure 9
)
. D’emblée, notre attention fut attirée par un hirsutisme et un faciès cushingoïde qui témoignaient d’un hypercorticisme floride. L’hypothèse que nous avions commencé à échafauder à Pékin prenait de l’épaisseur. La plupart de ces enfants traités recevaient vraisemblablement des corticoïdes à leur insu, et peut-être aussi à celui des médecins prescripteurs. Nos homologues pékinois ont finalement accepté que nous ramenions en Europe, en plus des prélèvements d’ADN de chaque enfant examiné, des échantillons des décoctions médicinales et autres gélules faites de
traditional chinese medicine
administrées aux patients.
 | Figure 9.
Le patient examiné à domicile à Yushu (Jilin) en compagnie de Fan Qishi (à sa gauche) et Xia Yuqin (debout à sa droite)
© J. Andoni Urtizberea.
|
Dans six cas sur dix, le diagnostic de myopathie de Duchenne ou de Becker fut confirmé en biologie moléculaire par le laboratoire de Cochin. Les quatre autres étaient cliniquement compatibles avec ce diagnostic et auraient pu correspondre à des événements mutationnels plus rares [
24
]. Des analyses complémentaires faites en Suisse par Thomas Meier, celui qui allait devenir quelques années plus tard le fondateur du laboratoire Santhera Therapeutics, révélèrent très vite que les gélules ramenées de Chine comprenaient, à des doses conséquentes, deux types de composés ayant une activité glucocorticoïde importante, sans pouvoir en déterminer l’origine végétale ou synthétique [
25
]. Dans le retour d’informations fait au
Duchenne Parent Project
, nous mettions en garde, non contre le fait de prendre des corticostéroides comme traitement de fond de la myopathie de Duchenne, mais contre leur utilisation sauvage et surtout camouflée. Nos homologues étaient sincèrement convaincus que leur protocole était efficace, ce qui n’était qu’une demi-vérité. Ils ignoraient pour la plupart la notion
d’evidence-based medicine
et avaient plutôt fait leurs la devise de Deng Xiao Ping : « qu’importe que le chat soit blanc ou noir, du moment qu’il attrape la souris… ». On ne peut en vouloir à des familles d’avoir explorer toutes les pistes possibles (au sens de
looking under every rock
, l’expression reprise dans le titre de l’article relatant ces faits).
Prudence avec la médecine traditionnelle chinoise Il faut également se rappeler qu’à l’époque, plusieurs scandales sanitaires avaient éclaté concernant des crèmes et onguents en tout genre en provenance de Chine. Ceux-ci s’étaient avérés contenir de manière clandestine des corticoïdes ou pire, des substances toxiques non déclarées, avec les conséquences que l’on peut imaginer. Les faits que nous rapportions n’avaient donc rien d’un scoop mais constituaient un exemple supplémentaire des dangers et des dérives d’une pharmacopée traditionnelle chinoise parfois utilisée de manière frauduleuse par certains médecins ou laboratoires peu scrupuleux. Pour autant, la médecine traditionnelle chinoise est parfois très utile comme l’ont prouvé les travaux de l’académicien Chen Zhu, formé en France et devenu ministre de la Santé de son pays, dans une forme réfractaire de leucémie. Ainsi mieux informés, les parents américains et européens d’enfants atteints de DMD cessèrent petit à petit de se rendre en Chine pour ce motif médical et l’on passa à autre chose. Une diffusion de la myologie à partir des villes côtières
Nos collaborations avec la Chine se sont poursuivies et se sont concentrées sur l’enseignement, la publication conjointe de cas cliniques, et la participation à des colloques médicaux et scientifiques. Le centre de gravité de la myologie chinoise est resté shanghaïen mais s’est progressivement déplacé de l’hôpital Rui Jin vers l’hôpital Huashan, autour de Zhao Changbo et de son mentor le vénérable professeur Lu Chuanzen. L’intérêt pour la pathologie neuromusculaire s’est également propagé dans le reste du pays, à Pékin, à Guangzhou et Fuzhou pour l’essentiel, même si les mégapoles de l’intérieur ne sont pas complètement restées à l’écart du mouvement. L’hôpital Huashan en a fait une spécialité d’excellence au sens où beaucoup de patients neuromusculaires lui sont référés pour avis diagnostique et prise en charge. C’est également Huashan qui a envoyé le plus d’élèves se former à la
Summer School of Myology
de Paris ces vingt dernières années. à Pékin, on compte désormais plusieurs groupes devenus experts en myologie, dont celui de Yun Yuan formé en histologie musculaire au Japon et en Allemagne. On notera au passage que les collaborations scientifiques entre la Chine et le Japon ont toujours été, en tout cas dans le domaine de la myologie, excellentes et productives, loin des querelles politiques et mémorielles entre les deux grandes puissances. La grande majorité des spécialistes chinois de biopsie musculaire sont ainsi passés par le laboratoire tokyoïte d’Ikuya Nonaka et de son successeur, Ichizo Nishino. Pour l’avoir constaté
de visu,
on peut affirmer que la qualité des biopsies musculaires faites à Pékin et à Shanghai n’a plus rien à envier à celle des meilleures équipes du monde, abstraction faite d’un accès en partie limité à certains anticorps du commerce.
Nous avons pu mesurer aussi le chemin parcouru à l’occasion des symposiums de myologie organisés à intervalles réguliers par l’hôpital Huashan et auxquels il nous a été donné d’assister ces dernières années. Beaucoup d’Européens dont David Beeson, Anders et Carola Oldfors, Bjarne Udd, et d’autres ont également fait le voyage à Shanghaï. Quand il n’est pas diffusé en ligne en direct à l’ensemble de la Chine, le symposium rassemble chaque année des neurologues, des pédiatres, des généticiens et des anatomopathologistes venus des quatre coins du pays. Les présentations scientifiques y sont de qualité et les cas cliniques très didactiques. Il existe de fait une de société chinoise de myologie regroupant à ce stade surtout des cliniciens impliqués dans le domaine et qui organise des colloques ou des cours à travers le pays. Vers des standards de niveau international
De façon générale, les installations de Huashan mais aussi celles de nombreux hôpitaux chinois des grandes villes sont désormais au standard international, à l’exception notable de certaines investigations génétiques. De façon paradoxale, l’accès au séquençage à haut débit à visée diagnostique a pris du retard dans le domaine de la pathologie neuromusculaire. La Chine avait pourtant, par l’intermédiaire du
Beijing Genome Institute
(BGI) créé à Pékin en 1999 et transféré à Shenzhzen en 2003, un atout indéniable dont elle n’a pas su profiter pleinement. BGI faisait figure de pionnier en la matière, inondant le monde entier de ses séquences produites par une kyrielle de séquenceurs d’ADN alignés en batterie, le tout à des tarifs défiant toute concurrence. Ceci est en train de changer, de plus en plus d’hôpitaux chinois intégrant cet outil dans leur activité diagnostique de routine comme illustré dans l’observation citée plus haut.
Une production scientifique en net progrès Pour qui scrute régulièrement la littérature en matière de pathologie neuromusculaire, force est de constater la montée en flèche du nombre de publications chinoises depuis une dizaine d’années. Par le passé, les cliniciens chinois étaient surtout connus pour s’intéresser à la myasthénie auto-immune. Les cohortes rapportées étaient souvent impressionnantes par le nombre de patients qui les constituaient. Dans un pays de 1,3 milliard d’individus, il n’y avait rien d’étonnant à cela. Les séries de patients thymectomisés, par exemple, ou d’études sérologiques (auto-anticorps), n’avaient rien à envier à celles de l’Ouest par leur taille. Cet intérêt pour la myasthénie perdure de nos jours et nous a fait demander un moment si la pathologie neuromusculaire héréditaire existait vraiment dans ce pays… Ou, à tout le moins, si elle intéressait vraiment quelqu’un !
Pendant longtemps, nous avons aussi cru que la politique de l’enfant unique et la taille, forcément réduite, des familles chinoises, rendait peu attractive cette population en vue de l’identification de gènes de pathologie neuromusculaire
(
Figure 10
)
. Il y avait pourtant des exceptions à ces lois destinées avant tout à contrôler la démographie, surtout dans les villes : quand le premier enfant souffrait d’une situation de handicap grave, par exemple, ou lorsque la famille appartenait à une des nombreuses minorités ou nationalités recensées en Chine. Cinquante-cinq minorités ou nationalités totalisent 120 millions d’individus à travers tout le pays comme au Xinjiang à l’ouest (avec les Ouïghours) et dans le Yunnan au sud (avec les Yis, les Baïs et bien d’autres). Nous nous étions d’ailleurs étonnés que ces minorités ou nationalités non-Han connues pour leur forte endogamie, n’aient pas fait l’objet de plus de recherches en génétique des populations.
 | Figure 10.
Si la politique de l’enfant unique est abolie depuis 2015, la Chine compte bien poursuivre la régulation de sa démographie
© J. Andoni Urtizberea.
|
Des associations de malades assez isolées
Le modèle social et politique actuel s’accommode peu de revendications émanant de la base, même si c’est pour une cause noble, en l’occurrence l’amélioration de la santé des individus. Par définition, le système communiste est déjà censé répondre aux aspirations et aux besoins des individus. Le droit d’association est donc limité et strictement encadré afin de prévenir tout débordement. Malgré ces obstacles, on dénombre plusieurs associations chinoises de patients atteints de maladies neuromusculaires. La MDA-China (pour
Muscular Dystrophy Association
–
China
) est la plus ancienne d’entre elles. Zhu Changqing, sa présidente en poste depuis près de vingt ans, fait tout son possible avec le peu de moyens dont elle dispose, qu’il s’agisse de modiques subventions octroyées par la municipalité de Shanghai ou d’opérations de
fund raising
conduites à l’échelle régionale. Cette ingénieure de formation et enseignante à l’école polytechnique de Shanghaï, est atteinte d’une forme invalidante de dysferlinopathie. Elle se bat comme une diablesse pour que l’État se préoccupe, plus qu’il ne le fait, du sort et la prise en charge des personnes en situation de handicap d’origine génétique. De ce point de vue, il faut bien avouer que les retards se sont accumulés malgré l’amélioration spectaculaire du niveau de vie de la population chinoise, surtout en ville. Car la préoccupation principale des autorités sanitaires semble bien être, hors Covid-19, non pas les maladies rares mais plutôt le vieillissement accéléré de la population. En dépit de l’adoption récente d’un plan d’action national pour les maladies rares calqué sur des standards occidentaux [
26
], les avancées apparaissent encore bien maigres dans ce domaine. La
China DMD Care and Support Association
(CCSA) est une autre association de patients, également très active, plutôt tournée vers les familles DMD et rayonnant à partir de Pékin, la capitale. Elle promeut les registres de patients neuromusculaires, les consultations multidisciplinaires à travers tout le pays, des camps de vacances, la célébration de journées nationales de mobilisation, et une meilleure couverture sociale pour les personnes concernées.
La crainte de voir les vieux démons ressurgir
La Chine continue de faire l’objet de fantasmes voire de peurs plus ou moins rationnelles. Cela ne date ni d’aujourd’hui ni de l’avènement du régime communiste en 1949. Ce n’est pas non plus la façon dont la pandémie de Covid-19 a été gérée là-bas qui risque de rassurer les plus sceptiques des analystes quant à la transparence de l’information. Dans le domaine qui nous intéresse, en l’occurrence la génétique, les récents dérapages d’un scientifique chinois concernant l’utilisation de l’édition génomique appliquée au clonage humain ont, à juste raison, relancé les polémiques et les craintes. On est d’ailleurs toujours sans nouvelles du jeune et téméraire chercheur ayant conduit cette expérimentation sans précédent et sans garde-fou éthique aucun… Rappelons-nous aussi qu’un projet de loi à très forte connotation eugéniste, avait déjà fait scandale dans les années 2000 et avait été retiré sous l’effet de la pression de la communauté scientifique internationale. Il fut également un temps, pas si lointain, où la Chine était devenue un eldorado, pour ne pas dire un Far-West (ou un Far-East, c’est selon), pour les thérapies cellulaires à visée commerciale. Les cliniques privées, dont beaucoup étaient en lien avec la biotech chinoise Beike, ont appliqué à la lettre les directives du feu président Deng et de ses successeurs à la tête du Parti et qui se résumaient en deux mots : « enrichissez-vous ! ». Grâce à un marketing savamment étudié et profitant de la crédulité de parents, non pas tant ceux du monde occidental que ceux vivant dans le Golfe, le sous-continent indien ou l’Asie du Sud-Est, la thérapie cellulaire pour les maladies neurologiques dégénératives ou séquellaires était devenue une activité florissante et très lucrative, et ce au mépris de toute approche véritablement scientifique. Les cellules souches qu’on se proposait de vous injecter guérissaient tout, maladies neuromusculaires comprises. D’ailleurs, aucun élément de preuve de votre diagnostic n’était exigé puisque,
in fine,
l’étiologie importait peu. Ces temps semblent néanmoins révolus, le gouvernement chinois ayant enfin décidé d’y mettre bon ordre il y a peu.
Un rôle encore modeste dans le concert international Malgré sa puissance militaire, économique et industrielle, et en dépit de son poids démographique, la Chine peine encore à s’imposer dans le concert des nations impliquées en myologie. Elle dispose pourtant d’équipes performantes, certes pas assez nombreuses et inégalement réparties sur l’ensemble du territoire, mais dont la production scientifique est devenue tout à fait estimable.
La Chine fait partie des pays membres ayant fondé, en 2001, l’
Asian Oceanian Myology Center
(AOMC), une organisation largement inspirée de
l’European Neuro Muscular Center (ENMC)
qui rassemble chaque année (sauf en 2020, pandémie oblige) les spécialistes en myologie de la zone Asie-Pacifique. Elle a même accueilli son congrès annuel à deux reprises (en 2002 à Pékin et à Xi’an en 2013). Comme beaucoup d’autres membres de l’organisation, la Chine y apparait un peu comme un vassal du Japon dont elle est tributaire pour la sur-spécialisation de ses myologues. Elle doit en outre faire face à la concurrence d’équipes plus en pointe à Taiwan (en particulier dans les programmes de dépistage néonatal de la maladie de Pompe et de l’amyotrophie spinale), et dans une moindre mesure, à Hong Kong. Autant dire dans deux territoires que les dirigeants de la Chine populaire espèrent bien ré-intégrer dans le giron de la mère-patrie d’ici quelques années.
Au niveau des instances mondiales de gouvernance de la myologie comme l’Alliance TREAT-NMD ou la
World Muscle Society
(WMS), la Chine est encore peu visible. Un seul congrès conjoint avec le TREAT-NMD a été organisé à Guangzhou (Canton) en avril 2011 et s’est traduit par la mise en place de registres nationaux de patients pour la DMD et pour la SMA (opérés depuis Pékin par Shin-Wen Wu et ses collaborateurs) et la traduction des
standards of care
pour ces deux maladies neuromusculaires [
27
]. On notera également que le seul congrès jamais organisé en Asie par la WMS l’a été au Japon (Kumamoto, 2010) et pas en Chine…
Quel avenir pour la myologie en Chine ?
La vision que nous avons de la Chine est souvent biaisée. Il est difficile de sortir des clichés habituels sur son développement économique à marche forcée, ses villes-champignons, ses néo-milliardaires ou son impérialisme millénaire. La réalité est sans doute beaucoup plus complexe… Les experts s’accordent néanmoins à dire que la Chine sera demain un géant des technologies et que parmi celles-ci figureront en bonne place les biotechnologies. Pour autant, et à ce stade, sa contribution au développement de la myologie de pointe reste modeste, qu’il s’agisse, par exemple, de la thérapie génique à base de vecteurs viraux ou des essais multicentriques internationaux (hors Covid-19). Mais qu’en sera-t-il demain ? La Chine dispose d’atouts indéniables tels qu’exposés plus haut. Elle doit faire face aussi à de redoutables défis comme l’analyse très bien un article récent sur le sujet [
28
] : l’engorgement des hôpitaux universitaires à un point qu’on a du mal à imaginer, la quasi-absence de médecine générale à travers le pays, plus encore dans les zones rurales, sans compter les problèmes récurrents de corruption et/ou de fraude scientifique. Tout en restant vigilant et nonobstant les difficultés actuelles, nous restons persuadés qu’il y a encore beaucoup à construire avec nos homologues chinois dans le domaine de la myologie
(
Figure 11
)
.
 | Figure 11.
Une jeune génération de myologues chinois est en marche (colloque national de myologie de Shanghaï, novembre 2019)
© J. Andoni Urtizberea.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
En Europe :
Marc Delpech, pour sa relecture du manuscrit et son intarissable connaissance de la Chine.
Elizabeth et Justus Vroom, Thomas Meier, Norma Romero, Michel Fardeau, Denise Paulin, Patrick Vicart, Li Zhenlin, France Leturcq, Jamel Chelly, Cherif Beldjord, Hu Yuhong, Françoise Salama et bien d’autres.
En Chine :
Zhao Changbo, Lu Chuanzhen, et leurs nombreux collaborateurs de l’hôpital Huashan, Chen Shengdi,Fan Qishi et son mari, Yu Wen, Zheng Hong, Xia Yuqin, Chen Zhu, Zhu Changqing.
|
1.
Vicart
P
,
Caron
A
,
Guicheney
P
,
et al.
A missense mutation in the alphaB-crystallin chaperone gene causes a desmin-related myopathy.
.
Nat Genet.
1998;
;
20
:
:92.
–
95
.
2.
Selçen
D
,
Engel
AG
.
Myofibrillar myopathy caused by novel dominant negative alpha-B-crystallin mutations.
.
Ann. Neurol.
2003;
;
54
:
:804.
–
810
.
3.
Béhin
A
,
Salort-Campana
E
,
Wahbi
K
,
et al.
Myofibrillar myopathies: state of the art, present and future challenges.
.
Rev Neurol (Paris).
2015;
;
171
:
:715.
–
729
.
4.
Sarparanta
J
,
Jonson
PH
,
Kawan
S
,
et al.
Neuromuscular diseases due to chaperone mutations: a review and Some new results.
.
Int J Mol Sci.
2020;
;
21
:
:1409.
.
5.
Fardeau
M
,
Godet-Guillain
J
,
Tome
FM
,
et al.
Une nouvelle affection musculaire familiale définie par l’accumulation intra-sarco-plasmique d’un matériel granulo-filamentaire dense en microscopie électronique.
.
Rev Neurol.
1978;
;
134
:
:411.
–
425
.
6.
De Bleecker
JL
,
Engel
AG
,
Ertl
BB
.
Myofibrillar myopathy with abnormal foci of desmin positivity. I. Immunocytochemical analysis reveals accumulation of multiple other proteins.
.
J Neuropathol Exp Neurol.
1996;
;
55
:
:563.
–
577
.
7.
Sacconi
S
,
Féasson
L
,
Antoine
JC
,
et al.
A novel CRYAB mutation resulting in multisystemic disease.
.
Neuromuscul Disord.
2012;
;
22
:
:66.
–
72
.
8.
Reilich
P
,
Schoser
B
,
Schramm
,
et al.
The p. G154S mutation of the alpha-B crystallin gene (CRYAB) causes late-onset distal myopathy.
.
Neuromuscul Disord.
2010;
;
20
:
:255.
–
259
.
9.
Berry
V
,
Francis
P
,
Reddy
MA
,
et al.
Alpha-B crystallin gene (CRYAB) mutation causes dominant congenital posterior polar cataract in humans.
.
Am J Hum Genet.
2001;
;
69
:
:1145.
–
1145
.
10.
Liu
Y
,
Zhang
X
,
Luo
L
,
et al.
Invest Ophthalmol Vis Sci.
2006;
;
47
:
:1069.
–
1075
.
11.
Inagaki
N
,
Hayashi
T
,
Arimura
T
,
et al.
Alpha B-crystallin mutation in dilated cardiomyopathy.
.
Biochem Biophys Res Commun.
2006;
;
342
:
:379.
–
386
.
12.
Jiao
Q
,
Sanbe
A
,
Zhang
X
,
et al.
αB-Crystallin R120G variant causes cardiac arrhythmias and alterations in the expression of Ca
2+
-handling proteins and endoplasmic reticulum stress in mice
.
.
Clin Exp Pharmacol Physiol.
2014;
;
41
:
:589.
–
599
.
13.
Brodehl
A
,
Gaertner-Rommel
A
,
Klauke
B
,
et al.
The novel αB-crystallin (CRYAB) mutation p. D109G causes restrictive cardiomyopathy.
.
Hum Mutat.
2017;
;
38
:
:947.
–
952
.
14.
Bortolani
S
,
Fattori
F
,
Monforte
M
,
et al.
Peculiar muscle imaging findings in a patient with alphaB-crystallinopathy and axial myopathy.
.
J Neurol Sci.
2020;
;
416
:
:116999.
.
15.
Van der Smagt
JJ
,
Vink
A
,
Kirkels
JH
,
et al.
Congenital posterior pole cataract and adult onset dilating cardiomyopathy: expanding the phenotype of αB-crystallinopathies.
.
Clin Genet.
2014;
;
85
:
:381.
–
385
.
16.
Safieh
LA
,
Khan
AO
,
Alkuraya
FS
.
Identification of a novel CRYAB mutation associated with autosomal recessive juvenile cataract in a Saudi family.
.
Mol Vis.
2009;
;
15
:
:980.
–
984
.
17.
Lacson
AG
,
Seshia
SS
,
Sarnat
HB
,
et al.
Autosomal recessive, fatal infantile hypertonic muscular dystrophy among Canadian Natives.
.
Can J Neurol Sci.
1994;
;
21
:
:203.
–
212
.
18.
Del Bigio
MR
,
Chudley
AE
,
Sarnat
HB
,
et al.
Infantile muscular dystrophy in Canadian aboriginals is an αB-crystallinopathy.
.
Ann Neurol.
2011;
;
69
:
:866.
–
871
.
19.
Forrest
KM
,
Al-Sarraj
S
,
Sewry
C
,
et al.
Infantile onset myofibrillar myopathy due to recessive CRYAB mutations.
.
Neuromuscul Disord.
2011;
;
21
:
:37.
–
40
.
20.
Wu
Y
,
Han
C
,
He
Y
,
et al.
CRYAB gene related fatal infantile fattening myofibrillar myopathy: a report of two cases with literature review.
.
Clin Pediatr.
2019;
;
37
:
:134.
–
137
.
21.
Ma
K
,
Luo
D
,
Tian
T
,
et al.
A novel homozygous initiation codon variant associated with infantile alpha-B crystallinopathy in a Chinese family.
.
Mol Genet Genomic Med.
2019;
;
7
:
:e825.
.
22.
Marcos
AT
,
Amorós
D
,
Muñoz-Cabello
B
,
et al.
A novel dominant mutation in CRYAB gene leading to a severe phenotype with childhood onset.
.
Mol Genet Genomic Med.
2020;
;
8
:
:e1290.
.
23.
Beck
DB
,
Ferrada
MA
,
Sikora
KA
,
et al.
Somatic mutations in UBA1 and severe adult-onset autoinflammatory disease.
.
N Eng J Med.
2020
. doi:
10.1056/NEJMoa2026834
.
24.
Urtizberea
JA
,
Fan
QS
,
Vroom
E
,
et al.
Looking under every rock : Duchenne muscular dystrophy and traditional Chinese medicine.
.
Neuromuscul Dis.
2003;
;
13
:
:705.
–
707
.
25.
Courdier-Fruh
I
,
Barman
L
,
Wettstein
P
,
et al.
Detection of glucocorticoid-like activity in traditional Chinese medicine used for the treatment of Duchenne muscular dystrophy.
.
Neuromuscul Dis.
2003;
;
13
:
:699.
–
704
.
26.
Song
P
,
He
J
,
Li
F
,
et al.
Innovative measures to combat rare diseases in China: the national rare diseases registry system, larger-scale clinical cohort studies, and studies in combination with precision medicine research.
.
Intractable Rare Dis Res.
2017;
;
6
:
:1.
–
5
.
27.
Xu
EX
.
Professor Shi-Wen Wu: One City, One Doctor-building up the national DMD registry network.
.
Ann Transl Med.
2015;
;
3
:
:204.
.
28.
Delpech
M.
.
L’évolution de la médecine en Chine vue au travers d’une longue coopération.
.
Les Tribunes de la Santé.
2019;
;
59
:
:1.
–
7
.
|