| |
| Med Sci (Paris). 36: 13–16. doi: 10.1051/medsci/2020207.Développement et maintenance du système neuromusculaire Camille Guillermin,1* Mathilde Bouchet,1 Alain Garcès,1 and Jonathan Enriquez1 1Institut De Génomique Fonctionnelle De Lyon, ENS de Lyon, UMR CNRS 5242
,
Lyon
,
France MeSH keywords: Adulte, Animaux, Axones, Systèmes CRISPR-Cas, Régulation de l'expression des gènes au cours du développement, Génomique, Humains, Motoneurones, Muscles squelettiques, RNA-Seq, Régénération, physiologie, méthodes, croissance et développement, innervation, génétique |
La locomotion se traduit par un ensemble de mouvements indispensables à la survie des espèces ; elle permet aux animaux de trouver de la nourriture, d’échapper aux prédateurs ou encore de trouver des partenaires. Chez l’Homme, la réparation des lésions du système locomoteur dues à des accidents ou à des maladies neurodégénératives est un enjeu sociétal majeur. L’étude détaillée du système neuromusculaire, de ses fonctions et de son développement, permettra de développer les thérapies de demain. Mon projet de thèse consiste à comprendre le développement et la maintenance du système neuromusculaire en utilisant la mouche
Drosophila melanogaster
comme modèle d’étude. Ce puissant modèle génétique permet une étude fine du système locomoteur lors du développement et de la vie adulte.
Au cours du développement, une reconnaissance spécifique entre un axone et son partenaire musculaire s’établit et sera maintenue tout au long de la vie. La spécificité de cette reconnaissance est à l’origine du bon fonctionnement du système locomoteur. Lors de la mise en place de ce système, les terminaisons nerveuses font rapidement face à plusieurs choix de connexions musculaires. Cependant, ces terminaisons nerveuses vont toujours faire le même choix, et ce de manière stéréotypée. Par exemple, chez l’Homme, une fibre musculaire sera toujours innervée par le même motoneurone (MN). Chaque MN se connecte à des fibres musculaires spécifiques et possède une architecture unique définie par leur forme et leur nombre de boutons synaptiques. Un mécanisme doit donc se mettre en place au cœur de la reconnaissance spécifique entre un axone et un muscle, et ceci dans un laps de temps court. Malgré les nombreuses études sur les premières étapes contrôlant le guidage axonal, les molécules impliquées dans cette reconnaissance spécifique et stéréotypée restent encore inconnues. De plus, l’architecture unique de ces MNs établie lors du développement doit être maintenue tout au long de la vie afin de garder un système locomoteur fonctionnel. Mes travaux ont pour objectif de définir les mécanismes moléculaires et cellulaires à l’origine : (1) de cette reconnaissance et (2) de leur maintien au cours de la vie. |
Chez les vertébrés, au cours du développement, les MNs sont subdivisés en groupe de MNs exprimant le même code de facteurs de transcription (FTs) et innervant les mêmes muscles [
1
]. Alors que ce code de FTs confère aux MNs la capacité de se connecter à des muscles spécifiques, les effecteurs de ce code restent inconnus. L’hypothèse de mon projet est que chaque muscle et donc chaque MN exprime de manière différentielle, lors du développement, des molécules à l’origine de la reconnaissance spécifique axone-muscle.
Chez la drosophile, un réseau axonal stéréotypé entre individus est également retrouvé. Des études sur le système neuromusculaire larvaire et adulte ont montré que la spécificité du réseau axonal se situe au niveau du MN. En d’autres termes, chaque MN va innerver, de manière invariante d’un individu à l’autre, la même fibre musculaire. Des observations sur les MNs innervant la paroi musculaire des larves de drosophile ont mis en avant des molécules spécifiques et leur rôle dans le contact axone-muscle. Deux classes de molécules ont été caractérisées : des molécules attractives et des molécules répulsives [
2
]. Cependant, les études sur la reconnaissance axone-muscle ont été réalisées au stade larvaire qui est un système où chaque muscle est composé d’une seule fibre musculaire et où les tendons sont des cellules différenciées de l’épiderme. De plus, chez la larve, la guidance axonale commence après la myogenèse : le muscle se développe puis l’axone grandit en direction de sa cible. A l’inverse, la patte de drosophile propose un modèle d’étude analogue aux membres supérieurs et inférieurs des vertébrés en termes de structure et de développement. En effet, le système adulte se compose de plusieurs fibres musculaires par muscle et les tendons sont des structures indépendantes de l’épiderme [
3
]. Comme chez les vertébrés, la myogenèse des muscles des pattes se déroule en même temps que le développement axonal. Des études récentes ont montré le rôle de deux nouvelles protéines, la
Defective proboscis extension response 10
(Dpr10) et la
Dpr-interacting protein alpha
(DIP-α), exprimées respectivement dans des sous-populations de muscles et de MNs de pattes. Il a été démontré que ces protéines interagissaient
in vitro
et permettaient la stabilisation des terminaisons axonales
in vivo
[
4
]. Cependant, DIP-α et Dpr10 ne sont pas nécessaires au premier contact axone-muscle mais au maintien de l’innervation déjà établie. Les molécules permettant une reconnaissance spécifique entre un axone et son partenaire musculaire au niveau des membres sont inconnues que ce soit chez les vertébrés ou les invertébrés.
Au cours de la vie, les connexions établies lors du développement sont soumises à de nombreuses formes de stress (chimique, physique ou biologique). Ainsi, des mécanismes doivent permettre le maintien de l’architecture de l’innervation musculaire et son homéostasie. Un de mes axes de recherche est de comprendre comment cette architecture est maintenue au cours de la vie adulte. En effet, le système périphérique fait face à de possibles blessures et doit se régénérer de manière spécifique. Par exemple, des études chez l’écrevisse ont montré que lorsqu’un nerf moteur est coupé, celui-ci se régénère et innerve de nouveau sa cible musculaire d’origine [
5
]. Chez l’Homme, quand un nerf périphérique est atteint, les axones se régénèrent avec une vitesse de 1 mm par jour et la fonction musculaire est rétablie, ce qui suggère que les axones ré-innervent de nouveau la bonne cible musculaire [
6
]. La maintenance de l’innervation suite à des conditions physiologiques ou pathologiques doit préserver l’architecture unique des MNs afin d’assurer une fonction locomotrice correcte. Des études précédentes conduites dans notre laboratoire ont montré qu’un code de FTs joue un rôle crucial au cours du développement du système neuro-musculaire en permettant de spécifier la morphologie unique de chaque MN [
7
,
8
]. Des résultats préliminaires ont montré qu’une partie de ce code est maintenue chez l’adulte. En conséquence, notre hypothèse de travail est que ces FTs sont maintenus chez l’adulte afin de conserver une innervation spécifique, unique et stéréotypée en cas, par exemple, de blessure ou de régénération.
|
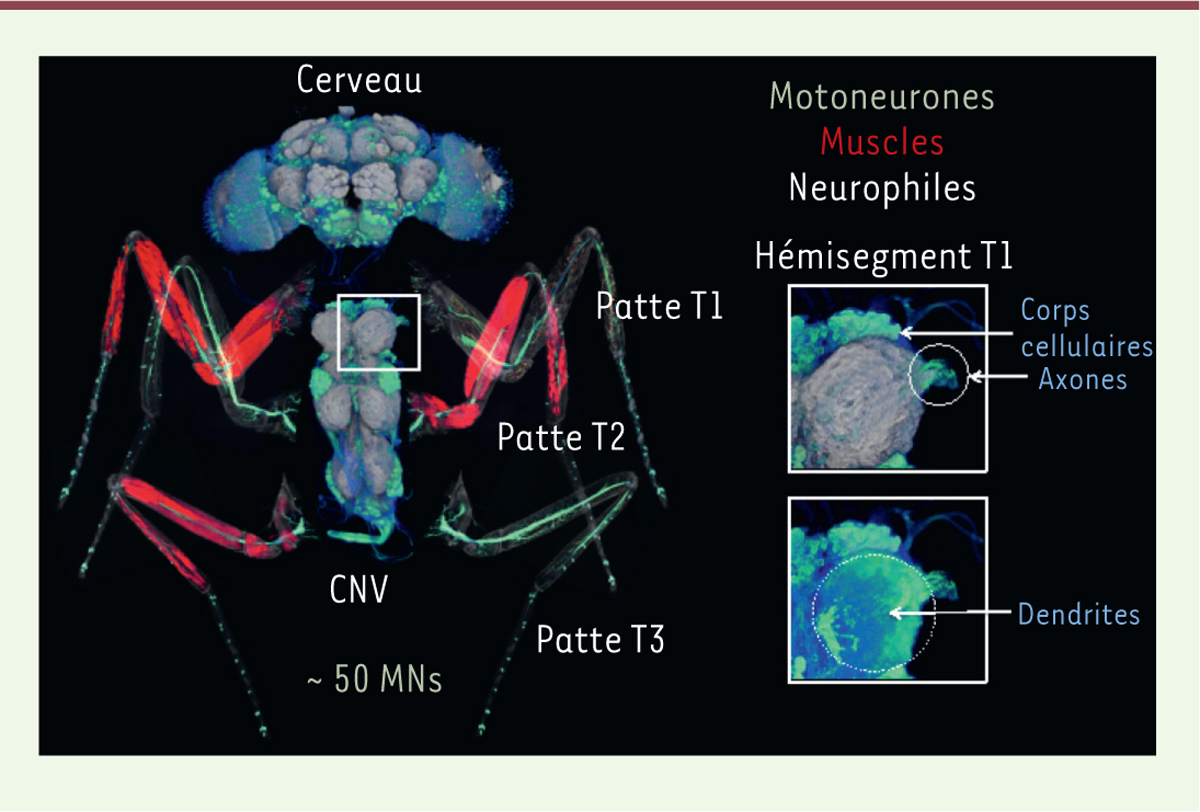
Afin de comprendre le développement et la maintenance d’une innervation spécifique, nous utilisons comme modèle d’étude les pattes et la corde nerveuse ventrale (ou CNV, un équivalent de la moelle épinière chez les vertébrés) de
Drosophila melanogaster
. Chez la drosophile, chaque patte est composée de 14 muscles innervés par 50 MNs dont les corps cellulaires sont localisés dans 6 ganglions thoraciques au sein de la CNV [
9
]
(
Figure 1
)
. Chaque MN possède une morphologie unique et stéréotypée définie par une arborisation dendritique et des cibles musculaires uniques. Ces morphologies sont sous le contrôle de codes de FTs appelés FT morphologiques (FTm). La reprogrammation de ce code pendant le développement induit des changements d’identité morphologiques tels que le ciblage axonal et l’arborisation dendritique des MNs [
7
,
8
].
 | Figure 1.
Système neuromusculaire adulte de Drosophila melanogaster.
Reconstruction 3D d’une image confocale du système neuromusculaire d’une drosophile adulte. Les corps cellulaires des MNs sont localisés dans les segments thoraciques (T) de la corde nerveuse ventrale (CNV).
|
D’autre part, les 14 muscles de la patte sont produits à partir de cellules nommées myoblastes situées au sein d’une structure développementale appelée disque imaginal. Au cours de la métamorphose, les disques imaginaux s’évaginent afin de former la patte adulte. Au début de cette évagination, le disque est traversé par un simple nerf et les myoblastes sont organisés en groupes. Il a été montré que dix heures après la formation de la pupe les contacts muscles-axones sont déjà établis [
4
]. Ainsi, le premier contact doit se faire dans les dix heures qui suivent la pupaison.
|
Méthodologie et résultats attendus
La première partie de ma thèse vise donc à comprendre les mécanismes contrôlant la reconnaissance spécifique d’un MN et de son muscle cible au cours du développement. Pour cela, j’étudierai la mise en place de l’innervation par imagerie sur tissus fixés ou
in vivo
. Ces expériences permettront d’étudier le développement simultané des myoblastes et des axones au cours de la métamorphose. Puis, afin d’identifier les effecteurs du code de FTm, mon projet est de réaliser le séquençage des ARN des MNs et des muscles. Je me concentrerai sur la signature moléculaire des muscles de pattes, tandis que les MNs seront étudiés en collaboration avec le laboratoire du Pr Richard S. Mann (
Columbia University
, NY, USA). Du séquençage en cellule unique sera réalisé sur les myoblastes en utilisant la technologie « 10X Genomics single-cell RNAseq ». La première étape sera d’isoler les myoblastes au moment du premier contact axone-muscle. Cette étape sera réalisée par FACS grâce à des marqueurs fluorescents. La sélection des gènes candidats sera basée sur une expression différentielle entre chaque cluster et le profil des molécules différentiellement exprimées : récepteur/ligand, molécules sécrétées. Finalement, les résultats seront comparés avec ceux du séquençage des MNs afin de trouver des duos récepteur/ligand, molécules sécrétées/ récepteurs. De plus, si l’hypothèse que chaque muscle exprime de manière différentielle des molécules est vraie, il devra être observé 14 groupes de myoblastes différents pour les 14 muscles de la patte. Une autre hypothèse est que l’unité fonctionnelle de la reconnaissance axone-muscle soit la fibre musculaire et non le muscle. Ainsi, comme chaque muscle est composé en moyenne de 10 fibres musculaires, le séquençage de cellule unique devrait révéler 140 groupes différents. Enfin, l’étape suivante du projet est de valider et d’analyser la fonction de ces molécules candidates au sein de ces groupes grâce à des techniques de RNAi (pour
RNA interference
) et de surexpression pour identifier l’impact de ces modifications
in vivo
sur la mise en place d’une innervation spécifique et stéréotypée.
La deuxième partie de ma thèse a pour but d’étudier les mécanismes permettant la maintenance du système neuromusculaire au cours de la vie adulte. Des résultats préliminaires ont montré que certains FTms sont maintenus chez la mouche adulte tel que
Oli
. Ainsi, afin de confirmer le rôle de ce code dans la maintenance du système adulte, la fonction d’Oli sera étudiée en supprimant spécifiquement Oli dans les MNs adultes. Pour cela, le laboratoire a conçu un allèle conditionnel de
Oli
qui permet de le muter spécifiquement dans des cellules adultes et de visualiser les cellules mutantes et normales (WT pour
wild-type
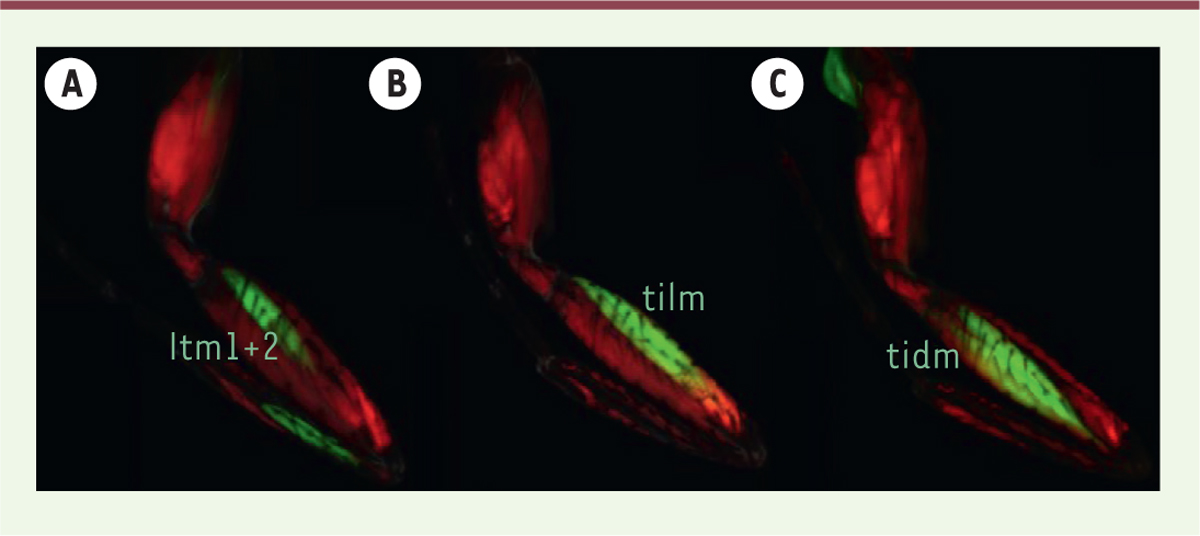
) avec deux marqueurs différents. La suite du projet sera de réaliser une analyse phénotypique de l’innervation sur ces mutants adultes à différents temps durant la vie adulte et cela dans différentes conditions : après une ablation au laser, et avec ou sans stress de marche. De plus, il pourra être réalisé une étude du phénotype de marche des mutants grâce à une technologie de pointe : « Flywalker ». Cet appareil permet d’analyser les mouvements de marche grâce à un système optique enregistrant les empreintes de chaque patte. Il sera alors possible de voir si des défauts d’innervation sont liés à des défauts de locomotion lorsque la machinerie moléculaire de la maintenance est modifiée. Enfin, en complément de ce projet, le profil d’expression des muscles adultes sera réalisé par un chercheur du laboratoire. Pour cela, seront utilisés des « drivers », obtenus grâce à un criblage réalisé lors de mon Master, et dont le but est de marquer spécifiquement un muscle au sein de la patte
(
Figure 2
)
. Grâce à une technique appelée «
Translating Ribosome Affinity Purification
», il sera possible de capturer, de manière spécifique à la cellule, l’ARN messager d’un muscle donné [
10
]. Nous pourrons ensuite réaliser du séquençage d’ARN (RNAseq) pour isoler des gènes candidats. Dans un premier temps, nous étudierons les protéines membranaires et protéines sécrétées. Puis, la fonction de ces gènes candidats sera étudiéeen utilisant des techniques de CRISPR-Cas9 somatique. Par mutation spécifique chez l’adulte de ces gènes, leur impact sur la maintenance d’une innervation spécifique pourra être étudié.
 | Figure 2.
Exemples de drivers spécifiques.
Expression de la GFP (
green fluorescent protein
) sous le contrôle de différents
drivers
.
A.
Long tendon muscle 1 (ltm1, fémur) et 2 (ltm2, tibia).
B.
Tibia levator muscle (tilm, fémur).
C.
Tibia depressor muscle (tidm, fémur). Rouge : muscles (Mhc-RFP) ; vert : expression du X-Gal4 (UAS-mCD8::GFP).
|
|
Ce projet mènera à de nouveaux concepts biologiques qui accroîtront nos connaissances fondamentales en biologie du développement. Ces connaissances seront essentielles pour trouver des thérapies efficaces pour lutter contre des maladies neuromusculaires ou réparer le système locomoteur après lésion. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Camille Guillermin a reçu le Prix Master de la Société Française de Myologie en 2019 pour l’ensemble de ses travaux de recherche.
|
1.
Catela
C
,
Shin
MM
,
Dasen
JS
.
Assembly and function of spinal circuits for motor control.
.
Annu Rev Cell Dev Biol.
2015;
;
31
:
:669.
–
698
.
2.
Ruiz-Cañada
C
,
Budnik
V
.
Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition.
.
Int Rev Neurobiol.
2006;
;
75
:
:1.
–
31
.
3.
Soler
C
,
Daczewska
M
,
Da Ponte
JP
,
et al.
Coordinated development of muscles and tendons of the Drosophila leg.
.
Development.
2004;
;
131
:
:6041.
–
6051
.
4.
Venkatasubramanian
L
,
Guo
Z
,
Xu
S
,
et al.
Stereotyped terminal axon branching of leg motor neurons mediated by IgSF proteins DIP-a and Dpr10.
.
Elife.
2019;
;
8
:
:e42692.
.
5.
Worden
MK
,
Hwang
JC
,
Vélez
SJ
,
et al.
Regeneration studies on a crayfish neuromuscular system. I. Connectivity changes after intersegmental nerve transplants.
.
J Neurobiol.
1988;
;
19
:
:127.
–
140
.
6.
Huebner
EA
,
Strittmatter
SM
.
Axon regeneration in the peripheral and central nervous systems.
.
Results Probl Cell Differ.
2009;
;
48
:
:339.
–
351
.
7.
Enriquez
J
,
Venkatasubramanian
L
,
Baek
M
,
et al.
Specification of individual adult motor neuron morphologies by combinatorial transcription factor codes.
.
Neuron.
2015;
;
86
:
:955.
–
970
.
8.
Enriquez
J
,
Rio
LQ
,
Blazeski
R
,
et al.
Differing strategies despite shared lineages of motor neurons and glia to achieve robust development of an adult neuropil in Drosophila.
.
Neuron.
2018;
;
97
:
:538.
–
554
.
9.
Baek
M
,
Mann
RS
.
Lineage and birth date specify motor neuron targeting and dendritic architecture in adult Drosophila.
.
J Neurosci.
2009;
;
29
:
:6904.
–
6916
.
10.
Heiman
M
,
Schaefer
A
,
Gong
S
,
et al.
A translational profiling approach for the molecular characterization of CNS cell types.
.
Cell.
2008;
;
135
:
:738.
–
748
.
|