| |
| Med Sci (Paris). 36: 56–60. doi: 10.1051/medsci/2020194.Stratégies de ciblage spécifique de la tumeur fondées sur les caractéristiques des antigènes tumoraux et du microenvironnement tumoral Tristan Mangeat,1a Matthieu Gracia,1b Pierre Martineau,1d and Bruno Robert1c 1IRCM, Institut de Recherche en Cancérologie de Montpellier U1194, Université de Montpellier, Institut régional du Cancer de Montpellier
,
Montpellier
,
France |
Succès des anticorps thérapeutiques L’immunothérapie à base d’anticorps monoclonaux (AcM) a considérablement amélioré le pronostic des patients atteints de cancers, même à des stades métastatiques. Ces AcM ciblent des marqueurs membranaires surexprimés par les cellules tumorales, appelés antigènes associés aux tumeurs (AAT) ou bien des molécules du micro-environnement tumoral. Le plus souvent, ces AcM agissent en tuant les cellules tumorales ou en bloquant l’activation des AAT ou en stimulant le système immunitaire pour induire une régression tumorale. Par exemple, la combinaison des AcM nivolumab et ipilimumab, qui ciblent respectivement les points de contrôles du système immunitaire PD1 et CTLA-4 présents à la surface des lymphocytes T (LT), a permis d’augmenter la médiane de survie globale de 9 mois à plus de 5 ans pour les patients atteints de mélanomes avancés. Malgré une faible expression de ces AAT par les tissus sains, la fixation des AcM sur ces derniers peut générer des toxicités, parfois sévères pour le patient. |
Les toxicités dues au ciblage des antigènes associés aux tumeurs
Il est bien documenté que le traitement du cancer du côlon métastatique par l’AcM anti-EGFR (
epithelial growth factor receptor
), le cétuximab, entraîne des effets indésirables cutanés du fait de sa fixation sur les kératinocytes de la peau qui expriment également ce récepteur [
1
]. Ces toxicités dues à la liaison à la cible extra-tumorale sont encore plus importantes avec certains nouveaux formats d’anticorps. C’est le cas du bivatuzumab mertansine, un AcM armé
1
se liant au récepteur CD44v6, surexprimé dans les carcinomes squameux de la tête et du cou. Lors de l’essai clinique de phase I, près de 80% des patients traités ont souffert de manifestations cutanées importantes dès la dose de 100 mg/m
2
(environ 0,83mg/kg) et un patient a succombé à la suite d’une nécrolyse épidermique toxique. Ces toxicités cutanées, attribuées à l’expression basale de ce variant par les épithéliums squameux, ont conduit à l’arrêt du développement de l’AcM [
2
].
Face au rôle prépondérant du système immunitaire dans la lutte anti-tumorale, des LT ont été modifiés pour exprimer à leur surface un récepteur chimérique (CAR-T)
2,
, qui est constitué d’un fragment d’anticorps fusionné à des modules d’activation intracellulaires. Ces LT sont capables d’être activés après fixation du fragment d’anticorps à l’antigène tumoral. Si le potentiel anti-tumoral des CAR-T est prometteur, une activation dérégulée de ces cellules peut induire un syndrome de relargage des cytokines
3
faisant suite à la reconnaissance de la cible extra-tumorale. L’administration de CAR-T ciblant le récepteur HER2 (
human epithelial growth factor receptor-2
) chez une patiente atteinte d’un cancer du côlon métastatique a induit une infiltration pulmonaire lymphocytaire, précédant le choc cytokinique, et une détresse respiratoire fatale due à la reconnaissance par les CAR-T de la cible présente au niveau pulmonaire [
3
].
Ainsi, l’expression, même à faible densité, de la cible par le tissu sain reste problématique pour le développement de thérapies anti-tumorales avec un bon profil de sécurité pour le patient. Face à la difficulté d’identifier des antigènes parfaitement spécifiques des tumeurs, il est nécessaire de développer des stratégies améliorant la spécificité des anticorps thérapeutiques pour les AAT de la tumeur de façon à limiter leurs toxicités chez le patient. Nous présentons dans cette revue les nouvelles pistes de ciblage spécifique de la tumeur fondées sur les caractéristiques antigéniques de la tumeur et du microenvironnement tumoral. |
Stratégies fondées sur l’utilisation de pro-drogues Activation de pro-anticorps par les protéases du microenvironnement tumoral Il est désormais établi que le microenvironnement tumoral est enrichi en protéases, qui jouent un rôle dans le caractère invasif de la tumeur, et dont l’expression est corrélée à un mauvais pronostic. En tirant profit de cette caractéristique, ont été développés des pro-anticorps, dont l’activité de liaison à l’antigène cible est restituée après protéolyse d’un « masque ».
Desnoyers
et al.
ont ainsi associé un peptide, masquant et bloquant le paratope
4
du cétuximab, à l’extrémité N-terminale de la chaine légère, par l’intermédiaire d’un site peptidique clivable par des protéases spécifiques, telles que la matriptase. Dans un environnement dépourvu de protéases, ce pro-anticorps, appelé PB1, perd fortement sa capacité de fixation à la cible, l’EGFR. En revanche, une fois la tumeur atteinte, les protéases présentes dans le microenvironnement tumoral assurent alors le clivage du lien peptidique, libérant l’accessibilité du paratope pour rétablir la liaison de l’anticorps à sa cible. Outre son activité anti-tumorale similaire au cétuximab contre des xénogreffes de cancer du poumon chez la souris, ce pro-anticorps démontre un très bon profil de tolérance chez le macaque. En effet, alors qu’une toxicité cutanée survient chez 66% des singes recevant une dose d’entretien de 25 mg/kg/semaine de cétuximab pendant 5 semaines, il faut une dose de 75 mg/kg/semaine de l’AcM PB1 pendant 7 semaines pour voir survenir les premiers effets indésirables cutanées [
4
].
Sur ce même principe, Trang
et al.
ont conçu un masque peptidique « universel », constitué de superhélices peptidiques. Une fois associées aux chaines lourdes et légères de l’anticorps via un espaceur clivable par les protéases, les hélices assurent un blocage stérique du paratope de l’anticorps. Comme attendu, l’ajout de ce masque à un AcM armé anti-CD19 entraine une réduction drastique de sa cytotoxicité dans un modèle cellulaire de lymphome
in vitro
. En revanche, dans un modèle de souris immunodéficientes greffées avec les cellules d’un lymphome humain non Hodgkinien, une dose unique de 6 mg/kg du pro-anticorps armé suffit à contrôler la croissance tumorale de manière identique à l’anticorps parental [
5
].
|
Activation de pro-anticorps par l’hypoxie tumorale
La croissance rapide des tumeurs se traduit par un défaut de vascularisation responsable de l’apparition de zones appauvries en oxygène. Cet environnement hypoxique a déjà été exploité pour l’activation conditionnelle de petites molécules. L’équipe de W. Tan a généré des macromolécules cagées (anticorps et aptamères
5
), dont le paratope est bloqué stériquement par du polyéthylène-glycol, qui peut être éliminé en condition réductrice. En normoxie, les électrons fournis par l’oxygène empêchent la bioréduction de la fonction clivable par les réductases. Le site de liaison à l’antigène reste alors inaccessible. Mais, la fixation de la macromolécule est spécifiquement restaurée sur des sphéroïdes cultivés en hypoxie. Une étude de biodistribution chez la souris démontre que l’accumulation privilégiée des macromolécules au niveau de la tumeur n’est rendue possible qu’avec l’élimination du masque par bioréduction [
6
].
|
Stratégies fondées sur les propriétés de liaison de l’anticorps Modulation de l’affinité et du format des anticorps
La plupart des AcM thérapeutiques actuels sont sélectionnés sur la base de leur affinité élevée (de l’ordre du nanomolaire [nM] voire du picomolaire [pM] pour l’AAT cible). Ceci engendre une fixation des anticorps très largement indépendante de la densité de l’antigène présent à la surface des cellules. Wong
et al
. ont donc généré un AcM armé anti-EGFR de faible affinité (une centaine de nM) : celui-là montre une fixation restreinte et une moindre toxicité sur les kératinocytes présentant une faible densité antigénique à des doses où le cétuximab (~0,5 nM) est, quant à lui, cytotoxique. Seule une expression tumorale élevée de l’EGFR permet de restaurer une liaison bivalente
6
de cet anticorps ainsi que son internalisation. Couplé à des agents anti-mitotiques cet anticorps possède un fort potentiel anti-tumoral [
7
]. L’utilisation d’anticorps bispécifiques, c.à.d. liant simultanément deux antigènes co-exprimés par la tumeur, a aussi été envisagée pour accroître la spécificité de ciblage tumoral. Mais l’équipe de Dall’Acqua a montré avec un anticorps bispécifique anti-HER2/neu et anti-EGFR qu’il est nécessaire de réduire l’affinité d’un des partenaires (dans son cas l’EGFR) pour augmenter la sélectivité et ainsi épargner les tissus sains [
8
]. Slaga
et al.
ont développé un anticorps engageant les LT par liaison monovalente au récepteur CD3 et par une liaison bivalente mais de faible affinité (~ 50 nM) au récepteur HER2/neu (fusion de deux Fab en tandem à l’extrémité N-terminale de la région charnière de l’IgG). Ce format original limite la liaison, et donc l’activation des LT, à des cellules ayant un faible niveau d’expression de HER2, comme les cardiomyocytes (qui ont été impliqués dans les effets cardiologiques indésirables observés chez des patientes traitées par un AcM anti-HER2/neu). La liaison bivalente au récepteur HER2, rendue possible par une densité antigénique élevée, déclenche par contre
in vitro
un effet cytotoxique des LT spécifiquement contre les cellules tumorales [
9
].
|
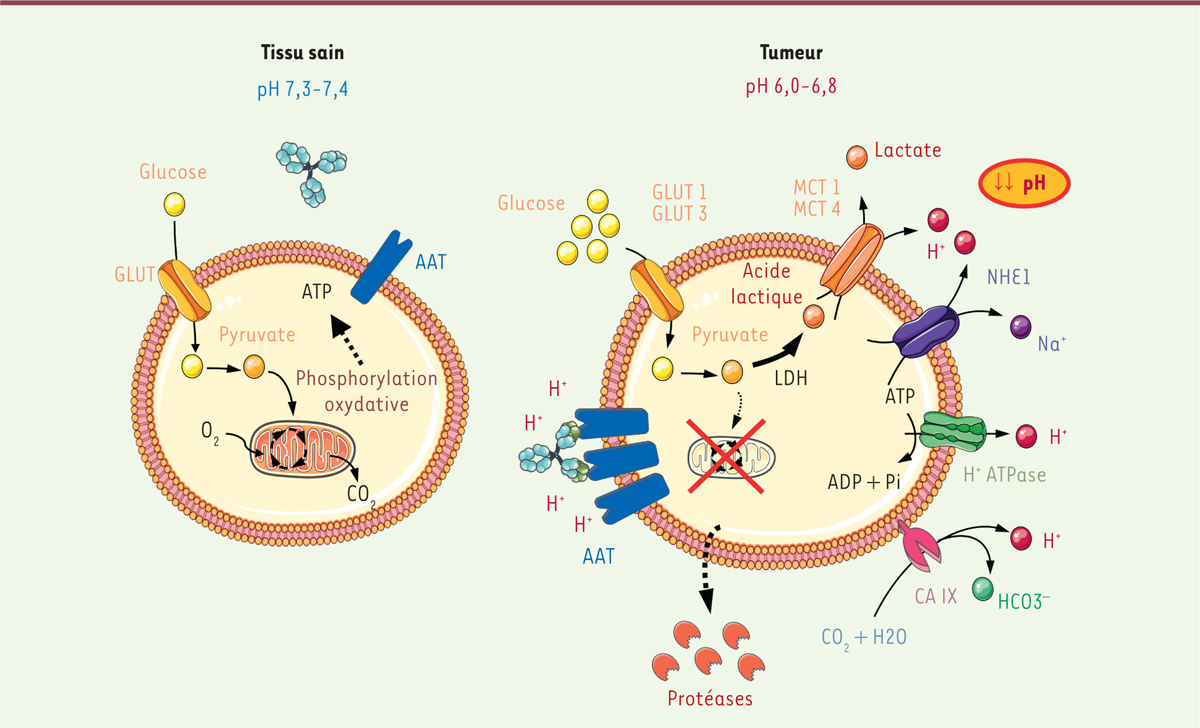
Interaction pH-dépendante des anticorps Implication et mise en évidence de l’effet de Warburg
La modification métabolique des cellules cancéreuses, décrite par Otto Warburg, se caractérise, entre autres, par un besoin accru en glucose. Ce dernier est préférentiellement métabolisé en acide lactique au cours de la glycolyse aérobie lors d’un processus non oxydatif. L’excès acide est alors principalement sécrété par les transporteurs des monocarboxylates (MCT 1,4) et le transporteur Na
+
/H
+
de type 1 (NHE 1) dans le microenvironnement tumoral. Il en résulte une acidification du microenvironnement tumoral stimulant l’invasion tumorale [
10
]
(
Figure 1
)
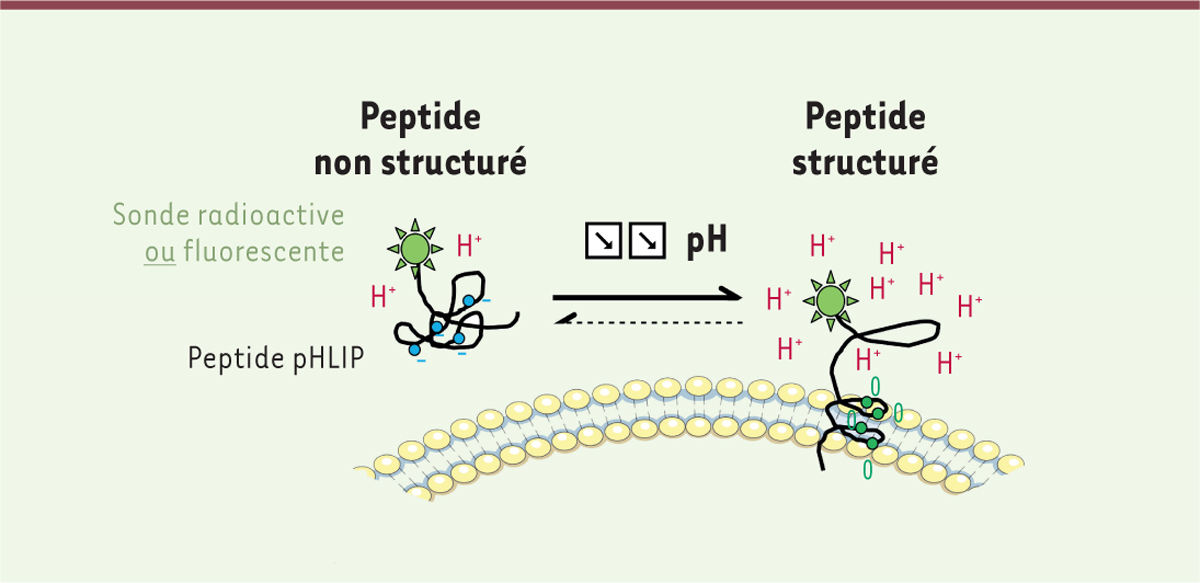
. L’apparition de nouvelles méthodes d’imagerie permet maintenant de visualiser le pH tumoral acide de manière non invasive. De par leur insertion pH-dépendante au sein des membranes cellulaires (pH<6,5), les peptides pHLIP (
pH-low insertion peptides
) assurent la détection des zones acides des tumeurs de souris par tomographie à émission de positrons
(
Figure 2
)
. En clinique, l’imagerie IRM de transfert d’aimantation par échange chimique avec le iopamidol (Acido-CEST pour
acido-chemical exchange saturation transfer
) permet la détection de l’acidification de tumeurs de l’ovaire et du sein [
11
].
 | Figure 1.
Caractéristiques du métabolisme tumoral.
AAT : antigènes associés aux tumeurs ; LDH : lactate deshydrogénase ; GLUT : transporteurs du glucose ; CA : anhydrase carbonique ; MCT : transporteur des monocarboxylates ; NHE : transporteur du sodium et du proton.
|
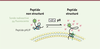 | Figure 2.
Principe de l’imagerie par peptides pHLIP.
Représentation du mécanisme d’insertion membranaire pH-dépendante des peptides pHLIP (
pH-low insertion peptides
) couplés à une sonde (fluorescente ou radioactive) [
11
].
|
Conceptions empirique et rationnelle d’anticorps pH-dépendants
Une approche consiste à exploiter ce phénomène métabolique pour développer des AcM dits « pH-dépendants », c’est-à-dire capables de se lier à leur cible au pH tumoral acide (pH 6,0-6,8) tout en n’ayant qu’une fixation très faible, voire nulle, sur la même cible exprimée à l’état basal par le tissu sain à pH physiologique (pH 7,2-7,4). Kodandapani
et al.
ont muté aléatoirement résidu par résidu une centaine de positions des parties variables du cétuximab. Après un premier criblage différentiel selon le pH de 1 501 simples mutants, 39 ont présenté une meilleure interaction à pH acide qu’à pH physiologique. En combinant ces différentes mutations, ces chercheurs ont identifié un AcM qui démontre
in vitro
une très bonne fixation pH-dépendante à l’EGFR [
12
]. A l’issue d’un procédé similaire, des AcM pH-dépendants armés, dirigés contre le récepteur AXL, ont montré une cytotoxicité spécifique à pH acide contre des cellules de lignées cancéreuses. De plus, l’administration d’une dose unique à 6 mg/kg d’un de ces anticorps pH-dépendant suffit à contrôler la croissance de tumeurs du poumon et de prostate chez des souris, aussi efficacement que l’anticorps parental. Finalement, cet anticorps semble présenter un meilleur profil de tolérance hépatique et immunologique chez le macaque [
13
]. Ces résultats encourageants ont mené à l’évaluation de cet AcM anti-AXL pH-dépendant couplé à l’auristatine E dans le traitement de tumeurs solides localement avancées ou métastatiques (essai de phase I, NCT04425279). Plus récemment, T. Sulea
et al.
ont opté pour l’introduction de manière rationnelle d’histidines dans le paratope d’un AcM afin de le rendre pH-dépendant, à partir de la structure cristallographique du complexe immun. En effet, la chaîne latérale imidazole des histidines présentant un pKa moyen de 6,0, ces acides aminés sont théoriquement les seuls dont l’état de protonation change entre le pH acide tumoral et le pH physiologique des tissus sains. Avec cette méthode, les chercheurs ont réduit le nombre de mutants à tester et ont identifié des AcM pH-dépendants dirigés contre le récepteur HER2/neu. Ces anticorps perdent totalement leur fixation à pH physiologique, jusqu’à 300 nM sur une lignée avec une expression de HER2/neu similaire aux cellules cardiaques. Les anticorps ainsi sélectionnés induisent un ralentissement de la croissance de sphéroïdes spécifiquement en condition acide, alors que le trastuzumab, l’anticorps anti-HER2/neu de référence (Herceptin®), exerce un effet cytostatique indépendant du pH [
14
]. Cependant, en l’absence de données structurales sur le complexe anticorps-antigène, la génération ainsi que la caractérisation d’un grand nombre de clones mutants peut s’avérer laborieuse.
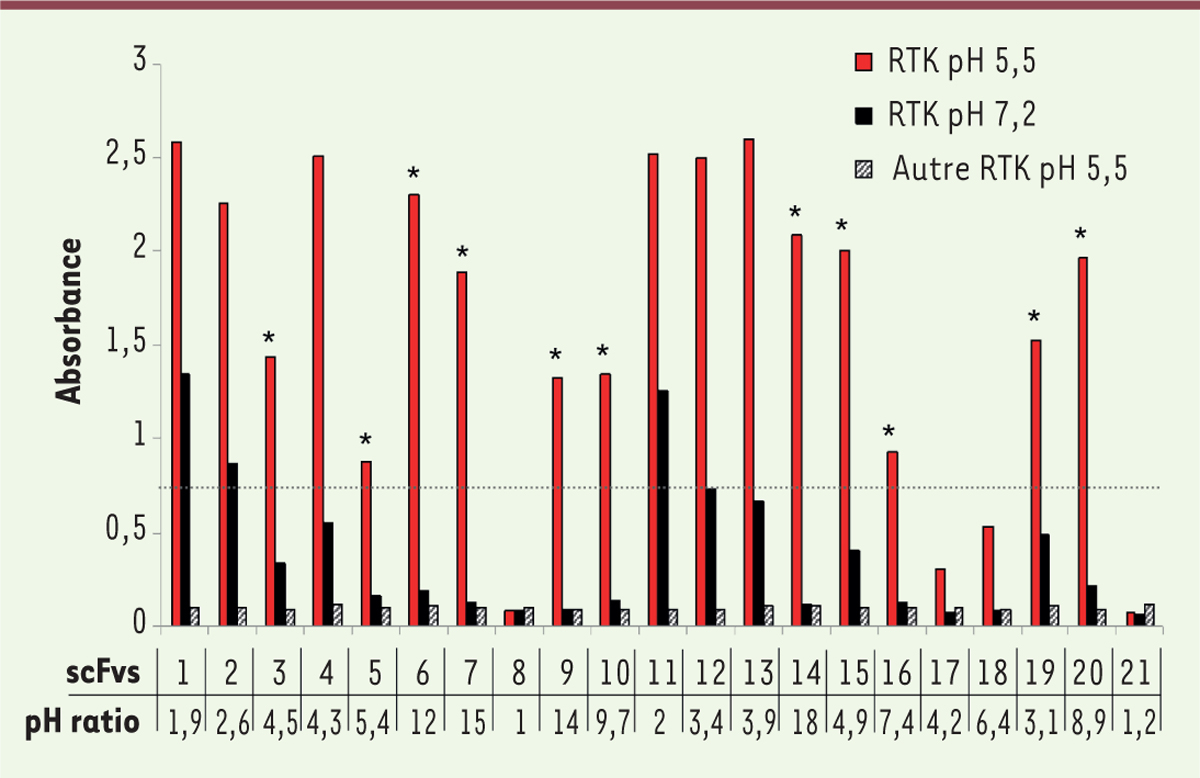
Sélection d’anticorps pH-dépendants par phage display
Afin de contourner cette dernière limitation, notre équipe a privilégié une approche combinatoire pour sélectionner des anticorps pH-dépendants en s’appuyant sur la technologie du
phage display
. À partir de banques de phages exprimant des fragments d’anticorps à leur surface [
15
], nous avons mis au point une méthode pour favoriser l’identification d’anticorps se liant préférentiellement à pH acide à une cible d’intérêt. À l’issue d’un criblage différentiel utilisant deux pH distincts, plusieurs fragments d’anticorps ayant une liaison pH-dépendante contre un récepteur à activité tyrosine kinase ont pu être sélectionnés
(
Figure 3
)
. Lorsque ces fragments ainsi sélectionnés ont été reformatés sous forme d’IgG, la plupart des AcM obtenus conservent cette propriété de fixation pH-dépendante sur la protéine recombinante, mais également sur le récepteur exprimé par des cellules de différentes lignées cellulaires. Nous évaluons actuellement la biodistribution de ces anticorps dans un modèle murin présentant à la fois du tissu sain et tumoral humain, pour démontrer leur innocuité.
 | Figure 3.
Exemple de criblage de scFvs pH-dépendants.
Analyse par ELISA (
enzyme-linked immunosorbent assay
) de la liaison pH-dépendante et de la spécificité des fragments d’anticorps scFv (
single chain fragment variable
) anti-récepteurs à activité tyrosine kinase (RTK) ciblée et non pertinent. Sélection des meilleurs scFvs (*) selon leur fixation à pH acide et leur ratio de fixation pH 5,5/pH 7,2.
|
|
Ces stratégies prometteuses, visant à prévenir les toxicités liées au ciblage des antigènes hors tumeur par des AcM, commencent à être intégrées dans le développement clinique des AcM. À long terme, ces traitements innovants devraient améliorer la qualité de vie des patients tout en maintenant leur fort potentiel anti-tumoral mais devraient aussi permettre d’augmenter le nombre futur d’AcM à usage thérapeutique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Peréz-oler
R
,
Saltz
L
.
Cutaneous adverse effects with HER1/EGFR-targeted agents: is there a silver lining.
.
J Clin Oncol.
2005;
;
23
:
:5235.
–
5246
.
2.
Riechelmann
H
,
Sauter
A
,
Golze
W
,
et al.
Phase I trial with the CD44v6- targeting immunoconjugate bivatuzumab mertansine in head and neck squamous cell carcinoma.
.
Oral Oncol.
2008;
;
44
:
:823.
–
829
.
3.
Morgan
RA
,
Yang
JC
,
Kinato
M
,
et al.
Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2.
.
Mol Ther.
2010;
;
18
:
:843.
–
851
.
4.
Desnoyers
LR
,
Vasiljeva
O
,
Richardson
JH
,
et al.
Tumor-pecific activation of an EGFR-targeting probody enhances therapeutic index.
.
Sci Transl Med.
2013;
;
5
:
:207ra144.
.
5.
Trang
VH
,
Zhang
X
,
Yumul
RC
,
et al.
A coiled-coil masking domain for selective activation of therapeutic antibodies.
.
Nat Biotechnol.
2019;
;
37
:
:761.
–
765
.
6.
Zhou
F
,
Fu
T
,
Huang
Q
,
et al.
Hypoxia-activated PEGylated conditional aptamer/antibody for cancer imaging with improved specificity.
.
J Am Chem Soc.
2019;
;
141
:
:18421.
–
18427
.
7.
Desnoyers
LR
,
Vasiljeva
O
,
Richardson
JH
,
et al.
Tumor-pecific activation of an EGFR-targeting probody enhances therapeutic index.
.
Sci Transl Med.
2013;
;
5
:
:207ra144.
.
8.
Mazor
Y
,
Sachsenmeir
KF
,
Yang
C
,
et al.
Enhanced tumor-targeting selectivity by modulating bispecific antibody binding affinity and format valence.
.
Sci Rep.
2017;
;
7
:
:1.
–
11
.
9.
Slaga
D
,
Ellerman
D
,
Lombana
TN
,
et al.
Avidity-based binding to HER2 results in selective killing of HER2-overexpressing cells by anti-HER2/CD3.
.
Sci Transl Med.
2018;
;
10
:
:eaat5775.
.
10.
Webb
BA
,
Chimenti
M
,
Jacobson
MP
,
et al.
Dysregulated pH: a perfect storm for cancer progression.
.
Nat Rev Cancer.
2011;
;
11
:
:671.
–
677
.
11.
Anemone
A
,
Consolino
L
,
Arena
F
,
et al.
Imaging tumor acidosis: a survey of the available techniques for mapping in vivo tumor pH.
.
Cancer Metastasis Rev.
2019;
;
38
:
:25.
–
49
.
12.
Kodandapani
L
,
Bookbinder
LH
,
Frost
GI
,
et al.
Methods for assessing and identifying or evolving conditionally active therapeutic proteins.
.
2017
;
:US9683985B2.
.
13.
Short
JM
,
Chang
HW
,
Frey
G
,
et al.
Anti-Axl antibodies, antibody fragments and their immunoconjugates and uses thereof.
.
2017
;
:WO2017180842A1.
.
14.
Sulea
T
,
Rohani
N
,
Baardsnes
J
,
et al.
Structure-based engineering of pH-dependent antibody binding for selective targeting of solid-tumor microenvironment.
.
mAbs.
2020;
;
12
:
:e1682866-1-15.
.
15.
Philibert
P
,
Stoessel
A
,
Wang
W
,
et al.
A focused antibody library for selecting scFvs expressed at high levels in the cytoplasm.
.
BMC Biotechnol.
2007;
;
7
:
:81.
.
|