| |
| Med Sci (Paris). 36: 50–55. doi: 10.1051/medsci/2020195.Une piste en immunothérapie du cancer Cibler la signalisation des cellules NK Pierre-Louis Bernard,1 Vladimir Laletin,1 Sonia Pastor,1 Jacques A. Nunès,1* and Geoffrey Guittard1* 1Centre de Recherche en Cancérologie de Marseille, CRCM, Institut Paoli-Calmettes, Inserm, CNRS, Aix Marseille Université
,
Marseille
,
France MeSH keywords: Animaux, Humains, Immunothérapie, Cellules tueuses naturelles, Thérapie moléculaire ciblée, Tumeurs, Transduction du signal, Résultat thérapeutique, méthodes, tendances, physiologie, immunologie, thérapie |
Succès et limites de l’immunothérapie du cancer
De nouvelles thérapies qui favorisent l’immunité anti-tumorale ont été récemment mises au point. Ces approches se sont concentrées sur l’amélioration des réponses des lymphocytes T, soit en ciblant les voies inhibitrices avec des points de contrôle immunitaires (
immune checkpoint inhibitor
, ICI) ou en ciblant les voies d’activation, comme dans le cas des cellules T exprimant des récepteurs antigéniques chimériques (
CAR-T cells
) ou des anticorps bispécifiques. Bien que ces thérapies aient connu des succès sans précédent, seule une minorité de patients atteints de cancer bénéficient de ces traitements, soulignant la nécessité d’identifier de nouvelles cellules et molécules qui pourraient être exploitées dans la prochaine génération de l’immunothérapie. Étant donné le rôle important des réponses immunitaires innées dans l’immunité, l’exploitation de ces réponses ouvre de nouvelles possibilités pour un contrôle durable des tumeurs. Les cellules
natural killer
(NK) sont des lymphocytes du système immunitaire inné capables de tuer des cellules tumorales. Les cellules NK sécrètent également des cytokines qui participent à l’orientation de la réponse immunitaire adaptative [
1
].
En outre, la diminution de l’expression des molécules HLA (
human leukocyte antigen
) de classe I et la perte de l’expression de la microglobuline β2 par les cellules tumorales, deux signaux activateurs pour les cellules NK, ont été décrits comme des mécanismes de résistance à la lyse après les thérapies ICI ciblant les lymphocytes T CD8
+
[
2
]. Les tumeurs présentant de telles caractéristiques pourraient être des cibles idéales dans les thérapies engageant les cellules NK.
L’objectif de cette revue est de résumer les stratégies actuelles ciblant les cellules NK et leurs voies de signalisation pour proposer de nouvelles pistes en immunothérapie du cancer. |
Importance des cellules NK dans la réponse anti-tumorale
Dans de nombreuses études précliniques, les cellules NK ont montré une capacité à limiter la propagation métastatique des tumeurs expérimentales et spontanées [
3
]. En clinique, l’activité des cellules NK a été inversement corrélée à l’incidence du cancer, et plusieurs études montrent que l’infiltration des cellules NK dans les cancers du poumon, gastrique et les carcinomes colorectaux sont associés à de meilleurs résultats pour les patients [
4
].
Il existe cependant des déficits NK (baisse d’expression de récepteurs activateurs et des fonctions NK) observés dans divers types de cancers, à l’origine de l’échappement tumoral [
5
]. Différentes stratégies d’immunothérapie visent à optimiser les fonctions anti-tumorales des cellules NK par l’administration d’anticorps ou de cytokines agissant sur des récepteurs de surface qui vont accroître leur signalisation.
|
Stimuler les voies de signalisations cytokiniques
L’administration
in vivo
de cytokines, telles que l’IL(interleukine)-2 et l’IL-15, importantes dans l’activation et l’expansion des cellules NK, est majoritairement employée en clinique. L’administration d’IL-2 a été approuvée pour le traitement des patients atteints de carcinome rénal et de mélanome. L’efficacité de ce traitement nécessite cependant de fortes doses qui sont responsables d’effets secondaires majeurs [
6
].
L’utilisation de l’IL-15 semble représenter une meilleure option thérapeutique car, outre le fait qu’elle cible les cellules NK, cette cytokine favorise la mise en place d’une réponse T mémoire [
7
]. Son effet est en cours d’investigation clinique (NCT01727076) chez des patients atteints de différents types de cancers.
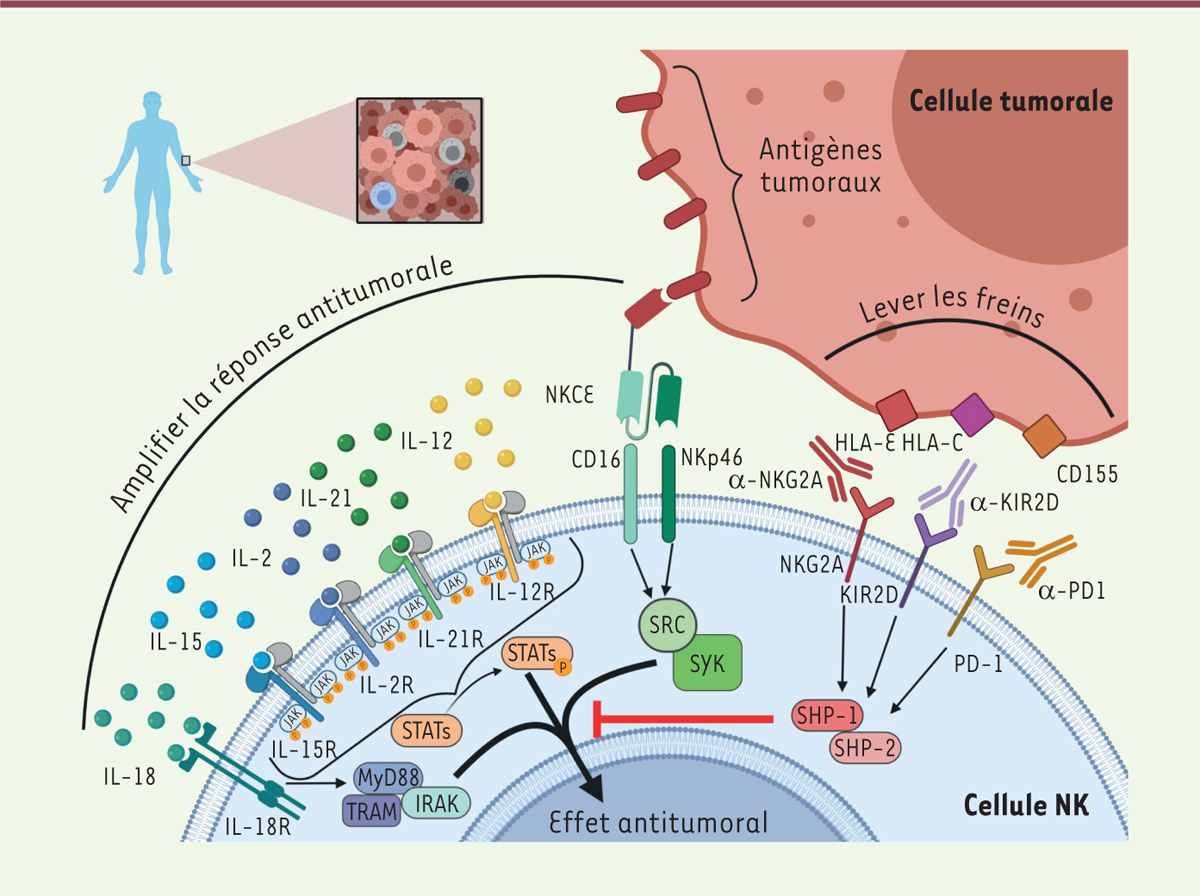
D’autres cytokines régulant l’activité des cellules NK sont également en cours d’investigation : la combinaison d’IL-12 et d’IL-18 favorise la persistance des cellules NK, alors que l’IL-21 protège de l’apparition de l’épuisement cellulaire
(
Figure 1
)
. Ces traitements ciblent les récepteurs membranaires de ces cytokines et activent alors leurs voies de signalisation
via
les protéines JAK (
Janus kinase
)/STAT (
signal transducers and activators of transcription
) (sauf pour l’IL-18 pour laquelle l’activation de son récepteur engage la voie TRAM [
TRIF
1
-related adaptor molecule
]-MyD88[
myeloid differentiation primary response 88
]-IRAK[
Interleukin-1 receptor-associated kinase
]).
|
Lever les freins à la surface de la cellule : les points de contrôle immunitaires (immune checkpoint inhibitors)
Un des mécanismes majeurs de l’échappement tumoral est la surexpression par les cellules cancéreuses de ligands des récepteurs inhibiteurs des lymphocytes cytotoxiques, freinant ainsi leur activité anti-tumorale. La conception et le développement d’anticorps monoclonaux (AcM) inhibant la fixation ligands-récepteurs est une stratégie importante en immunothérapie du cancer. Si les récepteurs PD-1 et CTLA-4(
cytotoxic T-lymphocyte-associated protein 4
) ont été les premiers à être ciblés par les ICI, de nombreux anticorps ciblant des récepteurs inhibiteurs sont actuellement évalués chez l’homme, tels que les KIR(
killer-cell immunoglobulin-like receptors
), Tim-3(
T-cell immunoglobulin and mucin containing protein-3
), LAG-3(
lymphocyte-activation gene 3
) ou TIGIT(
T cell immunoreceptor with Ig and ITIM domains
), ce dernier semblant être un frein majeur à la cytotoxicité NK [
8
]. Certains récepteurs inhibiteurs sont partagés par différents types cellulaires (lymphocytes T CD8
+
, cellules NK). C’est le cas notamment de NKG2A(
NK group 2 member A
), cible du monalizumab qui inhibe la fixation de son ligand sur les cellules NK et les lymphocytes T CD8
+
[
1
]. Cinq essais cliniques sont en cours, où le monalizumab est testé en monothérapie ou en association avec d’autres agents, pour le traitement de divers cancers. De plus en plus d’études et d’essais cliniques se tournent vers la combinaison de plusieurs anticorps ou l’utilisation d’anticorps ayant fait l’objet d’une ingénierie moléculaire (anticorps bi-tri-pécifiques) ciblant la surface des cellules cytotoxiques. Ainsi, l’anticorps NKCE (
NK Cell Engager)
va induire spécifiquement la réponse des cellules NK
(
Figure 1
)
[
9
].
 | Figure 1.
Rétablir la fonction des cellules NK
in vitro
. Les cellules NK peuvent être stimulées et leur nombre amplifié
via
l’administration de cytokines telles que certaines interleukines (IL-2, IL-15, IL-18 et IL-21). En se fixant sur leurs récepteurs, ces cytokines entraînent la phosphorylation spécifique de protéines de la famille des STAT, ce qui conduit
in fine
à l’amélioration de la réponse anti-tumorale. Mais d’autres molécules de signalisation peuvent être engagées : par exemple, l’engagement du récepteur de l’IL-18 conduit à l’activation d’une voie dépendante du complexe MyD88-TRAM-IRAK. Des anticorps permettant de rediriger les cellules NK contre les cellules tumorales ont été récemment développés, c’est le cas notamment des anticorps tri-pécifiques NKCE (
NK cell engager
) dont deux domaines reconnaissent des récepteurs activateurs exprimés par les cellules NK (NKp46, CD16a) et les activent, déclenchant la voie SRC-YK-dépendante (protéines à activité tyrosine kinase). Le troisième domaine reconnaît un antigène associé à la tumeur. Enfin, il existe des récepteurs inhibiteurs qui inhibent l’effet anti-tumoral en activant les protéine phosphatases SHP-1 et SHP-2, qui s’opposent à l’activation des cellules NK. Ces récepteurs sont ciblés par les anticorps ICI (
immune checkpoint inhibitors
), qui empêchent la fixation de ces récepteurs à leurs ligands.
|
|
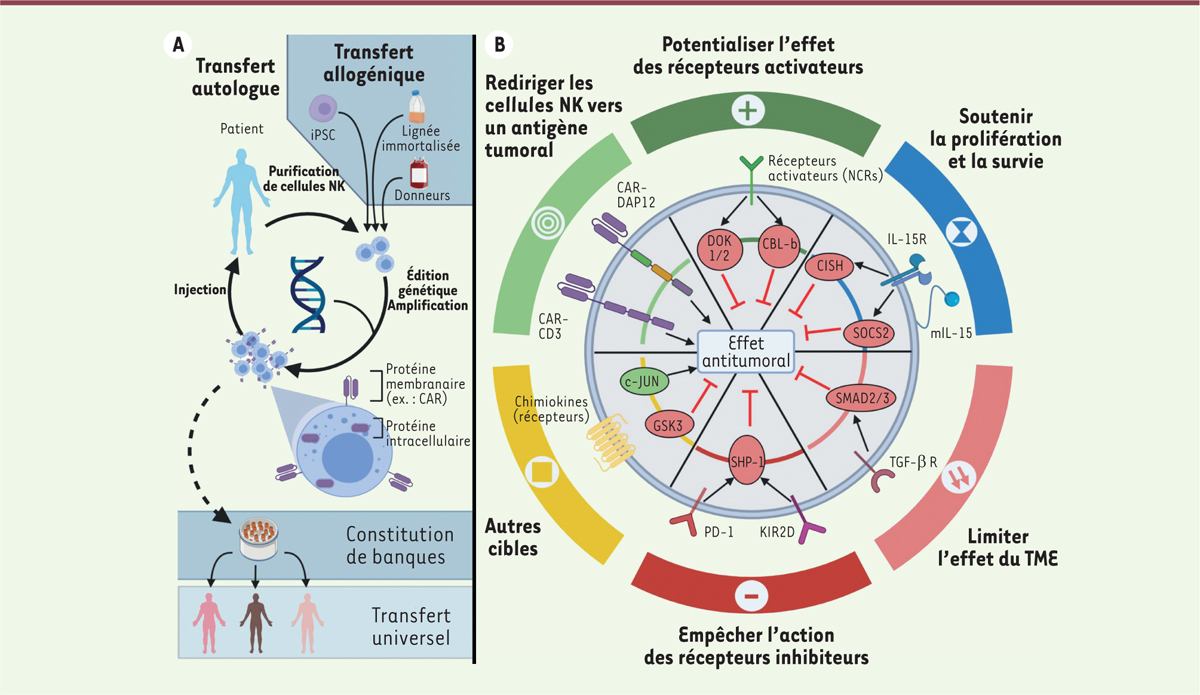
Utilisation des cellules NK en thérapie cellulaire
Les approches abordées ci-dessus visent à rétablir
in vivo
les fonctions des cellules NK. En complément, il est possible de suppléer l’organisme du patient avec des lymphocytes cytotoxiques isolés et cultivés
ex vivo,
puis réinjectés au patient. Si les thérapies cellulaires ont été d’abord développées avec les lymphocytes T, les cellules NK s’avèrent être des candidats prometteurs.
En effet, la cytotoxicité des lymphocytes T est centrée autour du récepteur des cellules T (TCR,
T-cell receptor
) qui s’active en présence d’antigènes étrangers présentés par le CMH (complexe majeur d’histocomptabilité). Le TCR est particulièrement impliqué dans la maladie du greffon contre l’hôte provoquée par les différences d’haplotypes du CMH entre donneurs et receveurs, ce qui limite la source des cellules utilisables dans les protocoles d’immunothérapie cellulaire T aux seules cellules du patient (cellules autologues). En revanche, les cellules NK n’expriment pas le TCR et utilisent un ensemble de récepteurs pour distinguer les cellules à épargner des cellules à tuer. Ainsi, les cellules NK ne sont notamment pas responsables de rejets de greffe, et permettent le transfert de cellules allogéniques. Par conséquent, il existe une possibilité de développer des cellules NK universelles anti-cancéreuses « prêtes à l’emploi » comme produit de thérapie cellulaire. Ces cellules peuvent être préparées à l’avance, optimisées et administrées à la demande à plusieurs patients. Cette perspective a été renforcée par le développement de méthodes en accord avec les exigences cliniques pouvant générer un grand nombre de cellules NK provenant de sources multiples, y compris le sang périphérique, le sang du cordon ombilical, de cellules NK immortalisées et maintenues en culture (lignée cellulaire NK-92) ou encore de cellules NK générées à partir de cellules souches pluripotentes induites (
iPSC
) [
10
]
(
Figure 2A
)
.
 | Figure 2.
Optimiser génétiquement le pouvoir antitumoral des cellules NK. A.
Principe des thérapies NK. Des cellules NK sont isolées à partir du sang de patients, de donneurs sains, de cellules différenciées à partir de cellules souches reprogrammées iPSC (
induced-pluripotent stem cell
) ou de lignées cellulaires immortalisées (NK-92). Elles sont cultivées
ex vivo
et modifiées génétiquement afin de leur faire exprimer, par exemple, un récepteur chimérique CAR (
chimeric antigen receptor
) à leur surface avant d’être réinjectées. Certaines protéines intracellulaires peuvent également être ciblées génétiquement avec l’espoir d’un bénéfice thérapeutique. Les deux approches CAR et protéines intracellulaires peuvent être combinées. Les particularités des cellules NK permettent d’utiliser des cellules autres que celles du patient, dans le cadre de transferts allogéniques. Le transfert allogénique doit permettre de constituer des banques de cellules NK qui pourront être administrées de manière universelle.
B.
Pistes pour optimiser les cellules NK. Il existe de nombreuses pistes pour améliorer génétiquement les cellules NK. Elles portent sur (1) l’optimisation des constructions des récepteurs CAR, notamment de leur partie responsable de la signalisation ; (2) sur la potentialisation de l’activité de leurs récepteurs activateurs comme les NCR (
natural cytotoxicty receptors
) ; (3) sur le renforcement du développement et de la prolifération des cellules NK
via
une signalisation induite par la présence de cytokines, comme la surexpression d’une version modifiée de l’IL-15 liée à la membrane (mIL-15) ; (4) sur l’isolation des cellules NK du microenvironnement tumoral (TME,
tumor microenvironement
) ; (5) sur la limitation de l’action des récepteurs inhibiteurs ou encore (6) sur une action sur un ensemble de cibles variées, telles que les récepteurs de chimiokines. Ces stratégies peuvent être aussi bien dirigées contre des molécules membranaires, en surexprimant ou en inactivant les protéines concernées, qu’au niveau intracellulaire, en ciblant les protéines impliquées dans la régulation de la signalisation des cellules NK. De nombreux freins intracellulaires ont été mis en évidence (en rouge), qui peuvent être supprimés génétiquement pour augmenter l’effet anti-tumoral des cellules NK.
|
Les cellules NK peuvent être rendues plus compétentes pendant la phase de culture
ex vivo
par l’ajout de petites molécules spécifiques dans le milieu de culture ou par édition génétique. Ces efforts en ce sens se concentrent sur leurs récepteurs de surface et, plus récemment, sur des voies de signalisation impliquées dans l’activation des cellules NK.
|
Thérapie cellulaire : cibler la surface de la cellule par des modifications génétiques
Les thérapies CAR (
chimeric antigen receptor
) utilisent des cellules modifiées qui expriment alors un récepteur antigénique chimérique visant à permettre la reconnaissance et potentialiser l’action des lymphocytes contre les tumeurs. Ce récepteur est composé de deux domaines principaux. Le premier (extracellulaire) reconnaît des antigènes exprimés par des tumeurs et le deuxième (intracellulaire) traduit cette fixation en cascades de signalisation activatrices.
Les thérapies CAR ont d’abord été appliquées aux lymphocytes T, et deux protocoles ont été autorisés par les autorités sanitaires américaines (FDA,
Food and Drug Administration
) et européennes (EMA,
European Medicines Agency
). Leur fabrication impose cependant des coûts élevés et des délais de fabrication parfois incompatibles avec la prise en charge des patients. Ces obstacles sont susceptibles d’être levés avec l’utilisation de cellules NK.
En effet, les thérapies CAR-NK sont pour l’instant une extension de ce qui a été réalisé pour les lymphocytes T. Ainsi, les constructions utilisées ont d’abord été conçues pour induire l’activation de ces cellules. Bien qu’une partie de la signalisation soit conservée entre les lymphocytes T et les cellules NK (CD3ζ et 4-1BB), certaines molécules de co-timulation (ex. la molécule CD28) dont les domaines intracellulaires sont couramment utilisés pour fabriquer le récepteur chimérique CAR dans les cellules CAR-T sont absentes dans les cellules NK.
Ainsi, les récepteurs activateurs des cellules NK utilisent une variété de molécules adaptatrices pour la signalisation telles que CD3ζ, DAP(
DNAX-activating protein
)10, DAP12 et la chaîne g des récepteurs de la région Fc des IgG de type III (RFcγIIIa/CD16a). Les constructions CAR spécifiques des cellules NK sont largement fondées sur l’incorporation de DAP10 ou DAP12 comme domaine de transduction ou comme domaine co-timulateur au côté de CD3ζ [
11
].
Différentes constructions CAR-NK spécifiques ont été testées dans les cellules de la lignée cellulaire NK-92, capables de cytotoxicité anti-tumorale ; ces constructions contiennent des domaines intracellulaires activateurs (dérivés de CD16a, NKp44, NKp46 ou NKG2D) et des domaines de co-timulation (dérivés de 2B4, DAP10, DAP12 ou CD137) diversement combinés avec CD3ζ [
11
]. Trois constructions ont montré une potentialisation des capacités anti-tumorales des cellules NK-92 (TM NKp46 - 2B4 - CD3ζ ; TM NKG2D - 2B4 - DAP10 - CD3ζ ; TM NKG2D - CD137- 2B4 - CD3ζ). Ces combinaisons doivent maintenant être testées dans des cellules NK primaires et les études sur le signal intracellulaire induit dans ces cellules NK primaires doivent se poursuivre pour comprendre le comportement des CAR dans des cellules NK primaires amplifiées.
Récemment, l’injection de cellules anti-CD19 CAR-NK, lors d’une étude de phase I/II, a montré une rémission complète de sept patients sur une cohorte de 11 patients leucémiques, sans développement d’effets toxiques majeurs [
12
]. Des pistes pour perfectionner l’effet des CAR-NK sont déjà à l’étude, certaines portant notamment sur la conception même du récepteur CAR à employer. Cela concerne à la fois le choix de la cible reconnue par le récepteur pour cibler divers cancers (CD19, CD22, mésothéline, HER2…) et le choix des modules de signalisation échafaudés dans la partie intracellulaire.
L’expression de CAR à la surface des NK n’est pas le seul axe d’optimisation génétique de ces cellules. De nombreux efforts portent sur la modification des protéines exprimées à leur surface et se concentrent notamment sur les récepteurs de l’IL-2 et de l’IL-15. Ainsi, il a été proposé de rendre les cellules NK capables de produire leur propre IL-15, dans une version légèrement modifiée afin que cette cytokine reste insérée dans la membrane et ne diffuse pas dans l’environnement [
12
]. Une telle expression membranaire permet le soutien de la croissance et de la survie des cellules NK, indépendamment de leur environnement.
Une autre stratégie vise à isoler les cellules NK des mécanismes immunosuppresseurs du microenvironnement tumoral en inactivant génétiquement les récepteurs impliqués dans cette régulation, comme les récepteurs TIGIT ou le récepteur du TGF(
transforming growth factor
)-β [
1
,
13
]. L’expression d’une version non fonctionnelle du récepteur du TGF-β sur des cellules NK dérivées du sang de cordon ombilical empêche l’action immunosuppressive de ce facteur sur les cellules NK, qui ont alors un effet anti-tumoral plus puissant
in vitro
. Ces résultats sont confirmés dans un modèle de xénogreffe de neuroblastome : comparée à l’injection de cellules NK non modifiées génétiquement, l’injection de cellules NK exprimant ce récepteur non fonctionnel améliore significativement la survie des souris.
Enfin, il existe des chimiokines qui permettent « l’adressage » (
homing
) des cellules NK dans les tissus. La surexpression de certains des récepteurs de ces chimiokines, comme CCR(
C-C chemokine receptor type
)7, CXCR(
C-X-C motif chemokine receptor
)-1, 2, 3 ou 4, favorise la pénétration des cellules NK au sein des tissus [
14
]. Les conséquences fonctionnelles de cet adressage restent encore à déterminer.
|
Cibler des protéines intracellulaires de la signalisation
Certaines protéines régulatrices ont un spectre d’action large sur la fonctionalité des lymphocytes cytotoxiques et pourraient être ciblées à ce titre. C’est le cas notamment de la protéine GSK(
glycogen synthase kinase
)3 dont l’inactivation génétique ou pharmacologique potentialise l’activité des cellules NK [
15
]. Plusieurs essais cliniques utilisant l’inhibiteur pharmacologique GSK3 LY2090314 ont été réalisés chez des patients atteints de cancers du pancréas et de leucémies (NCT01287520 ; NCT01214603). L’administration par voie générale d’une telle molécule peut cependant avoir des effets indésirables car elle agit sur d’autres types cellulaires tels que les Tregs qui favorisent l’immunotolérance. Un ciblage de GSK3 dans le cadre d’une thérapie cellulaire, notamment NK, permettrait de limiter ces effets aux cellules d’intérêt.
Il existe des protéines intracellulaires dont la surexpression ouvre la voie à une optimisation des thérapies cellulaires. La surexpression génétique de c-JUN dans les CAR-T les protège de l’épuisement [
16
], un phénomène également rencontré avec les cellules NK, qui perdent peu à peu leur fonctionnalité à la suite de stimulations chroniques, notamment par l’intermédiaire de l’expression de récepteurs inhibiteurs [
17
]. La surexpression du facteur de transcription c-JUN a un effet similaire dans les cellules T CD8
+
et dans les cellules NK, au moins en ce qui concerne la transcription de certains gènes codant quelques protéines [
18
]. Il est possible que ce qui a été observé avec les CAR-T puisse s’appliquer également aux CAR-NK.
|
Lever les freins de la signalisation de la cellule De nombreuses protéines intracellulaires régulent négativement l’activité des cellules NK. Ces protéines constituent une nouvelle de classe de cibles dont il faudrait, à l’instar des ICI, empêcher l’action.
C’est le cas des protéines SMAD(
small mothers against decapentaplegic
) 2/3 qui sont activées en aval du récepteur du TGF-β. Elles sont le relais de ce récepteur inhibiteur et leur déplétion favorise la réponse anti-tumorale des cellules NK [
19
]. En particulier, il a été montré que l’utilisation d’un inhibiteur de Smad-3 permet de freiner la progression tumorale en agissant notamment sur les cellules NK [
20
]. Cependant, toutes les protéines inhibitrices ne sont pas susceptibles d’être ciblées pour optimiser l’efficacité des cellules NK. En effet, bien que la phosphatase SHP(
Src homology region 2 domain-containing phosphatase
)-1 soit activée en aval de certains récepteurs inhibiteurs comme PD(
programmed cell death
)-1 ou certains récepteurs KIR, pour autant, l’inactivation génétique de cette phosphatase ne favorise pas la réponse anti-tumorale des cellules NK, mais les rend hyporéactives [
21
]. Il est donc primordial d’étudier les conséquences fonctionnelles de leur absence, à la fois dans les voies de signalisation et dans la réponse anti-tumorale.
C’est le cas des protéines adaptatrices DOK(
downstream of [tyrosine] kinases
)1/2 qui inhibent, dans les cellules NK, la signalisation de certains récepteurs activateurs chargés de reconnaître les cellules tumorales [
22
]. Des études sont nécessaires pour tester l’efficacité anti-tumorale de cellules NK dont les gènes
DOK1
et
DOK2
auraient été invalidés.
L’ubiquitine ligase CBL(
Casitas B-lineage lymphoma
)-b atténue le signal induit par le récepteur de l’IL-2 à la fois dans les lymphocytes T et les cellules NK, participant ainsi au blocage de l’activité anti-tumorale. Ces résultats ont été confirmés en utilisant des cellules NK issues de donneurs humains et ont permis le développement d’un essai clinique de phase I en utilisant la technique d’interférence par ARN (NCT03087591).
Enfin, les protéines inhibitrices de la famille SOCS (
suppresror of cytokine signaling
) sont largement étudiées en aval de la signalisation de certains récepteurs de cytokines, dont le récepteur de l’IL-15. Une étude récente menée chez la souris a montré que l’invalidation de SOCS2 favorise la réponse anti-tumorale des cellules NK en potentialisant l’effet de l’IL-15 [
23
]. Cependant, la délétion du gène
Socs2
s’accompagne d’une hyperactivité des cellules NK qui présentent alors un phénotype plus mature et sont retrouvées en plus grand nombre dans l’organisme, accentuant les risques d’effets secondaires.
L’expression de CISH (
cytokine-inducible SH2-containing protein
) est régulée par l’activation de la protéine STAT-5 située en aval des récepteurs de l’IL-15 et de l’IL-2, dont elle inhibe la signalisation. Nous avons montré que l’absence de CISH favorise les fonctions anti-tumorales des lymphocytes T CD8
+
[
24
,
25
]. Ces études ont permis la mise en place d’un essai clinique de phase I/II (NCT04426669) où le gène
CISH
est inactivé par la technique CRISPR-Cas9 dans des lymphocytes infiltrés au niveau de la tumeur (TIL) de patients ayant un cancer gastro-intestinal (GI). CISH favorise également la réponse anti-tumorale des cellules NK, sans toutefois modifier l’homéostasie de ces cellules [
26
]. CISH pourrait être un frein intracellulaire majeur à cibler pour optimiser l’effet des cellules NK, à l’instar de ce qui a été montré dans les lymphocytes T. Il convient maintenant d’étudier en détail son rôle dans la réponse anti-tumorale murine et humaine.
|
Les immunothérapies donnent des résultats encourageants dans la prise en charge des patients atteints de cancer. Pour l’instant, l’essentiel des efforts se concentrent sur le ciblage de molécules exprimées à la surface de cellules immunitaires. Il existe plusieurs pistes prometteuses permettant de cibler des molécules intracellulaires. Nous sommes entrés désormais dans l’ère où la thérapie cellulaire et la modification génétique d’une cellule est possible. De nouvelles stratégies peuvent être envisagées, ciblant des protéines intracellulaires d’intérêt, après avoir procédé à une ingénierie de la cellule. Ces approches permettront de compléter les stratégies actuellement développées dans le cadre de l’immunothérapie et pourront également être utilisées en combinaison avec d’autres traitements tels que ceux fondés sur l’utilisation d’ICI ou de cellules CAR-NK. Il convient cependant d’étudier en détail la signalisation des cellules NK pour proposer de nouveaux traitements innovants. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Le laboratoire (Équipe CRCM « Immunité et Cancer ») est soutenu par un label Équipe FRM2018 et par les financements institutionnels (Inserm, CNRS, Aix-Marseille Université et Institut Paoli-Calmettes). Ce travail est tout particulièrement financé par le fonds Janssen Horizon et la fondation ARC pour la recherche sur le cancer. PLB est soutenu par une allocation de 1
re
année de thèse de la Ligue Nationale contre le Cancer, VL par une allocation de thèse du Ministère de l’Enseignement Supérieur, de la Recherche, et de l’Innovation, GG par le fonds Janssen Horizon. Les figures ont été conçues sur BioRender (
https://BioRender.com/
).
|
Footnotes |
1.
Demaria
O
,
Cornen
S
,
Daeron
M
,
et al.
Harnessing innate immunity in cancer therapy.
.
Nature.
2019;
;
574
:
:45.
–
56
.
2.
Zaretsky
JM
,
Garcia-Diaz
A
,
Shin
DS
,
et al.
Mutations associated with acquired resistance to PD-1 blockade in melanoma.
.
N Engl J Med.
2016;
;
375
:
:819.
–
829
.
3.
Chockley
PJ
,
Chen
J
,
Chen
G
,
et al.
Epithelial-mesenchymal transition leads to NK cell-mediated metastasis-pecific immunosurveillance in lung cancer.
.
J Clin Invest.
2018;
;
128
:
:1384.
–
1396
.
4.
Souza-Fonseca-Guimaraes
F.
.
NK cell-based immunotherapies: awakening the innate anti-cancer response.
.
Discov Med.
2016;
;
21
:
:197.
–
203
.
5.
Chretien
AS
,
Devillier
R
,
Fauriat
C
,
et al.
NKp46 expression on NK cells as a prognostic and predictive biomarker for response to allo-CT in patients with AML.
.
Oncoimmunology.
2017;
;
6
:
:e1307491.
.
6.
Rosenberg
SA
.
IL-2: the first effective immunotherapy for human cancer.
.
J Immunol.
2014;
;
192
:
:5451.
–
5458
.
7.
Pilipow
K
,
Roberto
A
,
Roederer
M
,
et al.
IL15 and T-cell stemness in T-cell-based cancer immunotherapy.
.
Cancer Res.
2015;
;
75
:
:5187.
–
5193
.
8.
Zhang
Q
,
Bi
J
,
Zheng
X
,
et al.
Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity.
.
Nat Immunol.
2018;
;
19
:
:723.
–
732
.
9.
Gauthier
L
,
Morel
A
,
Anceriz
N
, et al.
Multifunctional natural killer cell engagers targeting NKp46 trigger protective tumor immunity.
.
Cell.
2019;
;
177
:
:1701.
–
13e16
.
10.
Chabannon
C
,
Mfarrej
B
,
Guia
S
,
et al.
Manufacturing natural killer cells as medicinal products.
.
Front Immunol.
2016;
;
7
:
:504.
.
11.
Li
Y
,
Hermanson
DL
,
Moriarity
BS
,
Kaufman
DS
.
Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity.
.
Cell Stem Cell.
2018;
;
23
:
:181.
–
92e5
.
12.
Liu
E
,
Marin
D
,
Banerjee
P
, et al.
Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors.
.
N Engl J Med.
2020;
;
382
:
:545.
–
53
.
13.
Burga
RA
,
Yvon
E
,
Chorvinsky
E
,
et al.
Engineering the TGFbeta receptor to enhance the therapeutic potential of natural killer cells as an immunotherapy for neuroblastoma.
.
Clin Cancer Res.
2019;
;
25
:
:4400.
–
4412
.
14.
Castriconi
R
,
Carrega
P
,
Dondero
A
,
et al.
Molecular mechanisms directing migration and retention of natural killer cells in human tissues.
.
Front Immunol.
2018;
;
9
:
:2324.
.
15.
Cichocki
F
,
Valamehr
B
,
Bjordahl
R
,
et al.
GSK3 inhibition drives maturation of NK cells and enhances their antitumor activity.
.
Cancer Res.
2017;
;
77
:
:5664.
–
5675
.
16.
Lynn
RC
,
Weber
EW
,
Sotillo
E
,
et al.
c-Jun overexpression in CAR T cells induces exhaustion resistance.
.
Nature.
2019;
;
576
:
:293.
–
300
.
17.
Judge
SJ
,
Murphy
WJ
,
Canter
RJ
.
Characterizing the dysfunctional NK cell: assessing the clinical relevance of exhaustion, anergy, and senescence.
.
Front Cell Infect Microbiol.
2020;
;
10
:
:49.
.
18.
Marusina
AI
,
Burgess
SJ
,
Pathmanathan
I
,
et al.
Regulation of human DAP10 gene expression in NK and T cells by Ap-1 transcription factors.
.
J Immunol.
2008;
;
180
:
:409.
–
417
.
19.
Viel
S
,
Marcais
A
,
Guimaraes
FS
, et al.
TGF-beta inhibits the activation and functions of NK cells by repressing the mTOR pathway.
.
Sci Signal.
2016;
;
9
:
:ra19.
.
20.
Tang
PM
,
Zhou
S
,
Meng
XM
,
et al.
Smad3 promotes cancer progression by inhibiting E4BP4-mediated NK cell development.
.
Nat Commun.
2017;
;
8
:
:14677.
.
21.
Viant
C
,
Fenis
A
,
Chicanne
G
,
et al.
SHP-1-mediated inhibitory signals promote responsiveness and anti-tumour functions of natural killer cells.
.
Nat Commun.
2014;
;
5
:
:5108.
.
22.
Celis-Gutierrez
J
,
Boyron
M
,
Walzer
T
,
et al.
Dok1 and Dok2 proteins regulate natural killer cell development and function.
.
EMBO J.
2014;
;
33
:
:1928.
–
1940
.
23.
Kim
WS
,
Kim
MJ
,
Kim
DO
,
et al.
Suppressor of cytokine signaling 2 negatively regulates NK cell differentiation by iinhibiting JAK2 activity.
.
Sci Rep.
2017;
;
7
:
:46153.
.
24.
Palmer
DC
,
Guittard
GC
,
Franco
Z
,
et al.
Cish actively silences TCR signaling in CD8
+
T cells to maintain tumor tolerance
.
.
J Exp Med.
2015;
;
212
:
:2095.
–
2113
.
25.
Guittard
G
,
Dios-Esponera
A
,
Palmer
DC
,
et al.
The Cish SH2 domain is essential for PLC-gamma1 regulation in TCR stimulated CD8
+
T cells
.
.
Sci Rep.
2018;
;
8
:
:5336.
.
26.
Delconte
RB
,
Guittard
G
,
Goh
W
, et al.
NK Cell priming from endogenous homeostatic signals is modulated by CIS.
.
Front Immunol.
2020;
;
11
:
:75.
.
|