| |
| Med Sci (Paris). 36: 33–37. doi: 10.1051/medsci/2020191.Neuropathie périphérique induite par l’oxaliplatine Comment faire barrière ? Sonia Taïb,1* Juliette Durand,1** and Isabelle Brunet1*** 1Centre interdisciplinaire de recherche en biologie (CIRB), Inserm U1050, CNRS UMR 7241, Collège de France
,
11 place Marcelin Berthelot
,
75005Paris
,
France MeSH keywords: Antinéoplasiques, Barrière hématonerveuse, Perméabilité capillaire, Chimioprévention, Humains, Maladie iatrogène, Syndromes neurotoxiques, Oxaliplatine, Neuropathies périphériques, effets indésirables, effets des médicaments et substances chimiques, anatomopathologie, physiologie, méthodes, tendances, épidémiologie, prévention et contrôle, induit chimiquement |
L’utilisation de l’oxaliplatine, une molécule chimio-thérapeutique, est fréquente pour traiter en première intention les cancers colorectaux et d’autres cancers ayant peu d’options thérapeutiques. L’efficacité de ce traitement est nuancée par les effets secondaires qu’il provoque, particulièrement les douleurs neuropathiques, qui conduisent à la diminution ou l’arrêt du traitement. Les neuropathies périphériques chimio-induites (NPCI) sont en effet caractérisées par des symptômes neurologiques très invalidants [1]. L’amélioration de la prise en charge des symptômes neuropathiques représente donc un objectif thérapeutique crucial, alors qu’il n’existe actuellement aucun traitement efficace pour les soigner ou les prévenir. Mieux comprendre l’étiologie des neuropathies consécutives à l’administration d’oxaliplatine par voie sanguine est donc absolument nécessaire. Peu d’études existent sur l’implication de la composante vasculaire dans leur développement, qui se caractérise par une dégénérescence nerveuse et vasculaire. Déterminer le rôle du système vasculaire intra-nerveux dans la survenue de la neuropathie est donc un enjeu important, qui pourrait permettre le développement de nouvelles pistes thérapeutiques pour traiter les neuropathies périphériques et améliorer la qualité de vie des patients cancéreux. |
La neuropathie induite par l’oxaliplatine : un effet secondaire fréquent encore mal compris L’utilisation de l’oxaliplatine comme antinéoplasique
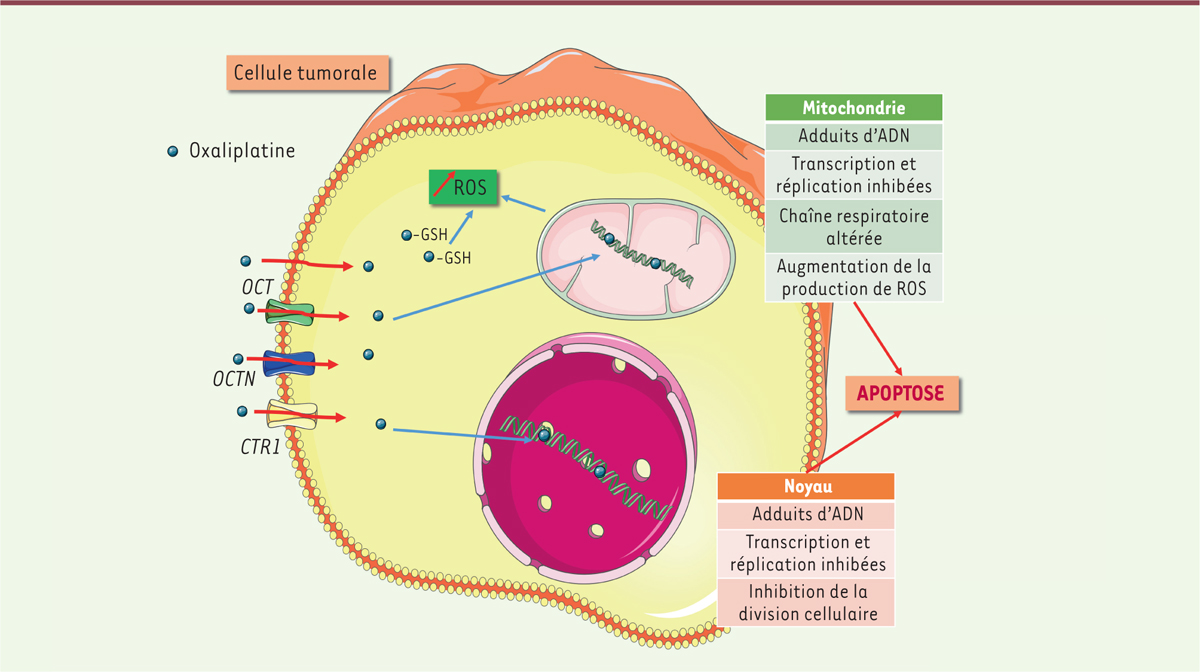
L’oxaliplatine est une molécule antinéoplasique de synthèse appartenant à la famille des sels de platine, largement utilisée depuis 1996 pour le traitement de tumeurs solides. Elle est souvent utilisée comme traitement de première intention des cancers de la voie digestive, notamment les cancers colorectaux, de l’œsophage, gastriques et les cancers métastatiques du pancréas. Le traitement adjuvant de référence utilisé suit le protocole « FOLFOX4 » composé d’oxaliplatine, d’acide folinique et de 5-fluoro-uracile. Son administration se fait par voie intraveineuse avec plusieurs cycles d’injections. L’oxaliplatine a différentes cibles au sein de la cellule tumorale afin de conduire à sa dysfonction et à sa mort par apoptose
(
Figure 1
)
. L’oxaliplatine est transportée dans la cellule tumorale par transport passif à travers la membrane plasmique ou par transport actif via des transporteurs cationiques de la famille des OCT (
organic cationic transporter
) comme OCT1 et OCT2 ou encore CTR1 (
copper transporter 1
) [2]. Une fois dans la cellule, la molécule est hydratée et devient réactive, provoquant des adduits
1
à l’ADN nucléaire et mitochondrial. La platination de l’ADN nucléaire provoque l’activation des mécanismes de réparation dits BER (
base excision repair
) et NER (
nucleotides excision repair
) de l’ADN, conduisant à une inhibition de la transcription et de la réplication. Au niveau de l’ADN mitochondrial, la réplication et la transcription sont alors également inhibées, provoquant une altération de la chaîne respiratoire. La production d’espèces réactives de l’oxygène (ROS, pour
reactive oxygen species
) est augmentée, ce qui augmente le stress oxydatif intracellulaire. Les molécules d’oxaliplatine hydratées se liant également aux molécules nucléophiles comme le glutathion, elles provoquent une déplétion des réserves d’antioxydants et participent aussi à l’augmentation de la concentration de ROS intracellulaire [3]. Enfin, des cellules immunitaires sont activées (macrophages, lymphocytes T et monocytes) et des cytokines pro-inflammatoires sont produites. Tous ces phénomènes conduisent à la mort cellulaire par apoptose.
 | Figure 1.
Représentation graphique des principaux mécanismes moléculaires de l’action anti-tumorale de l’oxaliplatine. L’oxaliplatine entre dans la cellule via des transporteurs ou par transport passif.
Elle provoque des adduits à l’ADN nucléaire et mitochondrial inhibant la réplication et la transcription. L’altération de la chaine respiratoire mitochondriale et la diminution de l’activité des antioxydants (GSH : glutathion) participent à l’augmentation de la concentration en espèces réactives de l’oxygène (ROS pour
reactive oxygen species
) menant à un stress oxydatif. L’oxaliplatine provoque ainsi la mort cellulaire par apoptose.
|
Les effets iatrogènes de l’oxaliplatine
La chimiothérapie étant un traitement agressif, utilisant souvent des doses très élevées, les effets iatrogènes sont pratiquement inévitables. Les complications associées et leur incidence peuvent varier selon les facteurs de comorbidité du patient éventuellement présents, la molécule et la dose utilisées. L’effet neurotoxique, et donc le développement d’une NPCI, est une complication majeure de l’utilisation des agents anticancéreux. En effet, environ 70 % des patients recevant une chimiothérapie développent une NPCI dans le mois qui suit le traitement [4]. Dans le cas de l’oxaliplatine, la prévalence se situe entre 85 et 96 % pour les formes aigües (dans les heures qui suivent la perfusion). L’allodynie
2,
provoquée par des températures froides est un effet secondaire aigu spécifique de l’utilisation de l’oxaliplatine. Les autres symptômes neurologiques sensoriels sont des paresthésies
3,
, des dysesthésies
4
et des ataxies sensorielles au niveau des pieds, des mains et de la région péri-orale. Les symptômes neuropathiques moteurs sont constitués par des crampes aiguës et des fasciculations. Les perfusions se faisant par cycles, la neuropathie aiguë disparaît dans la plupart des cas avant l’entrée dans le cycle suivant. Cependant, la répétition de ces cycles conduit au développement d’une NPCI de forme chronique et cumulative, chez 40 à 93 % des patients [5]. L’apparition des symptômes est la plupart du temps distale et symétrique et se fait selon une distribution typique en « gants et chaussettes » au niveau des pieds et des mains. La survenue et la sévérité de la forme chronique dépendent de la dose cumulée : une dose cumulative dépassant les 510-765 mg/m
2
engendre une neuropathie sévère caractérisée par une persistance des symptômes entre les cycles d’injections. La réversibilité complète de ces symptômes reste rare. Ceux-ci peuvent persister, s’aggraver ou apparaître des mois voire des années après l’arrêt de la chimiothérapie (effet appelé effet de
coasting
). Certains patients peuvent donc être en rémission mais continuer de souffrir d’une neuropathie chronique invalidante.
Les mécanismes connus à l’origine de la neurotoxicité de l’oxaliplatine
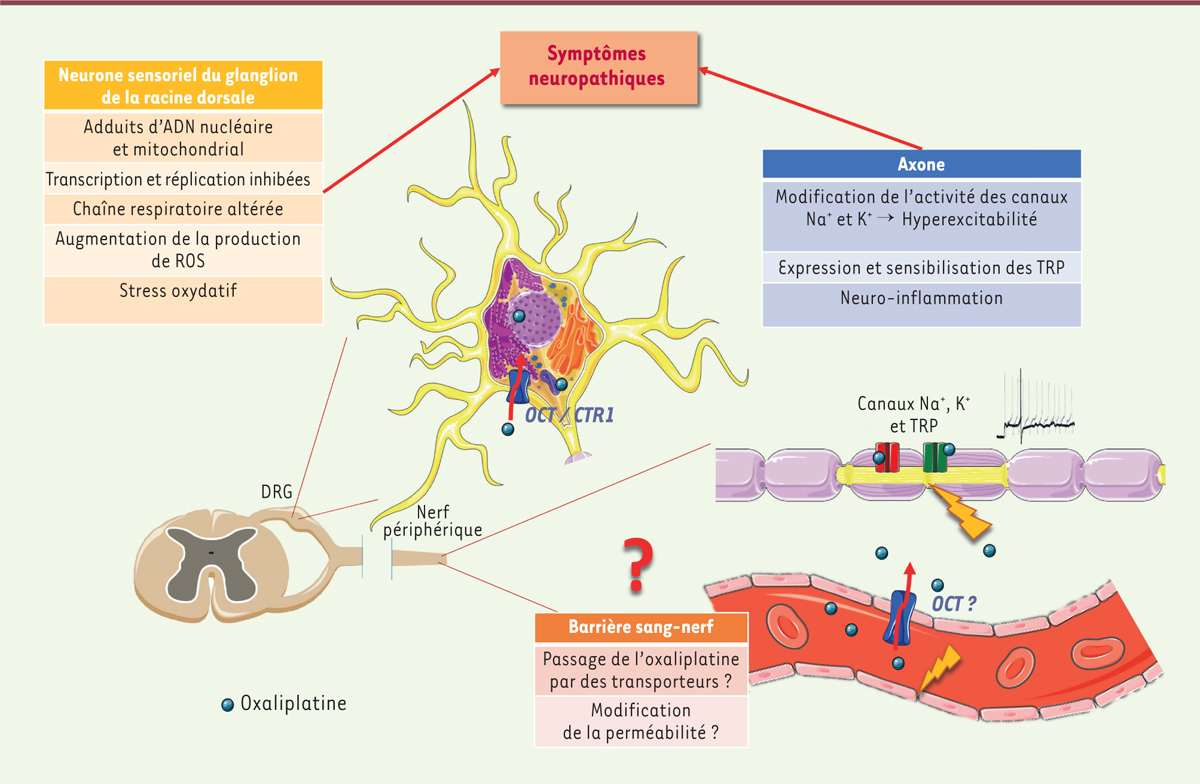
Les sels de platine ont une faible spécificité pour les cellules cancéreuses, affectant aussi les cellules normales. L’oxaliplatine, contrairement aux autres sels de platine, est particulièrement neurotoxique car elle provoque une neuropathie périphérique aiguë et transitoire qui apparait dans les heures qui suivent l’administration. Les mécanismes exacts menant à la NPCI ne sont pas complètement connus. Cependant, les cibles et mécanismes moléculaires responsables de l’effet anti-tumoral et de la neurotoxicité semblent être les mêmes. Plus spécifiquement, l’oxaliplatine serait transporté dans les neurones sensoriels des ganglions de la racine dorsale et s’y accumulerait préférentiellement [6]. Ce transport se ferait par le biais des OCT, notamment OCT2 [7]
(
Figure 2
)
. L’hypothèse communément acceptée est que l’oxaliplatine provoque une dérégulation des canaux calciques voltage-dépendants situés au niveau des nœuds de Ranvier des axones sensoriels. Ces effets sont probablement dus à l’effet chélateur de l’oxalate (un métabolite de l’oxaliplatine) sur les ions calcique et magnésium, ce qui interfère sur la cinétique des canaux [3]. L’amplitude et la durée des potentiels d’action des neurones se retrouvent alors augmentées, tout comme les courants sodiques, menant à une hyperpolarisation prolongée des neurones. Cette hyperexcitabilité neuronale serait à la base de la neurotoxicité aigüe. Par ailleurs, les canaux appartenant à la famille des TRP (
transient receptor potential
), des canaux cationiques non sélectifs, sont responsables de la détection des signaux thermiques, mécaniques et chimiques. Ils sont exprimés par les neurones sensoriels des ganglions de la racine dorsale (DRG pour
dorsal root ganglia
) et joueraient un rôle dans la pathogenèse car leurs activités et leurs expressions sont augmentées après administration d’oxaliplatine [8]. Comme pour les cellules tumorales, l’oxaliplatine provoque un stress oxydatif qui jouerait un rôle majeur dans le développement de la NPCI. En effet, le système nerveux périphérique (SNP) est particulièrement sensible au stress oxydatif [9]. Par ailleurs, l’oxaliplatine provoque également des adduits à l’ADN nucléaire des neurones qui sont particulièrement sensibles à ces modifications car les différents systèmes de réparation de l’ADN y sont inefficaces, ce qui engage des mécanismes d’apoptose dans ces neurones. Enfin, une augmentation des niveaux de facteurs pro-inflammatoires comme le tumor necrosis factor-α (TNF-a) l’interleukine (IL)-1β et l’IL-6) mène à une neuro-inflammation et à la sensibilisation des nocicepteurs pouvant provoquer les douleurs neuropathiques.
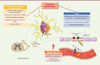 | Figure 2.
Représentation graphique des effets neurotoxiques de l’oxaliplatine.
L’oxaliplatine s’accumule dans les neurones sensoriels des DRG (
dorsal root ganglia
) en entrant par des transporteurs (OCT et CTR1). Les effets sur les corps cellulaires et sur les axones sont à l’origine des symptômes neuropathiques ressentis. Le rôle de la barrière sang-nerf reste à être élucidé ; l’oxaliplatine pourrait passer grâce à des transporteurs et/ou altérer la perméabilité de la barrière.
|
|
La barrière sang-nerf (BSN) : un acteur du développement de la neuropathie induite par l’oxaliplatine ? La BSN
Les NPCI sont des pathologies des nerfs périphériques. Ces nerfs rassemblent la partie axonale des neurones moteurs et sensoriels, et sont vascularisés par un système vasculaire appelé le
vasa nervorum
. Ce système apporte l’oxygène et les nutriments nécessaires au bon fonctionnement nerveux et joue également un rôle central dans le maintien de l’homéostasie du nerf. Les vaisseaux endoneuraux, situés à l’intérieur des nerfs, possèdent une propriété particulière de barrière. Les cellules endothéliales de ces vaisseaux sont liées entre elles par des protéines de jonctions serrées limitant le passage de solutés, de macromolécules et de xénobiotiques entre ces cellules. L’expression de différents transporteurs sur leurs membranes permet également de contrôler le passage de molécules spécifiques. Les neurones étant très sensibles, cette barrière permet de protéger les nerfs des agressions extérieures ; cependant, elle reste moins imperméable que la barrière hémato-encéphalique (BHE), la plus restrictive des barrières présentes dans le corps humain. La composition moléculaire de la BSN reste très peu décrite. Une étude récente a permis d’établir le transcriptome de cette barrière chez l’homme [10]. Ce transcriptome a été établi à partir de micro-vaisseaux endoneuraux de nerfs sciatiques humains disséqués au laser et à partir de de cultures primaires de cellules endothéliales humaines. Ces données pourraient permettre d’identifier de nouvelles molécules candidates jouant un rôle physiopathologique dans le développement des neuropathies périphériques.
Rôle de la BSN dans le développement des NPCI ? La molécule anti-cancéreuse étant administrée par voie intraveineuse, elle circule dans tout l’organisme, y compris dans les nerfs, et peut y exercer son effet neurotoxique. Une des hypothèses est qu’elle passerait librement à travers les capillaires fenêtrés vascularisant les ganglions de la racine dorsale, là où se trouvent les corps cellulaires des neurones sensoriels. Les vaisseaux au niveau de la moelle épinière sont eux moins perméables. Cependant, les mécanismes par lesquels la molécule passerait des vaisseaux sanguins vers les axones, au niveau des nerfs périphériques, restent encore non élucidés mais ne sont pas à exclure. En effet, les données disponibles sur les mécanismes d’action de l’oxaliplatine menant aux symptômes de la NPCI consistent essentiellement en une description de ses effets sur les neurones et ne discute pas du potentiel rôle de « porte d’entrée » des vaisseaux intra-nerveux. La BSN régulant l’homéostasie du nerf, elle est souvent impliquée dans des neuropathies périphériques induites par des lésions traumatiques du nerf comme un écrasement, une section, ou secondaires à des maladies comme le diabète [11]. Une altération de cette barrière peut entrainer une augmentation de sa perméabilité, laissant alors passer des molécules potentiellement nocives aux contact des cellules nerveuses. Par ailleurs, le nerf périphérique ne possède pas de système de drainage lymphatique. Une telle déstabilisation de la BSN peut alors contribuer à une dysfonction neuronale, une neuro-inflammation et donc au développement de neuropathies [12]. Enfin, les neuropathies centrales induites par l’oxaliplatine sont rares. Nous pouvons alors nous demander pourquoi les effets neurotoxiques de cette molécule sont majoritairement périphériques, et si la BHE jouerait un rôle protecteur. Considérant la rapidité d’apparition des symptômes, un effet direct sur les fibres nerveuses au niveau axonal est suggéré. L’oxaliplatine passerait-elle cette BSN grâce à des transporteurs spécifiques non ou peu exprimés par la BHE et la barrière sang-moelle épinière ? Cette molécule provoquerait-elle une déstabilisation de la BSN ? Répondre à ces questions permettrait d’identifier de nouvelles cibles afin de développer de nouvelles pistes thérapeutiques. Stratégies thérapeutiques et nouvelles approches
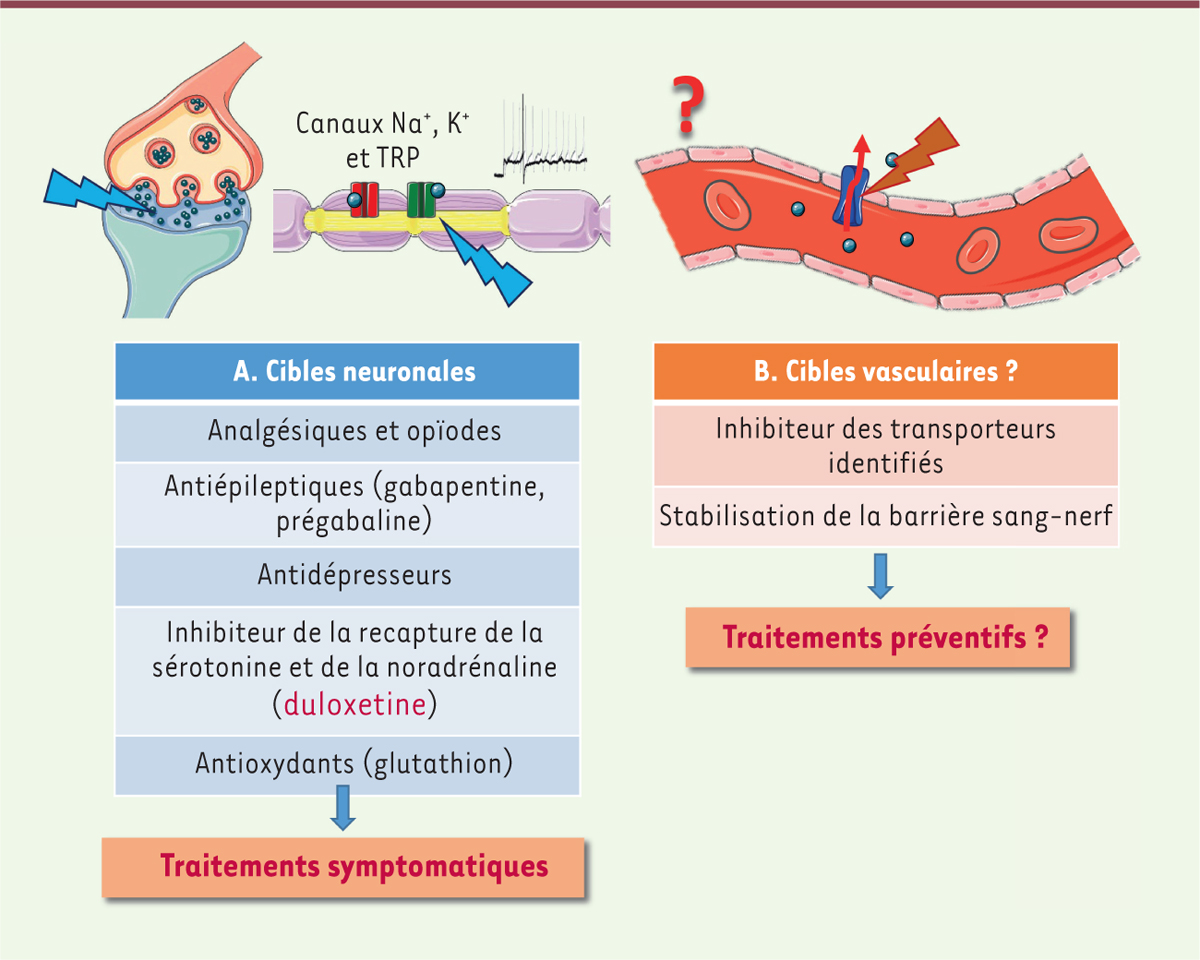
Du fait de notre manque de connaissances actuel sur l’étiologie des NPCI, il n’existe actuellement aucune stratégie préventive ou curative efficace. Il existe des approches pharmacologiques et non-pharmacologiques visant à diminuer la sévérité des symptômes. De nombreuses molécules sont testées, mais elles n’ont soit pas d’effet bénéfique soit un effet sur un petit nombre de patients testés. Les NPCI entrainent des douleurs neuropathiques très difficiles à soulager. Des inhibiteurs de la recapture de la sérotonine et de la noradrénaline, comme la duloxetine, sont utilisés pour traiter ces douleurs. Cette molécule est le seul médicament approuvé ayant un effet significatif sur la douleur neuropathique, d’après une étude clinique randomisée [13]. Elle permet l’inhibition du traitement des stimulus douloureux dans les neurones de la corne dorsale rachidienne. D’autres molécules sont aussi utilisées afin de calmer les douleurs neuropathiques, mais n’ont pas d’action préventive et leur efficacité n’est pas toujours complètement validée [14]. Les antiépileptiques, comme la gabapentine et la prégabaline ciblent les canaux calciques voltage-dépendants et diminuent le taux de neurotransmetteurs excitateurs comme le glutamate. Les analgésiques et des opioïdes, des antidépresseurs et des antioxydants sont également utilisés
(
Figure 3A
)
. Des approches alternatives non-pharmacologiques sont aussi envisagées comme l’utilisation de produits naturels antioxydants (curcumine, éthoxyquine…) et de pratiques calmantes (massages, acupuncture, activité sportive…).
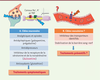 | Figure 3.
Principales stratégies thérapeutiques visant à atténuer les symptômes neuropathiques. A.
Les différentes familles de molécules utilisées agissant sur la transmission synaptique et la conduction nerveuse axonale.
B..
Les cibles possibles afin d’éviter les effets neurotoxiques au niveau des nerfs périphériques.
|
Les stratégies thérapeutiques actuelles consistent donc à soulager les symptômes douloureux et ne servent pas à prévenir l’apparition des NPCI, démontrant un réel besoin de développer des thérapies fondées sur les mécanismes initiateurs. Considérant le rôle capital éventuel de la BSN, mieux comprendre comment l’oxaliplatine passe du système vasculaire au tissu nerveux et particulièrement au contact des axones, permettrait d’envisager des pistes thérapeutiques inédites, préventives et protectrices. En effet, réduire les effets neurotoxiques de cette molécule en empêchant son passage du système sanguin vers le tissu nerveux périphérique pourrait être une piste envisageable
(
Figure 3B
)
. Enfin, aucune donnée n’existe quant à la toxicité des dérivés de sels de platine sur les cellules endothéliales et murales constituants les vaisseaux intra-nerveux. Si ces derniers sont endommagés et si la perméabilité de la BSN est altérée, l’homéostasie du nerf peut se retrouver dérégulée et exacerber les symptômes neuropathiques [12].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Grisold
W
,
Cavaletti
G
,
Windebank
AJ
.
Peripheral neuropathies from chemotherapeutics and targeted agents : diagnosis, treatment, and prevention.
.
NeuroOncol.
2012
;
:45.
–
54
.
2.
Harrach
S
,
Ciarimboli
G
.
Role of transporters in the distribution of platinum-based drugs.
.
Front Pharmacol.
2015;
;
6
:
:17.
.
3.
Calls
A
,
Carozzi
V
,
Navarro
X
,
et al.
Pathogenesis of platinum-induced peripheral neurotoxicity: Insights from preclinical studies.
.
Exp Neurol.
2020;
;
325
:
:113141.
.
4.
Seretny
M
,
Currie
GL
,
Sena
ES
,
et al.
Incidence, prevalence, and predictors of chemotherapy-induced peripheral neuropathy: a systematic review and meta-analysis.
.
Pain.
2014;
;
155
:
:2461.
–
2470
.
5.
Colvin
LA
.
Chemotherapy-induced peripheral neuropathy: where are we now?
.
Pain.
2019;
;
160
:
:1.
–
10
.
6.
Screnci
D
,
McKeage
MJ
,
Galettis
P
,
et al.
Relationships between hydrophobicity, reactivity, accumulation and peripheral nerve toxicity of a series of platinum drugs.
.
Br J Cancer.
2000;
;
82
:
:966.
–
972
.
7.
Sprowl
JA
,
Ciarimboli
G
,
Lancaster
CS
,
et al.
Oxaliplatin-induced neurotoxicity is dependent on the organic cation transporter OCT2.
.
Proc Natl Acad Sci USA.
2013;
;
110
:
:11199.
–
11204
.
8.
Chukyo
A
,
Chiba
T
,
Kambe
T
,
et al.
Oxaliplatin-induced changes in expression of transient receptor potential channels in the dorsal root ganglion as a neuropathic mechanism for cold hypersensitivity.
.
Neuropeptides.
2018;
;
67
:
:95.
–
101
.
9.
Areti
A
,
Yerra
VG
,
Naidu
VGM
,
et al.
Redox biology oxidative stress and nerve damage: role in chemotherapy induced peripheral neuropathy.
.
Redox Biol.
2014;
;
2
:
:289.
–
295
.
10.
Palladino
SP
,
Helton
ES
,
Jain
P
,
et al.
The human blood-nerve barrier transcriptome.
.
Sci Rep.
2017;
;
7
:
:17477.
.
11.
Richner
M
,
Ferreira
N
,
Dudele
A
,
et al.
Functional and structural changes of the blood-nerve-barrier in diabetic neuropathy.
.
Front Neurosci.
2019;
;
13
:
:1.
–
9
.
12.
Maiuolo
J
,
Gliozzi
M
,
Musolino
V
,
et al.
The role of endothelial dysfunction in peripheral blood nerve barrier: molecular mechanisms and pathophysiological implications.
.
Int J Mol Sci.
2019;
;
20
:
:3022.
.
13.
Smith
EML
,
Pang
H
,
Cirrincione
C
,
et al.
Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy-induced painful peripheral neuropathy: a randomized clinical trial.
.
JAMA.
2014;
;
309
:
:1359.
–
1367
.
14.
Ibrahim
EY
,
Ehrlich
BE
.
Prevention of chemotherapy-induced peripheral neuropathy: a review of recent findings.
.
Crit Rev Oncol Hematol.
2020;
;
145
:
:102831.
.
|